Журнал «Здоровье ребенка» Том 15, №2, 2020
Вернуться к номеру
Патогенез COVID-19
Авторы: Абатуров А.Е., Агафонова Е.А., Кривуша Е.Л., Никулина А.А.
ГУ «Днепропетровская медицинская академия Министерства здравоохранения Украины»,
г. Днепр, Украина
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
У статті на підставі літературних джерел наведені сучасні дані щодо основних патогенетичних особливостей коронавірусної інфекції, пов’язаної з вірусом SARS-CoV-2, що викликав в 2019 році, за визначенням Всесвітньої організації охорони здоров’я, пандемію. У літературному огляді детально висвітлені процеси зв’язування вірусу SARS-CoV-2 з рецептором клітин людини, що експресують ангіотензинперетворюючий фермент 2 (АСЕ2), а також інтерналізація, реплікація вірусу й вивільнення нових віріонів з інфікованої клітини, які вражають таргетні органи (легені, травний тракт, серце, центральну нервову систему та нирки) й індукують розвиток місцевої та системної запальної відповіді. Описано існуючі способи медикаментозного впливу, що перешкоджають інфікуванню людини вірусом SARS-CoV-2. Виділено основні епідеміологічні моменти інфікування вірусом SARS-CoV-2, що вказують на переважне ураження людей похилого віку і частіше осіб чоловічої статі у зв’язку з більш високим рівнем експресії АСЕ2, більшою мірою в альвеолоцитах, ніж в осіб жіночої статі. Продемонстровані механізми розвитку відповідної реакції вродженої і адаптивної імунної системи макроорганізму на інфікування вірусом SARS-CoV-2. Наведені терапевтичні стратегії, пов’язані з впливом на різні етапи життєдіяльності вірусу SARS-CoV-2: інтерналізацію — використання солютабних доменів S-білка, антитіл проти S-білка, одноланцюжкового варіабельного фрагмента антитіл до АСЕ2 або пригнічення глікозилювання клітинних рецепторів, блокування взаємодії S-протеїну вірусу SARS-CoV-2 з протеїном ACE2 і придушення інтерналізації вірусу за рахунок призначення препаратів хлорохін і гідроксихлорохін; реплікацію — інгібування вірусною РНК-залежною РНК-полімеразою і застосування фавіпіравіру, ненуклеозидного противірусного препарату тріазавірину, антиретровірусних препаратів (лопінавіру в поєднанні з ритонавіром), нелфінавіру, рибавірину, галідесивіру, арбідолу, інгібіторів хімотрипсиноподібної протеази (цинансерину, флавоноїдів) і папаїноподібної протеази. Перераховані вище терапевтичні методи в найближчому майбутньому будуть спрямовані на попередження розвитку та лікування як гострого респіраторного дистрес-синдрому, так і станів, обумовлених ураженням інших таргетних органів при COVID-19.
В статье на основании литературных источников представлены современные данные об основных патогенетических особенностях коронавирусной инфекции, связанной с вирусом SARS-CoV-2, вызвавшим в 2019 году, по определению Всемирной организации здравоохранения, пандемию. В литературном обзоре подробно освещены процессы связывания вируса SARS-CoV-2 с рецептором клеток человека, которые экспрессируют ангиотензинпревращающий фермент 2 (АСЕ2), а также интернализация, репликация вируса и высвобождение новых вирионов из инфицированной клетки, которые поражают таргетные органы (легкие, пищеварительный тракт, сердце, центральную нервную систему и почки) и индуцируют развитие местного и системного воспалительного ответа. Описаны существующие способы медикаментозного воздействия, препятствующие инфицированию человека вирусом SARS-CoV-2. Выделены основные эпидемиологические моменты инфицирования вирусом SARS-CoV-2, указывающие на преимущественное поражение пожилых людей и чаще лиц мужского пола в связи с более высоким уровнем экспрессии АСЕ2, в большей степени в альвеолоцитах, чем у лиц женского пола. Продемонстрированы механизмы развития ответной реакции врожденной и адаптивной иммунной системы макроорганизма на инфицирование вирусом SARS-CoV-2. Представлены терапевтические стратегии, связанные с влиянием на различные этапы жизнедеятельности вируса SARS-CoV-2: интернализацию — использование солютабных доменов S-белка, антител против S-белка, одноцепочечного вариабельного фрагмента антител к АСЕ2 или ингибирования гликозилирования клеточных рецепторов, блокирования взаимодействия S-протеина вируса SARS-CoV-2 с протеином ACE2 и подавления интернализации вируса за счет назначения препаратов хлорохин и гидроксихлорохин; репликацию — ингибирование вирусной РНК-зависимой РНК-полимеразой и применение фавипиравира, ненуклеозидного противовирусного препарата триазавирина, антиретровирусных препаратов (лопинавира в сочетании с ритонавиром), нелфинавира, рибавирина, галидесивира, умифеновира, ингибиторов химотрипсиноподобной протеазы (цинансерина, флавоноидов) и папаиноподобной протеазы. Вышеперечисленные терапевтические методы в ближайшем будущем будут направлены на предупреждение развития и лечение как острого респираторного дистресс-синдрома, так и состояний, обусловленных поражением других таргетных органов при COVID-19.
Based on the literature, the article presents modern data on the main pathogenetic features of coronavirus infection associated with severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2), which caused a pandemic, according to the World Health Organization definition, in 2019. The literature review details the processes of SARS-CoV-2 binding to a human cell receptor that express angiotensin-converting enzyme 2 (ACE2), as well as the internalization, replication of the virus, and the release of new virions from an infected cell, which affect target organs (lungs, digestive tract, heart, central nervous system and kidneys) and induce the development of local and systemic inflammatory responses. Existing methods of drug exposure that prevent human infection with SARS-CoV-2 are described. The main epidemiological moments of infection with SARS-CoV-2 were identified, indicating a predominant damage in the elderly and more often males due to the higher level of expression of angiotensin-converting enzyme 2, mostly in alveolocytes, than in females. The mechanisms of the development of the response of the innate and adaptive immune systems of a macroorganism to infection with SARS-CoV-2 are demonstrated. Therapeutic strategies are presented that are related to the effect of SARS-CoV-2 on various stages of vital activity: internalization — the use of soluble S-protein domains, antibodies against S-protein, single-chain variable fragment of antibodies to ACE2 or inhibition of glycosylation of cell receptors, blocking the interaction of SARS-CoV-2 S-protein with ACE2 protein and suppression of internalization of the virus by administration of chloroquine and hydroxychloroquine; replication — inhibition of a viral RNA-dependent RNA polymerase and the use of favipiravir, a non-nucleoside antiviral drug triazavirin, antiretroviral drugs (lopinavir in combination with ritonavir), nelfinavir, ribavirin, halidesivir, umifenovir, inhibitors of chymotrypsin-like protease (cinancerin, flavonoids) and papain-like protease. The above therapeutic methods in the near future will be aimed at preventing the development and treatment of both acute respiratory distress syndrome and conditions caused by damage to other targeted organs with COVID-19.
коронавірусна інфекція; гострий респіраторний дистрес-синдром; патогенез; імунна відповідь; ангіотензинперетворюючий фермент 2-го типу
коронавирусная инфекция; острый респираторный дистресс-синдром; патогенез; иммунный ответ; ангиотензинпревращающий фермент 2-го типа
coronavirus infection; acute respiratory distress syndrome; pathogenesis; immune response; angiotensin-converting enzyme 2
Введение
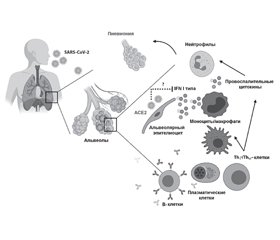
Связывание вируса SARS-CoV-2 с рецептором клеток человека
Интернализация вируса SARS-CoV-2 и высвобождение РНК вируса
Репликация вируса
Иммунный ответ
Реакция адаптивной иммунной системы
Поражение органов и систем
Заключение
- Абатуров А.Е., Волосовец А.П., Юлиш Е.И. Инициация воспалительного процесса при вирусных и бактериальных заболеваниях, возможности и перспективы медикаментозного управления (монография). Харьков: ООО «С.А.М.», 2011. 392 с.
- Alenina N., Bader M. ACE2 in Brain Physiology and Pathophysiology: Evidence from Transgenic Animal Models. Neuroche Res. 2019 Jun. 44(6). 1323-1329. doi: 10.1007/s11064-018-2679-4.
- Batlle D., Wysocki J., Satchell K. Soluble angiotensin-converting enzyme 2: a potential approach for coronavirus infection therapy? Clin. Sci. (Lond.). 2020 Mar 13. 134(5). 543-545. doi: 10.1042/CS20200163.
- Bell T.J., Brand O.J., Morgan D.J., Salek-Ardakani S., Jagger C., Fujimori T., Cholewa L., Tilakaratna V., Östling J., Thomas M., Day A.J., Snelgrove R.J., Hussell T. Defective lung function following influenza virus is due to prolonged, reversible hyaluronan synthesis. Matrix Biol. 2019 Jul. 80. 14-28. doi: 10.1016/j.matbio.2018.06.006.
- Chan J.F., Kok K.H., Zhu Z., Chu H., To K.K., Yuan S., Yuen K.Y. Genomic characterization of the 2019 novel human-pathogenic coronavirus isolated from a patient with atypical pneumonia after visiting Wuhan. Emerg. Microbes. Infect. 2020 Jan 28. 9(1). 221-236. doi: 10.1080/22221751.2020.1719902.
- Chen C., Zhou Y., Wang D.W. SARS-CoV-2: a potential novel etiology of fulminant myocarditis. Herz. 2020 [preprint]. Available at: http://www.ncbi.nlm.nih.gov/pubmed/32140732.
- Chen Y., Guo Y., Pan Y., Zhao Z.J. Structure analysis of the receptor binding of 2019-nCoV. Biochem. Biophys. Res. Commun. 2020 Feb 17. S0006-291X(20)30339-9. doi: 10.1016/j.bbrc.2020.02.071.
- Collum S.D., Chen N.Y., Hernandez A.M., Hanmandlu A., Sweeney H., Mertens T.C.J., Weng T., Luo F., Molina J.G., Davies J., Horan I.P., Morrell N.W., Amione-Guerra J., Al-Jabbari O., Youker K., Sun W., Rajadas J., Bollyky P.L., Akkanti B.H., Jyothula S., Sinha N., Guha A., Karmouty-Quintana H. Inhibition of hyaluronan synthesis attenuates pulmonary hypertension associated with lung fibrosis. Br. J. Pharmacol. 2017 Oct. 174(19). 3284-3301. doi: 10.1111/bph.13947.
- Colson P., Rolain J.M., Raoult D. Chloroquine for the 2019 novel coronavirus SARS-CoV-2. Int. J. Antimicrob. Agents. 2020 Mar. 55(3). 105923. doi: 10.1016/j.ijantimicag.2020.105923.
- Conti P., Ronconi G., Caraffa A., Gallenga C.E., Ross R., Frydas I., Kritas S.K. Induction of pro-inflammatory cytokines (IL-1 and IL-6) and lung inflammation by Coronavirus-19 (COVI-19 or SARS-CoV-2): anti-inflammatory strategies. J. Biol. Regul. Homeost. Agents. 2020 Mar 14. 34(2). 1. doi: 10.23812/CONTI-E.
- Cossarizza A., De Biasi S., Guaraldi G., Girardis M., Mussini C. Modena Covid-19 Working Group (MoCo19) SARS-CoV-2, the Virus that Causes COVID-19: Cytometry and the New Challenge for Global Health. Cytometry A. 2020 Mar 18. doi: 10.1002/cyto.a.24002.
- Diao B., Feng Z., Wang C., Wang H., Liu L., Wang C. et al. Human kidney is a target for novel severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) infection. medRxiv. 2020 Mar. 2020.03.04.20031120.
- Duan Y.J., Liu Q., Zhao S.Q., Huang F., Ren L., Liu L., Zhou Y.W. The Trial of Chloroquine in the Treatment of Corona Virus Disease 2019 COVID-19 and Its Research Progress in Forensic Toxicology. Fa Yi Xue Za Zhi. 2020 Mar 25. 36(2). doi: 10.12116/j.issn.1004-5619.2020.02.001.
- Genschmer K.R., Russell D.W., Lal C., Szul T., Bratcher P.E., Noerager B.D., Abdul Roda M., Xu X., Rezonzew G., Viera L., Dobosh B.S., Margaroli C., Abdalla T.H., King R.W., McNicholas C.M., Wells J.M., Dransfield M.T., Tirouvanziam R., Gaggar A., Blalock J.E. Activated PMN Exosomes: Pathogenic Entities Causing Matrix Destruction and Disease in the Lung. Cell. 2019 Jan 10. 176(1–2). 113-126.e15. doi: 10.1016/j.cell.2018.12.002.
- Gralinski L.E., Baric R.S. Molecular pathology of emerging coronavirus infections. J. Pathol. 2015 Jan. 235(2). 185-95. doi: 10.1002/path.4454.
- Guo Y.R., Cao Q.D., Hong Z.S., Tan Y.Y., Chen S.D., Jin H.J., Tan K.S., Wang D.Y., Yan Y. The origin, transmission and clinical therapies on coronavirus disease 2019 (COVID-19) outbreak — an update on the status. Mil. Med. Res. 2020 Mar 13. 7(1). 11. doi: 10.1186/s40779-020-00240-0.
- Gurwitz D. Angiotensin receptor blockers as tentative SARS-CoV-2 therapeutics. Drug. Dev. Res. 2020 Mar 4. doi: 10.1002/ddr.21656.
- Hanff T.C., Harhay M.O., Brown T.S., Cohen J.B., Mohareb A.M. Is There an Association Between COVID-19 Mortality and the Renin-Angiotensin System-a Call for Epidemiologic Investigations. Clin. Infect. Dis. 2020 Mar 26. ciaa329. doi: 10.1093/cid/ciaa329.
- He F., Deng Y., Li W. Coronavirus Disease 2019 (COVID-19): What we know? J. Med. Virol. 2020 Mar 14. doi: 10.1002/jmv.25766.
- Heldin P., Lin C.Y., Kolliopoulos C., Chen Y.H., Skandalis S.S. Regulation of hyaluronan biosynthesis and clinical impact of excessive hyaluronan production. Matrix Biol. 2019 May. 78-79. 100-117. doi: 10.1016/j.matbio.2018.01.017.
- Hoffmann M., Kleine-Weber H., Schroeder S., Krüger N., Herrler T., Erichsen S., Schiergens T.S., Herrler G., Wu N.H., Nitsche A., Müller M.A., Drosten C., Pöhlmann S. SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell. 2020 Mar 4. S0092-8674(20)30229-4. doi: 10.1016/j.cell.2020.02.052.
- Huang C., Wang Y., Li X., Ren L., Zhao J., Hu Y., Zhang L., Fan G., Xu J., Gu X., Cheng Z., Yu T., Xia J., Wei Y., Wu W., Xie X., Yin W., Li H., Liu M., Xiao Y., Gao H., Guo L., Xie J., Wang G., Jiang R., Gao Z., Jin Q., Wang J., Cao B. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020 Feb 15. 395(10223). 497-506. doi: 10.1016/S0140-6736(20)30183-5.
- Irani Thevarajan, Thi H.O. Nguyen, Marios Koutsakos, Julian Druce, Leon Caly, Carolien E. van de Sandt, Xiaoxiao Jia, Suellen Nicholson, Mike Catton, Benjamin Cowie, Steven Y.C. Tong, Sharon R. Lewin, Katherine Kedzierska. Breadth of concomitant immune responses prior to patient recovery: a case report of non-severe COVID-19. Nature Medicine. 2020. DOI: 10.1038/s41591-020-0819-2.
- Jin Y., Yang H., Ji W., Wu W., Chen S., Zhang W., Duan G. Virology, Epidemiology, Pathogenesis, and Control of COVID-19. Viruses. 2020 Mar 27. 12(4). E372. doi: 10.3390/v12040372.
- Kritas S.K., Ronconi G., Caraffa A., Gallenga C.E., Ross R., Conti P. Mast cells contribute to coronavirus-induced inflammation: new anti-inflammatory strategy. J. Biol. Regul. Homeost. Agents. 2020 Feb 4. 34(1). doi: 10.23812/20-Editorial-Kritas.
- Kruse R.L. Therapeutic strategies in an outbreak scenario to treat the novel coronavirus originating in Wuhan, China. F1000Res. 2020 Jan 31. 9. 72. doi: 10.12688/f1000research.22211.2.
- Kuba K., Imai Y., Penninger J.M. Multiple functions of angiotensin-converting enzyme 2 and its relevance in cardiovascular diseases. Circ. J. 2013. 77(2). 301-8. DOI: 10.1253/circj.cj-12-1544.
- Kuster G.M., Pfister O., Burkard T., Zhou Q., Twerenbold R., Haaf P., Widmer A.F., Osswald S. SARS-CoV2: should inhibitors of the renin-angiotensin system be withdrawn in patients with COVID-19? Eur. Heart J. 2020 Mar 20. ehaa235. doi: 10.1093/eurheartj/ehaa235.
- Li G., Fan Y., Lai Y., Han T., Li Z., Zhou P., Pan P., Wang W., Hu D., Liu X., Zhang Q., Wu J. Coronavirus infections and immune responses. J. Med. Virol. 2020 Apr. 92(4). 424-432. doi: 10.1002/jmv.25685.
- Li X., Geng M., Peng Y., Meng L., Lu S. Molecular immune pathogenesis and diagnosis of COVID-19. Journal of Pharmaceutical Analysis. 2020. doi: https://doi.org/10.1016/j.jpha.2020.03.001.
- Li Y.C., Bai W.Z., Hashikawa T. The neuroinvasive potential of SARS-CoV2 may play a role in the respiratory failure of COVID-19 patients. J. Med. Virol. 2020 Feb 27. doi: 10.1002/jmv.25728.
- Li Z., Yi Y., Luo X., Xiong N., Liu Y., Li S., Sun R., Wang Y., Hu B., Chen W., Zhang Y., Wang J., Huang B., Lin Y., Yang J., Cai W., Wang X., Cheng J., Chen Z., Sun K., Pan W., Zhan Z., Chen L., Ye F. Development and Clinical Application of A Rapid IgM-IgG Combined Antibody Test for SARS-CoV-2 Infection Diagnosis. J. Med. Virol. 2020 Feb 27. doi: 10.1002/jmv.25727.
- Lin L., Lu L., Cao W., Li T. Hypothesis for potential pathogenesis of SARS-CoV-2 infection — a review of immune changes in patients with viral pneumonia. Emerg. Microbes. Infect. 2020 Mar 20. 1-14. doi: 10.1080/22221751.2020.1746199.
- Liu J., Zheng X., Tong Q., Li W., Wang B., Sutter K., Trilling M., Lu M., Dittmer U., Yang D. Overlapping and discrete aspects of the pathology and pathogenesis of the emerging human pathogenic coronaviruses SARS-CoV, MERS-CoV, and 2019-nCoV. J. Med. Virol. 2020 May. 92(5). 491-494. doi: 10.1002/jmv.25709.
- Liu J., Cao R., Xu M., Wang X., Zhang H., Hu H., Li Y., Hu Z., Zhong W., Wang M. Hydroxychloroquine, a less toxic derivative of chloroquine, is effective in inhibiting SARS-CoV-2 infection in vitro. Cell. Discov. 2020 Mar 18. 6. 16. doi: 10.1038/s41421-020-0156-0.
- Liu R., Miller J. China approves use of Roche drug in battle against coronavirus complications. Reuters. 2020 Mar [cited 2020 Mar 11]. Available from: https://www.reuters.com/article/us-health-coronavirus-china-roche-hldg-idUSKBN20R0LF.
- Liu Y., Yang Y., Zhang C., Huang F., Wang F., Yuan J., Wang Z., Li J., Feng C., Zhang Z., Wang L., Peng L., Chen L., Qin Y., Zhao D., Tan S., Yin L., Xu J., Zhou C., Jiang C., Liu L. Clinical and biochemical indexes from 2019-nCoV infected patients linked to viral loads and lung injury. Sci. China Life Sci. 2020 Mar. 63(3). 364-374. doi: 10.1007/s11427-020-1643-8.
- Mao L., Wang M., Chen S., He Q., Chang J., Hong C. et al. Neurological manifestations of hospitalized patients with COVID-19 in Wuhan, China: A retrospective case series study. SSRN Electron. J. 2020. doi: 10.2139/ssrn.3544840.
- Matsuyama S., Nao N., Shirato K., Kawase M., Saito S., Takayama I., Nagata N., Sekizuka T., Katoh H., Kato F., Sakata M., Tahara M., Kutsuna S., Ohmagari N., Kuroda M., Suzuki T., Kageyama T., Takeda M. Enhanced isolation of SARS-CoV-2 by TMPRSS2-expressing cells. Proc. Natl. Acad. Sci. USA. 2020 Mar 12. 202002589. doi: 10.1073/pnas.2002589117.
- Newton A.H., Cardani A., Braciale T.J. The host immune response in respiratory virus infection: balancing virus clearance and immunopathology. Semin. Immunopathol. 2016 Jul. 38(4). 471-82. doi: 10.1007/s00281-016-0558-0.
- Ou X., Liu Y., Lei X., Li P., Mi D., Ren L., Guo L., Guo R., Chen T., Hu J., Xiang Z., Mu Z., Chen X., Chen J., Hu K., Jin Q., Wang J., Qian Z. Characterization of spike glycoprotein of SARS-CoV-2 on virus entry and its immune cross-reactivity with SARS-CoV. Nature Communications. 2020. 11(1620).
- Paz Ocaranza M., Riquelme J.A., García L., Jalil J.E., Chiong M., Santos R.A.S., Lavandero S. Counter-regulatory renin-angiotensin system in cardiovascular disease. Nat. Rev. Cardiol. 2020 Feb. 17(2). 116-129. doi: 10.1038/s41569-019-0244-8.
- Perico L., Benigni A., Remuzzi G. Should COVID-19 Concern Nephrologists? Why and to What Extent? The Emerging Impasse of Angiotensin Blockade. Nephron. 2020 Mar 23. 1-9. doi: 10.1159/000507305.
- Prompetchara E., Ketloy C., Palaga T. Immune responses in COVID-19 and potential vaccines: Lessons learned from SARS and MERS epidemic. Asian Pac. J. Allergy Immunol. 2020 Mar. 38(1). 1-9. doi: 10.12932/AP-200220-0772.
- Qi F., Qian S., Zhang S., Zhang Z. Single cell RNA sequencing of 13 human tissues identify cell types and receptors of human coronaviruses. Biochem. Biophys. Res. Commun. 2020 Mar 18. S0006-291X(20)30523-4. doi: 10.1016/j.bbrc.2020.03.044.
- Qin C., Zhou L., Hu Z., Zhang S., Yang S., Tao Y., Xie C., Ma K., Shang K., Wang W., Tian D.S. Dysregulation of immune response in patients with COVID-19 in Wuhan, China. Clin. Infect. Dis. 2020 Mar 12. ciaa248. doi: 10.1093/cid/ciaa248.
- Rabi F.A., Al Zoubi M.S., Kasasbeh G.A., Salameh D.M., Al-Nasser A.D. ARS-CoV-2 and Coronavirus Disease 2019: What We Know So Far. Pathogens. 2020. 9(3). 231; https://doi.org/10.3390/pathogens9030231.
- Remuzzi A., Remuzzi G. COVID-19 and Italy: what next? Lancet. 2020 Mar 13. S0140-6736(20)30627-9. doi: 10.1016/S0140-6736(20)30627-9.
- Rismanbaf A., Zarei S. Liver and Kidney Injuries in COVID-19 and Their Effects on Drug Therapy; a Letter to Editor. Arch. Acad. Emerg. Med. 2020 Mar 9. 8(1). e17.
- Ruan Q., Yang K., Wang W., Jiang L., Song J. Clinical predictors of mortality due to COVID-19 based on an analysis of data of 150 patients from Wuhan, China. Intensive Care Med. 2020. https://doi.org/10.1007/s00134-020-05991-x.
- Shi Y., Wang Y., Shao C., Huang J., Gan J., Huang X., Bucci E., Piacentini M., Ippolito G., Melino G. COVID-19 infection: the perspectives on immune responses. Cell Death Differ. 2020 Mar 23. doi: 10.1038/s41418-020-0530-3.
- Singhal T. A Review of Coronavirus Disease-2019 (COVID-19). Indian J. Pediatr. 2020 Apr. 87(4). 281-286. doi: 10.1007/s12098-020-03263-6.
- Sun D., Li H., Lu X.X., Xiao H., Ren J., Zhang F.R., Liu Z.S. Clinical features of severe pediatric patients with coronavirus disease 2019 in Wuhan: a single center's observational study. World J. Pediatr. 2020 Mar 19. doi: 10.1007/s12519-020-00354-4.
- Sun P., Lu X., Xu C., Sun W., Pan B. Understanding of COVID-19 based on current evidence. J. Med. Virol. 2020 Feb 25. doi: 10.1002/jmv.25722.
- Sun T., Guan J. Novel coronavirus and central nervous system. Eur. J. Neurol. 2020 Mar 26. doi: 10.1111/ene.14227.
- Tian X., Li C., Huang A., Xia S., Lu S., Shi Z., Lu L., Jiang S., Yang Z., Wu Y., Ying T. Potent binding of 2019 novel coronavirus spike protein by a SARS coronavirus-specific human monoclonal antibody. Emerg. Microbes. Infect. 2020 Feb 17. 9(1). 382-385. doi: 10.1080/22221751.2020.1729069.
- Totura A.L., Baric R.S. SARS coronavirus pathogenesis: host innate immune responses and viral antagonism of interferon. Curr. Opin. Virol. 2012 Jun. 2(3). 264-75. doi: 10.1016/j.coviro.2012.04.004.
- Touret F., de Lamballerie X. Of chloroquine and COVID-19. Antiviral. Res. 2020 Mar 5. 177. 104762. doi: 10.1016/j.antiviral.2020.104762.
- Tyrrell D.A., Bynoe M.L. Cultivation of viruses from a high proportion of patients with colds. Lancet. 1966 Jan 8. 1(7428). 76-7. doi: 10.1016/S0140-6736(66)92364-6
- Velavan T.P., Meyer C.G. The COVID-19 epidemic. Trop. Med. Int. Health. 2020 Mar. 25(3). 278-280. doi: 10.1111/tmi.13383.
- Volunteers A-2019-nCoV. Caution on kidney dysfunctions of 2019-nCoV patients. medRxiv. 2020 Feb. 2020.02.08.20021212.
- Walls A.C., Park Y.J., Tortorici M.A., Wall A., McGuire A.T., Veesler D. Structure, Function, and Antigenicity of the SARS-CoV-2 Spike Glycoprotein. Cell. 2020 Mar 6. S0092-8674(20)30262-2. doi: 10.1016/j.cell.2020.02.058.
- Wan Y., Shang J., Graham R., Baric R.S., Li F. Receptor Recognition by the Novel Coronavirus from Wuhan: an Analysis Based on Decade-Long Structural Studies of SARS Coronavirus. J. Virol. 2020 Mar 17. 94(7). Е00127-20. doi: 10.1128/JVI.00127-20.
- Wang D., Hu B., Hu C., Zhu F., Liu X., Zhang J., Wang B., Xiang H., Cheng Z., Xiong Y., Zhao Y., Li Y., Wang X., Peng Z. Clinical Characteristics of 138 Hospitalized Patients With 2019 Novel Coronavirus-Infected Pneumonia in Wuhan, China. JAMA. 2020 Feb 7. doi: 10.1001/jama.2020.1585.
- Wang M., Cao R., Zhang L., Yang X., Liu J., Xu M., Shi Z., Hu Z., Zhong W., Xiao G. Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro. Cell. Res. 2020 Mar. 30(3). 269-271. doi: 10.1038/s41422-020-0282-0.
- Wevers B.A., van der Hoek L. Renin-angiotensin system in human coronavirus pathogenesis. Future Virol. 2010 Mar. 5(2). 145-161. doi: 10.2217/fvl.10.4.
- Wong H.H., Fung T.S., Fang S., Huang M., Le M.T., Liu D.X. Accessory proteins 8b and 8ab of severe acute respiratory syndrome coronavirus suppress the interferon signaling pathway by mediating ubiquitin-dependent rapid degradation of interferon regulatory factor 3. Virology. 2018 Feb. 515. 165-175. doi: 10.1016/j.virol.2017.12.028.
- Wong S.H., Lui R.N., Sung J.J. Covid-19 and the Digestive System. J. Gastroenterol. Hepatol. 2020 Mar 25. doi: 10.1111/jgh.15047.
- Wrapp D., Wang N., Corbett K.S., Goldsmith J.A., Hsieh C.L., Abiona O., Graham B.S., McLellan J.S. Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation. Science. 2020 Mar 13. 367(6483). 1260-1263. doi: 10.1126/science.abb2507.
- Wysocki J., Schulze A., Batlle D. Novel Variants of Angiotensin Converting Enzyme-2 of Shorter Molecular Size to Target the Kidney Renin Angiotensin System. Biomolecules. 2019 Dec 17. 9(12). E886. doi: 10.3390/biom9120886.
- Xu H., Zhong L., Deng J., Peng J., Dan H., Zeng X., Li T., Chen Q. High expression of ACE2 receptor of 2019-nCoV on the epithelial cells of oral mucosa. Int. J. Oral. Sci. 2020 Feb 24. 12(1). 8. doi: 10.1038/s41368-020-0074-x.
- Xu Z., Shi L., Wang Y., Zhang J., Huang L., Zhang C., Liu S., Zhao P., Liu H., Zhu L., Tai Y., Bai C., Gao T., Song J., Xia P., Dong J., Zhao J., Wang F.S. Pathological findings of COVID-19 associated with acute respiratory distress syndrome. Lancet Respir. Med. 2020 Feb 18. S2213-2600(20)30076-X. doi: 10.1016/S2213-2600(20)30076-X.
- Yan R., Zhang Y., Li Y., Xia L., Guo Y., Zhou Q. Structural basis for the recognition of the SARS-CoV-2 by full-length human ACE2. Science. 2020 Mar 4. eabb2762. doi: 10.1126/science.abb2762.
- Yi Y., Lagniton P.N.P., Ye S., Li E., Xu R.H. COVID-19: what has been learned and to be learned about the novel coronavirus disease. Int. J. Biol. Sci. 2020 Mar 15. 16(10). 1753-1766. doi: 10.7150/ijbs.45134.
- Zhang H., Penninger J.M., Li Y., Zhong N., Slutsky A.S. Angiotensin-converting enzyme 2 (ACE2) as a SARS-CoV-2 receptor: molecular mechanisms and potential therapeutic target. Intensive Care Med. 2020 Mar 3. doi: 10.1007/s00134-020-05985-9.
- Zhang L., Liu Y. Potential interventions for novel coronavirus in China: A systematic review. J. Med. Virol. 2020 May. 92(5). 479-490. doi: 10.1002/jmv.25707.
- Zheng Y.Y., Ma Y.T., Zhang J.Y., Xie X. COVID-19 and the cardiovascular system. Nat. Rev. Cardiol. 2020 Mar 5. doi: 10.1038/s41569-020-0360-5.
- Zhou N., Pan T., Zhang J., Li Q., Zhang X., Bai C., Huang F., Peng T., Zhang J., Liu C., Tao L., Zhang H. Glycopeptide Antibiotics Potently Inhibit Cathepsin L in the Late Endosome/Lysosome and Block the Entry of Ebola Virus, Middle East Respiratory Syndrome Coronavirus (MERS-CoV), and Severe Acute Respiratory Syndrome Coronavirus (SARS-CoV). J. Biol. Chem. 2016 Apr 22. 291(17). 9218-32. doi: 10.1074/jbc.M116.716100.
- Zhu N., Zhang D., Wang W., Li X., Yang B., Song J., Zhao X., Huang B., Shi W., Lu R., Niu P., Zhan F., Ma X., Wang D., Xu W., Wu G., Gao G.F., Tan W.; China Novel Coronavirus Investigating and Research Team. A Novel Coronavirus from Patients with Pneumonia in China, 2019. N. Engl. J. Med. 2020 Feb 20. 382(8). 727-733. doi: 10.1056/NEJMoa2001017.
- Zou X., Chen K., Zou J., Han P., Hao J., Han Z. Single-cell RNA-seq data analysis on the receptor ACE2 expression reveals the potential risk of different human organs vulnerable to 2019-nCoV infection. Front. Med. 2020 Mar 12. doi: 10.1007/s11684-020-0754-0.

/88.jpg)
/89.jpg)