Введение
Все больные сахарным диабетом (СД), у которых отсутствует, недостаточна или не поддается стимуляции собственная секреция инсулина, нуждаются в немедленной и пожизненной инсулинотерапии. Промедление в назначении инсулина сопровождается прогрессированием симптомов декомпенсации заболевания (нарастающие признаки дегидратации, потеря массы тела, адинамия, кетоз, кетоацидоз и др.), что приводит к развитию диабетической комы, угрожающей жизни больного. Выраженная и длительная декомпенсация СД способствует развитию и быстрому прогрессированию диабетических ангиопатий и нейропатий. В инсулинотерапии нуждаются более 30 % всех больных сахарным диабетом 2-го типа и 100 % больных СД 1-го типа [1].
В настоящее время существует возможность выбора между базальной инсулинотерапией, лечением смешанными инсулинами и прандиальной инсулинотерапией. При выборе вида инсулинотерапии, конечно, принимается во внимание оптимальный контроль гликемии и способность больного и его подготовленность к проведению самоконтроля. Главной целью лечения является тщательный контроль гликемии с минимальным риском развития серьезной гипогликемии и значительной прибавки массы тела [2]. Метаанализ крупных интервенционных исследований ACCORD, ADVANCE, UKPDS и VADT установил, что поддержание уровня гликемии, близкой к нормальным показателям, предупреждает не только микро-, но и макрососудистые осложнения. Исходя из этого, требования международных специализированных организаций, как и прежде, являются жесткими к уровню гликированного гемоглобина HbA1c, который колеблется между 6,5 и 7 % (IDF, ADA, EASD, AACE), однако подход к целевым показателям должен быть оправданным. Подчеркивается важность нормализации постпрандиальной гликемии, и здесь условным показателем является уровень менее 9 ммоль/л через 2 часа после приема пищи [3].
Учитывая необходимость тщательного контроля гликемии и прогрессирующий характер течения СД 2-го типа, рано или поздно при достаточно продолжительном течении диабета большинство больных нуждается в лечении инсулином. В исследовании UKPDS четко установлено, что через 5–6 лет лечения производными сульфонилмочевины более 50 % больных нуждаются в инсулинотерапии [4]. Вообще следует исходить из того, что в Украине около 30 % больных с СД 2-го типа нуждаются в инсулинотерапии.
Патофизиологическое обоснование инсулинотерапии. Одним из наиболее ранних и важных патофизиологических дефектов при СД 2-го типа является недостаточно быстрая секреция прандиального инсулина, в то же время, напротив, базальная продукция инсулина ночью и между приемами пищи в большинстве случаев достаточна. Позже возникает недостаточность секреции инсулина в ночное время и особенно в ранние утренние часы (т.н. феномен «утренней зари»). В сравнении с СД 1-го типа при диабете 2-го типа базальная секреция инсулина в течение дня достаточная, и только затем, спустя некоторое время, в связи с истощением эндогенного резерва требуется базальная инсулинотерапия. Дефицит прандиального инсулина влечет за собой рост продукции глюкагона с последующим недостаточным подавлением продукции глюкозы печенью во время еды за счет глюконеогенеза [5]. В результате этого наблюдается значительный постпрандиальный рост гликемии. Постпрандиальные пики гликемии не только способствуют развитию осложнений, но и в значительной степени определяют рост HbA1c. При целевых показателях HbA1c 7 % особую роль в процессе гликирования играет постпрандиальная гликемия в сравнении с тощаковой [6].
Режимы инсулинотерапии. В настоящее время существует три принципиальных и конкурирующих режима инсулинотерапии при СД 2-го типа:
1. Базальная инсулинотерапия в сочетании с пероральными препаратами направлена в первую очередь на уровень гликемии натощак и не влияет прямо на дефицит прандиального инсулина. Однако важнейший показатель гликемии после завтрака может в этом случае улучшаться, так как бета-клетки «отдохнут» ночью в связи с назначением базального инсулина и снизится метаболически обусловленная инсулинорезистентность из-за уменьшения глюкозотоксичности [7].
2. Терапия смешанными инсулинами заключается в назначении двух инъекций инсулинов утром и вечером: таким образом восполняется прандиальный компонент. Компонент пролонгированного инсулина утренней инъекции зачастую покрывает потребность в нем в обеденное время.
3. Прандиальная инсулинотерапия с базальным инсулином на ночь или без него ориентирована на устранение патофизиологических дефектов секреции инсулина.
Базальная инсулинотерапия является простым способом интродукции инсулинотерапии. Больные оценивают тот факт, что необходимо вводить инсулин один раз перед сном. Врачей устраивает этот вид терапии в связи с незначительным риском развития гипогликемии и небольшими затратами времени на обучение. Для проведения базальной инсулинотерапии в настоящее время существует широкая палитра пролонгированных инсулинов — как человеческих, так и аналогов инсулина.
NPH-инсулин используется в течение десятилетий и достаточно изучен. Недостатком этого инсулина является нежелательный пик действия с опасностью ночной гипогликемии, а также значительные колебания при достижении целевых показателей натощак.
Инсулин гларгин по сравнению с NPH-инсулином не дает пиков, кривая действия имеет плоский характер с незначительным риском развития ночной гипогликемии. Исследования свидетельствуют о возможности достижения хороших целевых показателей HbA1c, которые могут быть тождественными таковым при режиме многократных инъекций прандиальными инсулинами.
Инсулин детемир реже вызывает прибавку массы тела и дает более стабильные воспроизводимые показатели гликемии натощак. Это позволяет достигать более низких показателей гликемии без угрозы развития гипогликемии в ночное время. Новые фармакодинамические исследования, проводимые у больных с СД, показывают тождественность кривых действия гларгина и детемира [8].
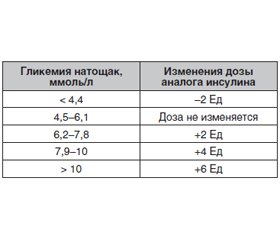
Назначение инсулина на ночь в первую очередь преследует цель нормализации сахара крови натощак. Доза составляет, как правило, около 10–12 Ед (или 0,2 Ед на 1 кг массы тела, если требуется быстрое достижение целевых показателей). Инсулин вводится в большинстве случаев перед сном. Инсулин гларгин и детемир можно вводить также перед ужином и утром. Титрование дозы представлено в табл. 2. Каждые три дня дозу увеличивают на 3 Ед до тех пор, пока не достигнут целевых показателей гликемии.
При превышении целевых показателей или возникновении гипогликемии дозу необходимо уменьшить на 3 Ед. Эта схема титрования дозы очень хорошо подходит для выполнения самими больными. Для титрования в этом случае необходимо только определение показателей гликемии натощак. После достижения целевых показателей необходимо спорадически также определять уровень гликемии в 2–3 часа ночи для исключения гипогликемии.
В том случае, если, несмотря на достижение целевых показателей гликемии натощак, HbA1c остается высоким, необходимо определение постпрандиальных показателей гликемии. У этих пациентов, как правило, имеются высокие показатели постпрандиальной гликемии. В данном случае необходима интенсификация терапии путем назначения прандиального инсулина или смесей инсулина. Такую терапию необходимо начинать сразу после старта базальной инсулинотерапии и не откладывать на длительное время. По расчетам некоторых авторов, повышение дозы базального инсулина свыше 0,5 ЕД на 1 кг массы тела лишено смысла [9].
С некоторых пор используется комбинация инъекций инкретиномиметиков и инсулина. Это сочетание дает возможность достичь хорошего контроля при относительно низкой потребности в инсулине, сопровождается низким риском развития гипогликемии и приводит к снижению массы тела [10].
Использование смесей инсулинов при СД имеет долгую историю. Они позволяют использовать простую схему инсулинотерапии с помощью введения препаратов два раза в сутки. Начало лечения простое как для врача, так и для больного. Утренняя инъекция покрывает с помощью короткого инсулина его потребность для завтрака, а с помощью пролонгированного компонента — для обеда. Следовательно, режим приема пищи в значительной степени предопределен временем инъекций. В особенности это касается обеда, который должен быть в строго определенное время и в привычном объеме. Пролонгированный компонент смеси может повышать риск гипогликемии в предобеденное время, поэтому требуется перекус [11].
Ранний ужин является причиной того, что пролонгированный инсулин не в состоянии обеспечить достаточное подавление глюконеогенеза в печени в утреннее время. Следствием этого является высокая гликемия натощак. Зачастую отмечается значительная прибавка массы тела. Чтобы устранить часть недостатков традиционной терапии смешанными препаратами, в последнее время инсулин короткого действия заменяют в смеси ультракороткими аналогами. В результате этой модификации улучшается фармакодинамика препарата. Постпрандиальная гликемия в сравнении с традиционными смесями снижается и уменьшается склонность к развитию гипогликемии как ночью, так и в течение дня, что благоприятно отражается на снижении массы тела. Кроме того, отпадает необходимость выдерживать временной промежуток между инъекцией и приемом пищи. Современные исследования показывают, что смеси с ультракороткими аналогами позволяют достичь целевых показателей HbA1c меньше 7 % у большей части больных с СД 2-го типа [12].
Терапия смесями с ультракороткими аналогами дважды в день может быть интенсифицирована третьей инъекцией того же инсулина перед обедом. Гибкость этой схемы в повседневной жизни незначительна, а динамика массы тела в сопоставлении с детемиром неблагоприятна.
Смесь аналогов рекомендуется вводить в начале в количестве 10 ЕД перед ужином один раз в сутки или 6 Ед утром перед завтраком и 6 Ед перед ужином (две инъекции в день). Титрование проводят по очень простой схеме (табл. 3). Следует обратить внимание на вероятность возникновения гипогликемии перед обедом при утреннем введении инсулина. В большинстве случаев утренняя доза несколько выше, чем вечерняя.
/88.jpg)
Прандиальная инсулинотерапия и базис-болюс-терапия. Введение инсулина короткого действия перед основными приемами пищи называется прандиальной инсулинотерапией, а дополнительное введение на ночь инсулина пролонгированного действия — базис-болюс-терапией. Выражение «интенсифицированная инсулинотерапия» или «интенсифицированная традиционная инсулинотерапия» следует закрепить за СД 1-го типа. Прандиальная терапия направлена, по существу, на устранение дефицита инсулина при приеме пищи. Прандиальная инсулинотерапия может проводиться как инсулином короткого действия, так и короткодействующим аналогом инсулина. Подавляющее большинство пациентов при гибком образе жизни при использовании короткодействующих аналогов инсулина может достичь хорошего терапевтического эффекта: уменьшается постпрандиальная гликемия и снижается HbA1c. До сих пор неизвестно, приводит ли это к редукции микро- и макрососудистых осложнений СД. Позитивной стороной прандиальной инсулинотерапии является отсутствие необходимости вводить инсулин за 30 мин до еды, исключаются перекусы, уменьшается количество гипогликемий и облегчается контроль массы тела. Постпрандиальное введение инсулина не имеет существенных недостатков. Гибкость и непредвиденные обстоятельства в повседневной жизни легче преодолеваются, что для пациентов очень важно. Они имеют возможность это использовать, повышая в конечном итоге качество жизни.
Использование аналогов инсулина характеризуется высокой метаболической безопасностью, поскольку снижается риск развития гипогликемии и прибавки массы тела, а также наблюдается низкий уровень митогенной стимуляции [13]. Поэтому инсулины лизпро и аспарт разрешены к использованию не только у детей, но и на всех этапах беременности [14]. Особых различий в действии присутствующих на рынке короткодействующих аналогов инсулина аспарт, лизпро и глюлизин не отмечается. Индивидуальный выбор зависит от наличия или отсутствия такого препарата на рынке.
Широко распространен очень осторожный подход к началу прандиальной инсулинотерапии с применением инсулинов короткого действия или лучше с использованием короткодействующих аналогов инсулина в дозе 12–4–8 ЕД перед завтраком — обедом — ужином. Несмотря на то что суточная доза инсулина составляет 0,5–1 ЕД/кг массы тела, титрация до окончательной дозы при этом варианте продолжается довольно длительное время. Суточная доза распределяется в течение дня следующим образом: 3 : 1 : 2 перед основным приемом пищи и при использовании аналогов инсулина — в соотношении 1 : 1 : 1.
После начала прандиальной инсулинотерапии необходимо повышать отдельные дозы на 10–20 % до тех пор, пока постпрандиальная гликемия не достигнет показателя менее 9 ммоль/л. Очень важна величина повышения дозы для того, чтобы достичь целевых показателей в приемлемое время. При использовании современных короткодействующих аналогов инсулина, как показывают исследования, суточная доза распределяется в течение дня в соотношении 1 : 1 : 1 в соответствии с существующими среднеевропейскими пищевыми привычками, даже если терапия начиналась с соотношения 3 : 1 : 2 [15].
В случае достижения целевых показателей постпрандиальной гликемии после ужина и перед сном и сохраняющейся высокой гликемией натощак требуется дополнительное введение пролонгированного инсулина на ночь (базис-болюс-терапия). При СД 2-го типа введение базального инсулина в течение дня не требуется. При выборе пролонгированного базального инсулина мы руководствуемся теми же соображениями, что и при выборе базального инсулина при комбинированной терапии с пероральными сахароснижающими препаратами.
В исследовании 4Т установлен хороший терапевтический эффект сочетания аналогов инсулина аспарт и инсулина детемир, особенно если терапия начиналась с использования детемира, а вторым шагом в качестве интенсификации было назначение аналога инсулина аспарт. Побочные действия, такие как гипогликемия, увеличение массы тела, в значительной степени связанные с назначением инсулина короткого действия и его дозой, редко встречались при применении инсулинов аспарт и детемир. Поэтому при проведении базис-болюсной терапии у типичного больного следует обращать внимание на общую дозу инсулина и соотношение базального и пролонгированного компонентов [16].
Зачастую совершают ошибку, перенося правила интенсификации инсулинотерапии при СД 1-го типа на практику проведения прандиальной терапии при СД 2-го типа. В рамках обычных вариаций содержания углеводов в пище нет необходимости проводить подсчет углеводных единиц и, соответственно, расчет дозы инсулина. Только при очень значительных отклонениях в содержании углеводов от обычного уровня необходимо корректировать дозу прандиального инсулина — уменьшать или увеличивать. Это связано с тем, что с помощью прандиальной терапии в первую очередь подавляется глюконеогенез в печени. Следовательно, необходимая доза инсулина зависит от индивидуальной инсулинорезистентности, и количество употребляемых углеводов играет соподчиненную роль [17]. Это облегчает затраты на обучение.
Также нет необходимости в таком количестве определений сахара крови, как при СД 1-го типа. Только во время титрования дозы и изменения вида лечения требуется тщательный контроль гликемии с определением пре- и постпрандиальных показателей, с определением уровня сахара в 2–3 часа ночи. Только после завершения титрования дозы и при стабильном течении заболевания и отсутствии других факторов спустя некоторое время определяется гликемический профиль. Частота исследований устанавливается индивидуально и в случае необходимости дополняется отдельными исследованиями в другие дни.
Комбинированное лечение с пероральными сахароснижающими препаратами. Каждая вышеописанная терапия может сочетаться с метформином. Такой тип терапии оправдан с позиций доказательной медицины [18]. С помощью этого вида терапии удается уменьшить дозу инсулина, особенно ночью, и свести к минимуму прибавку массы тела. Разумеется, что при этом следует учитывать противопоказания к назначению метформина, о чем в последнее время много говорится, и что почти единственным противопоказанием к его назначению является хроническая почечная недостаточность [19].
Комбинированная терапия с производными сульфонилмочевины (глимепирид) имеет смысл только в том случае, когда доза инсулина менее 30 ЕД в сутки и достаточно одной инъекции. С точки зрения патофизиологии секреции инсулина имеет смысл сочетание базального инсулина на ночь и короткодействующих секретогенов натеглинида и репаглинида. Следует заметить, что это возможно только у пациентов с высоким уровнем комплайенса, т.к. необходимо принимать препараты перед каждым основным приемом пищи. Следует только учитывать, что длительно действующие секретогены приводят к быстрому исчезновению эндогенного резерва инсулина, о чем свидетельствуют данные исследования АDОРТ. В этом отношении более перспективным будет сочетание ингибиторов ДПП-4 и инсулина с учетом их позитивного влияния на дозу инсулина и динамику массы тела [20].
Перед началом инсулинотерапии необходимо проводить определение гликемического профиля с исследованием пре- и постпрандиальной гликемии. При этом следует обратить внимание, что около 25–30 % людей не завтракают. При выборе метода инсулинотерапии следует учитывать то, что терапия базальными инсулинами в первую очередь направлена на нормализацию гликемии натощак, а прандиальная терапия — на высокий постпрандиальный уровень показателей. Если сочетают прандиальную терапию с назначением базального инсулина (базис-болюс-терапия), то воздействие происходит как на постпрандиальную гликемию, так и на тощаковую. Это же происходит при введении смесей инсулина 2–3 раза в сутки.
При введении только базального инсулина достигается ограниченное влияние на динамику HbA1c. При высоких исходных показателях HbA1c следует с самого начала назначать прандиальную терапию, для того чтобы достичь целевых величин HbA1c. Наряду с этими метаболическими параметрами в первую очередь играют решающую роль желание и способность пациента, а также наличие сопутствующей патологии.
Терапия сочетанием базального инсулина с пероральными сахароснижающими препаратами и лечение смесями инсулинов являются самыми простыми вариантами, для которых характерны постоянные дозы инсулина, незначительное количество инъекций и определений гликемии. Поэтому они подходят для плохо обученных больных и тех, кто требует постороннего ухода, с высокими показателями HbA1c и кто с самого начала отказывался от инсулинотерапии. Гибкость этой схемы в повседневной жизни незначительна, особенно это касается питания, а эффект носит кратковременный характер.
Прандиальная терапия, особенно базис-болюс-терапия, является затратной, требует хорошего комплайенса пациента в плане проведения самоконтроля и инъекций, но она обеспечивает гибкость и гарантирует мотивированным пациентам при врачебном наблюдении долгосрочный эффект с достижением компенсации. В связи с наличием различных структурированных методов терапии, удобных средств введения, метаболической и митогенной безопасностью современных инсулинов календарный возраст уже не играет той роли, как ранее, при выборе приемлемой инсулинотерапии.
В заключение следует подчеркнуть, что стойкий успех инсулинотерапии обеспечивают доверительные и откровенные беседы с пациентом, оптимальная индивидуально подобранная терапия, а также длительный контакт с профессиональным и опытным эндокринологом и непрерывное обучение.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.
Список литературы
1. Sokolova L.K. Insulin therapy for patients with diabetes mellitus. When? To whom? For what purpose? www.iem.net.ua (in Ukrainian).
2. Von Bibra H. et al. Effects of analogue insulin in multiple daily injection therapy of type 2 diabetes on postprandial glucose control and cardiac function compared to human insulin: a randomized controlled long-term study. Cardiovasc. Diabetol. 2016. 15 (1). 7.
3. Lovre D., Fonseca V. Benefits of timely basal insulin control in patients with type 2 diabetes. J. Diabetes Complications. 2015. 29 (2). 295-301.
4. Meah F., Juneja R. Insulin tactics in type 2 diabetes. Med. Clin. North Am. 2015. 99 (1). 157-186.
5. Holman R.R., Farmer A.J., Davies M.J. et al. Three-year efficacy of complex insulin regimens in type 2 diabetes. N. Engl. J. Med. 2009. 361 (18). 1736-1747. doi: 10.1056/NEJMoa0905479.
6. McBrien K.A., Manns B.J., Chui B. et al. Health care costs in people with diabetes and their association with glycemic control and kidney function. Diabetes Care. 2013. 36 (5). 1172-1180. doi: 10.2337/dc12-0862.
7. Freemantle N., Danchin N., Calvi-Gries F., Vincent M., Home P.D. Relationship of glycaemic control and hypoglycaemic episodes to 4-year cardiovascular outcomes in people with type 2 diabetes starting insulin. Diabetes Obes. Metab. 2016. 18 (2). 152-158. doi: 10.1111/dom.12598.
8. Garber A.J., Abrahamson M.J., Barzilay J.I. et al. Consensus statement by the American Association of Clinical Endocrinologists and American College of endocrinology on the comprehensive type 2 diabetes management algorithm — 2017 executive summary. Endocr. Pract. 2017. 23 (2). 207-238. doi: 10.4158/EP161682.CS.
9. Gerstein H.C., Bosch J., Dagenais G.R. et al. Basal insulin and cardiovascular and other outcomes in dysglycemia. N. Engl. J. Med. 2012. 367 (4). 319-328. doi: 10.1056/NEJMoa1203858.
10. Beck R.W., Riddlesworth T.D., Ruedy K. et al. Continuous glucose monitoring versus usual Care in Patients with Type 2 diabetes receiving multiple daily insulin injections: a randomized trial. Ann. Intern. Med. 2017. 167 (6). 365-374. doi: 10.7326/M16-2855.
11. Riddle M.C., Bolli G.B., Ziemen M. et al. New insulin glargine 300 units/mL versus glargine 100 units/mL in people with type 2 diabetes using basal and mealtime insulin: glucose control and hypoglycemia in a 6-month randomized controlled trial (EDITION 1). Diabetes Care. 2014. 37 (10). 2755-2762. doi: 10.2337/dc14-0991.
12. Holman R.R., Thorne K.I., Farmer A.J. et al. Addition of biphasic, prandial, or basal insulin to oral therapy in type 2 diabetes. N. Engl. J. Med. 2007. 357 (17). 1716-1730. doi: 10.1056/NEJMoa075392.
13. Buse J.B., Wolffenbuttel B.H., Herman W.H. et al. DURAbility of basal versus lispro mix 75/25 insulin efficacy (DURABLE) trial 24-week results: safety and efficacy of insulin lispro mix 75/25 versus insulin glargine added to oral antihyperglycemic drugs in patients with type 2 diabetes. Diabetes Care. 2009. 32 (6). 1007-1013. doi: 10.2337/dc08-2117.
14. Strange P. Treat-to-target insulin titration algorithms when initiating long or intermediate acting insulin in type 2 diabetes. J. Diabetes Sci Technol. 2007. 1 (4). 540-548. doi: 10.1177/193229680700100412.
15. Harper R., Donnelly R., Bi Y., Bashan E., Minhas R., Hodish I. Dynamics in insulin requirements and treatment safety. J. Diabetes Complicat. 2016. 30 (7). 1333-1338. doi: 10.1016/j.jdiacomp.2016.05.017.
16. Hodish I. Can the current healthcare delivery model cope with advanced type 2 diabetes? J. Diabetes Compl. 2015. 29 (3). 321-322. doi: 10.1016/j.jdiacomp.2015.01.005.
17. Hayward R.A., Reaven P.D., Wiitala W.L. et al. Follow-up of glycemic control and cardiovascular outcomes in type 2 diabetes. N. Engl. J. Med. 2015. 372 (23). 2197-2206. doi: 10.1056/NEJMoa1414266.
18. Ganz M.L., Wintfeld N.S., Li Q., Lee Y.C., Gatt E., Huang J.C. Severe hypoglycemia rates and associated costs among type 2 diabetics starting basal insulin therapy in the United States. Curr. Med. Res. Opin. 2014. 30 (10). 1991-2000. doi: 10.1185/03007995. 2014.936930.
19. Gamble J.M., Chibrikov E., Twells L.K. et al. Association of insulin dosage with mortality or major adverse cardiovascular events: a retrospective cohort study. Lancet Diabetes Endocrinol. 2017. 5 (1). 43-52. doi: 10.1016/S2213-8587 (16)30316-3.
20. Mora P., Buskirk A., Lyden M., Parkin C.G., Borsa L., Petersen B. Use of a novel, remotely connected diabetes management system is associated with increased treatment satisfaction, reduced diabetes distress, and improved glycemic control in individuals with insulin-treated diabetes: first results from the personal diabetes management study. Diabetes Technol. Ther. 2017. 19 (12). 715-22.

/87.jpg)
/88.jpg)