Международный неврологический журнал Том 16, №1, 2020
Вернуться к номеру
Ефективність застосування кверцетину в пацієнтів з ішемічним інсультом і коморбідною патологією
Авторы: Прокопів М.М.(1), Рогоза С.В.(1), Поливода М.В.(2)
(1) — Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
(2) — Лікарня Дніпровського району м. Херсона, м. Херсон, Україна
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
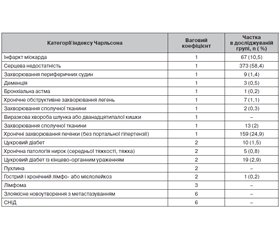
Актуальність. На сьогодні існує необхідність упровадження ефективного й безпечного патогенетичного лікування мозкового інсульту, направленого на захист нейронів від ішемічного пошкодження. Коморбідна патологія в пацієнтів з ішемічним інсультом може істотно впливати на перебіг захворювання й ефективність відновлення порушених функцій. Метою дослідження було вивчення впливу кверцетину на функціональний результат гострого періоду ішемічного інсульту, що виник у хворих на фоні соматичної патології. Матеріали та методи. Наведені результати аналізу 639 випадків гострого мозкового ішемічного інсульту залежно від застосованої схеми лікування й рівня коморбідності. Результати. Досліджувані групи пацієнтів були порівнянними за показниками вихідного неврологічного дефіциту. 98 % з них мали коморбідну патологію з діапазоном значень від 1 до 8 балів за індексом Чарльсона (середнє значення 3,75 ± 1,40 бала). Пацієнти з високим рівнем коморбідності продемонстрували гірші показники функціонального відновлення в гострому періоді ішемічного інсульту за модифікованою шкалою Ренкіна (3,3 ± 1,6 бала) порівняно з пацієнтами з низьким рівнем коморбідності (2,2 ± 1,4 бала) (p < 0,01, U). Вивчення ефективності різних схем лікування на фоні коморбідної патології показало вірогідну ефективність призначення кверцетину в пацієнтів із високою коморбідністю. Серед пацієнтів із низькою коморбідністю не було відзначено статистично значущих відмінностей за показниками інвалідизації і виживання хворих у гострому періоді ішемічного інсульту. Висновки. У 98 % хворих з ішемічним інсультом виявляється коморбідна патологія, що негативно впливає на показники виживання й функціонального відновлення хворих у гострому періоді ішемічного інсульту. Гірші показники функціонального відновлення продемонстрували пацієнти з високим рівнем коморбідності за індексом Чарльсона. Застосування кверцетину в гострому періоді ішемічного інсульту показало високу ефективність у хворих із високим рівнем коморбідності, що підтвердило мультимодальний спектр його терапевтичних ефектів. Індивідуальний підбір лікувальних заходів у хворих з ішемічним інсультом з урахуванням супутньої патології підвищує ефективність лікування.
Актуальность. На сегодняшний день существует необходимость внедрения эффективного и безопасного патогенетического лечения мозгового инсульта, направленного на защиту нейронов от ишемического повреждения. Коморбидная патология у пациентов с ишемическим инсультом может оказывать существенное воздействие на течение заболевания и влиять на эффективность восстановления нарушенных функций. Целью исследования было изучение влияния кверцетина на функциональный исход острого периода ишемического инсульта, возникшего у больных на фоне соматической патологии. Материалы и методы. Представлены результаты анализа 639 случаев острого мозгового ишемического инсульта в зависимости от применявшейся схемы лечения и уровня коморбидности. Результаты. Исследуемые группы пациентов были сопоставимы по показателям исходного неврологического дефицита. 98 % из них имели коморбидную патологию с диапазоном значений от 1 до 8 баллов по шкале Чарльсона (среднее значение 3,75 ± ± 1,40 балла). Пациенты с высоким уровнем коморбидности продемонстрировали худшие показатели функционального восстановления в остром периоде ишемического инсульта по шкале инвалидизации (3,3 ± 1,6 балла) по сравнению с пациентами с низким уровнем коморбидности (2,2 ± 1,4 балла) (p < 0,01, U). Изучение эффективности разных схем лечения на фоне коморбидной патологии показало достоверную эффективность назначения кверцетина у пациентов с высокой коморбидностью. Среди пациентов с низкой коморбидностью не было отмечено статистически значимых различий по показателю инвалидизации и выживаемости больных в остром периоде ишемического инсульта. Выводы. У 98 % больных с ишемическим инсультом выявляется коморбидная патология, которая негативно влияет на показатели выживания и функционального восстановления у больных в остром периоде ишемического инсульта. Худшие показатели функционального восстановления продемонстрировали пациенты с высоким уровнем коморбидности по индексу Чарльсона. Применение кверцетина в остром периоде ишемического инсульта продемонстрировало высокую эффективность у больных с высоким уровнем коморбидности, что подтвердило мультимодальный спектр его терапевтических эффектов. Индивидуальный подбор лечебных мероприятий у больных с ишемическим инсультом с учетом сопутствующей патологии повышает эффективность лечения.
Background. Nowadays, there is a necessity to introduce effective and safe pathogenetic treatment of cerebral stroke, aimed to protect neurons from ischemic damage. Comorbidity in patients with ischemic stroke can have a significant effect on the course of the disease and effectiveness of the recovery of impaired functions. The purpose of the study was to investigate the effects of quercetin on the functional outcome of the acute period of ische-mic stroke in patients with comorbidity. Materials and methods. An analysis of 639 cases of the acute cerebral ischemic stroke depending on the treatment regimen and the level of comorbidity was performed. Results. The studied groups of patients were comparable in terms of the initial neurological deficit. 98 % of them had comorbid pathology with a range of Charlson comorbidity index from 1 to 8 points (average values of 3.75 ± 1.40). Patients with a high level of comorbidity had worse functional recovery in the acute period of ischemic stroke on the Rankin scale (3.3 ± 1.6 points) compared to the patients with a low level of comorbidity (2.2 ± 1.4 points) (p < 0.01, U). The efficacy of quercetin in patients with ischemic stroke and high comorbidity was shown. Among patients with low comorbidity, there were no statistically significant differences in terms of disability and survival rate in the acute period of ischemic stroke. Conclusions. In 98 % of patients with ischemic stroke, comorbid pathology is detected. The negative effect of comorbidity on survival and functional recovery in patients with acute ischemic stroke is shown. The worst indicators of functional recovery by the Charlson comorbidity index were demonstrated in patients with a high level of comorbidity. The use of quercetin in the acute period of ischemic stroke was very effective in patients with high levels of comorbidity, which confirmed the multimodal spectrum of its therapeutic effects. Individual selection of therapeutic measures in patients with ischemic stroke and comorbidities increases the efficacy of treatment.
ішемічний інсульт; кверцетин; лікування; функціональний результат; індекс коморбідності Чарльсона; соматична патологія
ишемический инсульт; кверцетин; лечение; функциональный исход; индекс коморбидности Чарльсона; соматическая патология
ischemic stroke; quercetin; treatment; functional outcome; Charlson comorbidity index; somatic pathology
Вступ
Матеріали та методи
Результати та обговорення
Висновки
1. Барабой В.А. Биоантиоксиданты. Киев: Книга плюс, 2006. 461 с.
2. Виничук С.М., Мохнач В.А., Прокопив М.М., Турчина Н.С., Унич П.П., Трепет Л.Н. Окислительный стресс при остром ишемическом инсульте и его коррекция с внедрением антиоксиданта мексидола. Междунар. невролог. журн. 2006. № 1(5). С. 18-22.
3. Виничук С.М., Прокопив М.М., Черенько ТМ. Поиск новых подходов в лечении острого ишемического инсульта. Укр. неврол. журн. 2010. № 1(14). С. 8-19.
4. Вирстюк А.А., Герасимчук Р.Д. Клиническая эффективность комплексной терапии острого ишемического инсульта на фоне метаболического синдрома с внедрением препарата «корвитин». Украинский неврологический журнал. 2009. № 3. С. 18-29.
5. Виничук С.М., Прокопив М.М., Трепет Г.С. Клиническое и биохимическое обоснование целесообразности комплексного использования Цераксона и Корвитина в лечении острого ишемического инсульта. Международный неврологический журнал. 2011. № 1(39). С. 67-79.
6. Зозуля И.С., Сыч Н.С., Боброва В.И. Возможности лечения когнитивных и эмоциональных нарушений в остром периоде инфаркта мозга. Международный неврологический журнал. 2013. № 5(59). С. 23-31.
7. Ковалев В.Б., Ковчан В.В., Колчина Е.Ю. Механизмы лечебного действия биофлавоноида кверцетина (обзор литературы). Укр. мед. альманах. 1999. Т. 2. № 4. С. 176-184.
8. Кузнецова С.М., Егорова М.С., Скрипченко А.Г. Клинические аспекты применения кверцетина у больных, перенесших ишемический инсульт. Журнал неврологии им. Б.М. Маньковского. 2014. Т. 1. № 3. С. 34-40.
9. Мищенко Т.С., Дмитриева Е.В. Комбинированная терапия препаратами Корвитин и Аксотилин в лечении больных с ишемическим инсультом. Междунар. неврол. журн. 2018. № 1(95). С. 31-36.
10. Мойбенко А.А. Патогенетическое обоснование эффективности нового отечественного кардиопротектора корвитин (водорастворимого кверцетина) при остром инфаркте миокарда. Вестник фармакологии и фармации. 2007. № 5. С. 38-47.
11. Мойбенко А.А. Эндогенные механизмы кардиопротекции как основа патогенетической терапии заболеваний сердца. Київ: Наукова думка, 2008. 511 с.
12. Пархоменко А.Н., Кожухов С.Н. Эффективность внутривенной формы блокатора 5-липоксигеназы кверцетина у больных с инфарктом миокарда и синдромом острой сердечной недостаточности: возможная свиязь с коррекцией метаболизма оксида азота. Украинский медицинский журнал. 2005. Т. 46. № 3–4. С. 45-51.
13. Сучасні принципи діагностики і лікування пацієнтів із гострим ішемічним інсультом і ТІА: Клінічні рекомендації, засновані на доказах. Київ, 2018.
14. Уніфікований клінічний протокол медичної допомоги. Ішемічний інсульт (екстрена, первинна, вторинна (спеціалізована) медична допомога, медична реабілітація). Наказ Міністерства охорони здоров’я України 03.08.2012 № 602 «Про затвердження та впровадження медико-технологічних документів зі стандартизації медичної допомоги при ішемічному інсульті» [Електрон-ний ресурс]. URL: http://www.dec.gov.ua/mtd/reestr.html.
15. Barreca D., Bellocco E., D’Onofrio G., Nabavi S.F., Daglia M., Rastrelli L., Nabavi S.M. Neuroprotective Effects of Quercetin: From Chemistry to Medicine. CNS & Neurological Disorders — Drug Targets. 2016. 15(8). 964-975.
16. Charlson M.E., Pompei P., Ales K.L., MacKenzie C.R. A new method of classifying prognostic comorbidity in longitudinal studies: development and validation. J. Chronic. Dis. 1987. Vol. 40. P. 373-383.
17. Costa L.G., Garrick J.M., Roquè P.J., Pellacani C. Mechanisms of Neuroprotection by Quercetin: Counteracting Oxidative Stress and More. Oxid. Med. Cell Longev. 2016. 2016. 2986796. doi:10.1155/2016/2986796.
18. Feinstein A.R. The pre-therapeutic classification of comorbi-dity in chronic disease. J. Chronic Dis. 1970. Vol. 23(7). P. 455-468.
19. Goldstein L.B., Samsa G.P., Matchar D.B., Horner R.D. Charlson index comorbidity adjustment for ischemic stroke outcome studies. Stroke. 2004. Vol. 35. P. 1941-1945.
20. Eid H.M., Haddad P.S. The Antidiabetic Potential of Quercetin: Underlying Mechanisms. Current Medicinal Chemistry. 2017. 24. 355.
21. Middleton E. Jr, Kandaswami C. Theoharides T.C. The effects of plant flavonoids on mammalian cells: implications for inflammation, heart disease, and cancer. Pharmacol. Rev. 2000. Vol. 52. № 4. P. 673-751.
22. Rankin J. Cerebral vascular accidents in patients over the age of 60: II. Prognosis. Scottish Med. J. 1957. Vol. 2. P. 200-213.
23. Oboh G., Ademosun A.O., Ogunsuyi O.B. Quercetin and Its Role in Chronic Diseases. Gupta S., Prasad S., Aggarwal B. (eds.). Drug Discovery from Mother Nature. Advances in Experimental Medicine and Biology. 2016. Vol. 929.
24. Patel R.V., Mistry B.M., Shinde S.K., Syed R., Singh V., Shin H.S. Therapeutic potential of quercetin as a cardiovascular agent. Eur. J. Med. Chem. 2018 Jul 15. 155. 889-904.
25. Sahebkar A. Effects of quercetin supplementation on lipid profile: A systematic review and meta-analysis of randomized controlled trials. Critical Reviews in Food Science and Nutrition. 2017. 57. 4. 666-676.

/55.jpg)
/56_2.jpg)
/56.jpg)