Вступ
Набута гемолітична анемія — це швидко прогресуючий невідкладний стан, що виникає внаслідок аномального передчасного розпаду еритроцитів і потребує негайної корекції та лікування. Гемоліз може відбуватися внутрішньосудинно або позасудинно (у селезінці та/або печінці) внаслідок низки причин, проте часто його етіологія залишається нез’ясованою [1, 2].
Автоімунна гемолітична анемія (AIГA) — це гетерогенна група захворювань, в основі яких спостерігається декомпенсований набутий гемоліз, обумовлений виробленням імунною системою хазяїна антитіл, що діють проти власних антигенів еритроцитів і спричинюють їх руйнування [1]. Якщо це руйнування досить інтенсивне і перевищує здатність кісткового мозку до регенерації червоних кров’яних тілець, у пацієнта виникає анемія та супутні симптоми [2, 3].
Захворюваність у популяції становить приблизно 1 випадок на 100 000. Захворювання може виникати в будь-якому віці, але його частота зростає зі збільшенням віку [4]. AIГA є порівняно рідкісним захворюванням у дітей і найчастіше спостерігається після перенесеного вірусного захворювання, також її можна спостерігати у підлітків, часто на тлі основного системного захворювання. Хоча точна частота захворювання у дитячому віці невідома, кількість уражених дітей (< 20 років) оцінюється як менше за 0,2 на 100 000, а найвищі показники спостерігаються у дітей дошкільного віку [3]. Приблизно в 77 % випадків це захворювання має самообмежений перебіг та вимагає лише короткочасної терапії [1].
Клінічний випадок
Пацієнт В.Ш., 4-річний хлопчик, захворів гостро з підвищенням температури тіла до фебрильних цифр, появи нежитю та малопродуктивного кашлю. Сімейний лікар призначив амбулаторно цефтріаксон в/м. Однак через 5 днів у нього з’явився повторно фебрилітет, у зв’язку з чим 01.01.2019 р. він був госпіталізований у ТОДКЛ.
При надходженні загальний стан середньої тяжкості, обумовлений інтоксикаційним і диспептичним синдромами та дихальними розладами. Свідомість ясна. Шкірні покриви бліді, чисті. Задня стінка ротоглотки гіперемована. На другу добу госпіталізації з’явилися нестійкі випорожнення до 7 разів на добу, водянисто-кашкоподібні, з домішками крові (одноразово).
Дані аналізів при надходженні
Загальний аналіз крові (01.01.19 р.): Нb 112 г/л, еритроцити 3,75 × 1012/л, Ht 0,35, КП 0,85, лейкоцити 4,5 × 109/л, ШОЕ 5 мм/год, паличкоядерні нейтрофіли — 10 %, сегментоядерні нейтрофіли — 44 %, лімфоцити — 37 %, моноцити — 1 %, еозинофіли — 1 %, плазматичні клітини — 1 %.
Загальний аналіз сечі (02.01.2019 р.): варіант норми.
Дані рентгенологічного дослідження органів грудної порожнини (01.01.19 р.): дані про двобічну бронхопневмонію.
Враховуючи наявні клініко-лабораторні прояви, хлопчику був виставлений діагноз: ГРВІ з абдомінальним синдромом. Позалікарняна двобічна пневмонія, неускладнена, 3-го ступеня, ДН І ст., гострий перебіг.
Хлопчику було призначено цефтріаксон в/в, смекту, інфузійну дезінтоксикаційну терапію.
04.01.2019 р. під час забору зразка крові для біохімічного аналізу у пацієнта різко погіршився стан: хлопчик став млявим, сонливим, зросла блідість. У зв’язку з цим об 11:30 його було переведено з інфекційно-боксованого відділення у відділення анестезіології та інтенсивної терапії (ВАІТ).
На момент надходження у ВАІТ загальний стан дитини тяжкий. Хлопчик притомний, млявий. Виражена воскоподібна блідість шкірних покривів. Із анамнезу: дитина від 1-ї вагітності, 1-х фізіологічних пологів. Маса тіла при народженні 3 кг 850 г. Виписаний з пологового будинку на 3-тю добу. Алергологічний анамнез: атопічний дерматит, набряк Квінке у дитинстві. Перенесені захворювання: ГРЗ, інфекційний мононуклеоз в 1 рік. Профілактичні щеплення отримав за індивідуальним графіком. У контакті з інфекційними хворими протягом 21 дня не перебував.
Об’єктивно: температура тіла 38,3 °С. Менінгеальні симптоми негативні. Зіниці D = S, фотореакція жвава. Дихання самостійне, ритмічне, вільне, через верхні дихальні шляхи. ЧД 24 на 1 хв. Кашель вологий. Аускультативно над легенями вислуховувалося жорстке дихання, крепітуючі хрипи справа. SpO2 98–99 %. Діяльність серця ритмічна, тони приглушені, систолічний шум в II точці. ЧСС 136 на 1 хв, пульс задовільних властивостей. АТ 115/65 мм рт.ст. Живіт симетричний, піддутий, при пальпації болючість у ділянці лівого підребер’я. Печінка +1,5 см. Селезінка пальпувалася на рівні нижнього краю грудної клітки. Периферичні набряки відсутні. Фізіологічні відправлення не порушені.
Для діагностики стану було повторно зроблено такі аналізи.
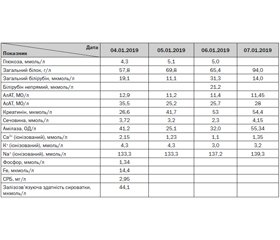
Загальний аналіз крові (04.01.19 р., 11:30): Нb 57 г/л, еритроцити 2,58 × 1012/л, Ht 0,16, лейкоцити 13,88 × 109/л, ШОЕ 69 мм/год, тромбоцити 400 × 109/л, паличкоядерні нейтрофіли — 5 %, сегментоядерні нейтрофіли — 34 %, лімфоцити — 39 %, моноцити — 5 %, мієлоцити — 6 %, метамієлоцити — 3 %, еозинофіли — 7 %, плазматичні клітини — 1 %, гіпохромія значної кількості еритроцитів, анізоцитоз (+), пойкілоцитоз (+), тривалість кровотечі — 1 хв, час зсідання — з 3 хв 15 с до 4 хв 10 с. Зміни показників у динаміці подані у табл. 1.
Біохімічний аналіз крові (04.01.19 р.): дані надані в табл. 2.
Кров на групу і резус-фактор (04.01.2019 р.): В(ІІІ) Rh+.
Коагулограма (04.01.2019 р.): ПЧ — 14,6 с, ПІ — 72,5 %, АЧТЧ — 23,5 с, ТЧ — 14,6 с, фібрин плазми — 1,5 г/л, МНВ — 1,33.
ЕФГДС: даних про шлунково-кишкову кровотечу на час огляду немає.
На підставі проведеного клініко-лабораторного дослідження було виставлено основний діагноз: «автоімунна набута гемолітична анемія, арегенераторний криз, тяжкий перебіг», супутній діагноз: «позалікарняна двобічна пневмонія, неускладнена, 3-го ступеня, ДН 0 ст., гострий перебіг».
Проведене лікування у ВАІТ. Режим — ліжковий.
Етіологічне: левофлокс по 150 мг 2 р/д, в/в.
Патогенетичне:
— преднізолон в/в: 04.01.2019 р. — 120 мг; 05.01.2019 р. — 120 мг; 06.01.2019 p. — 120 мг; 07.01.2019 р. — 120 мг; 08.01.2019 р. — 120 мг;
— метилпреднізолон (солумедрол) в/в: 04.01.2019 р. — 500 мг; 05.01.2019 р. — 250 мг; 06.01.2019 р. — 150 мг; 07.01.2019 р. — 150 мг; 08.01.2019 р. — 75 мг;
— біовен моно 5% в/в: 04.01.2019 р. — 400 мл; 05.01.2019 р. — 100 мл;
— октагам 5% в/в: 05.01.2019 р. — 400 мл; 06.01.2019 р. — 400 мл; 07.01.2019 р. — 200 мл; 08.01.2019 р. — 200 мл.
Симптоматично: флуконазол, фолієва кислота, вітамін В12, фосфалюгель у вікових дозах.
З огляду на те, що погіршення стану дитини відбулося на тлі антибактеріальної терапії (цефтріаксон), також спостерігались підвищення температури тіла до фебрильних цифр, підвищення ШОЕ (50 мм/год) і лейкоцитоз (38,0 × 10/9л), було запідозрено можливість розвитку синдрому системної запальної відповіді (SIRS). За відсутності вірогідних ознак гемолізу консиліарно було вирішено призначити антибіотик фторхінолонового ряду.
Стояло питання про переливання крові. Але під час проведення індивідуальної проби на сумісність було відхилено 20 пакетів одногрупної крові через прояви несумісності. Враховуючи, що агресивна імуносупресивна терапія (комплексне призначення глюкокортикостероїдів із високими дозами імуноглобулінів) дозволила зупинити гемоліз, питання про переливання крові було зняте.
Обговорення
Хоча AIГA є порівняно рідкісним захворюванням у дітей, випадки набутого гемолізу можуть спостерігатися на тлі або після перенесених інфекцій чи бути ускладненням основного системного захворювання.
Набута гемолітична анемія може виникати внаслідок різних причин.
Токсична набута гемолітична анемія може розвинутися:
— під дією гемолітичних отрут (сполуки миш’яку, свинцю, нітробензол, фенілгідразин, алкоголь, жовчні кислоти, токсичні продукти азотистого обміну, зміїна, бджолина, грибна отрути);
— збудників інфекційних і паразитарних хвороб (гемолітичний стрептокок, анаеробні мікроорганізми, малярійний плазмодій, лейшманія, бартонела).
Імунна (гетеро-, ізо-, автоімунна) гемолітична анемія виникає:
— при переливанні видо-, групо- і резус-несумісної крові;
— резус-несумісності матері і плода;
— утворенні автоантитіл до власних еритроцитів у випадку зміни їх антигенних властивостей (внаслідок дії лікарських засобів, вірусів, радіації);
— виникненні мутантного клона лімфоцитів, що утворюють антитіла до нормальних еритроцитів (при лейкозі, системному червоному вовчаку тощо).
Механічна гемолітична анемія спостерігається:
— у разі механічного ушкодження еритроцитів протезами кровоносних судин і клапанів серця;
— тривалої ходьби або бігу по твердому грунту (маршева гемоглобінурія);
— спленомегалії, коли еритроцити проходять крізь звужені синусоїдні капіляри збільшеної селезінки.
Набута гемолітична анемія може виникати під дією інших фізичних факторів, наприклад іонізуючого випромінювання, ультразвуку.
Патогенез. Механізм гемолізу при набутій гемолітичній анемії полягає в ушкодженні структури мембрани еритроцитів. У разі імунної гемолітичної анемії антитіла IgG і IgM приєднують до мембрани еритроцитів комплемент, який при цьому активується і зумовлює лізис мембран (імунний комплементзалежний гемоліз). У випадку холодової імунної гемолітичної анемії, що спостерігається при деяких інфекціях, зумовлених вірусом Епштейна — Барр, Mycoplasma pneumoniae, а також у пізніх стадіях сифілісу, у разі хронічного лімфолейкозу гемоліз еритроцитів відбувається за температури крові 4–18 °С (частіше в судинах кінцівок). Це пов’язано зі здатністю IgM (холодові антитіла) активувати комплемент за зниженої температури.
Під дією гемолітичних факторів у мембрані еритроцита утворюються пори, крізь які з клітини виходять іони калію, фосфати, а іони натрію надходять у клітину. Унаслідок іонного дисбалансу вода проникає в еритроцит, що набухає, набуває сферичної форми. Його здатність змінювати конфігурацію знижується. Коли об’єм еритроцита сягає критичного (146 % від початкового), а розмір пор їх мембрани перевищує 6 нм, настає гемоліз із виходом гемоглобіну в плазму.
Гемоліз еритроцитів при набутій гемолітичній анемії відбувається переважно в кровоносному руслі (внутрішньосудинний гемоліз). Проте в разі резус-конфлікту (гемолітична хвороба новонароджених) антирезусні аглютиніни, що утворилися в організмі жінки з резус-негативною кров’ю, зумовлюють гемоліз резус-позитивних еритроцитів плода або новонародженого не тільки всередині судин, а й у печінці та селезінці (внутрішньоклітинний гемоліз).
Серологічно випадки поділяються на АІГА з тепловими антитілами (65 %), холодовими антитілами (хвороба холодових аглютинінів (29 %), а також пароксизмальну холодову гемоглобінурію (1 %)) та змішаний тип (≈ 5 %). Приблизно половина випадків є первинними (ідіопатичними) AIГA, а половина — вторинними внаслідок основних порушень [1].
Пацієнти з AIГA можуть мати симптоми анемії (слабкість — у 88 %, запаморочення — в 50 %, задишка — у 9 % випадків), гемолізу (жовтяниця — в 21 %, темна сеча — в 3 %) або прояви основного розладу [5]. Без основного захворювання дані при фізикальному обстеженні можуть бути незначними чи виявляти легку блідість або спленомегалію. Рідше тяжкий гемоліз призводить до гепатоспленомегалії, гемоглобінурії та ознак серцевої недостатності [6]. При хворобі холодових аглютинінів акроціаноз, індукований холодом (синюшні кінцівки, кінчики носа або вух), або синдром Рейно зустрічаються у 40–90 % пацієнтів [7]. При пароксизмальній холодовій гемоглобінурії симптоми виникають протягом кількох хвилин або годин після впливу холоду та включають біль у спині, нижніх кінцівках, животі, озноб і лихоманку, червоний або червоно-коричневий колір першої порції сечі [2].
Діагностичний алгоритм у пацієнтів із підозрою на AIГA передбачає відповідь на три запитання: 1) чи наявний гемоліз; 2) чи є причиною гемолізу автоімунний процес; 3) який серологічний тип AIГA?
Типові лабораторні дані у пацієнтів з гемолізом включають підвищення білірубіну (некон’югованого), збільшення кількості ретикулоцитів, зниження гаптоглобіну, підвищену активність ЛДГ. У мазках крові зазвичай виявляються анізоцитоз, пойкілоцитоз, поліхромазія, сфероцитоз або аглютинація. Про імунну етіологію свідчить позитивний прямий антиглобуліновий тест (з антитілами анти-IgG або анти-C3d, що проявляють максимальну активність при температурі 37 °C, при АІГА з тепловими антитілами; з антитілами IgM анти-C3d при АІГА з холодовими антитілами) [2]. Взагалі сучасний діагностичний алгоритм при AIГA передбачає, що у випадку виявлення прямого антиглобулінового тесту, позитивного до IgG та С3d, пацієнта необхідно перевірити на наявність холодових антитіл. Скринінгово можна застосувати тест прямої аглютинації: клінічно значущий холодовий гемаглютинін може бути виключений, якщо нормалізовані еритроцити, суспендовані фізіологічним розчином, не аглютинуються сироваткою пацієнта після інкубації при кімнатній температурі протягом 30–60 хв [8]. Якщо цей тест є позитивним, необхідне подальше дослідження, щоб відрізнити незначні показники поліклональних холодових аглютинінів від хвороби холодових аглютинінів. Зразки для титру та теплової амплітуди (максимальна температура, при якій антитіла зв’язують еритроцити in vitro) слід зберігати при 37 °C для транспортування [1].
Оскільки пацієнти з гемолітичною анемією можуть потребувати гемотрансфузії, важливо визначити групу крові та Rh-фактор, а також рекомендовано K-антиген [1].
Метою лікування АІГА є контроль над гемолізом з мінімальними побічними ефектами. Пацієнти з легким компенсованим гемолізом можуть не потребувати активної терапії. Загальна лікувальна стратегія у випадку АІГА передбачає невідкладні (рятівні) заходи та залежить від етіологічних чинників. У випадку, коли є підозра на медикаментозну гемолітичну анемію, введення препарату, що міг спричинити гемоліз, слід негайно припинити, якщо діагностовано інфекційне захворювання, слід призначити етіологічну терапію.
Гемотрансфузія показана при анемії тяжкого ступеня. Слід пам’ятати, що повне дослідження на визначення групи крові та сумісність займає 4–6 годин. Приблизно у 30 % пацієнтів із АІГА виявляють основні аллоантитіла (найчастіше Rh або K) [8]. Втім, якщо анемія стає загрозливою для життя, рекомендують переливання одногрупної, сумісної за Rh або K антигенами, крові, не чекаючи на повне серологічне визначення типу гемолітичної анемії. У пацієнтів з холодовими антитілами доцільним є переливання зігрітої крові та забезпечення теплого середовища.
Для пригнічення автоімунних процесів рекомендується введення імуноглобулінів. Дані низки випадків свідчать про те, що 40 % пацієнтів виявляли добру реакцію на внутрішньовенне введення імуноглобуліну у дозі 0,4–0,5 г/кг/добу протягом 5 днів, а в нашому випадку мало місце 2 г/кг/добу. Показником ефективності терапії було припинення падіння гемоглобіну з подальшим відновленням його рівня у більшості випадків протягом 3 тижнів.
Призначення глюкокортикостероїдів більш показане при хворобі холодових аглютинінів, втім терапевтичний ефект стероїдів є позитивним у 14–69 % таких пацієнтів. Дослідження ефективності преднізолону продемонструвало, що його призначення у дозі 1 мг/кг/добу може розглядатися як невідкладна терапія. Вивчення застосування метилпреднізолону також показало його позитивну роль у надзвичайних випадках, але ризик серйозних інфекцій також може зростати [1, 9]. При АІГА з тепловими антитілами приблизно 80 % пацієнтів реагують на кортикостероїди в дозі, еквівалентній 60–100 мг преднізолону на добу, і приблизно дві третини досягають повної ремісії. Терапевтичний ефект може розвиватися протягом кількох тижнів, але відсутність відповіді через 21 день свідчить про нечутливість до стероїдів.
Докази ефективності переливання плазми крові при АІГА є обмеженими і подаються у повідомленнях про клінічні випадки. Цей метод застосовують у пацієнтів з тяжким гемолізом, поєднуючи з іншими методами терапії, такими як імуносупресія, оскільки його дія є тимчасовою [8].
Препаратом другого ряду при АІГА з тепловими антитілами є ритуксимаб, що призначається за стандартною схемою — 375 мг/м2 щотижня протягом чотирьох тижнів поспіль — та, за різними джерелами, забезпечує повну ремісію у 79–100 % випадків [1].
Крім препаратів невідкладної терапії у гострому періоді в подальшому слід пам’ятати про профілактику тромбоемболії (призначення препаратів низькомолекулярного гепарину), застосування фолієвої кислоти у вікових дозах для попередження мегалобластної анемії при хронічному перебігу АІГА, призначення гастропротекторів для мінімізації ульцерогенної дії кортикостероїдів тощо.
У резистентних випадках АІГА розглядається можливість спленектомії, призначення таких імуносупресивних препаратів, як азатіоприн, циклоспорин, даназол тощо.
Висновки
Особливістю поданого випадку є критичне наростання анемії за відсутності класичних ознак гемолізу, унеможливлення проведення гемотрансфузії у зв’язку з індивідуальною несумісністю з донорською кров’ю та позитивна динаміка при призначенні високих доз кортикостероїдів і імуноглобуліну.
Оскільки прояви АІГА є неспецифічними, але можуть розвиватися швидко і прогресувати до загрозливих для життя станів, слід формувати настороженість у педіатрів щодо АІГА та підвищувати рівень знань про правильний діагностичний алгоритм у таких випадках.
Завданням лікування АІГА є контроль над гемолізом з мінімальними побічними ефектами від призначеної терапії та досягнення повної ремісії. Препаратами вибору є внутрішньовенні імуноглобуліни в імуносупресивній дозі та глюкокортикоїди коротким курсом. При наявності проб несумісності крові, що унеможливлює трансфузію еритроцитів, необхідно збільшувати дозу глюкокортикоїдів і імуноглобуліну до позитивного ефекту. В критичному випадку показана трансфузія перфторанів.
Інформація про внесок кожного автора в підготовку статті: Никитюк Світлана Олексіївна — концепція і дизайн дослідження, збирання матеріалів, написання тексту; Галіяш Наталя Богданівна — аналіз отриманих даних, написання та редагування тексту; Галич Михайло Михайлович — збирання матеріалів, редагування тексту; Борис Зоряна Ярославівна — збирання матеріалів, редагування тексту; Яцюк Марія Йосипівна — збирання матеріалів та аналіз отриманих даних.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.

/55.jpg)
/56.jpg)