Вступ
У наш час пресинкопальні й синкопальні стани, що є проявом вегетативної дисфункції (ВД) унаслідок ортостатичної інтолерантності (нестійкості), зустрічаються в 40 % населення, причому в половини — протягом підліткового періоду, найчастіше — у віці 15 років [9, 32]. Ці стани суттєво дезадаптують дітей і їхніх батьків [38]. Частіше ортостатична інтолерантність відмічається в дівчаток [8], у 5–10 разів більше — у пацієнтів з еозинофільними гастроінтестинальними розладами, ніж у загальній популяції [19].
Слід зазначати, що пацієнту із симптомами ортостатичної інтолерантності діагноз встановлюється через 6–72 міс. (у середньому через 24 міс.), половині пацієнтів — через 1–3 роки [16].
Серед основних клінічних форм ортостатичної інтолерантності — початкова ортостатична гіпотензія (ОГ), що відмічається переважно в юному віці; істинна ортостатична гіпотензія (нейрогенна й ненейрогенна); вазовагальні синкопе; синдром постуральної тахікардії (СПОТ) [30, 32].
ОГ — зниження систолічного артеріального тиску (АТ) ≥ 20 мм рт.ст. і/або діастолічного артеріального тиску ≥ 10 мм рт.ст. без підвищення частоти серцевих скорочень (ЧСС) протягом 3 хвилин після переходу у вертикальне положення [8] з положення лежачи або нахилу голови не менше ніж 60° при виконанні тилт-тесту [17].
У 2018 р. робочою групою з діагностики й лікування синкопальних станів Європейського кардіологічного товариства критерії ОГ були доповнені — зниження систолічного АТ < 90 мм рт.ст., особливо в пацієнтів із систолічним АТ у положенні лежачи на спині < 110 мм рт.ст. [12].
ОГ є кардинальним проявом ВД унаслідок недостатнього контролю ВНС за постуральним гомеостазом [16].
СПОТ — клінічно гетерогенний розлад, що триває понад 3 міс., зі складними патофізіологічними механізмами, що маніфестує симптомами ортостатичної інтолерантності, зокрема ортостатичною тахікардією (збільшення ЧСС при переході в ортоположення як мінімум на 30 уд/хв або наявність ЧСС понад 120 уд/хв при тривалому стоянні) без ортостатичної гіпотензії [8, 11, 23, 41].
Вважається, що критерієм СПОТ у підлітків є наявність симптомів ортостатичної інтолерантності та ВД при збільшенні ЧСС ≥ 40 уд/хв при використанні тилт-тесту [10]. Однак при вивченні особливостей СПОТ у підлітків встановлено, що в групах пацієнтів, у яких ЧСС збільшилась в ортоположенні на 30–39 уд/хв і ≥ 40 уд/хв або ЧСС понад 120 уд/хв при тривалому стоянні, частота й прояви основних 28 симптомів СПОТ практично не відрізнялись [10].
Етіологія та патогенез
У нормі в сидячому положенні близько 30 % крові знаходиться в грудній клітці, при переході з горизонтального положення у вертикальне відбувається гравітаційно обумовлений перерозподіл об’єму крові, 10–15 % її депонується у венах нижніх кінцівок, у результаті чого зменшуються венозне повернення до серця, на 20 % знижується ударний об’єм. Швидкість мозкового кровотоку при цьому уповільнюється на 3–12 %, частково через зниження на 20 мм рт. тиску церебральної перфузії [13].
Ці гемодинамічні зміни провокують компенсаторну рефлекторну активацію барорецепторів (дуги аорти, каротидних синусів, серця, легеневих судин), яка, у свою чергу, обумовлює рефлекторне посилення симпатичної і пригнічення парасимпатичної іннервації. У результаті звужуються резистивні та ємнісні судини у вісцеральному, шкірно-м’язовому й нирковому судинних руслах. Це спричинює незначне зниження систолічного й незначне підвищення діастолічного АТ на фоні помірного зростання ЧСС. Саме системна вазоконстрикція є ключовим механізмом підтримки АТ у вертикальному положенні, більш значущим, ніж збільшення ЧСС. Крім вегетативної нервової системи (ВНС), у регулюванні ортостазу бере участь і ренін-ангіотензин-альдостеронова система. Нормальна адаптивна відповідь на перехід у вертикальне положення триває приблизно 60 с. Більш тривалі гемодинамічні зміни в ортостазі вважаються патологічними.
Порушення механізмів адаптації до вертикального положення призводить до ортостатичної інтолерантності. Серед причин — зміни норадренергічної нейротрансмісії, при цьому постгангліонарні симпатичні нейрони не виділяють достатньої кількості норадреналіну. Це призводить до порушення вазоконстрикції, неадекватного приросту ЧСС і зниження об’єму циркулюючої крові. Зокрема, барорефлекторна недостатність лежить в основі неадекватних змін АТ (наприклад, зниження АТ у спеку або в жарких приміщеннях, при фізичному навантаженні, у тому числі при ортостатичному стресі).
Суттєве зниження АТ безпосередньо після вставання відображає невідповідність між серцевим викидом і периферичним судинним опором, для підтримки хвилинного об’єму крові даний стан швидко компенсується збільшенням ЧСС. Некомпенсована ОГ викликає церебральну гіпоперфузію, спричиняючи запаморочення або втрату свідомості [33]. Синкопальні стани в дітей є результатом переважно неадекватної реакції на ортостатичний стрес унаслідок гіпоперфузії головного мозку через недостатні компенсаторні можливості ВНС [9]. Зміни ВНС можуть відбуватися під впливом вірусної інфекції, вакцинації, травми, оперативного втручання, психосоціального стресу тощо [16]. Суттєві порушення вегетативного забезпечення діяльності у дітей відмічаються в несприятливі метеодні [1, 2]. Лікарські засоби, що пригнічують симпатичну активацію судин, наприклад нейролептики або інгібітори моноаміноксидази, також викликають ОГ [22, 40].
Описано три основні патологічні механізми СПОТ (рис. 1): автоімунні розлади, ненормальна підвищена симпатична активність і вивільнення катехоламінів або симпатична денервація, що веде до центральної гіповолемії і рефлекторної тахікардії [8, 16]. Також у пацієнтів зі СПОТ виявляється знижена вагальна барорефлекторна чутливість [20] і зменшення серцевого викиду [34]. У пацієнтів наявний як мінімум один із цих механізмів [23].
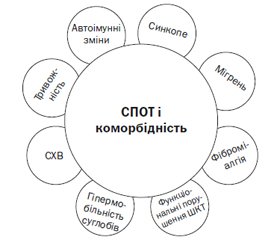
Серед проявів коморбідності СПОТ (дані стани роблять внесок у перебіг ортостатичної інтолерантності) — синдром хронічної втоми [37], хронічне порушення відпочинку, швидка втрата маси тіла, синдром гіпермобільності, тривожність, гастроінтестинальні розлади тощо [32] (рис. 2). У більшості пацієнтів зі СПОТ відмічається когнітивна дисфункція, зокрема зниження уваги й робочої пам’яті [29].
У пацієнтів з ортостатичною інтолерантністю без тахікардії та ортостатичної гіпотензії виявляють гіпокапнічну церебральну гіпоперфузію в ортоположенні [26].
Клініка
ОГ може супроводжуватися симптомами, а може бути безсимптомною. Основні клінічні прояви ортостатичної інтолерантності — головокружіння, головний біль, біль у грудній клітці, слабість, швидка втомлюваність, збліднення обличчя, пре- і синкопальні стани [38]. Причому такі симптоми, як запаморочення, тахікардія, пре- і синкопе, головний біль, проблеми з концентрацією уваги, відмічаються більше ніж у 90 % пацієнтів.
Також пацієнти часто відмічають зниження фізичної працездатності, затуманення голови, порушення дихання, гастроінтестинальні розлади й м’язово-скелетний біль [15], слабість у нижніх кінцівках («ватність» ніг), нечіткість (розпливчастість) зору, «мушки» перед очима, нудоту, біль у ділянці шиї, що поширюється на субокципітальні зони, задню поверхню шиї і плечі, ортостатичну задишку [17].
Втрата свідомості при ОГ зазвичай відбувається поступово, але може виникнути й раптово.
Напади серцебиття також є частим симптомом ОГ і пресинкопальних станів. Обстеження 142 дітей віком у середньому 10,12 ± 2,88 року із серцебиттям неясної природи показало, що в 79 дітей (55,6 %) серцебиття пояснюється порушенням функцій ВНС. Серед цих пацієнтів у 38 (48,1 %) виявлена ОГ, у 36 (45,6 %) — вазовагальні синкопе вазодепресивного типу, у 5 (6,3 %) — вазовагальні синкопе змішаного типу [18].
Для діагностики пацієнтів із пресинкопальними станами й ортостатичною інтолерантністю високоінформативні кардіоваскулярні вегетативні тести [39]. Серед найбільш чутливих і специфічних методів діагностики — активна кліноортостатична проба (КОП). Нормальна реакція на КОП визначається відсутністю скарг, підвищенням ЧСС на 20–40 % від початкової, збільшенням систолічного й діастолічного АТ не більше ніж на 5–15 % (залежно від початкового). Зниження пульсового АТ у процесі ортостатичної проби не перевищує 50 %. На 3–4-й хвилині після дослідження показники в практично здорових дітей повертаються до вихідних цифр. Виділяють 5 патологічних варіантів реакції гемодинаміки на проведення КОП: із надмірним включенням симпатоадреналової системи (гіперсимпатикотонічний), із недостатнім включенням симпатоадреналової системи (асимпатикотонічний, гіпердіастолічний), змішані варіанти (симпатоастенічний, астеносимпатичний) [2].
Для діагностики ВД, особливо синкопальних станів, останнім часом використовують тилт-тест (від англійського tilt — «нахил»). Проба є чутливою і достатньо легко відтворюється, вона проводиться в добре провітрюваному приміщенні не раніше ніж через 1,5–2 години після вживання їжі. Пробі передує 15-хвилинний відпочинок пацієнта в положенні лежачи на спині на спеціальному поворотному столі, пристебнутого спеціальним ременем безпеки, із закріпленими нижніми кінцівками. Потім стіл із пацієнтом переводиться у вертикальне положення (під кутом 60° щодо горизонтальної площини), ноги при цьому перебувають унизу. Під час проби впродовж 30 хвилин або до появи симптомів нездужання обстежуваний перебуває в розслабленому стані. Після закінчення проби пацієнта повертають у вихідне горизонтальне положення [2]. Тилт-тест корисний для визначення недостатності симпатичної норадренергічної системи [14]. Також застосовують тест із нахилом голови (head-up tilt test), тест із нахилом голови з медикаментозною провокацією. Доведено, що тест із нахилом голови підтверджує наявність ВД у підлітків із функціональними розладами травного тракту (порушенням моторики, румінацією, вісцеральною гіпералгезією) [42] і хронічною нудотою [36].
Визначення АТ і ЧСС в ортоположенні є важливим діагностичним методом скринінгу й реєстрації ОГ і СПОТ [21]. Діагностичні критерії ортостатичної інтолерантності: а) 5 і більше епізодів; б) ортостатична гіпотензія, СПОТ або синкопе при стоянні або під час тилт-тесту; в) не є проявом іншого захворювання або розладу. Вірогідні критерії ортостатичної інтолерантності: а) 5 і більше епізодів; б) принаймні один із симптомів: генералізована слабість/швидка втомлюваність, труднощі з концентрацією уваги або мисленням, тахікардія/серцебиття; в) не є проявом іншого захворювання або розладу [21].
Доведено, що тривалість симптомів і зниження максимальної ЧСС у вертикальному положенні є незалежними показниками ризику тяжкого перебігу [35].
Лікування
Для цілеспрямованого лікування важливо встановити основний діагноз. Передусім слід виключити причини, не пов’язані з ураженням нервової системи (наприклад, крововтрата, зневоднення, серцево-судинні й ендокринні порушення), і виявити ознаки первинних вегетативних порушень і вегетативних периферичних нейропатій. Велике значення мають психотерапія і кінезитерапія [4].
Пацієнти з ОГ повинні бути ознайомлені з низкою простих заходів, що застосовуються при загостренні симптоматики. Рекомендують вести щоденник АТ, регулярно його вимірювати й відмічати симптоми, що з’являються при зміні положення тіла або після прийому їжі. При медикаментозно індукованій ОГ необхідно скоригувати фармакотерапію. Терапія ОГ може бути направлена також на збільшення надходження натрію, уникання швидких постуральних змін, використання еластичного одягу, споживання достатньої кількості води (дотримання питного режиму) [24].
Для розробки ефективних методів лікування СПОТ важливо усвідомлювати багатофакторність патогенезу і роль коморбідних станів [28]. Велике значення має освіта пацієнтів із проблем СПОТ [8]. Перша лінія лікування СПОТ — адекватне споживання води й солі, фізичні вправи [37]. Встановлено, що оральна регідратація в пацієнтів із СПОТ підвищує церебральний кровотік і покращує ортостатичну толерантність [25], зменшує когнітивний дефіцит [29].
За результатами низки досліджень доведено роль фізичного навантаження в корекції вегетативного забезпечення в дітей [15, 27, 31].
На даний час відсутній золотий стандарт фармакотерапії ортостатичної інтолерантності в дітей, завданням фармакотерапії є покращення якості життя пацієнтів [37]. У дорослих пацієнтів при певних типах ОГ застосовують симпатоміметики, бета-блокатори [33]. Використання антидепресантів не було ефективним. Так, через 4 години сертралін викликав у пацієнтів із СПОТ виражений пресорний ефект: вірогідно вищим порівняно з плацебо в сидячому положенні був систолічний АТ (106 ± 12 мм рт.ст. проти 101 ± 8 мм рт.ст., p = 0,041), діастолічний АТ (72 ± 8 мм рт.ст. проти 69 ± 8 мм рт.ст., p = 0,022), середній АТ (86 ± 9 мм рт.ст. проти 81 ± 9 мм рт.ст., p = 0,007), але це не знижувало ЧСС в ортоположенні й не покращувало симптоми СПОТ [24]. Досліджується ефективність лікарських засобів, що контролюють серцевий ритм, підвищують периферичну вазоконстрикцію і внутрішньосудинний об’єм [15]. Терапія інсомнії була більш ефективною в дівчаток-підлітків [10].
У низці досліджень було встановлено роль амінокислот, седативних фітозасобів, вітаміну В6 і препаратів магнію в покращанні вегетативного забезпечення діяльності за даними КОП [3]. Так, 58 дітей віком 6–9 років із ВД вживали протягом 2 тижнів препарати Когівіс (група І — 28 дітей) по 5 мл 2 рази на добу і Сілента (група ІІ — 30 дітей) по 10 мл 2 рази на добу (сиропи виробництва Perrery Farmaсeutici S.r.l., Італія). Когівіс містить по 35 мг аспарагіну моногідрату й DL-фосфосерину, 32,5 мг N-ацетил-L-глутаміну, 0,75 мг вітаміну В6; Сілента — 50 мг L-триптофану, 278,2 мг цитрату магнію (у тому числі магнію 30 мг) і сухі екстракти квіток ромашки аптечної, листя меліси лікарської, суцвіть липи широколистої. У наших попередніх роботах [5, 6] описано механізм впливу компонентів даних препаратів.
Зокрема, відомо, що глутамін — замінна найпоширеніша вільна амінокислота, що містить не один, а два атоми азоту, тому є матеріалом для побудови амінокислот в організмі, а крім того, є попередником головних збуджуючих та інгібуючих нейротрансмітерів мозку, а також відіграє ключову роль у регуляції синтезу глутатіону, а отже, в антиоксидантному захисті. Аспарагінова кислота забезпечує нейронну збудливість через аспарагін-зв’язане глікозилювання каналів Т-типу. DL-фосфосерин бере участь в активації, регенерації і диференціюванні нейронів; синтезі й вивільненні нейромедіаторів, знижує вироблення стресового гормону кортизолу в надниркових залозах. Піридоксин сприяє функціонуванню гіпокампу [5].
Магній, будучи антагоністом глутаматного рецептора, завдяки зменшенню інтенсивності оксидативного стресу й нейронального апоптозу відіграє важливу нейропротекторну роль. L-триптофан забезпечує утворення нікотинамідних коферментів, серотоніну, мелатоніну і за рахунок цього зменшує прояви оксидативного стресу, стрес-реактивність, тривожність, імпульсивність, регулює добові ритми. Комбінація екстрактів квіток ромашки аптечної, листя меліси лікарської, суцвіть липи широколистої гармонізує баланс збудливих і гальмівних процесів у центральній нервовій системі; зменшує психоемоційне напруження, дратівливість, страхи, тривожність, психовегетативні прояви [6].
Через 1 міс. лікування препаратами Когівіс і Сілента в дітей відмічено нормалізацію об’ємного кровотоку й тонусу церебральних судин (у 39,7 і 70,5 % пацієнтів відповідно), венозного відтоку (у 49,9 %), мікроциркуляції (у 33,8 %), згідно з даними КОП, з 22 до 60 % зросла кількість дітей із нормальним вегетативним забезпеченням діяльності, тобто зникли прояви ортостатичної інтолерантності. Найбільш виражена позитивна динаміка соматичного й вегетативного статусу після прийому Сіленти відмічалась у дітей із гіперсимпатикотонічною реактивністю (схильність до СПОТ), тоді як у групі дітей, які приймали Когівіс, найкраща відповідь на лікування була при асимпатикотонічній вегетативній реактивності (схильність до ОГ). Автори рекомендують за наявності в пацієнтів ваготонії вихідного вегетативного тонусу розпочинати корекцію з препарату Когівіс, а за наявності симпатикотонії — з препарату Сілента.
Висновки
Отже, у дітей і підлітків із ВД часто відмічається ортостатична інтолерантність. Її клінічними проявами є ОГ, СПОТ, пре- і синкопальні стани. У патогенезі ОГ ключову роль відіграє недостатність барорецепторної чутливості й норадренергічної нейротрансмісії, тоді як СПОТ є відображенням підвищеної симпатичної активності й низки коморбідних станів (синдром хронічної втоми, гастроінтестинальні й алергічні розлади, тривожність тощо). Лікування ортостатичної інтолерантності включає достатній питний режим, зміни фізичної активності. Встановлено доцільність застосування препарату Когівіс у дітей із проявами ОГ і препарату Сілента — у дітей зі СПОТ.
Конфлікт інтересів. Не заявлений.
Список литературы
1. Бурлай В.Г., Кухта Н.М., Місюра Л.І. та ін. Вегетативні дисфункції у дітей: підсумки проведених досліджень. Педіатрія, акушерство та гінекологія. 2006. № 2. С. 24-27.
2. Вегетативні дисфункції у дітей: навчальний посібник / В.Г. Майданник, О.І. Сміян, Т.П. Бинда, Н.О. Савельєва-Кулик. Суми: Сумський державний університет, 2014. 186 с.
3. Квашніна Л.В., Майдан І.С., Ігнатова Т.Б. Можливі шляхи корекції порушень вегетативного гомеостазу в дітей молодшого шкільного віку. Здоров’я дитини. 2019. Т. 14. № 2. С. 2-7.
4. Хайтович М.В. Ефективність психотерапії та релаксаційної гімнастики в комплексному лікуванні вегетативних дисфункцій у дітей. Автореф. дис. ... канд. мед. наук. Київ, 1996. 25 с.
5. Хайтович М.В. Когнітивна дисфункція у дітей: можливості фармакологічної корекції із застосуванням комплексу амінокислот та вітаміну В6. Міжнародний неврологічний журнал. 2019. Т. 103. № 3. С. 32-37.
6. Хайтович М.В. Фармакологічна корекція стрес-індукованих вегетативних порушень та інсомнії у дітей. Міжнародний неврологічний журнал. 2018. Т. 102. № 8. С. 38-43.
7. Хайтович М.В., Бурлай В.Г., Місюра Л.І., Клець Т.Д. Особливості вегетативного гомеостазу у несприятливі метеодні. Педіатрія, акушерство та гінекологія. 1997. № 3. С. 42-43.
8. Åberg I., Mattsson G., Magnusson P. Postural orthostatic tachycardia syndrome. Lakartidningen. 2018. 115. pii: FAUW.
9. Arnold A.C., Ng J., Lei L., Raj S.R. Autonomic Dysfunction in Cardiology: Pathophysiology, Investigation, and Management. Can. J. Cardiol. 2017. Vol. 33. № 12. Р. 1524-1534.
10. Boris J.R., Bernadzikowski T. Utilisation of medications to reduce symptoms in children with postural orthostatic tachycardia syndrome. Cardiol. Young. 2018. Vol. 28. № 12. P. 1386-1392.
11. Boris J.R., Huang J., Bernadzikowski T. Orthostatic heart rate does not predict symptomatic burden in pediatric patients with chronic orthostatic intolerance. Clin. Auton. Res. 2019. Epub ahead of print.
12. Brignole M., Moya A., de Lange F.J. et al. 2018 ESC Guidelines for the diagnosis and management of syncope. Eur. Heart. J. 2018. Vol. 39. № 21. P. 1883-1948.
13. Carey B.J., Manktelow B.N., Panerai R.B., Potter J.F. Cerebral autoregulatory responses to head-up tilt in normal subjects and patients with recurrent vasovagal syncope. Circulation. 2001. Vol. 104. P. 898-902.
14. Cheshire W.P. Jr, Goldstein D.S. Autonomic uprising: the tilt table test in autonomic medicine. Clin. Auton. Res. 2019. Vol. 29. № 2. P. 215-230.
15. Fedorowski A. Postural orthostatic tachycardia syndrome: clinical presentation, aetiology and management. J. Intern. Med. 2019. Vol. 285. № 4. P. 352-366.
16. Fedorowski A., Ricci F., Sutton R. Orthostatic hypotension and cardiovascular risk. Kardiol. Pol. 2019. [Epub ahead of print].
17. Freeman R., Wieling W., Axelrod F.B. et al. Consensus statement on the definition of orthostatic hypotension, neurally mediated syncope and the postural tachycardia syndrome. Clin. Auton. Res. 2011. Vol. 21. № 2. P. 69-72.
18. Gan T., Wu L., Zou R. et al. Relationship between unexplained palpitation in children and head-up tilt test. Zhong Nan Da Xue Xue Bao Yi Xue Ban. 2018. Vol. 43. № 3. P. 282-286.
19. Huang K.Z., Dellon E.S. Increased prevalence of autonomic dysfunction due to postural orthostatic tachycardia syndrome in patients with eosinophilic gastrointestinal disorders. J. Gastrointestin. Liver Dis. 2019. Vol. 28. № 1. P. 47-51.
20. Jacob G., Diedrich L., Sato K. et al. Vagal and Sympathetic Function in Neuropathic Postural Tachycardia Syndrome. Hypertension. 2019. Vol. 73. № 5. P. 1087-1096.
21. Kim H.A., Bisdorff A., Bronstein A.M. et al. Hemodynamic orthostatic dizziness/vertigo: Diagnostic criteria. J. Vestib. Res. 2019. Vol. 29. № 2–3. P. 45-56.
22. Leung J.Y., Barr A.M., Procyshyn R.M. et al. Cardiovascular side-effects of antipsychotic drugs: the role of the autonomic nervous system. Pharmacol. Ther. 2012. Vol. 135. № 2. P. 113-122.
23. Mar P.L., Raj S.R. Postural Orthostatic Tachycardia Syndrome: Mechanisms and New Therapies. Annu Rev. Med. 2019. [Epub ahead of print].
24. Mar P.L., Raj V., Black B.K. et al. Acute hemodynamic effects of a selective serotonin reuptake inhibitor in postural tachycardia syndrome: a randomized, crossover trial. J. Psychopharmacol. 2014. Vol. 28. № 2. P. 155-161.
25. Medow M.S., Guber K., Chokshi S. et al. The Benefits of Oral Rehydration on Orthostatic Intolerance in Children with Postural Tachycardia Syndrome. J. Pediatr. 2019. Vol. 214. P. 96-102.
26. Novak P. Hypocapnic cerebral hypoperfusion: A biomarker of orthostatic intolerance. PLoS One. 2018. Vol. 13. № 9. e0204419.
27. Oksanen P., Tulppo M.P., Auvinen J. et al. Associations of fitness and physical activity with orthostatic responses of heart rate and blood pressure at midlife. Scand. J. Med. Sci Sports. 2019. Vol. 29. № 6. P. 874-885.
28. Raj S.R., Robertson D. Moving from the present to the future of Postural Tachycardia Syndrome — What we need. Auton. Neurosci. 2018. Vol. 215. P. 126-128.
29. Rodriguez B., Zimmermann R., Gutbrod K. et al. Orthostatic Cognitive Dysfunction in Postural Tachycardia Syndrome After Rapid Water Drinking. Front. Neurosci. 2019. Vol. 13. P. 327.
30. Shaw B.H., Stiles L.E., Bourne K. et al. The face of postural tachycardia syndrome — insights from a large cross-sectional online community-based survey. J. Intern. Med. 2019. Vol. 286. № 4. P. 438-448.
31. Speer K.E., Naumovski N., Semple S., McKune A.J. Lifestyle Modification for Enhancing Autonomic Cardiac Regulation in Children: The Role of Exercise. Children (Basel). 2019. Vol. 6 (11).
32. Stewart J.M., Boris J.R., Chelimsky G. et al. Pediatric Disorders of Orthostatic Intolerance. Pediatrics. 2018. Vol. 141. № 1. pii: e20171673.
33. Stumpf J.L., Mitrzyk B. Management of orthostatic hypotension. Am. J. Hosp. Pharm. 1994. Vol. 51. № 5. P. 648-660.
34. Tao C.Y., Li H.X., Li X.Y. et al. Hemodynamic changes in standing-up test of children and adolescents with postural tachycardia syndrome. Beijing Da Xue Xue Bao Yi Xue Ban. 2019. Vol. 51. № 3. P. 414-421.
35. Tao C., Lu W., Lin J. et al. Long-Term Outcomes of Children and Adolescents With Postural Tachycardia Syndrome After Conventional Treatment. Front. Pediatr. 2019. Vol. 7. P. 261.
36. Wagoner A.L., Tarbell S.E., Shaltout H.A. et al. Chronic nausea and orthostatic intolerance: Diagnostic utility of orthostatic challenge duration, Nausea Profile Questionnaire, and neurohumoral measures. Neurogastroenterol. Motil. 2018. Vol. 30. № 11. e13433.
37. van der Zalm T., Alsma J., van de Poll S.W.E. et al. Postural orthostatic tachycardia syndrome (POTS): a common but unfamiliar syndrome. Neth. J. Med. 2019. Vol. 77. № 1. P. 3-9.
38. Xu W.R., Liao Y., Jin H.F. et al. Progress in diagnosis and management of syncope in children. Beijing Da Xue Xue Bao Yi Xue Ban. 2017. Vol. 49. № 5. P. 756-759.
39. Yasa E., Ricci F., Holm H. et al. Cardiovascular Autonomic Dysfunction Is the Most Common Cause of Syncope in Paced Patients. Front. Cardiovasc. Med. 2019. № 6. P. 154.
40. Zandee W.T., Alsma J., Birkenhäger T.K. et al. Hypertension en orthostatic hypotension during use of monoamine oxidase (MAO) inhibitors. Tijdschr. Psychiatr. 2017. Vol. 59. № 6. P. 366-371.
41. Zhao S., Tran V.H. Postural Orthostatic Tachycardia Syndrome (POTS). StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing, 2019.
42. Zhang L.N., Moak J.P., Desbiens J. et al. Utility of Diagnostic Studies for Upper Gastrointestinal Symptoms in Children with Orthostatic Intolerance. J. Pediatr. 2019. Vol. 205. P. 138-144.
/43.jpg)

/42.jpg)