Журнал «Актуальная инфектология» Том 8, №1, 2020
Вернуться к номеру
Ефективність декаметоксину проти складних вірусів, незалежно від їх антигенної будови: перспективи використання при сучасних вірусних захворюваннях дихальних шляхів
Авторы: Гуменюк М.І.(1), Гуменюк Г.Л.(1, 2), Опімах С.Г.(1)
(1) — Державна установа «Національний інститут фтизіатрії і пульмонології ім. Ф.Г. Яновського НАМН України», м. Київ, Україна
(2) — Національна медична академія післядипломної освіти ім. П.Л. Шупика, м. Київ, Україна
Рубрики: Инфекционные заболевания
Разделы: Справочник специалиста
Версия для печати
На межі 2019 і 2020 років почався спалах вірусної пневмонії, спричиненої новим коронавірусом Coronavirus disease 2019 (Covid-19). З історії спалахів тяжкого гострого респіраторного синдрому (Severe Acute Respiratory Syndrome, SARS) у 2002–2003 роках і близькосхідного дихального синдрому (Middle East Respiratory Syndrome, MERS) у 2012 році відомо, що ефективної та безпечної етіотропної терапії коронавірусної інфекції не існує. Тому актуальним викликом сьогодення постало питання боротьби з коронавірусною інфекцією. Потенційно ефективними противірусними засобами є антисептики групи поверхнево-активних речовин. Зокрема декаметоксин, що має виражену бактерицидну, фунгiцидну й протистоцидну дію, має ще й експериментально доведену противірусну активність. У дослідженнях in vitro показано, що препарат проявляє статистично значущу віруліцидну дію, впливаючи на позаклітинний вірус з можливим ушкодженням вірусної протеази. У дослідженнях на культурі тканин і на експериментальних тваринах доведена здатність декаметоксину зупиняти репродукцію вірусів грипу А і В, вірусу простого герпесу через вплив на етапі проникнення вірусу до клітини й реплікації вірусної нуклеїнової кислоти. Іншим механізмом дії декаметоксину є його вплив на ранні етапи взаємодії вірусу з клітиною хазяїна, такі як адсорбція, проникнення й депротеїнізація вірусу. Використання декаметоксину для лікування інфекційних уражень дихальних шляхів є патогенетично обґрунтованим завдяки лікарській формі стерильного розчину для інгаляційного застосування за допомогою небулайзера Декасан® однодозові контейнери. Декаметоксин успішно застосовується в лікуванні хворих з інфекційними загостреннями бронхіальної астми та хронічного бронхіту без негативного впливу на бронхіальну обструкцію. Доведена дієвість декаметоксину як ефективного засобу проти складних вірусів незалежно від їх антигенної будови дає підстави для його практичного застосування при інфекційних ураженнях дихальних шляхів, у тому числі при коронавірусній інфекції.
На рубеже 2019 и 2020 годов началась вспышка вирусной пневмонии, вызванной новым коронавирусом Coronavirus disease 2019 (Covid-19). Из истории вспышек тяжелого острого респираторного синдрома (Severe Acute Respiratory Syndrome, SARS) в 2002–2003 годах и ближневосточного дыхательного синдрома (Middle East Respiratory Syndrome, MERS) в 2012 году известно, что эффективной и безопасной этиотропной терапии коронавирусной инфекции не существует. Поэтому сегодня борьба с коронавирусной инфекцией является актуальным вызовом. Потенциально эффективными противовирусными средствами являются антисептики группы поверхностно-активных веществ. В частности, декаметоксин, который имеет выраженное бактерицидное, фунгицидное и протистоцидное действие, обладает еще и экспериментально доказанной противовирусной активностью. В исследованиях in vitro показано, что препарат проявляет статистически значимое вирулицидное действие, влияя на внеклеточный вирус с возможным повреждением вирусной протеазы. В опытах на культурах тканей и на экспериментальных животных доказана способность декаметоксина угнетать репликацию вирусов гриппа А и В, вируса простого герпеса путем влияния на этапе проникновения вируса в клетку и репликации вирусной нуклеиновой кислоты. Другим механизмом действия декаметоксина является его влияние на ранние этапы взаимодействия вируса с клеткой хозяина, такие как адсорбция, проникновение и депротеинизация вируса. Использование декаметоксина для лечения инфекционных поражений дыхательных путей является патогенетически обоснованным благодаря лекарственной форме стерильного раствора для ингаляционного применения с помощью небулайзера Декасан® однодозовые контейнеры. Декаметоксин успешно применяется в лечении больных с инфекционными обострениями бронхиальной астмы и хронического бронхита без негативного влияния на бронхиальную обструкцию. Доказанная действенность декаметоксина в качестве эффективного средства против сложных вирусов независимо от их антигенной структуры дает основания для его практического применения при инфекционных поражениях дыхательных путей, в том числе при коронавирусной инфекции.
At the end of the 2019 and the beginning of 2020, an outbreak of viral pneumonia caused by the new coronavirus Coronavirus disease 2019 (Covid-19) began. From the history of outbreaks of severe acute respiratory syndrome in 2002–2003 and the Middle East respiratory syndrome in 2012, it is known that an effective and safe etiotropic treatment of coronavirus infection does not exist. Therefore, the actual challenge today is the fight against coronavirus infection. Potentially effective antiviral agents are antiseptics from the group of surfactants. In particular, decamethoxin, which has a pronounced bactericidal, fungicidal and antiprotistal effect, also has experimentally proven antiviral activity. In vitro, it was shown that decamethoxin exhibits a statistically significant virucidal effect influencing the extracellular virus with possible damage to the viral protease. In experiments on the tissue cultures and experimental animals, the ability of decamethoxin to inhibit the replication of influenza A and B viruses, herpes simplex virus by affecting the stage of virus penetration into the cell and viral nucleic acid replication has been proved. Another mechanism of decamethoxin action can be considered its effect on the early stages of the interaction of the virus with the host cell such as adsorption, penetration and deproteinization of the virus. The use of decamethoxin for the treatment of respiratory tract infections is pathogenetically justified due to the dosage form of a sterile solution for inhalation using a nebulizer — Decasan® single-dose containers. Decamethoxin is successfully used in the treatment of patients with infectious exacerbations of bronchial asthma and chronic bronchitis without negative impact on bronchial obstruction. The proven efficacy of decamethoxin as an effective agent against complex viruses regardless of their antigenic structure gives grounds for its practical use in respiratory tract infections, including coronavirus infection.
коронавірусна інфекція; противірусні властивості; декаметоксин; небулайзерна терапія
коронавирусная инфекция; противовирусные свойства; декаметоксин; небулайзерная терапия
coronavirus infection; antiviral properties; decamethoxin; nebulizer therapy
31 грудня 2019 року Всесвітня організація охорони здоров’я (ВООЗ) отримала сповіщення про кілька випадків вірусної пневмонії в місті Ухань, китайська провінція Хубей. Це викликало занепокоєння, адже збудник не відповідав жодному іншому відомому вірусу й було невідомо, як він впливатиме на людей. Через тиждень, 7 січня 2020 року, влада Китаю підтвердила, що новим вірусом виявився коронавірус, який отримав назву Coronavirus disease 2019 (Covid-19) [1].
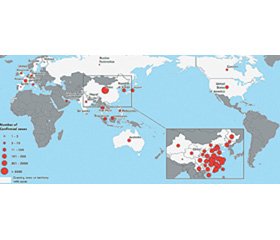
Станом на 10 лютого 2020 року у світі на Covid-19 інфекцію захворіло 37 558 осіб (усі випадки підтверджено). Серед них в Китаї захворіла 37 251 особа, померло 812, у тяжкому стані знаходяться 6188 пацієнтів. В інших країнах захворіло 307 осіб, помер 1 хворий. Усього за межами Китаю постраждали жителі 24 країн (рис. 1) [2].
Коронавіруси (CoV) — це велика родина вірусів, що викликають низку патологічних станів — від звичайної застуди до більш тяжких захворювань, таких як близькосхідний дихальний синдром (Middle East Respiratory Syndrome, MERS) і тяжкий гострий респіраторний синдром (Severe Acute Respiratory Syndrome, SARS). До загальних ознак зараження належать респіраторні симптоми, лихоманка, кашель, задишка й утруднення дихання. У більш тяжких випадках інфекція може спричинити пневмонію, тяжкий гострий респіраторний синдром, ниркову недостатність і навіть смерть. Новим коронавірусом (Covid-19) виявився новий штам, який раніше не був ідентифікований у людини [3]. Коронавіруси зоонотичні, тобто можуть передаватися між тваринами й людьми. Детальним дослідженням було встановлено, що SARS-CoV передається від кішок-цивет людям, а MERS-CoV — від верблюдів-дромедарів до людини. Відомі кілька коронавірусів, що циркулюють серед тварин, і на сьогодні немає фактів, що ними було інфіковано людину.
Згідно зі звітом міжнародного комітету з таксономії вірусів (International Committee on Taxonomy of Viruses, ICTV) [4], коронавіруси посідають таке місце в класифікації:
Царство Riboviria
Тип Negarnaviricota
Порядок Nidovirales
Підряд Cornidovirineae
Родина Coronaviridae
Підродина Coronavirinae (рис. 2).
Підродина Coronavirinae містить 4 роди вірусів:
— Alphacoronavirus (у тому числі 12 підродів, 34 види);
— Betacoronavirus (у тому числі 5 підродів, 12 видів);
— Deltacoronavirus (у тому числі 4 підроди, 7 видів);
— Gammacoronavirus (у тому числі 2 підроди, 2 види).
Вважається, що з чотирьох описаних родів коронавірусу альфа- і бета-коронавіруси походять від кажанів, тоді як гамма- і дельта-коронавіруси мають пташинне походження [6].
За структурою всі коронавіруси — це РНК-вмісні оболонкові віруси сферичної форми діаметром 120–160 нм. Геном коронавірусів представлений однонитчатою лінійною молекулою нефрагментованої РНК із позитивною полярністю (РНК+). Щільна суперкапсидна оболонка містить білок і поверхневий глюкопротеїд, під суперкапсидною оболонкою розташовані трансмембранні білки. У серцевині віріону — нуклеокапсид, один з білків з’єднаний з геномною РНК і входить до складу нуклеокапсиду [7].
Найбільш тяжкими захворюваннями людини, що були спричинені коронавірусами, є тяжкий гострий респіраторний синдром і близькосхідний дихальний синдром.
Перші випадки тяжкого гострого респіраторного синдрому, основними проявами якого були пневмонія і лихоманка, з’явилися у 2002 році в Китаї (рис. 3). Більших масштабів цей спалах набув в 2003 році, коли з березня по липень в усьому світі сталося понад 8000 випадків захворювання й загинуло 774 людини. Загальна смертність під час спалаху оцінювалася в 9,6 %. Переважною клінічною особливістю SARS була швидкість, з якою у багатьох пацієнтів розвивалися симптоми гострого респіраторного дистрес-синдрому. Це ускладнення траплялося приблизно в 16 % усіх хворих на SARS, у хворих із гострим респіраторним дистрес-синдромом смертність сягала 50 % [8].
На час епідемії SARS не було відомо, якими засобами можна ефективно лікувати хворих. Оскільки терміновість спалаху не дала часу на наукові дослідження, найперших пацієнтів лікували внутрішньовенним введенням рибавірину з огляду на його противірусну активність широкого спектра дії. Кортикостероїди й імуномодулюючі засоби часто призначалися емпірично. Незабаром після того, як SARS-CoV був визначений як збудник, були розпочаті дослідження, які виявили декілька противірусних засобів, що інгібували реплікацію SARS-CoV in vitro. Ці результати привели до експериментального використання інгібіторів протеази й інтерферону альфа (IFN-α) для лікування пацієнтів [8].
Проте при аналізі тридцяти повідомлень про інфікованих SARS пацієнтів, які отримували рибавірин, немає переконливих доказів того, що це лікування призвело до одужання. У трьох дослідженнях спостерігали гемолітичну анемію, визнану побічною дією цього лікування. Учені дійшли висновку, що будь-яке подальше використання рибавірину для лікування SARS повинно проводитися в рамках контрольованого дослідження, у якому пильна увага повинна приділятися несприятливим наслідкам. Повідомлялося про два дослідження щодо застосування комбінованої терапії IFN-α зі стероїдами і/або рибавірином, проведених у хворих на SARS. У результаті не спостерігалося суттєвої різниці в результатах між групою лікування IFN-α і групою, що отримувала інші схеми лікування. Результати обох досліджень були непереконливими через відсутність послідовної схеми лікування або відповідної контрольної групи [8].
Близькосхідний дихальний синдром був уперше виявлений у 2012 році, і з того часу це захворювання викликало широкий міжнародний інтерес до вирішення питань, пов’язаних з епідеміологією, клінічними особливостями й терапією коронавірусної інфекції. Станом на 23 червня 2019 року у 27 країнах світу було зареєстровано 2428 випадків інфекції MERS-CoV, більшість випадків пов’язані з Близьким Сходом (рис. 4). Поки були відомі три закономірності передачі вірусу MERS-CoV: спорадичні випадки, внутрішньосімейна передача та передача, пов’язана з наданням медичної допомоги (healthcare-associated transmission). Захворювання має високий рівень летальності — 34,5 % [10].
SARS-CoV і MERS-CoV — це бета-коронавіруси, що відрізняються один від одного, хоча й генетично пов’язані між собою. На момент спалаху MERS-CoV у роді бета-коронавірусу було описано чотири лінії: A, B (що включає SARS-CoV), C і D. MERS-CoV — це бета-коронавірус роду C, перший із цієї лінії, який, як відомо, заразив людей. Геном MERS-CoV кодує 10 білків: 2 реплікації поліпротеїну (ORFs 1a і 1b), включно з РНК-залежною РНК-полімеразою (RdRp); 4 структурні білки: оболонка (Е), М (мембрана), N (нуклеокапсид) і S (поверхневий шиповий глікопротеїн), і 4 неструктурні білки (ORFs 3, 4a, 4b і 5) [6].
З моменту появи інфекції MERS-CoV спостерігається великий інтерес до розробки ефективної терапії цього захворювання. Було проведено багато досліджень in vitro, що виявили противірусну властивість (проти MERS-CoV) різних препаратів, таких як: інтерферон (IFN), рибавірин та інгібітори протеази ВІЛ (нельфінавір, ритонавір і лопінавір), інгібітори злиття (fusion inhibitors) камостат і heptad repeat 2 peptide (hr2p), нітазоксанід, тейкопланін, циклоспорин, тореміфен, хлорпромазин і трифлупромазин, хлорохін, іматинібу мезилат і дазатиніб, саракатиніб, гемцитабін, ремдезивір. Ту чи іншу ефективність як противірусний засіб в експериментах на тваринах продемонстрували моноклональні антитіла проти MERS-CoV, інтерферон альфа-2а спільно з рибавірином, мофетил мікофенолату, лопінавір із ритонавіром, дипептилпептидаза-4 людини (hDPP4), гуманізовані антитіла mAb 4C2h, людський Fc-злитий варіант нейтралізації нанотіл (human-Fc-fused version of neutralizing nanobody NbMS10-Fc), антитіла до поліклонального імуноглобуліну людини G (IgG), рекомбінантний білок, що зв’язує тримерний рецептор (RBD-Fd).
Доступний клінічний досвід щодо терапії MERS-CoV у людини покладається на обмежені звіти про клінічні випадки й серії випадків спостереження. Найпоширеніша комбінація — рибавірин та IFN, але ці дослідження мають неоднорідний характер, тому не вдалося зробити загального висновку з твердими рекомендаціями щодо використання такої комбінації в звичайній клінічній практиці поза перспективними клінічними дослідженнями.
Так, при намаганнях застосовувати нові лікарські засоби для лікування інфекції MERS-CoV у 5 пацієнтів у 2013 році, які отримували рибавірин перорально та інтерферон альфа-2b підшкірно, на жаль, усі пацієнти померли через 1–2 місяці через респіраторну й поліорганну недостатність, а в чотирьох пацієнтів виникли такі побічні реакції на медикаменти, як тромбоцитопенія, анемія і панкреатит. У 2014 році було проведено ретроспективне когортне дослідження за 24 підтвердженими випадками MERS у Джидді, Саудівська Аравія; лікування було розпочато в перший день підтвердження MERS-CoV. Серед цих пацієнтів 13 отримували інтерферон α-2a підшкірно один раз на тиждень, а 11 пацієнтів отримували інтерферон β-1a підшкірно тричі на тиждень. Обидві групи також отримували рибавірин перорально. Рівень летальності становив 85 % у групі IFN-α-2a проти 64 % у групі IFN-β-1a (p = 0,24). Рівень летальності в пацієнтів, які застосовують IFN із позитивною RT-PCR MERS-CoV, становив 90 % проти 44 % у пацієнтів із негативним тестом RT-PCR на MERS-CoV [10].
На жаль, незважаючи на численні дослідження на людях, немає єдиної думки щодо оптимальної терапії для MERS-CoV. На сьогодні не було доведено ефективної терапії і не було затверджених методів лікування інфекції MERS-CoV міжнародними або національними товариствами [10].
У даний час вакцинопрофілактика коронавірусних інфекцій не розроблена. Стандартні рекомендації щодо запобігання поширенню інфекції включають регулярне миття рук, прикриття рота й носа при кашлі й чханні, ретельне приготування м’яса та яєць, уникнення тісного контакту з будь-ким, хто проявляє симптоми респіраторних захворювань, такі як кашель і чхання [3].
Щодо лікування коронавірусної інфекції тривають пошуки ефективної противірусної терапії. На сьогодні важливим практичним завданням є перегляд потенціалу протимікробних засобів широкого спектра дії, особливо з противірусною активністю, для терапії захворювання в таких хворих.
Потенційно ефективними противірусними засобами є антисептики групи поверхнево-активних речовин. Вони гальмують процес депротеїнізації вірусу в клітині шляхом зниження рівня рН, мають лізосомотропні властивості, завдяки чому можуть втручатися в процес репродукції вірусу в клітині, що призводить до гальмування процесу репродукції вірусу взагалі. Можна розраховувати також, що властивості цих препаратів будуть впливати на структуру й взаємодію рецепторів вірусу та клітин хазяїна, втручаючись у найбільш ранні етапи взаємодії вірусу з клітиною, що також призведе до гальмування процесу вірусної репродукції [12].
Властивості одного з представників таких засобів добре вивчені. Це декаметоксин, біс-четвертинна амонієва сполука, напівсинтетичний препарат, поверхнево-активний катіонний детергент із широкою протимікробною активністю. Декаметоксин чинить виражений бактерицидний вплив на стафiлококи, стрептококи, дифтерiйну й синьогнiйну палички, капсульнi бактерiї та фунгiцидну дiю — на дрiжджi, дрiжджоподiбнi гриби, збудники епiдермофiтiї, трихофiтiї, мiкроспорiї, еритразми, деякi види плiснявих грибiв (аспергiли, пенiцили), протистоцидну дiю — на трихомонади, лямблiї, вiрусоцидну дiю — на віруси. Утворення стiйких до декаметоксину форм мікроорганізмів при тривалому застосуваннi вiдбувається повiльно й не перевищує ефективних концентрацiй препарату. У процесi лiкування препаратом підвищується чутливість антибiотикорезистентних мiкроорганiзмiв до антибiотикiв. Препарат практично не всмоктується слизовими оболонками, неушкодженою шкiрою і рановою поверхнею [13].
Антимікробний спектр декаметоксину вивчено на 350 штамах мікроорганізмів (бактерії, віруси, гриби). На особливу увагу заслуговують результати експериментального вивчення противірусної активності декаметоксину. У дослідах на культурі тканин і на експериментальних тваринах доведена здатність декаметоксину зупиняти репродукцію вірусів грипу А і В, вірусу простого герпесу. Одержані дані розкривають перспективу профілактичного використання декаметоксину в період епідемій грипу, а також з метою запобігання внутрішньолікарняним вірусним інфекціям, що передаються з кров’ю (гепатити, СНІД тощо) [14].
Протимікробні властивості декаметоксину доведені в наукових дослідженнях, що засвідчено патентними документами, виданими на розробки. На тему застосування декаметоксину як протимікробного засобу проти бактерій роду Bulkholderia видано два охоронних документи — патент на корисну модель [15] і патент на винахід України [16]. Патент на корисну модель видано на предмет застосування декаметоксину як протимікробного засобу проти бактерій виду Pseudomonas aeruginosa [17]. Для лікування інфекційного загострення бронхіальної астми запатентовано як спосіб лікування [18], так і фармацевтичну композицію декаметоксину [19].
Противірусні властивості декаметоксину вивчалися в межах планових науково-дослідних робіт лабораторії біохімії Одеського науково-дослідного інституту вірусології та епідеміології ім. І.І. Мечникова «Дослідження протигрипозної та протигерпетичної ефективності деяких офіцинальних препаратів (амбен, унітіол, етоній, декаметоксин) для обґрунтування їх застосування у терапії масових вірусних інфекцій», «Обґрунтування розширення показань до застосування деяких препаратів як противірусних засобів» і лабораторії хіміотерапевтичних та імунобіологічних препаратів Українського науково-дослідного протичумного інституту ім. І.І. Мечникова «Дослідження антивірусної дії нових перспективних сполук та удосконалення деяких імунобіологічних препаратів», «Розробка імунобіологічних препаратів та дослідження антивірусних властивостей хіміопрепаратів» [20].
Декаметоксин гальмує процес утворення вірус-специфічних внутрішньоядерних включень на культурі клітин, що свідчить про можливий вплив препарату на такі стадії репродукції вірусу, як етап проникнення вірусу до клітини й реплікації вірусної нуклеїнової кислоти, що пояснюється хімічною природою декаметоксину, який є поверхнево-активною речовиною [21].
Іn vitro показано, що препарат проявляє статистично значущу віруліцидну дію, впливаючи на позаклітинний вірус. Отримані результати, що чутливими до декаметоксину є віруси грипу людини А (серопідтипи H1N1 і H3N2) і В, віруси грипу птахів (серопідтипи H5N3 і H7N3) незалежно від їх антигенної структури [21].
В експерименті на тваринах противірусну дію декаметоксину вивчали на моделі інфекції, яку отримували шляхом інтраназального зараження білих безпородних мишей. Розчин декаметоксину вводили інтраназально у дозі 50 мкг на мишу, яка була в 16 разів нижче за токсичну, за профілактичною, лікувально-профілактичною і лікувальною схемами. Інтраназальне введення декаметоксину за лікувально-профілактичною і лікувальною схемами статистично вірогідно захищало мишей, інфікованих вірусом грипу А/PR/8/34 (H1N1), знижуючи кількість загиблих тварин. Застосування препарату за всіма схемами супроводжувалось зниженням активності лужних протеаз у легенях інфікованих тварин. Титр інфекційного вірусу в гомогенатах легенів експериментальних тварин, які отримували декаметоксин, був нижчим, ніж у контрольних мишей, при всіх схемах введення на 4–5-ту добу після інфікування. Це збігається з даними літератури щодо використання препаратів із різним механізмом дії, які, знижуючи активність протеолітичних ферментів у легенях дослідних тварин, гальмували розвиток інфекційного процесу [21].
З метою вивчення механізмів противірусної дії декаметоксину досліджено його вплив на протеолітичну активність під час вірус-мембранної взаємодії. Для цього в модельних експериментах визначали протеолітичну активність як окремо в препаратах вірусу і мембран, так і після короткочасної взаємодії віріонів вірусу грипу з мембранами, під час якої утворювався вірус-мембранний комплекс. Встановлено, що декаметоксин чинив регулярний вплив на ензиматичну активність вірусу й вірус-мембранного комплексу і гальмував протеолітичні процеси на ранніх етапах репродукції вірусу грипу під час взаємодії вірусу з мембранами чутливих клітин. Механізм дії декаметоксину може бути пов’язаний із впливом на позаклітинний вірус і можливим ушкодженням вірусної протеази. Крім того, властивості цього препарату як поверхнево-активної речовини перешкоджали взаємодії вірусних і клітинних рецепторів, що й приводило до інгібування протеолітичної активності вірус-мембранного комплексу. Тобто іншим механізмом дії декаметоксину можна вважати його вплив на ранні етапи взаємодії вірусу з клітиною-хазяїном, такі як адсорбція, проникнення й депротеїнізація вірусу грипу. Стан системи протеолізу має важливе значення на ранніх етапах вірусної репродукції, а також для патогенезу й поширення інфекції в організмі [21].
У більш пізній роботі було досліджено чутливість вірусних збудників інфекційного загострення БА до декаметоксину in vitro. Визначення віруліцидної дії декаметоксину in vitro на моделях простих і складних тест-вірусів показало, що стосовно складних респіраторних вірусів, зокрема вірусу грипу, 0,02% розчин декаметоксину є ефективним дезінфікуючим засобом. Механізм його віруліцидної дії як поверхнево активної речовини може реалізуватись через руйнування ліпідного шару суперкапсидної оболонки вірусу, що походить із клітинної оболонки, модифікованої вірус-специфічними білками [22, 23].
Використання декаметоксину для лікування інфекційних уражень дихальних шляхів є патогенетично обґрунтованим завдяки лікарській формі стерильного розчину для інгаляційного застосування за допомогою небулайзера — Декасан® однодозові контейнери. Небулайзерна терапія дає можливість застосовувати лікарські речовини в незміненому вигляді, що діють при захворюваннях дихальних шляхів і легенів більш ефективно. Інгаляційна доставка ліків дає можливість створити високу концентрацію безпосередньо в місці ураження й мінімізувати системні ефекти, що особливо важливо для лікування захворювань органів дихання [24, 25].
Декаметоксин успішно застосовується в лікуванні хворих з інфекційними загостреннями бронхіальної астми. Природа інфекційних загострень БА різноманітна. Так, до 85 % загострень астми в дітей і порівнянна їх кількість у дорослих (від 76 до 80 %) пов’язані з вірусними інфекціями. Вірус-індуковані загострення БА найчастіше пов’язані з виявленням риновірусів, респіраторно-синцитіальних вірусів, вірусів парагрипу, вірусів грипу, аденовірусу, певних штамів коронавірусу. Рідше серед них фіксуються метапневмовіруси й бокавіруси [26].
Клінічна ефективність 0,02% розчину декаметоксину у вигляді інгаляцій у комплексній терапії вивчалася за участю 64 хворих з інфекційним загостренням БА. Додавання декаметоксину сприяло вірогідній позитивній динаміці стосовно інтоксикаційного синдрому й більш швидкому (у середньому на 1–2 дні) зникненню субфебрилітету, рясного потовиділення й головного болю порівняно з контролем. Поряд з цим мала місце більш швидка позитивна динаміка щодо зменшення симптомів астми в денний і нічний час і потреби в бронхолітиках. Бактеріальні ускладнення в пацієнтів, які отримували декаметоксин, спостерігалися у 2,3 раза рідше, ніж у контрольній групі [13].
Досвід інгаляційного застосування декаметоксину за допомогою небулайзера у хворих із бронхообструктивною патологією є дуже цінним, адже окремим фрагментом роботи було дослідження впливу інгаляції 0,02% розчину антисептика декаметоксину на показники функції зовнішнього дихання у хворих з інфекційним загостренням БА. Було доведено, що інгаляції 0,02% розчину антисептика декаметоксину (Декасан® небули) не чинять негативного впливу на функцію зовнішнього дихання. Небулайзерна терапія розчином декаметоксину добре переноситься пацієнтами з інфекційним загостренням БА і не супроводжується розвитком побічних ефектів [27].
Аналогічне дослідження було проведено з метою підвищення ефективності лікування інфекційних загострень у хворих на хронічний бронхіт (ХБ). Причинами загострень ХБ є інфекції трахеобронхіального дерева та вплив екзогенних пошкоджуючих факторів. Від 60 до 80 % всіх загострень становлять саме інфекційні загострення ХБ. У випадках загострень ХБ унаслідок інфекцій виявлено 3 класи збудників. За узагальненими даними, аеробні грампозитивні й грамнегативні бактерії становлять близько 45 % випадків загострень ХБ, респіраторні віруси — 30 % випадків та атипові бактерії — до 10 % усіх випадків. У середньому в 15 % випадків причиною інфекційних загострень ХБ є множинні патогени [28].
Додаткове інгаляційне застосування стерильного розчину декаметоксину 0,02% у комплексному лікуванні пацієнтів з інфекційним загостренням ХБ дозволило зменшити вираженість і тривалість (у середньому на 1–2 дні) проявів інтоксикації та катаральних явищ і скоротити тривалість інфекційного загострення хронічного бронхіту в середньому на 1,6 дня, скоротити середню тривалість застосування антибіотиків на 2,1 дня і дає можливість уникнути невиправданого призначення антибактеріальних препаратів при нетяжкому перебігу інфекційного загострення хронічного бронхіту [29].
Важливий аспект противірусної терапії — це безпека для пацієнта, адже низці противірусних препаратів притаманні токсичні небажані прояви й незадовільна переносимість [30]. Питання безпеки декаметоксину ґрунтовно вивчено в дослідах на тваринах. За допомогою методу обліку хромосомних аберацій шляхом реєстрації видимих структурних порушень хромосом у клітинах кісткового мозку мишей на стадії метафази встановлено, що декаметоксин не чинить мутагенної дії. У дослідах на тваринах препарат не спричиняє порушень репродуктивної функції самців і самок, не викликає ембріолетальної дії, не чинить негативного впливу на розвиток потомства. Декаметоксин не чинить токсичної дії на гуморальну й клітинну імунну відповідь у мишей за результатами тестів реакції гіперчутливості сповільненого типу й за кількістю антитілоутворюючих клітин у селезінці, титрів гемаглютинінів у сироватці крові. Декаметоксин не є потенційним алергеном, оскільки при пероральному введенні не спричиняє сенсибілізації організму й не викликає анафілактичної реакції в мурчаків. Підтверджено відсутність місцевоподразнювальної дії декаметоксину при введенні до кон’юнктивального мішка ока кролів, а також відсутність подразнення органів шлунково-кишкового тракту після 28-денного курсу внутрішньошлункового введення препарату щурам. Субстанція декаметоксину не виявляє здатності до кумуляції в дослідах на щурах [31].
Декаметоксин у концентрації, що застосовується в однодозових контейнерах Декасан®, не має токсичної дії. Тривале застосування Декасану® не спричиняє жодних токсичних реакцій. У разі медичного застосування декаметоксин не має місцевих побічних ефектів, не подразнює слизові оболонки, не всмоктується з їх поверхні, тобто немає ризику його системної побічної дії. Декаметоксину притаманна протизапальна дія за рахунок пригнічення продукції серотоніну й зменшення ексудації, десенсибілізаційний і спазмолітичний вплив [32].
Декасан® 0,02% розчин в однодозових контейнерах можна застосовувати у дорослих та дітей з 12 років по 2 мл розчину 1–2 рази на день. Підігрівання препарату до 38 °С перед застосуванням підвищує ефективність його дії. При запальних явищах препарат слід розводити дистильованою водою у співвідношенні 1 : 1 або 1 : 2 [33].
Отже, доведена дієвість декаметоксину як ефективного засобу проти складних вірусів незалежно від їх антигенної будови дає підстави для його практичного застосування при інфекційних ураженнях дихальних шляхів, у тому числі при коронавірусній інфекції.
Конфлікт інтересів. Не заявлений.
1. Novel Coronavirus (2019-nCoV). Available from: https://www.who.int/emergencies/diseases/novel-coronavirus-2019 (last accessed 29.01.2020).
2. Novel Coronavirus (2019-nCoV). Situation Report — 20. Available from: https://www.who.int/docs/default-source/coronaviruse/situation-reports/20200209-sitrep-20-ncov.pdf?sfvrsn=6f80d1b9_4 (last accessed 10.02.2020).
3. Coronaviruses (CoV). Available from: https://www.who.int/health-topics/coronavirus (last accessed 29.01.2020).
4. Virus Taxonomy: 2018b Release. Available from: https://talk.ictvonline.org/taxonomy/ (last accessed 30.01.2020).
5. Virus Taxa Infecting Vertebrates. Available from: https://talk.ictvonline.org/ictv-reports/ictv_9th_report/introduction/w/9th_report_intro/88/virus-taxa-infecting-vertebrates (last accessed 03.02.2020).
6. Dawson P., Malik M.R., Parvez F., Morse S.S. What Have We Learned About Middle East Respiratory Syndrome Coronavirus Emergence in Humans? A Systematic Literature Review. Vector-Borne and Zoonotic Diseases. 2019. Vol. 19. Issue 3. P. 174-192. doi: 10.1089/vbz.2017.2191.
7. Дзюблик І.В., Обертинська О.В. Коронавіруси людини та захворювання органів дихання. Здоров’я суспільства. 2015. № 1–2. С. 39-47.
8. Stockman L.J., Bellamy R., Garner P. SARS: systematic review of treatment effects. PLoS Med. 2006. Vol. 3. Issue 9. P. e343. doi: 10.1371/journal.pmed.0030343.
9. Wuhan virus surpasses 2003 SARS numbers; death toll continues to rise. Available from: https://www.ibtimes.sg/wuhan-virus-surpasses-2003-sars-numbers-death-toll-continues-rise-38502 (last accessed 03.02.2020).
10. Momattin H., Al-Ali A.Y., Al-Tawfiq J.A. A Systematic Review of therapeutic agents for the treatment of the Middle East Respiratory Syndrome Coronavirus (MERS-CoV). Travel Medicine and Infectious Disease. 2019. Vol. 30. P. 9-18. https://doi.org/10.1016/j.tmaid.2019.06.012.
11. Is China Coronavirus deadlier than SARS and MERS outbreaks? Here’s a comparison. Available from: https://www.ibtimes.sg/drawing-parallels-sars-mers-wuhan-coronavirus-38517 (last accessed 03.02.2020).
12. Гридіна Т.Л., Палій Г.К., Лозицький В.П., Федчук А.С. Результати дослідження деяких механізмів противірусної дії декаметоксину та етонію. Biomedical and Biosocial Anthropology. 2008. № 11. С. 43-45.
13. Гуменюк М.І., Опімах С.Г., Гуменюк Г.Л., Ігнатьєва В.І. Декаметоксин: допомога хворим з інфекційними загостреннями бронхіальної астми. Укр. пульмонол. журнал. 2019. № 2. С. 25-32. doi: 10.31215/2306-4927-2019-104-2-25-32.
14. Палій В.Г., Мороз В.М., Соболєв В.О., Сафронов К.М., Желіба М.Д., Гуменюк М.І. Антимікробний лікарський препарат декасан: стратегія і тактика застосування для профілактики та лікування гнійно-запальних захворювань. Вісник Вінницького національного медичного університету. 2004. № 8(2). С. 449-452.
15. Застосування декаметоксину як протимікробного засобу проти бактерій роду Bulkholderia: пат. 92941 Україна. № u 2014 03770; заявл. 10.04.2014; опубл. 10.09.2014. Бюл. № 17 (кн. 1). 1 с.
16. Застосування декаметоксину як протимікробного засобу проти бактерій роду Bulkholderia: пат. 111857 Україна. № a 2014 04625; заявл. 29.04.2014; опубл. 24.06.2016. Бюл. № 12 (кн. 1). 1 с.
17. Застосування декаметоксину як протимікробного засобу проти бактерій виду Pseudomonas aeruginosa: пат. 101964 Україна. № u 2015 03347; заявл. 10.04.2015; опубл. 12.10.2015. Бюл. № 19 (кн. 1). 1 с.
18. Спосіб лікування інфекційного загострення бронхіальної астми: пат. 90979 Україна. № u 2014 02169; заявл. 03.03.2014; опубл. 10.06.2014. Бюл. № 11 (кн. 1). 1 с.
19. Фармацевтична композиція для лікування інфекційного загострення бронхіальної астми: пат. 92831 Україна. № u 2014 02170; заявл. 03.03.2014; опубл. 10.09.2014. Бюл. № 17 (кн. 1). 1 с.
20. Гридіна Т.Л. Противірусні властивості офіцінальних препаратів декаметоксину, етонію та унітіолу по відношенню до вірусів грипу і простого герпесу: Дис... канд. біол. наук: 03.00.06. 2008.
21. Гридіна Т.Л. Противірусні властивості офіцінальних препаратів декаметоксину, етонію та унітіолу по відношенню до вірусів грипу та простого герпесу: автореф. дис. … канд. біол. наук: 03.00.06. Київ. 2008. 14 с.
22. Панчук С.І., Гуменюк М.І., Трохименко О.П., Дзюблик І.В. Віруліцидна дія декаметоксину по відношенню до вірусних тригерів інфекційного загострення бронхіальної астми. Укр. пульмонол. журнал. 2014. № 2. С. 48-51.
23. Трохименко О.П., Панчук С.І., Гуменюк М.І., Дзюблик І.В. Визначення in vitro віруліцидної дії декаметоксину на моделях простих і складних вірусів — як можливих тригерів інфекційного загострення бронхіальної астми. Профілактична медицина. 2013. № 3–4(21). С. 78-84.
24. Гуменюк М.І., Денисова О.В., Гуменюк Г.Л., Опімах С.Г., Ігнатьєва В.І. Декаметоксин: небулайзерна терапія інфекційного загострення хронічного бронхіту. Астма та алергія. 2019. № 3. С. 17-28. doi: 10.31655/2307-3373-2019-3-17-28.
25. Добрянский Д.В., Гуменюк Г.Л., Дудка П.Ф., Ильницкий Р.И., Тарченко И.П., Кузьменко Н.М. Небулайзерная терапия: практические аспекты. Астма та алергія. 2018. № 3. С. 54-62. doi: 10.31655/2307-3373-2018-3-54-62.
26. Дзюблик А.Я., Гуменюк Н.И., Капитан Г.Б., Панчук С.И., Ячник В.А. Роль инфекционных агентов в развитии и обострении бронхиальной астмы. Астма та алергія. 2012. № 2. С. 36-41.
27. Гуменюк М.І., Панчук С.І., Ігнатьєва В.І., Денисова О.В. Вплив інгаляції розчину антисептика декаметоксину на показники функції зовнішнього дихання у пацієнтів з інфекційним загостренням бронхіальної астми. Астма та алергія. 2015. № 3. С. 23-27.
28. Дзюблик О.Я., Недлінська Н.М., Ячник В.А. та ін. Хронічний бронхіт і його загострення: погляд на проблему. Укр. пульмонол. журнал. 2015. № 3. С. 44-48.
29. Дзюблик О.Я., Гуменюк М.І., Капітан Г.Б., Недлінська Н.М., Денисова О.В. Ефективність та безпека інгаляційного застосування декаметоксину в лікуванні хворих з інфекційним загостренням хронічного бронхіту. Астма та алергія. 2015. № 4. С. 22-27.
30. De Clercq E., Li G. Approved Antiviral Drugs over the Past 50 Years. Clinical Microbiology Reviews. 2016. Vol. 29. Issue 3. P. 695-747. doi: 10.1128/CMR.00102-15.
31. Деркач Н.М., Штриголь С.Ю., Лар’яновська Ю.Б., Кошова О.Ю., Ковальова Є.О. Специфічна токсичність препарату «Декасан». Клінічна та експериментальна патологія. 2016. Т. 15. № 2(56). Ч. 1. С. 59-66.
32. Трохименко О.П., Панчук С.І. Характеристики цитотоксичної дії декаметоксину в різних культурах клітин. Туберкульоз, легеневі хвороби, ВІЛ-інфекція. 2014. № 2(17). С. 69-73.
33. Iнструкцiя для медичного застосування препарату ДЕКАСАН® (DЕСАSАNUМ): затв. наказом МОЗ від 22.12.2016 р. № 1391. URL: http://mozdocs.kiev.ua/likiview.php?id=41615 (дата звернення 03.02.2020).

/37-1.jpg)
/38-1.jpg)
/39-1.jpg)
/40-1.jpg)