Журнал «Практическая онкология» Том 2, №4, 2019
Вернуться к номеру
Сучасні підходи в діагностиці й лікуванні ALK-позитивного недрібноклітинного раку легені
Авторы: Овсяннікова Д.І.
Національний медичний університет ім. О.О. Богомольця, м. Київ, Україна
Рубрики: Онкология
Разделы: Справочник специалиста
Версия для печати
Актуальність. ALK-позитивний недрібноклітинний рак легені зустрічається лише в 3–5 % випадків усіх недрібноклітинних пухлин легені. Проте останнім часом частота виявлення зростає, що, можливо, пов’язано із покращенням методів діагностики та тим, що імуногістохімічне дослідження далі стає рутинним. Огляд літератури присвячений з’ясуванню ефективності використання таргетних препаратів у першій лінії терапії ALK-позитивного недрібноклітинного раку легені. Матеріали та методи. Основу статті становив аналіз даних 12 клінічних досліджень, які були отримані з пошукового ресурса PubMed за ключовими словами: ALK positive non-small cell lung cancer, ALK inhibitors, alectinib, crizotinib; клінічних рекомендацій NCCN (National Comprehensive Cancer Network), ESMO (European Society for medical oncology). Результати. Доведено, що алектиніб може бути препаратом вибору в лікуванні АLК-позитивного недрібноклітинного раку легені в першій лінії, оскільки є його істотна перевага над хіміотерапією (7,1 проти 1,6 місяця ALUR) та кризотинібом (20,3 проти 10,2 місяця J-ALEX) щодо виживаності без прогресування, а також ефективності в лікуванні пацієнтів з метастатичним ураженням головного мозку. Висновки. Таргетні препарати мають використовуватися в першій лінії лікування ALK-позитивного недрібноклітинного раку легені. ALK-інгібітори досягли кращих результатів у виживаності без прогресії та якості життя порівняно з хіміотерапією. Таргетні препарати наступного покоління, зокрема алектиніб та бригатиніб, є більш безпечними та ефективними при інтракраніальному прогресуванні і мають бути обрані в першій лінії лікування.
Актуальность. ALK-положительный немелкоклеточный рак легкого встречается только в 3–5 % случаев всех немелкоклеточных опухолей легкого. Несмотря на это, в последнее время частота выявляемости возрастает, что, возможно, связано с улучшением методов диагностики и тем, что иммуногистохимическое исследование становится рутинным. Обзор литературы посвящен исследованию эффективности использования таргетных препаратов в первой линии лечения ALK-положительного немелкоклеточного рака легкого. Материалы и методы. Основу этой статьи составил анализ данных 12 клинических исследований, полученных с поискового ресурса PubMed по ключевым словам: ALK positive non-small cell lung cancer, ALK inhibitors, alectinib, crizotinib; клинических рекомендаций NCCN (National Comprehensive Cancer Network), ESMO (European Society for medical oncology). Результаты. Доказано, что алектиниб может быть препаратом выбора в лечении ALK-положительного немелкоклеточного рака легкого в первой линии, так как обнаружено его существенное преимущество над химиотерапией (7,1 против 1,6 месяца ALUR) и кризотинибом (20,3 против 10,2 месяца J-ALEX) в выживаемости без прогрессии, а также эффективности в лечении пациентов с метастатическим поражением головного мозга. Выводы. Таргетные препараты должны использоваться в первой линии лечения ALK-положительного немелкоклеточного рака легкого. ALK-ингибиторы достигли лучших результатов в выживаемости без прогрессии и качестве жизни в сравнении с химиотерапией. Препараты следующего поколения, такие как алектиниб и бригатиниб, являются более безопасными и эффективными при интракраниальном прогрессировании и должны быть выбраны в первой линии терапии.
Background. ALK-positive non-small-cell lung cancer (NSCLC) is observed in approximately 3–5 % out of all types of lung cancer. However, its incidence has increased in recent years. This can be caused by the development of diagnostic methods, such as immunohistochemistry testing, which becomes more routine now. There is no longer any doubt that targeted drugs should be used in the first line of treatment. Materials and methods. This article deals with the data from 12 clinical trials, recommendations of NCCN (National Comprehensive Cancer Network), ESMO (European Society of Medical Oncology) and the PubMed search resource. Results. Alectinib is proved to be first choice of ALK-positive NSCLC treatment as it has been reported to be superior over chemotherapy (7.1 against 1.6 months ALUR) as well as crizotinib (20.3 against 10.2 months J-ALEX) in terms of progression-free survival and intracranial efficacy and by far safer to other agents including ceritinib. Conclusions. Thus, ALK inhibitors are safe and effective treatment option in ALK-positive non-small-cell lung cancer. Moreover, ALK inhibitors have achieved better results in prolonging the progression-free survival and improving the quality of life in comparison to chemotherapy. Next generation agents, in particular alectinib and brigatinib are safer and more effective intra-cranially and can be preferred as first option.
ALK-позитивний недрібноклітинний рак легені; інгібітор тирозинкінази; ALK-інгібітори; таргетні препарати; алектиніб; кризотиніб
ALK-положительный немелкоклеточный рак легкого; ингибитор тирозинкиназы; ALK-ингибиторы; таргетные препараты; алектиниб; кризотиниб
ALK-positive non-small-cell lung cancer; Tyr-kinase inhibitors; ALK inhibitors; target agents; alectinib; crizotinib
Вступ
Щорічно від раку легені вмирає 1,5 мільйона людей та менш ніж 20 % мають виживаність більше ніж 5 років. Головна причина смертності — дисемінація хвороби, яка може бути спричинена пізньою діагностикою чи поганою відповіддю на проведене лікування. Це пояснює актуальність та необхідність розробки нових методів ранньої діагностики та ефективного лікування.
Метою роботи є огляд сучасних публікацій і рекомендацій для визначення якісних методів діагностики мутацій гена кінази анапластичної лімфоми (Anaplastic Lymphoma Kinase — ALK), оцінки та аналізування вже проведених 12 клінічних досліджень, порівняння ефективності та токсичності різних поколінь інгібіторів протеїнкіназ, їх впливу на якість і тривалість життя.
Матеріали та методи
У роботі використовувались дані клінічних випробувань: PROFILE 1014, Cui et al., Lu et al., Zhou et al., ASCEND-4, PROFILE 1007, ALUR, Tan et al., ALEX, J-ALEX, ALTA-1L, що були отримані за допомогою пошукового ресурса PubMed за ключовими словами: ALK positive non-small cell lung cancer, ALK inhibitors, alectinib, crizotinib; клінічних рекомендацій NCCN (National Comprehensive Cancer Network), ESMO (European Society for medical oncology).
Результати
Гістологічно рак легені поділяється на дрібноклітинний (15–20 %) та недрібноклітинний (НДКРЛ) (80–85 %). В свою чергу, розрізняють такі варіанти недрібноклітинного раку легені: аденокарцинома (50 %), плоскоклітинна (30 %) та великоклітинна карциноми. Проте саме молекулярно-генетичні характеристики аденокарцином призвели до прориву в лікуванні. Генні мутації, такі як EGFR (epidermal growth factor receptor — рецептор епідермального фактора росту) (10–15 % НДКРЛ), KRAS (Kirsten rat sarcoma 2 viral oncogene homolog — вірусний онкогенний гомолог саркоми щурів 2 Кірстен) (10–15 % НДКРЛ), ALK (3–5 % НДКРЛ), та інші таргети суттєво змінили концепцію персоналізованого підходу в онкології.
Ген ALK кодує рецепторну тирозинкіназу, яка належить до родини інсулінозалежних рецепторів. У нормі ген активний лише в ембріогенезі та бере участь в нормальному розвитку нервової системи. Він передає ростові сигнали через RAS/MAPK та PI3K-сигнальні шляхи. Вперше ген ALK був описаний в анапластичній великоклітинній лімфомі, для якої транслокація ALK — NPN є характерною особливістю, завдяки якій ген і отримав свою назву. Пізніше, у 2007 році, транс–локація ALK була виявлена й у пацієнтів з НДКРЛ. У більшості випадків відбувається злиття гена ALK з геном ELM4. Ген ELM4 активно експресується в епітеліальних клітинах та має домен, що сприяє димеризації білка. Саме той домен присутній в химерному білку ALK — ELM4, а від ALK йому дістається кіназний домен. В той самий час для здійснення кіназної активності білка ALK також необхідна димеризація, яка і призводить до конститутивної активності ALK — ELM4 та стимулює ріст клітин.
Мутації ALK виявляють приблизно в 3–5 % випадків НДКРЛ. Частіше це жінки віком близько 55 років, 70 % яких не є курцями або були легкими курцями (< 15 пачко-років). Найбільш часто ALK-транслокація зустрічається при залозистій формі раку легені. Як правило, така пухлина не містить мутацій в генах EGFR і KRAS.
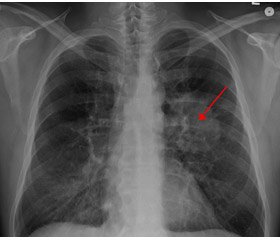
Незважаючи на те, що поширеність даних мутацій невелика, обстеження на дану мутацію є вкрай важливим і має проводитися при всіх аденокарциномах (рис. 1).
На сьогодні існує 3 стратегії ALK-тестування: метод флуоресцентної гібридизації in situ (fluorescence in situ hybridization — FISH); скринінг з антитілом клона 5А4 (Novocastra) та подальше підтвердження імуногістохімічним дослідженням (ІГХ) + зразок методом FISH; використання тест-системи ALK (D5F3) CDx assay (Ventana Medical Systems Inc.) з автостейнером BenchMark (може використовуватися як самостійний метод, що не потребує підтвердження за допомогою FISH).
Перевагою метода FISH є можливість розпізнавати практично всі види перебудов гена ALK незалежно від другого партнера транслокації, придатності для дослідження архівних блоків, цитологічних препаратів, відбитків. Проте трапляються і складні випадки: невелика кількість клітин в препараті, дефекти преаналітичної фази, складнощі в інтерпретації результатів дослідження.
Незважаючи на поширеність методу, при використанні ІГХ можуть траплятися артефакти. Хибнопозитивні реакції відмічаються при порушеннях фіксації, слабкій експресії протеїну та невидимій для антитіла конформаційній структурі при рідкому партнері ALK з транслокації. Тому слід пам’ятати, що при виявленні сумнівних або позитивних результатів тестування необхідно проводити FISH аналізів зразків.
Як першу лінію терапії до відкриття EML4 — ALK використовували стандартну хіміотерапію, тобто платиновмісні хіміопрепарати з іншими агентами (паклітаксел, гемцитабін, пеметрексед, вінорельбін, доцетаксел та ін.) [1]. Згодом почалося випробування І фази кризотинібу, інгібітора тирозинкінази, націленого на МЕТ, ROS1 та АLК. Було повідомлено про 72 % 6-місячної виживаності без прогресування (ВБП) та 57 % об’єктивної частоти відповіді (ОЧВ) при ALK-позитивному НДКРЛ [2]. Це випробування призвело до пришвидшеного схвалення Управління продовольства і медикаментів (Food and Drug Administration — FDA). У II фазі дослідження кризотинібу при АLК-позитивному НДКРЛ також повідомлялося про подібні обнадійливі позитивні результати (загальна виживаність (ЗВ) — 53 % та медіана ВБП — 8,5 місяця), у той час як монотерапія хіміопрепаратами зазвичай показала ВБП всього 2–3 місяці та 10 % ОЧВ [3]. Дослідження ІІІ фази демонструвало порівняльні результати терапії кризотинібом з монотерапією хіміопрепаратами (пеметрексед або доцетаксел) у пацієнтів, які раніше не лікувалися, що були значно вищими за середню ВБП (7,7–3,0 місяця; р < 0,001) та ОВ (65–20 %; р < 0,001). Кризотиніб показав значну ВБП та ОЧВ у ІІІ фазі дослідження порівняно з хіміотерапією пеметрекседом разом із платиною в першій лінії.
Однак при терапії кризотинібом можна стикнутися з проблемами резистентності та рецидиву через АLК-залежні та незалежні механізми. Церитиніб, інгібітор ALK-тирозинкінази другого покоління, схожий за дією на кризотиніб, але не здатний інгібувати МЕТ. Церитиніб порівнювали з хіміотерапією, та він довів свою перевагу в першій лінії, а також у другій лінії [4, 5]. Алектиніб, ще один інгібітор ALK, є більш потужним інгібітором ALK з доведеною активністю щодо мутацій, що мають ALK-стійкість до кризотинібу [6]. Одним із важливих аспектів алектинібу є його проникнення в центральну нервову систему (ЦНС). Для поширеного ALK-позитивного НДКРЛ характерний високий життєвий ризик розвитку метастатичного ураження центральної нервової системи і висока частота наявності метастазів у головному мозку на момент встановлення діагнозу, причому ЦНС є найчастішою локалізацією прогресування хвороби. Нещодавно завершене порівняльне дослідження алектинібу та бригатинібу з хіміотерапією та кризотинібом, яке додало препарати до списку вибору інгібіторів ALK. Церитиніб, алектиніб та бригатиніб називають препаратами наступного покоління. Наразі розробляються новіші агенти, які колись розширять варіанти лікування АLК-позитивного НДКРЛ [7].
Обговорення
На сьогодні було проведено 12 клінічних досліджень, в яких брали участь більше 3297 пацієнтів. Порівняння ALK-інгібіторів та хіміотерапії в першій лінії оцінювалося в 5 клінічних дослідженнях (n = 1079, 4 дослідження включали кризотиніб та 1 дослідження — церитиніб). Дослідження другої лінії базувалося на 3 дослідженнях (n = 687). В той час як наступне покоління агентів (церитиніб, алектиніб і бригатиніб) порівнювалося з кризотинібом. Одне дослідження включало порівняння церитинібу з кризотинібом (n = 746). Два дослідження ІІІ фази базувалися на порівнянні алектинібу з кризотинібом та одне дослідження — бригатинібу з кризотинібом.
У цілому ці препарати успішно контролювали прогресування захворювання порівняно з хіміотерапією. Виживання без прогресії було значно покращено при застосуванні кризотинібу та ALK-інгібіторів наступного покоління порівняно з хіміотерапією першої лінії, а також з лікуванням в другій лінії. Крім того, було показано, що кожен препарат окремо був ефективним порівняно з хіміотерапією за результатами ВБП. Так, наприклад, в дослідженні ALEX показник ВБП хвороби був суттєво вищим у групі алектинібу порівняно з групою кризотинібу (12-місячний показник виживаності без прогресування становив 68,4 % при лікуванні алектинібом проти 48,7 % при лікуванні кризотинібом) [7]. Повідомлялося про об’єктивну швидкість відповіді, визначену комбінацією повної відповіді та часткової відповіді, у всіх дослідженнях на користь таргетних терапевтичних засобів. Значна кількість пацієнтів відповіли на таргетну терапію. Таргети наступного покоління, включаючи церитиніб, алектиніб і бригатиніб, переважали за показниками ВБП та ОЧВ кризотиніб [8].
Метастази в мозок — частий прояв дисемінації ALK-позитивного НДКРЛ, що викликає відповідні симптоми у пацієнтів (втома, головні болі та депресія). Хіміотерапія, так само як і кризотиніб, обмежена у здатності проникати через гематоенцефалічний бар’єр, а тому в більшості випадків місцем прогресування захворювання є ЦНС. Наявність метастазів в мозок вважається найгіршим прогностичним фактором. Незначне збільшення часу до інтракраніального прогресування та швидкості контролю інтракраніальної хвороби кризотинібом протягом 12 тижнів порівняно з хіміотерапією у пацієнтів зі стабільною хворобою, згідно з RECIST-критеріями, було зареєстровано у дослідженні PROFILE 1014 [15].
На відміну від кризотинібу, інгібітори наступного покоління, церитиніб та алектиніб, мають більшу здатність до пенетрації через гематоенцефалічний бар’єр (табл. 1). Ці таргетні препарати також значно затримали прогресування захворювання з ЦНС у пацієнтів із первинними метастазами у ЦНС або без, а також з попередньою променевою терапією або без неї, що було пов’язано з кращою реакцією на таргетну терапію. Дванадцятимісячна сукупна частота прогресування в ЦНС становить 9,4 % в групі алектинібу проти 41,4 % в групі кризотинібу [14].
Також доказано, що інгібітори ALK (крім алектинібу) викликають значно більшу кількість побічних явищ 1-го та 2-го ступеня. Найбільш поширеними виявилися: порушення зору, діарея, набряки, блювання, підвищення амінотрансфераз, кашель, біль у спині, біль в епігастральній зоні, зниження маси тіла, підвищення лужної фосфатази в крові, підвищення креатиніну в крові, збільшення гамма-глутамілтрансферази та некардіогенний біль у грудях. У той час як пацієнти, які отримували хіміотерапію, відзначали втому, алопецію, анемію, нейтропенію, лейкопенію. Кілька побічних подій були унікальними для кожного таргета. Порушення зору, запаморочення, дисгевзія та набряки відзначалися лише при прийомі кризотинібу. Церитиніб мав такі побічні дії, як біль у спині, біль епігастральної зони, зниження маси тіла, підвищення лужної фосфатази в крові, підвищення рівня креатиніну в крові, збільшення гамма-глутамілтрансферази та некардіогенний біль у грудях. Аналіз не коригувався протягом тривалості лікування, оскільки тривалість лікування кризотинібом була довшою порівняно з хіміотерапією. Середня тривалість лікування становила 10,6 місяця та 31 тиждень у групі кризотинібу порівняно з 4,1 місяця та 21 тиждень у групі хіміотерапії у дослідженні PROFILE 1014 та 1007 відповідно.
Побічні дії 3-го та 4-го ступеня були майже однаковими за частотою в обох методах лікування. Не було різниці між методами лікування, коли кожен окремий засіб (церитиніб або кризотиніб) порівнювався з хіміотерапією при спричиненні побічних явищ 3-го або 4-го ступеня. Усього 6 пацієнтів, які отримували кризотиніб, кваліфікувались за критеріями закону Хая1 [22], що призводить до припинення лікування (5 пацієнтів — повідомлялося у PROFILE 1014, 1 — у PROFILE 1007). У трьох із шести пацієнтів було відмічено підвищення амінотрансфераз 2-го або 3-го ступеня, а один мав медикаментозний гепатит. У групі церитинібу, що відповідає критеріям закону Хая, не повідомлялося про жодного пацієнта. Загальні побічні явища, що призводять до постійного припинення лікування, були значно вищими у групі хіміотерапії порівняно з кризотинібом та церитинібом. Більшість побічних дій вдавалося уникнути коригуванням дози, перервами або затримками.
Церитиніб показав зменшення периферичної ней–ропатії, тоді як кризотиніб асоціювався з її збільшенням. Церитиніб також призводить до значного зменшення таких симптомів, як стоматит і дисфагія. Біль в руці або плечі суттєво зменшувався при терапії кризотинібом, а щодо церитинібу порівняно з хіміотерапією не спостерігалося суттєвої різниці. Використання інгібіторів ALK в першій лінії лікування призводило до зменшення симптомів та покращення якості життя порівняно з лікуванням в другій лінії.
Кризотиніб зазвичай призначають як препарат вибору в першій лінії. Проте в дослідженнях показано, що рецидиви при його застосуванні зустрічаються частіше. Обидва наступні покоління інгібіторів довели свою ефективність при резистентності до кризотинібу. З іншого боку, церитиніб та особливо алектиніб ефективніше контролюють прогресування захворювання порівняно з кризотинібом та активніші при метастатичних ураженнях ЦНС, що є головним місцем прогресування у пацієнтів, які отримували кризотиніб. Порівняно з кризотинібом та церитинібом алектиніб має вигідніший профіль безпеки (табл. 2, 3). Новіші агенти — бригатиніб, лорлатиніб, енсартиніб та ентректиніб знаходяться на етапі досліджень. Бригатиніб вже схвалений FDA, а лорлатиніб показав хорошу ефективність на проміжному оцінюванні [21]. Препарати вибору будуть змінюватися найближчим часом, враховуючи доказовість більшої ефективності інгібіторів нового покоління. В даний час клінічне випробування (NCT03596866) проводить порівняння бригатинібу з електинібом у пацієнтів з ALK-позитивним НДКРЛ, які прогресували на кризотинібі. Енсартиніб та ентректиніб перебувають на стадії вивчення.
Висновки
Проаналізувавши вищевикладену інформацію, можна зробити такі висновки:
1. За наявності неплоскоклітинної карциноми легені обов’язковим є обстеження на ALK-мутацію, яку бажано підтвердити не тільки імуногістохімічним методом, але й FISH або D5F3.
2. ALK-інгібітори всіх поколінь показали значно кращі результати як ВБП і ОЧП, так і ЗВ, ніж хіміотерапія.
3. Сучасні таргетні препарати демонструють також вигідніший профіль токсичності порівняно з хіміотерапією.
4. ALK-інгібітори показали ефективність як в першій, так і в другій лінії, тому їх можна вважати препаратами вибору при ALK-позитивному НДКРЛ.
5. Алектиніб має найкращі показники ефективності та інтракраніальної відповіді в першій лінії порівняно з кризотинібом, церитинібом або хіміотерапією. Його ефективність вже порівнюють з лідером ALK-інгібіторів — бригатинібом.
6. Дослідження нових препаратів енсартинібу та ентректинібу дають надію на кращі результати.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
1. Muhammad Khan, Jie Lin, Guixiang Liao, Yunhong Tian, Yingying Liang, Rong Li, Mengzhong Liu, Yawei Yuan. ALK Inhibitors in the Treatment of ALK Positive NSCLC. 2019.
2. Shaw A.T., Kim D.-W., Nakagawa K., Seto T., Crinó L., Ahn M.-J. Crizotinib versus chemotherapy in advanced ALK-positive lung cancer. N. Engl. J. Med. 2015. 373. 1582. 10.1056/NEJMx150036 [PubMed] [CrossRef] [Google Scholar].
3. Solomon B.J., Mok T., Kim D.W., Wu Y.L., Nakagawa K., Mekhail T. et al. First-line crizotinib versus chemotherapy in ALK-positive lung cancer. N. Engl. J. Med. 2014. 371. 2167-77. 10.1056/NEJMoa1408440 [PubMed] [CrossRef] [Google Scholar].
4. Soria J.C., Tan D.S.W., Chiari R., Wu Y.L., Paz-Ares L., Wolf J. et al. First-line ceritinib versus platinum-based chemothe–rapy in advanced ALK-rearranged non-small-cell lung cancer –(ASCEND-4): a randomised, open-label, phase 3 study. Lancet. 2017. 389. 917-29. 10.1016/S0140-6736(17)30123-X [PubMed] [CrossRef] [Google Scholar].
5. Shaw A.T., Kim T.M., Crinò L., Gridelli C., Kiura K., Liu G. et al. Ceritinib versus chemotherapy in patients with ALK-rearranged non-small-cell lung cancer previously given chemotherapy and crizotinib (ASCEND-5): a randomised, controlled, open-label, phase 3 trial. Lancet Oncol. 2017. 18. 874-86. 10.1016/S1470-2045(17)30339-X [PubMed] [CrossRef] [Google Scholar].
6. Novello S., Mazières J., Oh I.J., de Castro J., Migliorino M.R., Helland Å. et al. Alectinib versus chemotherapy in crizotinib-pretreated anaplastic lymphoma kinase (ALK)-positive non-small-cell lung cancer: results from the phase III ALUR study. Ann. Oncol. 2018. 29. 1409-16. 10.1093/annonc/mdy121 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
7. Shaw A.T., Peters S., Mok T., Gadgeel S.M., Ahn J.S., Ignatius Ou S.-H. et al. Alectinib versus crizotinib in treatment-naive advanced ALK-positive non-small cell lung cancer (NSCLC): primary results of the global phase III ALEX study. J. Clin. Oncol. 2017. 35(Suppl. 18). LBA9008. 10.1200/JCO.2017.35.15_suppl.LBA9008 [CrossRef] [Google Scholar].
8. Hida T., Nokihara H., Kondo M., Kim Y.H., Azuma K., Seto T. et al. Alectinib versus crizotinib in patients with ALK-positive non-small-cell lung cancer (J-ALEX): an open-label, randomised phase 3 trial. Lancet. 2017. 390. 29-39. 10.1016/S0140-6736(17)30565-2 [PubMed] [CrossRef] [Google Scholar].
9. Camidge D.R., Kim H.R., Ahn M.J., Yang J.C., Han J.Y., Lee J.S. et al. Brigatinib versus crizotinib in ALK-positive non-small-cell lung cancer. N. Engl. J. Med. 2018. 10.1056/NEJMoa1810171 [Epub ahead of print] [PubMed] [CrossRef] [Google Scholar].
10. Cui S., Zhao Y., Dong L., Gu A., Xiong L., Qian J. et al. Is there a progression-free survival benefit of first-line crizotinib versus standard chemotherapy and second-line crizotinib in ALK-positive advanced lung adenocarcinoma? A retrospective study of Chinese patients. Cancer Med. 2016. 5. 1013-21. 10.1002/cam4.659 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
11. Lu S., Mok T., Lu Y., Zhou J., Shi Y., Sriuranpong V. et al. Phase 3 study of first-line crizotinib vs pemetrexed–cisplatin/carboplatin (PCC) in East Asian patients (pts) with ALK+ advanced non-squamous non-small cell lung cancer (NSCLC). J. Clin. Oncol. 2016. 34(Suppl. 15). 9058. 10.1200/JCO.2016.34.15_suppl.9058 [CrossRef] [Google Scholar].
12. Zhou J., Zheng J., Zhang X., Zhao J., Zhu Y., Shen Q. et al. Crizotinib in patients with anaplastic lymphoma kinase-positive advanced non-small cell lung cancer versus chemotherapy as a first-line treatment. BMC Cancer. 2018. 18. 10. 10.1186/s12885-017-3720-8 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
13. Tan D.S., Araújo A., Zhang J., Signorovitch J., Zhou Z.Y., Cai X. et al. Comparative efficacy of ceritinib and crizotinib as initial ALK-targeted therapies in previously treated advanced NSCLC: an adjusted comparison with external controls. J. Thorac. Oncol. 2016. 11. 1550-7. 10.1016/j.jtho.2016.05.029 [PubMed] [CrossRef] [Google Scholar].
14. Guérin A., Sasane M., Zhang J., Culver K.W., Dea K., Nitulescu R. et al. Brain metastases in patients with ALK+ non-small cell lung cancer: clinical symptoms, treatment patterns and economic burden. J. Med. Econom. 2015. 18. 312-22. 10.3111/13696998.2014.1003644 [PubMed] [CrossRef] [Google Scholar].
15. Solomon B.J., Cappuzzo F., Felip E., Blackhall F.H., Costa D.B., Kim D.W. et al. Intracranial efficacy of crizotinib versus chemotherapy in patients with advanced ALK-positive non-small-cell lung cancer: results from PROFILE 1014. J. Clin. Oncol. 2016. 34. 2858-65. 10.1200/JCO.2015.63.5888 [PubMed] [CrossRef] [Google Scholar].
16. Solomon B.J., Kim D.W., Wu Y.L., Nakagawa K., Mekhail T., Felip E. et al. Final overall survival analysis from a study comparing first-line crizotinib versus chemotherapy in ALK-mutation-positive non-small-cell lung cancer. J. Clin. Oncol. 2018. 36. 2251-8. 10.1200/JCO.2017.77.4794 [PubMed] [CrossRef] [Google Scholar].
17. Nishio M., Nakagawa K., Mitsudomi T., Yamamoto N., Tanaka T., Kuriki H. et al. Analysis of central nervous system efficacy in the J-ALEX study of alectinib versus crizotinib in ALK-positive non-small-cell lung cancer. Lung. Cancer. 2018. 121. 37-40. 10.1016/j.lungcan.2018.04.015 [PubMed] [CrossRef] [Google Scholar].
18. Gadgeel S., Peters S., Mok T., Shaw A.T., Kim D.W., Ou S.I. et al. Alectinib versus crizotinib in treatment-naive anaplastic lymphoma kinase-positive (ALK+) non-small-cell lung cancer: CNS efficacy results from the ALEX study. Ann. Oncol. 2018. 10.1093/annonc/mdy405 [Epub ahead of print] [PMC free article] [PubMed] [CrossRef] [Google Scholar].
19. Duruisseaux M., Besse B., Cadranel J., Pérol M., Mennecier B., Bigay-Game L. et al. Overall survival with crizotinib and next-generation ALK inhibitors in ALK-positive non-small-cell lung cancer (IFCT-1302 CLINALK): a French nationwide cohort retrospective study. Oncotarget. 2017. 8. 21903-17. 10.18632/oncotarget.15746 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
20. Gettinger S.N., Bazhenova L.A., Langer C.J., Salgia R., Gold K.A., Rosell R. et al. Activity and safety of brigatinib in ALK-rearranged non-small-cell lung cancer and other malignancies: a single-arm, open-label, phase 1/2 trial. Lancet Oncol. 2016. 17. 1683-96. 10.1016/S1470-2045(16)30392-8 [PubMed] [CrossRef] [Google Scholar].
21. Shaw A.T., Felip E., Bauer T.M., Besse B., Navarro A., Postel-Vinay S. et al. Lorlatinib in non-small-cell lung cancer with ALK or ROS1 rearrangement: an international, multicentre, open-label, single-arm first-in-man phase 1 trial. Lancet Oncol. 2017. 18. 1590-9. 10.1016/S1470-2045(17)30680-0 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
22. United States Department of Health and Human Services, Food and Drug Administration, Center for Drug Evaluation and Research (CDER), Center for Biologics Evaluation and Research (CBER): Guidance for Industry Drug-Induced Liver Injury: Premarketing Clinical Evaluation, Final, July 2009. https://www.fda.gov/regulatory-information/search-fda-guidance-documents/drug-induced-liver-injury-premarketing-clinical-evaluation.

/60-1.jpg )
/61-1.jpg )