Журнал «Боль. Суставы. Позвоночник» Том 9, №4, 2019
Вернуться к номеру
Сучасний погляд на остеопороз в умовах неврологічної патології (огляд літератури)
Авторы: Бистрицька М.А.
ДУ «Інститут геронтології імені Д.Ф. Чеботарьова НАМН України», м. Київ, Україна
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
У статті наведені сучасні дані літератури щодо вивчення впливу патології нервової системи на метаболізм кісткової тканини. Серед захворювань нервової системи доведено впливають на кісткову тканину й збільшують ризик розвитку остеопорозу й переломів епілепсія, розсіяний склероз, інсульт, травма хребта й спинного мозку, хвороба Паркінсона та м’язова дистрофія. Продовжується вивчення механізмів формування остеопорозу у цієї категорії хворих, з’являються нові погляди на причини підвищеного ризику переломів, а отже, й нові напрямки профілактики та лікування.
В статье представлены современные данные литературы по изучению влияния патологии нервной системы на метаболизм костной ткани. Среди заболеваний нервной системы доказано влияют на костную ткань и увеличивают риск развития остеопороза и переломов эпилепсия, рассеянный склероз, инсульт, травма позвоночника и спинного мозга, болезнь Паркинсона и мышечная дистрофия. Продолжается изучение механизмов формирования остеопороза у этой категории больных, появляются новые взгляды на причины повышенного риска переломов, а значит, и новые направления профилактики и лечения.
The article presents the current literature data of the nervous system’s pathology influence on bone metabolism. The nervous system diseases proven to affect bone and increase the risk of osteoporosis and fractures are epilepsy, multiple sclerosis, stroke, spinal cord injury, Parkinson’s disease and muscular dystrophy. Study of the mechanisms of osteoporosis formation in this category of patients is ongoing, the new views of the increased fracture risk causes appear, and therefore new trends in prevention and treatment are required.
остеопороз; хвороба Паркінсона; інсульт; травма хребта й спинного мозку; розсіяний склероз; огляд
остеопороз; болезнь Паркинсона; инсульт; травма позвоночника и спинного мозга; рассеянный склероз; обзор
osteoporosis; Parkinson’s disease; stroke, spinal cord injury; multiple sclerosis; review
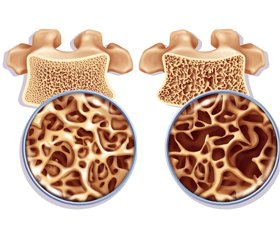
Остеопороз — багатофакторне захворювання, викликане складними взаємодіями між генетичними, ендогенними та екзогенними чинниками, яке суттєво впливає не тільки на біомеханіку опорно–рухового апарату, але й на якість та тривалість життя [6]. На сьогодні у світі близько 200 мільйонів людей страждають від остеопорозу і майже 9 мільйонів мають остеопоротичні переломи [6, 7]. Від 17 до 80 % випадків остеопорозу мають вторинний генез [17].
У рекомендаціях, опублікованих у 2014 році в Osteoporosis International, у переліку причин вторинного остеопорозу серед захворювань нервової системи вказані епілепсія, розсіяний склероз, інсульт, травма хребта й спинного мозку, хвороба Паркінсона та м’язова дистрофія. Захворювання з цього списку істотно відрізняються за патогенезом (судинний, нейродегенеративний, автоімунний, травматичний та ін.), перебігом (гострий, хронічний), клінічною картиною, проте в усіх цих станах розвивається комплекс порушень, що призводять до втрати кісткової маси.
Вплив патології нервової системи на метаболізм кісткової тканини достеменно не вивчений, але виділені основні механізми, що беруть участь тією чи іншою мірою в розвитку вторинного остеопорозу в неврологічних хворих.
До таких механізмів відносять:
— відсутність осьового навантаження на скелет в умовах тривалого перебування в положенні лежачи (іммобілізація);
— м’язова слабкість і обмеження активних рухів;
— дефіцит вітаміну D;
— порушення нервової регуляції метаболізму кісткової тканини.
Вплив іммобілізації на кісткову тканину різносторонній. У дослідженні за участю 11 здорових добровольців (9 чоловіків і 2 жінки віком 34 ± 11 років) вивчали вплив 12 тижнів ліжкового режиму на параметри кальцієвого гомеостазу, маркерів ремоделювання й показники гістологічного дослідження кісткової тканини. Через 12 тижнів іммобілізації показники мінеральної щільності кісткової тканини (МЩКТ) на рівні поперекового відділу хребта зменшувалися на 2,9 % (p = 0,09), на рівні великого вертлюга стегнової кістки — на 3,8 % (p = 0,002). Ліжковий режим викликав швидке й значне збільшення вмісту кальцію та фосфору в сечі, а також вірогідне збільшення кальцію в сироватці крові. Рівні паратиреоїдного гормону (ПТГ) та вітаміну D, навпаки, значно зменшувалися, хоча середні значення залишалися в межах норми. Під час гістологічного дослідження кісткової тканини було визначено помірне пригнічення формування губчастої (від 3,1 ± 1,3 % до 1,9 ± 1,5 %, p = 0,01) і збільшення резорбції як губчастої, так і кортикальної кісткової тканини. Сироваткові маркери формування кісткової тканини (остеокальцин, кістково–специфічна лужна фосфатаза і пропептид проколагену I типу) вірогідно не змінювалися. На відміну від цього, маркери резорбції кісткової тканини (гідроксипролін, дезоксипіридинолін і N–телопептид колагену I типу в сечі та С–телопептид колагену I типу в сироватці) значно збільшувалися під час іммобілізації й поверталися до первинних значень через тиждень після припинення іммобілізації.
Таким чином, на відсутність осьового навантаження кісткова тканина реагує швидким та стійким збільшенням темпів резорбції та менш значним зменшенням утворення кісткової тканини [63]. У зв’язку з цим рання вертикалізація й активізація пацієнтів є ефективною профілактикою розвитку остеопорозу в пацієнтів з неврологічною патологією.
Виділити вплив зниження м’язової сили й спастичності на кісткову тканину вкрай складно, оскільки ці фактори визначають функціональність і мобільність пацієнтів.
Роль вітаміну D у розвитку остеопорозу добре відома. Пацієнти з неврологічною патологією в зв’язку з руховими порушеннями рідше перебувають під впливом сонячних променів, що сприяє розвитку дефіциту вітаміну D. Крім того, роль дефіциту вітаміну D на сьогодні доведена в генезі багатьох неврологічних захворювань.
Роль нервової системи в регуляції процесів ремоделювання кісткової тканини
Діяльність остеобластів і остеокластів регулюється системними гормонами, зокрема ПТГ, вітаміном D (1,25(OH)2D3), кальцитоніном, глюкокортикоїдами, статевими стероїдами тощо. Крім того, на сьогодні доведено зв’язок між масою тіла та показниками МЩКТ, що вказує на ймовірність існування загального фактора, що регулює масу тіла й кісткову масу. Найбільш перспективним претендентом на цю роль є лептин, який регулює масу тіла через гіпоталамус і його рецептори [16].
Також функція клітин кісткової тканини регулюється факторами, що продукуються як самими клітинами кісткової тканини, так і клітинами їх безпосереднього оточення. Такі автокринні й паракринні чинники включають цитокіни, фактори росту й простагландини. На додаток до ендокринних і паракринних механізмів, регулювання ремоделювання кісткової тканини, як і більшості інших гомеостатичних функцій, також перебуває під контролем симпатичної нервової системи. Клітини кісткової тканини мають функціонуючі рецептори до декількох нейроостеогенних факторів [58]. До «кісткових нейромедіаторів» відносять норадреналін, нейропептид, ендоканнабіноїди, допамін, серотонін, кальцитонін–ген–зв’язаний пептид та ін. Як нейронний шлях контролю функції остеобластів і кісткової маси була визначена симпатична нервова система [26].
Гістологічні дослідження показали, що кістка й окістя іннервовані у великій кількості сенсорними й симпатичними нервовими волокнами, щільність яких найбільша навколо пластин росту й у метафізах довгих трубчастих кісток. Остеобласти й остеокласти людини мають адренорецептори (АР) і рецептори до нейропептиду, що передбачає динамічну нейроендокринну центральну регуляцію метаболізму кісткової тканини через адренергічні системи. Симпатоміметичний вплив на формування й резорбцію кісткової тканини здійснюється впливом на остеобласти й остеокласти через a– і b–АР відповідно [16].
В експерименті показано, що адреналін здатний стимулювати остеокластогенез шляхом зміни співвідношення між активатором рецептора ліганда ядерного фактора kВ і остеопротегерином, які продукуються остеобластами.
Збільшення активності симпатичної нервової системи призводить до збільшення рівня маркерів кісткової резорбції й зниження рівня лептину, яке сприяє пригніченню формування кортикальної кістки. Таким чином, адренергічна стимуляція збільшує кількість й активність остеокластів та одночасно пригнічує функцію остеобластів, у результаті чого порушується співвідношення темпів формування й резорбції кісткової тканини, що в подальшому сприяє розвитку остеопорозу.
Для кількох клінічних ситуацій цей механізм формування остеопорозу був одним з основних:
— використання агоністів b2–адренорецепторів (наприклад, бронхолітики для лікування бронхіальної астми) призводить до дворазового збільшення ризику перелому стегнової кістки;
— розвиток локального остеопорозу при рефлекторній симпатичній дистрофії, яка характеризується гі–перактивністю адренергічних шляхів;
— зниження кісткової маси й підвищення ризику стресових переломів у спортсменів, які застосовують легальні агоністи b2–адренорецепторів для анаболічного ефекту на м’язи й катаболічного впливу на жирову тканину. Незважаючи на доведену роль симпатичної нервової системи в розвитку остеопорозу, доцільність застосування блокаторів b–АР у терапії й профілактиці остеопорозу на сьогодні не отримала достатньо доказів [23].
На жаль, пацієнти з вторинним остеопорозом частіше потрапляють у поле зору фахівців–остеологів тільки після перелому, і не завжди після першого перелому.
Остеопороз у хворих, які перенесли інсульт
Гостре порушення мозкового кровообігу може статися в будь–якому віці, але частіше до нього схильні особи старших вікових груп, і половина з усіх інсультів відбувається в осіб старше 70 років [1, 13, 52]. Таким чином, це група населення з уже підвищеним ризиком остеопорозу та переломів. У пацієнтів, які перенесли інсульт, ризик переломів стегнової кістки в 2–4 рази вищий, ніж у популяції в цілому [37]. Виживання й відновлення рухової функції після перелому стегнової кістки були вірогідно гіршими у постінсультних пацієнтів порівняно з тими, хто не переніс інсульт. У 4 % пацієнтів, які перенесли оперативне втручання з приводу перелому стегнової кістки, протягом 1 року розвивається інсульт, у 5 % пацієнтів, які перенесли інсульт, протягом 1 року відбувається перелом проксимального відділу стегнової кістки, що акцентує увагу на подібних факторах ризику цих двох станів [44]. Безумовно, велике значення в збільшенні ризику переломів має високий ризик падінь [36].
Більше 80 % переломів у пацієнтів, які перенесли інсульт, викликані падіннями. Серед постінсультних пацієнтів з переломом стегнової кістки 66 % падали на бік на стегно, і здебільшого в бік парезу, що пояснює переважну локалізацію переломів на боці парезу — 82 % [29]. Крім того, слабкість триголового м’яза паретичної верхньої кінцівки не дозволяє пом’якшити удар при падінні. Але не тільки збільшення частоти падінь пояснює високий ризик переломів. У пацієнтів, які перенесли інсульт, МЩКТ нижче, ніж в популяції [5, 15, 19, 32], але коли й наскільки розвивається це зниження, залишається дискутабельним. Зниження МЩКТ на рівні проксимального відділу стегнової кістки на 2 SD у цих хворих збільшує ризик перелому при падінні в 7 разів [29]. Медіана часу до настання першого перелому в середньому становить 24 міс.
У дорослих здорових осіб МЩКТ залишається постійною або знижується зі швидкістю 0,5 % на рік до настання менопаузи, у постменопаузальному періоді втрата кісткової маси зростає до 1,5 % на рік [1]. Протягом року після інсульту втрата кісткової маси на рівні паретичних кінцівок зростає до 12–17 % [37]. Зареєстрована також втрата МЩКТ на інтактному боці, але меншою мірою, ніж в уражених кінцівках [2]. Згідно з даними периферичної комп’ютерної томографії, втрата трабекулярної кісткової тканини, виміряної на рівні 4 % променевої кістки паретичной кінцівки, через 12 міс. становила 14 % у чоловіків і 9 % у жінок. На рівні шийки стегнової кістки ці показники становили 11 % у чоловіків і 13 % у жінок. Втрата кортикальної кісткової тканини, виміряна на рівні 20 % променевої кістки, — відповідно 4 і 2,5 % [40].
Детермінант втрати кісткової маси після інсульту досить багато: тривалість іммобілізації [37], тяжкість геміплегії [36], тривалість постменопаузи в жінок [51], а також низька маса тіла в доінсультний період і пізня вертикалізація (пізніше 2 міс. після інсульту) [23].
Максимальна втрата кісткової маси розвивається в перші роки після інсульту. Пізніше такі фактори, як низький ступінь функціонального відновлення [40], триваюча іммобілізація, дефіцит вітаміну D [36], застосування антикоагулянтів (варфарин) [47] і антиконвульсантів [18], може сприяти подальшій втраті кісткової маси. Все вищенаведене свідчить, що пацієнти, які перенесли інсульт, — це категорія хворих з високим ризиком розвитку остеопорозу та його серйозних ускладнень — переломів стегнової кістки.
Остеопороз і хвороба Паркінсона
Хвороба Паркінсона (ХП) та остеопороз — вік–асоційовані захворювання, що зустрічаються у пацієнтів однієї вікової категорії. Хвороба Паркінсона — хронічне прогресуюче захворювання головного мозку, яке переважно пов’язане з дегенерацією дофамінергічних нейронів чорної субстанції з накопиченням у них білка a–синуклеїну та утворенням особливих внутрішньоклітинних включень (тілець Леві), що проявляється поєднанням гіпокінезії з ригідністю, тремором спокою та постуральною нестабільністю, а також широким спектром немоторних проявів — психічних, вегетативних, сенсорних та ін. [3].
Велике проспективне дослідження остеопорозу в жінок (Global Longitudinal Study of Osteoporosis in Women) показало, що зв’язок ризику переломів з хворобою Паркінсона був сильнішим, ніж для будь–якої іншої супутньої патології [24].
Постуральна нестабільність та порушення ходи, обумовлені хворобою Паркінсона, збільшують ризик падінь: 60,5 % пацієнтів з ХП падають принаймні один раз на рік, а 39 % мають повторні падіння, при цьому 33 % падінь призводять до переломів [8]. Ризик переломів у пацієнтів з ХП перевищує цей показник в осіб контрольної групи в 2–4 рази у різних популяціях [55, 61]. Як відомо, 90 % переломів в осіб літнього віку є результатом падінь [55].
Проте не всі переломи у цих пацієнтів обумовлені падіннями, зокрема, переломи тіл хребців [35]. Основний предиктор переломів внаслідок низькоенергетичної травми — низька МЩКТ [42]. І хоча вивчення МЩКТ у пацієнтів з ХП продовжується вже понад 25 років, кількість нових робіт збільшується. У недавно опублікованій статті остеопороз названий «прихованим немоторним обличчям» хвороби Паркінсона, вказується його роль у посиленні моторних та немотор–них симптомів і наголошується на необхідності його лікування у пацієнтів з ХП [45]. Ризик падінь частково залежить від проявів захворювання, і спосіб впливу на ризик падінь — лікування хвороби Паркінсона, а вплив на МЩКТ з метою зниження ризику переломів може бути здійсненим лише специфічними засобами після проведення відповідної діагностики [3, 61].
У багатьох дослідженнях показано, що МЩКТ у пацієнтів з ХП вірогідно нижча, ніж в осіб контрольної групи [45, 50, 55, 60]. Частота виявлення низької МЩКТ досягає 60–90 % [48, 50]. При цьому показники МЩКТ у пацієнток з ХП нижчі порівняно з особами контрольної групи на 7–20 % [30, 48]. Незважаючи на все вищенаведене, проведення обстеження кісткової тканини не включене в обов’язковий перелік для пацієнтів з хворобою Паркінсона.
Рухові порушення — один із провідних факторів, що пояснює зниження МЩКТ та підвищений ризик переломів у пацієнтів з ХП. При цьому тремор позитивно впливає на МЩКТ, а іммобілізація й порушення функціональності — негативно. Різноспрямованість впливів окремих симптомів хвороби Паркінсона на кісткову тканину пояснює відмінності в результатах різних досліджень. Кісткова тканина постійно підлягає механічній стимуляції у зв’язку зі скороченням м’язів та рухами тіла. У відповідь на механічні навантаження активуються темпи її ремоделювання. Клітини кісткової тканини — остеоцити у відповідь на механічне навантаження стимулюють діяльність остеобластів та остеокластів [14]. З одного боку, зменшення рухової функції зменшує стимуляцію остеоцитів, а з іншого — збільшення м’язового тонусу й тремор збільшують цю стимуляцію. За результатами одних досліджень, МЩКТ у хворих з ХП пов’язана з тривалістю та тяжкістю захворювання [4], за даними інших — цей зв’язок відсутній [22].
До провідних чинників зниження МЩКТ відносять порушення харчування, низький індекс маси тіла (ІМТ), дефіцит вітаміну D, зниження м’язової сили та мобільності, підвищений рівень гомоцистеїну внаслідок лікування високими дозами леводопи [60].
Втрата маси тіла, зокрема жирової маси — один із немоторних вегетативних симптомів хвороби Паркінсона [38]. Зниження маси тіла в пацієнтів з ХП було описане вже в першій публікації Джеймса Паркінсона в 1817 році. Результати досліджень останніх років показують, що ІМТ у пацієнтів з ХП вірогідно нижчий порівняно з показниками контрольної групи й залежить від тяжкості захворювання. Також у хворих з ХП були нижчими показники жирової та знежиреної маси [38, 41].
Дослідження ролі вітаміну D у генезі та прогнозі хвороби Паркінсона тривають. Вітамін D — відомий фактор ризику остеопорозу та остеомаляції. На сьогодні доведено, що у пацієнтів з ХП сироваткові рівні вітаміну D вірогідно нижчі, ніж у популяції, але зміни цього показника під впливом прогресування та лікування хвороби досліджуються [39, 47].
Мінеральна щільність кісткової тканини у хворих на розсіяний склероз
Інше неврологічне захворювання, що також супроводжується значним збільшенням ризику переломів, — розсіяний склероз (РС), що характеризується класичною тріадою симптомів: ураження пірамідного шляху (рухові порушення), координаторна дисфункція та порушення зору. На відміну від попередніх захворювань це хвороба переважно молодих осіб. Пацієнти з РС мають більший ризик розвитку остеопорозу та низькоенергетичних переломів внаслідок використання глюкокортикоїдів, іммобілізації та дефіциту вітаміну D [28, 33]. При обстеженні 9346 пацієнтів з РС у 2501 (27,2 %) зареєстроване зниження кісткової маси, більше 15 % пацієнтів повідомили про переломи в анамнезі у віці старше 13 років (n = 1482), серед них 685 (46,2 %) мали множинні переломи, у 522 (35,2 %) був перелом кісток передпліччя, 165 (11,1 %) повідомили про перелом хребців, у 100 (7,4 %) був перелом шийки стегнової кістки [43]. Серед учасників дослідження з переломами в анамнезі 746 (55 %) приймали препарати кальцію, 858 (68,8 %) — вітамін D і 334 (22,5 %) — бісфосфонати [43].
Зміни МЩКТ виявлені не лише у літніх, але й у молодих осіб. Ранні дослідження, як і в випадку з іншими захворюваннями, пов’язували зниження МЩКТ у цієї категорії пацієнтів зі знерухомленням. В наступних роботах стали розглядати вплив інших факторів. На нашу думку, механізми змін кісткової тканини у пацієнтів з РС не повністю зрозумілі. У пацієнтів з РС віком до 50 років виявлені значущі корелятивні зв’язки між МЩКТ на рівні шийки стегнової кістки та віком, а також між МЩКТ та фізичною активністю, між віком початку РС та МЩКТ [54]. У результаті дослідження було знайдено, що низька МЩКТ переважає у молодих пацієнтів, і отже, саме ця категорія потребує найбільшої уваги до кісткової тканини.
При дослідженні факторів ризику остеопорозу, незалежних від іммобілізації, виявлено вірогідно нижчу концентрацію вітаміну D й остеокальцину та вірогідно вищі показники ПТГ, лужної фосфатази, піридиноліну та дезоксипіридиноліну у пацієнтів з РС зі збереженою руховою функцією. Показники МЩКТ на рівні поперекового відділу хребта та шийки й великого вертлюга стегнової кістки також були значно нижчими, ніж у контрольній групі. Знайдені значні негативні корелятивні зв’язки між тривалістю хвороби та МЩКТ. Також знайдені вірогідні зв’язки між загальною функціональною незалежністю та МЩКТ шийки й великого вертлюга стегнової кістки, негативні кореляції між EDSS і МЩКТ на рівні поперекового відділу хребта та всіх вимірювань на рівні стегнової кістки. Щодо сироваткових показників ремоделювання кісткової тканини, то не знайдено ніяких вірогідних зв’язків, крім значного взаємозв’язку між рівнем вітаміну D і МЩКТ на рівні поперекового відділу хребта. Таким чином, тривалість захворювання та зниження функціональних можливостей є основними чинниками, що впливають на МЩКТ у пацієнтів з РС. Поряд зі зменшенням функціональних можливостей дефіцит D і вторинне збільшення ПТГ сприяють змінам МЩКТ, які спостерігаються у пацієнтів з РС [56].
Якщо в загальній популяції остеопороз та підвищений ризик переломів, пов’язаних з остеопорозом, проявляються у чоловіків приблизно на 10 років пізніше, ніж у жінок, то в чоловіків з РС ризик переломів вірогідно вищий, ніж у жінок відповідної вікової групи [62].
Згідно з сучасними тенденціями, застосування глюкокортикостероїдів у пацієнтів із розсіяним склерозом зменшується, натомість поширюється застосування імуномодулюючих засобів. Даних щодо впливу цих препаратів на кісткову тканину набагато менше. Отже, важливо вивчити стан кісткової тканини у сучасних пацієнтів, враховуючи особливості лікування основного захворювання. При дослідженні 37 пацієнтів з РС, які отримували імуномодулюючу терапію та високодозову пульс–терапію глюкокортикоїдами (внутрішньовенно метилпреднізолон 500 мг), виявлено, що МЩКТ у цих пацієнтів на рівні поперекового відділу хребта та проксимального відділу стегнової кістки була зі знаком «+» за Z–показником. Автори зробили висновок про позитивний вплив імуномодулюючої терапії на кісткову тканину навіть у присутності стероїдної терапії [34].
В іншому дослідженні отримані протилежні результати. МЩКТ у жінок, які отримували інтерферон, вірогідно не відрізнялась від МЩКТ тих пацієнток, які отримували глюкокортикостероїди. Проте у чоловіків, які отримували лікування інтерфероном, МЩКТ була нижчою, ніж у тих, хто не отримував цього препарату, та ніж в контрольній групі. У параметрах кісткового ремоделювання не було виявлено відмінностей [49]. На нашу думку, це парадоксальні результати, оскільки інтерферон відіграє роль в регуляції метаболізму кісткової тканини — гальмує розвиток остеокластів.
У сучасних дослідженнях як найбільш значимий фактор ризику виділяють хронічний запальний процес основного захворювання, а не використання глюкокортикоїдів, як вважалось в попередніх роботах [33, 46]. Хоча високі дози глюкокортикоїдів, навіть короткостроково, призводять до зменшення формування кісткової тканини, але у пацієнтів з РС цей ефект звичайно оборотний, тому формування остеопорозу у хворих з РС не можна пояснити тільки застосуванням кортикостероїдів [53]. Клінічні дані свідчать про важливу роль вітаміну D як модифікуючого фактора ризику РС. Низькі рівні циркулюючого вітаміну D були виявлені у хворих з РС, особливо під час рецидивів. Припускають, що вітамін D може бути залучений до регулювання клінічної активності захворювання. Вітамін D реалізує свої функції через рецептор вітаміну D (VDR). Поліморфізм VDR спричиняє значний вплив на функцію вітаміну D, а деякі з генотипів VDR були пов’язані з остеопорозом і РС. Також в літературі нами знайдені поодинокі роботи про роль остеопонтину в патогенезі як розсіяного склерозу, так і остеопорозу. При обстеженні 50 пацієнтів з РС виявлено вірогідно нижчий рівень остеопонтину, ніж в популяції відповідного віку [9].
Отже, згідно з сучасними даними літератури, у пацієнтів з РС вірогідно вищий ризик переломів та більша частота остеопорозу й остеопенії, ніж в популяції. Що ж до механізмів розвитку зниженої мінеральної щільності кісткової тканини, то вони досі не з’ясовані. Звісно, певну роль в цьому процесі відіграють як іммобілізація, так і застосування глюкокортикоїдів, але основне значення, на нашу думку, має зміна метаболізму кісткової тканини, пов’язана як з запальним процесом, так і з поліморфізмом генів рецептора до вітаміну D та ін.
Ця проблема є дуже актуальною саме для нашої популяції і потребує інформованості пацієнтів. Наприклад, в дослідженні R.A. Marrie та співавт. [43] 746 (55 %) пацієнтів з РС з переломами в анамнезі приймали препарати кальцію, 858 (68,8 %) — вітамін D та 334 (22,5 %) — бісфосфонати. Навряд чи в нашій популяції так само активно відбувається корекція кісткової тканини у пацієнтів з неврологічною патологією.
Остеопороз, індукований травмою хребта і спинного мозку
Травма хребта та спинного мозку (ТХСМ) породжує каскад нейронних, судинних, гормональних і механічних чинників, що призводить до швидкої втрати кісткової маси в усьому скелеті та розвитку остеопорозу. Зниження мінеральної щільності кісткової тканини відбувається переважно в ділянках скелета, розташованих нижче рівня травми та позбавлених осьового навантаження. У кістках з однаковим навантаженням резорбція переважає в ділянках, представлених губчастою кістковою тканиною. Так, за даними периферичної комп’ютерної томографії, за 3–7 років після травми МЩКТ знижується на рівні епіфіза стегнової кістки на 50 %, епіфіза великогомілкової кістки — на 60 %, а на рівні діафізів — на 35 та 25 % відповідно [27]. При цьому, згідно з даними двофотонної рентгенівської абсорбціометрії (ДРА), в перший рік після ТХСМ ділянки скелета, представлені переважно губчастою кістковою тканиною, втрачають до 4 %, а кортикальною кістковою тканиною — до 2 % кісткової маси щомісячно [11].
У пацієнтів із ТХСМ зміни в кістковій тканині різноспрямовані: в ділянках, розташованих нижче рівня травми та позбавлених осьового навантаження, розвивається остеопороз з втратою за 3–5 років до 50 % кісткової маси, а на рівні хребта спочатку МЩКТ знижується, а потім повертається до норми. МЩКТ верхніх кінцівок залежить від рівня ураження спинного мозку та функціональних можливостей пацієнтів [21, 31]. В осіб з тетраплегією МЩКТ верхніх кінцівок нижча, а у пацієнтів з параплегією — не відрізняється або вища, ніж в осіб контрольної групи, що зумовлено збільшенням навантаження на верхні кінцівки у повсякденному житті [31].
Поширеність переломів в осіб із ТХСМ досягає 40 % [59]. Переважна локалізація переломів — нижня третина стегнової кістки та верхня третина великогомілкової кістки. Це ділянки скелета з найнижчою МЩКТ. Частота переломів збільшується зі збільшенням тривалості посттравматичного періоду. Також частота залежить від рівня та ступеня пошкодження спинного мозку. Ризик переломів вищий у пацієнтів з параплегією порівняно з хворими з тетраплегією, що зумовлено вищим рівнем фізичних можливостей та більшою мобільністю, та у пацієнтів з повним пошкодженням спинного мозку порівняно з показником хворих із частковим пошкодженням [31].
Нетипова для остеопорозу локалізація переломів та різноспрямовані зміни ділянок скелета, розташованих вище і нижче рівня травми, обумовлюють особливості обстеження кісткової тканини та обмежують діагностичні можливості методик у пацієнтів із ТХСМ.
Стандартні ділянки обстеження методом ДРА — це поперековий відділ хребта, дистальний відділ кісток передпліччя, весь скелет та проксимальний відділ стегнової кістки. Якщо враховувати специфічність змін у скелеті після ТХСМ, то цільовою ділянкою обстеження є проксимальний відділ стегнової кістки та весь скелет, хоча МЩКТ дистального відділу стегнової кістки на 8–13 % нижча порівняно з показниками проксимального відділу стегнової кістки [25]. Після ТХСМ зміни кісткової тканини розвиваються дуже швидко, а отже, й профілактичні та лікувальні заходи повинні бути розпочаті якомога швидше. Той факт, що на сього–дні не існує засобів, здатних повною мірою відновити кісткову масу, втрачену внаслідок ТХСМ, обґрунтовує необхідність раннього припинення резорбції кісткової тканини. Основним профілактичним засобом є рання активізація пацієнта, включаючи відновлення осьового навантаження, яка здатна уповільнити резорбцію та зменшити ступінь втрати кісткової маси. Доведено, що вагонавантажувальні вправи у вертикальному положенні ефективні в уповільненні втрати кісткової маси [21]. Крім того, підтримання адекватних рівнів вітаміну D знижує прогресування остеопорозу і може знизити ризик виникнення переломів. У дослідженні W. Bauman та співавт. [12] показано, що додатковий прийом вітаміну D сприяв стабілізації МЩКТ нижніх кінцівок у пацієнтів з тетраплегією. На відміну від вищезазначеного, дефіцит вітаміну D може призвести до вторинного гіперпаратиреозу, збільшення ризику падінь, додаткової м’язової слабкості, що значно підвищує ризик переломів [10].
Згідно з сучасними даними літератури, лікування остеопорозу, індукованого травмою хребта та спинного мозку, складається з ранньої активізації пацієнтів, достатнього вмісту кальцію в дієті (1000–1500 мг/д) та підтримання цільових рівнів вітаміну D (30–50 нг/мл). Серед остеотропних препаратів застосовують бісфосфонати, як найбільш вивчені. Ці засоби досліджуються у пацієнтів з ТХСМ з 1981 року, і, незважаючи на це, їх роль у підтриманні МЩКТ після ТХСМ залишається суперечливою [20]. Неоднозначні результати при вивченні ефективності бісфосфонатів обумовлені різними дозами, шляхами та періодичністю введення препаратів, неоднорідністю пацієнтів, які беруть участь у дослідженні, та методологією дослідження [20].
Згідно з сучасними даними літератури, у хворих з неврологічними захворюваннями (порушення мозкового кровообігу, хвороба Паркінсона, розсіяний склероз, травма хребта та спинного мозку) доведена більша частота випадків остеопорозу та остеопенії, ніж в популяції, прискорена втрата кісткової тканини та значно вищий ризик переломів, особливо переломів стегнової кістки. Продовжується вивчення механізмів формування остеопорозу у цієї категорії хворих, з’являються нові погляди на причини підвищеного ризику переломів, а отже, нові напрями профілактики та лікування.
Узагальнюючи наведені дані, основними рекомендаціями щодо ведення пацієнтів з неврологічною патологією є:
1. Інформованість пацієнтів та медичної спільноти про підвищений ризик виникнення остеопорозу і переломів у пацієнтів з неврологічною патологією.
2. Рання вертикалізація пацієнтів з метою відновлення осьового навантаження на скелет.
3. Вживання достатньої кількості кальцію з дієтою або додатковими препаратами.
4. Регулярний контроль та корекція рівня вітаміну D у сироватці крові.
5. Регуляне обстеження кісткової системи у пацієнтів з високим ризиком розвитку остеопорозу.
6. Застосування специфічної остеотропної терапії у пацієнтів з остеопорозом тільки після контролю та корекції рівня вітаміну D в сироватці крові.
7. Включення обстеження на остеопороз в схеми ведення пацієнтів з неврологічною патологією з доведеним впливом на кісткову тканину.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
1. Поворознюк В.В., Григорьева Н.В. Менопауза и костно–мышечная система. К.: Експрес, 2004. 512 с.
2. Повреждение позвоночника и спинного мoзга. Под ред. Н.Е. Полищука, Н.А. Коржа, В.Я. Фищенко. К.: Книга плюс, 2001. 388 с.
3. Рекомендації щодо діагностики та лікування хвороби Паркінсона. За ред. І.М. Карабань. К.: ТОВ «Медичний журнал «Нейроньюс», 2017. 84 с.
4. Abou–Raya S., Helmii M., Abou–Raya A. Bone and mineral metabolism in older adults with Parkinson’s di–sease. Age and Ageing. Nov. 38(6). 675–80. doi: 10.1093/ageing/afp137.
5. Ahnstedt H., McCullough L.D., Cipolla M.J. The Importance of Considering Sex Differences in Translational Stroke Research. Transl. Stroke Res. 2016 Aug. 7(4). 261–273. doi: 10.1007/s12975–016–0450–1.
6. Al Anouti F., Taha Z., Shamim S., Khalaf K., Al Kaabi L., Alsafar H. An insight into the paradigms of osteoporosis, from genetics to biomechanics. Bone reports. 2019. 11. 100216. doi: 10.1016/j.bonr.2019.100216.
7. Akkawi I., Zmerly H. Osteoporosis, Current Concepts. Joints. 2018 Jun. 6(2). 122–127. doi: 10.1055/s–0038–1660790.
8. Allen N., Schwarzel A., Canning C. Recurrent falls in Parkinson’s disease: a systematic review. Parkinsons Dis. 2013. 2013. 906274. doi: 10.1155/2013/906274.
9. Altintaş A., Saruhan–Direskeneli G., Benbir G. et al. The role of osteopontin: a shared pathway in the pathogenesis of multiple sclerosis and osteoporosis? J. Neurol. Sci. 2009 Jan 15. 276(1–2). 41–44. doi: 10.1016/j.jns.2008.08.031.
10. Battaglino R., Lazzari A., Garshick E., Morse L. Spinal cord injury–induced osteoporosis: pathogenesis and emerging therapies. Curr. Osteoporos. Rep. 2012. 10(4). 278–285. doi: 10.1007/s11914–012–0117–0.
11. Bauman W., Cardozo C. Osteoporosis in individuals with spinal cord injury. PMR. 2015. 7(2). 188–201. doi: 10.1016/j.pmrj.2014.08.948.
12. Bauman W., Spungen A., Morrison N. et al. Effect of a vitamin D analog on leg bone mineral density in patients with chronic spinal cord injury. J. Rehabil. Res. 2005. 42(5). 625–634. doi: 10.1682/JRRD.2004.11.0145.
13. Beaupre G.S., Lew H.L. Bone–density changes after stroke. Am. J. Phys. Med. Rehabil. 2006 May. 85(5). 464–472. doi: 10.1097/01.phm.0000214275.69286.7a.
14. Bikle D. Integrins, insulin like growth factors, and the skeletal response to load. Osteoporos. Int. 2008. 19(9). 237–1246. doi: 10.1007/s00198–008–0597–z.
15. Boling E.P. Gender and osteoporosis: similarities and sex–specific differences. J. Gend. Specif. Med. 2001. 4(2). 36–43. PMID: 11480096.
16. Bonnet N., Pierroz D.D., Ferrari S.L. Adrenergic control of bone remodeling and its implications for the treatment of osteoporosis. J. Musculoskelet. Neuronal. Interact. 2008. 8(2). 94–104. PMID: 18622078.
17. Colangelo L., Biamonte F., Pepe J., Cipriani C., Minisola S. Understanding and managing secondary osteoporosis. Expert Rev. Endocrinol. Metab. 2019 Mar. 14(2). 111–122. doi: 10.1080/17446651.2019.1575727.
18. Carbone L., Chin A.S., Lee T.A. et al. The association of anticonvulsant use with fractures in spinal cord injury. Am. J. Phys. Med. Rehabil. 2013. 92(12). 1037–1046. doi: 10.1097/PHM.0000000000000014.
19. Carda S., Cisari C., Invernizzi M., Bevilacqua M. Osteoporosis after Stroke: A Review of the Causes and Potential Treatments Cerebrovasc Dis. 2009. 28. 191–200. doi: 10.1159/000226578.
20. Chang K., Hung C., Chen W. et al. Effectiveness of bisphosphonate analogues and functional electrical stimulation on attenuating post–injury osteoporosis in spinal cord injury patients — a systematic review and meta–ana–lysis. PLoS One. 2013. 8(11). e81124. doi: 10.1371/journal.pone.0081124.
21. Charmetant C., Phaner V., Condemine A., Calmels P. Diagnosis and treatment of osteoporosis in spinal cord injury patients: a literature review. Ann. Phys. Rehabil. Med. 2010. 53. 655–668. doi: 10.1016/j.rehab.2010.10.001.
22. Daniel S.K., Lansang M.C., Okun M.S. Bone mineral density (BMD) in male patients with Parkinson’s disease. Int. J. Neurosci. 2012. 122(9). 523–527. doi: 10.3109/00207454.2012.685530.
23. De Vries F., Pouwels S., Bracke M. et al. Use of beta–2 agonists and risk of hip/femur fracture: a populationbased case–control study. Pharmacoepidemiol. Drug Saf. 2007. 16. 612–629. doi: 10.1002/pds.1318.
24. Dennison E.M., Premaor M., Flahive J. et al. Effect of comorbidities on fracture risk: findings from the glow study. Osteoporos. Int. 2011. 22. 529–530. doi: 10.1016/j.bone.2012.02.639.
25. Doherty A.L., Battaglino R.A., Donovan J. et al. Аdiponectin is a candidate biomarker of lower extre–mity bone density in men with chronic spinal cord injury. J. Bone Miner Res. 2014 Jan. 29(1). 251–259. doi: 10.1002/jbmr.2020.
26. Ducy P., Amling M., Takeda S. et al. Leptin inhi–bits bone formation through a hypothalamic relay: a central control of bone mass. Cell. 2000. 100(2). 197–207. doi: 10.1016/s0092–8674(00)81558–5.
27. Eser P., Frotzler A., Zehnder Y. et al. Relationship between the duration of paralysis and bone structure: A pQCT study of spinal cord injured individuals. Bone. 2004. 34(5). 869–880. doi: 10.1016/j.bone.2004.01.001.
28. Faulkner M.A., Ryan–Haddad A.M., Lenz T.L., Degner K. Osteoporosis in long–term care residents with multiple sclerosis. Consult. Pharm. 2005 Feb. 20(2). 128–136.
29. Forster A., Young J. Incidence and consequences of falls due to stroke: a systematic inquiry. BMJ. 1995. 311(6997). 83–86. doi: 10.1136/bmj.311.6997.83.
30. Gao H., Wei X., Liao J. et al. Lower bone mineral density in patients with parkinson’s disease: a cross–sectio–nal study from Chinese Mainland. Front. Aging Neurosci. 2015. (7)203. doi: 10.3389/fnagi.2015.00203.
31. Gifre L., Vidal J., Carrasco et al. Risk factors for the development of osteoporosis after spinal cord injury. A 12–month follow–up study. Osteoporosis International. 2015. Sep. 26(9). 2273–2280. doi: 10.1007/s00198–015–3150–x.
32. Girijala R.L., Sohrabji F., Bush R.L. Sex differences in stroke: Review of current knowledge and evidence. Vasc. Med. 2017 Apr. 22(2). 135–145. doi: 10.1177/1358863X16668263.
33. Gupta S., Ahsan I., Mahfooz N. et al. Osteoporosis and multiple sclerosis: risk factors, pathophysiology, and therapeutic interventions. CNS Drugs. 2014 Aug. 28(8). 731–742. doi: 10.1007/s40263–014–0173–3.
34. Shuhaibar M., McKenna M.J., Au–Yeong M., Redmond J.M. Favorable effect of immunomodulator therapy on bone mineral density in multiple sclerosis. Ir. J. Med. Sci. 2009 Mar. 178(1). 43–45. doi: 10.1007/s11845–008–0253–9.
35. Kalilani L., Asgharnejad M., Palokangas T., Durgin T. Comparing the Incidence of Falls/Fractures in Parkinson’s Disease Patients in the US Population. PLoS One. 2016. 11(9). doi: 10.1371/journal.pone.0161689.
36. Huo K., Hashim S.I., Yonget K.L.Y. et al. Impact and risk factors of post–stroke bone fracture. World J. Exp. Med. 2016 Feb 20. 6(1). 1–8. doi: 10.5493/wjem.v6.i1.1.
37. Kapral M.K., Fang J., Alibhai S.M. et al. Risk of fractures after stroke: Results from the Ontario stroke registry. Neurology. 2017. 88. 57–64. doi: 10.1212/WNL.0000000000003457.
38. Kistner A., Lhommée E., Krack P. Mechanisms of Body Weight Fluctuations in Parkinson’s Disease. Front. Neurol. 2014. 5. 84. doi: 10.3389/fneur.2014.00084.
39. Knekt P., Kilkkinen A., Rissanen H. et al. Serum vitamin D and the risk of Parkinson disease. Arch. Neurol. 2010. 67. 808–811. doi: 10.1001/archneurol.2010.120.
40. Lazoura O., Groumas N., Antoniadou E. et al.: Bone mineral density alterations in upper and lower extremities 12 months after stroke measured by peripheral quantitative computed tomography and DXA. J. Clin. Densitom. 2008. 11. 511–517. doi: 10.1016/j.jocd.2008.05.097.
41. Lindskov S., Sjöberg K., Hagell P., Westergren A. Weight stability in Parkinson’s disease. An International Journal on Nutrition, Diet and Nervous System. 2016. 19. 11–20. doi: 10.1179/1476830515Y.0000000044.
42. Marks R. Hip fracture epidemiological trends, outcomes, and risk factors, 1970–2009. Int. J. Gen. Med. 2010. 3. 1–17. PMID: 20463818.
43. Marrie R.A., Cutter G., Tyry T., Vollmer T. A cross–sectional study of bone health in multiple sclerosis. Neurology. 2009 Oct 27. 73(17). 1394–1398. doi: 10.1212/WNL.0b013e3181beece8.
44. Wei M., Lyu H., Huo K., Su H. Impact of bone fracture on ischemic stroke recovery. Int. J. Mol. Sci. 2018 May. 19(5). 1533. doi: 10.3390/ijms19051533.
45. Metta V., Sanchez T., Padmakumar C. Osteoporosis: a hidden nonmotor face of parkinson’s disease. Int. Rev. Neurobiol. 2017. 134. 877–890. doi: 10.1016/bs.irn.2017.05.034.
46. Hearn A.P., Silber E. Osteoporosis in multiple sclerosis. Mult. Scler. 2010 Sep. 16(9). 1031–1043. doi: 10.1177/1352458510368985.
47. Namba S., Yamaoka–Tojo M., Hashikata T. et al. Long–term warfarin therapy and biomarkers for osteoporosis and atherosclerosis. BBA Clinical. 2015. 4. 76–80. doi: 10.1016/j.bbacli.2015.08.002.
48. Ozturk E., Gundogdu I., Tonuk B. et al. Bone mass and vitamin D levels in Parkinson’s disease: is there any difference between genders? J. Phys. Ther. Sci. 2016. 28(8). 2204–2209. doi: 10.1589/jpts.28.2204.
49. Pérez Castrillón J.L., Cano–del Pozo M., Sanz–Izquierdo S. et al. Bone mineral density in patients with multiple sclerosis: the effects of interferon. Rev. Neurol. 2003. 36(10). 901–903.
50. Raglione L., Sorbi S., Nacmias B. Osteoporosis and Parkinson’s disease. Clin. Cases Miner Bone Metab. 2011. 8(3). 16–18. PMCID: PMC3279061.
51. Sato Y., Maruoka H., Honda Y. et al. Development of osteopenia in the hemiplegic finger in patients with stroke. Eur. Neurol. 1996. 36. 278–283. PMID: 8864708.
52. Schnitzer T.J., Harvey R.L., Nack S.H. et al. Bone mineral density in patients with stroke: relationship with motor impairment and functional mobility. Top. Stroke Rehabil. 2012 Sep–Oct. 19(5). 436–43. doi: 10.1310/tsr1905–436.
53. Sioka C., Kyritsis A.P., Fotopoulos A. Multiple sclerosis, osteoporosis, and vitamin D. J. Neurol. Sci. 2009 Dec 15. 287(1–2). 1–6. doi: 10.1016/j.jns.2009.09.012.
54. Steffensen L.H., Mellgren S.I., Kampman M.T. Predictors and prevalence of low bone mineral density in fully ambulatory persons with multiple sclerosis. Neurol. 2010 Mar. 257(3). 410–418. doi: 10.1007/s00415–009–5337–6.
55. Tan L., Wang Y., Zhou L. et al. Parkinson’s Disease and Risk of Fracture: A Meta–Analysis of Prospective Cohort Studies. PLoS ONE. 2014. 9(4). e94379. doi: 10.1371/journal.pone.0094379.
56. Terzi T., Terzi M., Tander B. et al. Changes in bone mineral density and bone metabolism markers in premenopausal women with multiple sclerosis and the relationship to clinical variables. J. Clin. Neurosci. 2010 Oct. 17(10). 1260–1264. doi: 10.1016/j.jocn.2010.01.044.
57. Togari A., Arai M. Pharmacological topics of bone metabolism: the physiological function of the sympathetic nervous system in modulating bone resorption. J. Pharmacol. Sci. 2008. 106(4). 542–546. doi: 10.1254/jphs.FM0070227.
58. Togari A., Arai M., Kondo H. et al. The neuro–osteogenic network: The sympathetic regulation of bone resorption. Japanese Dental Science Review. 2012 Aug. 48(2). 61–70. doi: 10.1016/j.jdsr.2011.12.002.
59. Troy K.L., Morse L.R. Measurement of bone: diagnosis of SCI–induced osteoporosis and fracture risk prediction. Top. Spinal Cord Inj. Rehabil. 2015. 21(4). 267–274. doi: 10.1310/sci2104–267.
60. Van den Bos F., Speelman A., Samson M. et al. Parkinson’s disease and osteoporosis. Age Ageing. 2013. 42(2). 156–162. doi: 10.1093/ageing/afs161.
61. Voaklander D.C., Martin W., King–Jesso P. et al. Incidence of hip fracture in Parkinson disease: a population–based study in British Columbia, Canada. Injury Prevention. 2010. 16. A1–A289.
62. Weinstock–Guttman B., Gallagher E., Baier M. et al. Risk of bone loss in men with multiple sclerosis. Mult. Scler. 2004 Apr. 10(2). 170–175. doi: 10.1191/1352458504ms993oa.
63. Zerwekh J., Ruml L., Gottschalk F., Pak C. The effects of twelve weeks of bed rest on bone histology, biochemical markers of bone turnover, and calcium homeostasis in eleven normal subjects. J. Bone Miner Res. 1998 Oct. 13(10). 1594–601. doi: 10.1359/jbmr.1998.13.10.1594.