Журнал «Здоровье ребенка» Том 14, №8, 2019
Вернуться к номеру
Ефекти карбоцистеїну при хворобах органів дихання: огляд літератури
Авторы: Речкіна О.О.
Державна установа «Національний інститут фтизіатрії і пульмонології ім. Ф.Г. Яновського Національної академії медичних наук України», м. Київ, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
У літературному огляді обґрунтовано доцільність вибору карбоцистеїну при хворобах органів дихання в дітей, що супроводжуються кашлем (у першу чергу при гострих респіраторних інфекціях). Карбоцистеїн — мукорегулятор, ефективність і безпека якого були переконливо підтверджені впродовж десятиріч клінічного застосування. Проте останніми роками були отримані нові наукові дані, які свідчать про те, що поряд із основною мукорегуляторною дією карбоцистеїн має цілу низку додаткових сприятливих ефектів, що, безумовно, впливають на різні ланки патогенезу запальних захворювань органів дихання. В огляді узагальнені результати експериментальних і клінічних досліджень, що підтверджують мультимодальний характер дії карбоцистеїну й розкривають механізми його терапевтичної ефективності при хворобах органів дихання. Зокрема, наведені дані щодо здатності карбоцистеїну відновлювати кількісне співвідношення кислих і нейтральних муцинів у бронхіальному секреті (завдяки чому нормалізується в’язкість і еластичність слизу), зменшувати гіпертрофію келихоподібних клітин та обсяг секретованого ними слизу, перешкоджати адгезії вірусів (риновірусів і вірусів грипу А) і патогенних бактерій до епітеліоцитів слизової оболонки дихальних шляхів, а також нормалізувати секрецію імунологічно активного IgА і підвищувати ефективність антибіотикотерапії. Особливу увагу приділено протизапальному, антиоксидантному й антиапоптотичному ефектам карбоцистеїну. На підставі проаналізованих літературних джерел зроблено висновок, що карбоцистеїн — мультимодальний препарат, який доцільно застосовувати вже з перших днів гострих респіраторних захворювань у дітей з метою зменшення тяжкості клінічних проявів, полегшення виділення мокротиння, запобігання приєднанню інших інфекцій і розвитку ускладнень, а також для уникнення поліпрагмазії.
В литературном обзоре обоснована целесообразность выбора карбоцистеина при болезнях органов дыхания у детей, сопровождающихся кашлем (в первую очередь при острых респираторных инфекциях). Карбоцистеин — мукорегулятор, эффективность и безопасность которого были убедительно подтверждены в течение десятилетий клинического применения. Однако в последние годы были получены новые научные данные, свидетельствующие о том, что наряду с основным мукорегуляторным действием карбоцистеин имеет целый ряд дополнительных благоприятных эффектов, безусловно влияющих на различные звенья патогенеза воспалительных заболеваний органов дыхания. В обзоре обобщены результаты экспериментальных и клинических исследований, подтверждающих мультимодальный характер действия карбоцистеина и раскрывающих механизмы его терапевтической эффективности при болезнях органов дыхания. В частности, приведены данные относительно способности карбоцистеина восстанавливать количественное соотношение кислых и нейтральных муцинов в бронхиальном секрете (благодаря чему нормализуется вязкость и эластичность слизи), уменьшать гипертрофию бокаловидных клеток и объем секретируемой ими слизи, препятствовать адгезии вирусов (риновирусов и вирусов гриппа А) и патогенных бактерий к эпителиоцитам слизистой оболочки дыхательных путей, а также нормализовывать секрецию иммунологически активного IgА и повышать эффективность антибиотикотерапии. Особое внимание уделено противовоспалительному, антиоксидантному и антиапоптотическому эффектам карбоцистеина. На основе проанализированных литературных источников сделан вывод, что карбоцистеин — мультимодальный препарат, который целесообразно применять уже с первых дней острых респираторных заболеваний у детей с целью уменьшения тяжести клинических проявлений, облегчения выделения мокроты, предотвращения присоединения других инфекций и развития осложнений, а также во избежание полипрагмазии.
The literature review substantiates the feasibility of choosing carbocisteine in respiratory diseases in children, which are accompanied by cough (first of all in acute respiratory infections). Сarbocisteine is a mucoregulator, whose efficacy and safety have been conclusively proven over decades of clinical use. However, in recent years, new scientific evidence has been obtained suggesting that, along with the main mucoregulatory action, carbocisteine exerts a number of additional beneficial effects, which certainly influence various pathogenetic links of inflammatory respiratory diseases. The review summarizes the results of experimental and clinical studies that confirm the multimodal nature of carbocisteine action and reveal the mechanisms of its therapeutic efficacy in respiratory diseases. In particular, the data are provided on the ability of carbocisteine to restore the quantitative ratio of acidic and neutral mucins in bronchial mucus (thereby normalizing the viscosity and elasticity of mucus), to reduce goblet cell hyperplasia and the volume of mucus secreted by them, to prevent the adhesion of viruses (rhinoviruses and influenza A viruses) and pathogenic bacteria to the epithelial cells of the mucous membrane of the respiratory tract, as well as to normalize the secretion of immunologically active IgA and to increase the effectiveness of antibiotic therapy. Particular attention is paid to the anti-inflammatory, antioxidant and anti-apoptotic effects of carbocisteine. Based on the analyzed literature, it is concluded that carbocisteine is a multimodal drug that is advisable to use from the first days of acute respiratory diseases in children to reduce the severity of clinical manifestations, facilitate the secretion of sputum, prevent concomitant infections and the development of complications, as well as to avoid polypharmacy.
хвороби органів дихання; гострі респіраторні інфекції; діти; кашель; мукорегулятори; карбоцистеїн; огляд
болезни органов дыхания; острые респираторные инфекции; дети; кашель; мукорегуляторы; карбоцистеин; обзор
respiratory diseases; acute respiratory infections; children; cough; mucoregulators; carbocisteine; review
Вступ
Хвороби органів дихання є однією з найбільш важливих проблем медицини, оскільки вони традиційно посідають провідні позиції в структурі захворюваності, особливо серед дітей. У структурі загальної захворюваності дитячого населення України ураження органів дихання залишаються найбільш поширеною патологією, при цьому, згідно з аналізом даних офіційної державної статистики, відзначається тенденція до росту показників захворюваності й поширеності [1]. У свою чергу, у структурі захворюваності органів дихання у дітей і дорослих, безумовно, домінують гострі респіраторні інфекції (ГРІ). Щорічно в Україні на ГРІ хворіють 10–14 млн осіб, що становить 25–30 % від усієї захворюваності і близько 75–90 % — від інфекційної [2]. Найчастіше (до 5–7 разів на рік) на ГРІ хворіють діти раннього, дошкільного й молодшого шкільного віку [3]. Отже, кожен сімейний лікар, терапевт, педіатр щоденно зустрічається з різноманітними клінічними формами органних уражень, спричинених ГРІ, — риносинуситами, фарингітами, тонзилітами, бронхітами, пневмоніями. Тому питання ефективної і безпечної терапії ГРІ є наріжним каменем успішної лікарської практики.
У лікуванні ГРІ лікарі переважно використовують різноманітні симптоматичні лікарські засоби (жарознижувальні, протикашльові тощо). Проте на сьогодні парадигма лікування змінюється. За рекомендаціями провідних спеціалістів і асоціацій, акцент зміщується від поліпрагмазії до щадної терапії. Препарат має бути ефективним і відповідати основному принципу медицини — «не зашкодь».
Останніми роками все більшу увагу вчених і клініцистів привертають мультимодальні препарати, що починають діяти з першого дня використання й впливають на багато різних ланок патогенезу ГРІ. Серед таких препаратів сьогодні активно вивчається карбоцистеїн. Чому ж цей препарат, історія застосування якого як мукорегулятора при респіраторних захворюваннях веде свій відлік із 1960-х років, зараз знову привернув пильну увагу вчених і лікарів?
Раніше карбоцистеїн дійсно вважали лише мукорегуляторним засобом, що характеризується добрим проникненням у бронхіальний секрет [4, 5] і впливає на вироблення й характеристики мокротиння, тобто чинить подвійну мукоактивну дію. По-перше, впливаючи на активність келихоподібних і серозних клітин, карбоцистеїн зменшує обсяг вироблюваного мокротиння. По-друге, він зменшує патологічну в’язкість мокротиння в просвіті бронхів. В’язкоеластичні властивості бронхіального слизу визначаються саме глікопротеїнами — сіаломуцинами, фукомуцинами й сульфомуцинами. Карбоцистеїн активує сіалову трансферазу, відновлює співвідношення сіаломуцинів і фукомуцинів (збільшуючи концентрації перших і зменшуючи концентрації других) і, отже, нормалізує реологічні характеристики (в’язкість і еластичність) бронхіального секрету. По суті, карбоцистеїн виступає мукорегулятором. На відміну від істинних муколітичних засобів він не впливає на структуру вже секретованого в дихальні шляхи мокротиння [6]. Завдяки цьому карбоцистеїн не збільшує кількість мокротиння (так званий ефект заливання легенів), а, навпаки, зменшує. Але це зменшення нової якості, зі зміною властивостей мокротиння: воно стає менш в’язким і легше виводиться з дихальних шляхів за рахунок активації війок миготливого епітелію.
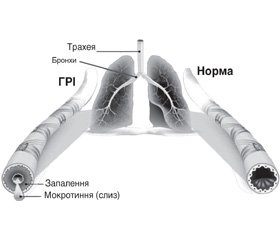
Як відомо, основним симптомом порушень секреції і виведення мокротиння як при гострих респіраторних захворюваннях, так і при загостреннях хронічних хвороб органів дихання є кашель. Безпосередніми механізмами, що зумовлюють виникнення кашлю в більшості пацієнтів із ГРІ, є викликане етіологічними агентами запалення слизової оболонки респіраторного тракту й накопичення в просвіті дихальних шляхів патологічного секрету — мокротиння (рис. 1).
Позитивний вплив карбоцистеїну на в’язкість мокротиння, а також його здатність покращувати мукоциліарний кліренс були переконливо продемонстровані в низці ранніх клінічних досліджень [7–10], а також були підтверджені десятиріччями успішного застосування карбоцистеїну в клінічній практиці в дітей і дорослих із захворюваннями, що супроводжуються порушеннями бронхіальної секреції і виведення мокротиння. Високий профіль безпеки карбоцистеїну при застосуванні в дітей віком старше 2 років з гострими захворюваннями верхніх і нижніх дихальних шляхів був переконливо підтверджений із позицій доказової медицини за даними кокранівського систематичного огляду 6 рандомізованих контрольованих клінічних досліджень [11].
Отже, на сьогодні офіційно затверджені показання до призначення карбоцистеїну з метою виведення мокротиння й полегшення кашлю як симптому. Механізм мукоактивної дії карбоцистеїну, його ефективність і безпека не викликають жодних сумнівів. Проте, як свідчать численні результати наукових досліджень, карбоцистеїн насправді характеризується набагато більш широким спектром позитивних ефектів, ніж вважалося раніше.
Обмеження інфекції — вплив на бактеріальні й вірусні патогени
Прикріплення (адгезія) патогенів до поверхні епітеліоцитів дихальних шляхів є першим кроком на шляху розвитку ГРІ, більшість з яких розпочинається з колонізації носоглотки. На сьогодні накопичені численні наукові дані про те, що карбоцистеїн запобігає адгезії патогенних мікроорганізмів до епітеліальних клітин респіраторного тракту й подальшому їх поширенню. Так, у вірусологічних дослідженнях [12, 13] отримані дані, що карбоцистеїн знижував титри риновірусу (RV), кількість РНК RV14 у клітинах, сприйнятливість клітин до RV-інфекції і концентрації цитокінів, у тому числі інтерлейкіну (IL) 6 і IL-8 після інфікування RV14 (основна група патогенних риновірусів). Карбоцистеїн знижував експресію мРНК, що кодує молекулу міжклітинної адгезії (ICAM-1) — рецептор для основної групи риновірусу. Карбоцистеїн також зменшував титри вірусу другорядної групи RV2, пригнічуючи інфікування шляхом блокади введення риновірусної РНК в ендосоми. Автори дійшли висновку, що карбоцистеїн модулює запалення дихальних шляхів, зменшуючи вироблення цитокінів при риновірусній інфекції.
Аналогічні дані були отримані й у дослідженнях з респіраторно-синцитіальним вірусом [14] і вірусом грипу А [15]. Клітини епітелію експресують сіалову кислоту з a2,6-зв’язком (SAa2,6Gal) — рецептором вірусу грипу людини в клітинах, а карбоцистеїн зменшує експресію SAa2,6Gal. За допомогою методу кількісної полімеразної ланцюгової реакції (ПЛР) у режимі реального часу вченими були отримані прямі докази інгібуючого ефекту карбоцистеїну на реплікацію РНК вірусу грипу А в епітеліальних клітинах людської трахеї (рис. 2).
Крім того, карбоцистеїн зменшує експресію білка NF-kB, включно з p50 і p65, у ядерних екстрактах клітин. Ці висновки свідчать, що карбоцистеїн може інгібувати інфекцію, викликану вірусом грипу, частково шляхом зниження експресії рецепторів до вірусу грипу людини в епітеліальних клітинах дихальних шляхів людини завдяки інгібуванню NF-kB і збільшенню рН у ендосомах. Отже, карбоцистеїн може зменшувати вираженість запалення в дихальних шляхах при грипі [15].
Окрім впливу на адгезію і поширення вірусів, карбоцистеїн здатен запобігати зараженню пневмококами, що може нашаровуватись на вірусну інфекцію. Як відомо, саме пневмокок (Streptococcus pneumoniae) є головним бактеріальним етіологічним фактором розвитку респіраторної патології, у тому числі тяжких позалікарняних пневмоній у дітей і дорослих. У дослідженні in vitro було показано, що пряма обробка карбоцистеїном епітеліальних клітин глотки, взятих у здорових добровольців, зменшує прикріплення до них S.рneumoniae [16]. Здатність карбоцистеїну ефективно пригнічувати адгезію пневмококів до епітеліальних клітин організму хазяїна згодом була продемонстрована й у дослідах, виконаних T. Sumitomo et al. [17]. Для того, щоб отримати уявлення про інгібіторний механізм, також досліджували вплив карбоцистеїну на експресію рецепторів фактора активації тромбоцитів (PAFR). Streptococcus pneumoniae використовує рецептори фактора активації тромбоцитів для адгезії до клітин хазяїна. Після застосування карбоцистеїну експресія PAFR зменшувалася як на рівні мРНК, так і на рівні посттранскрипції. Цікаво, що карбоцистеїн також ефективний при пригніченні адгезії пневмокока до клітин зі зміненими PAFR. Ці результати свідчать про те, що карбоцистеїн є імовірним інгібітором, орієнтованим також на інші численні епітеліальні рецептори, які взаємодіють із S.pneumoniae.
Також є наукові дані, що свідчать не лише про запобігання адгезії пневмококів, але й про аналогічні ефекти карбоцистеїну щодо Moraxella catarrhalis. У дослідженнях in vitro було встановлено, що на тлі застосування даного препарату адгезія цього мікроорганізму до епітеліоцитів глотки зменшується як у здорових людей, так і у хворих на хронічний бронхіт [18].
Протизапальний і антиоксидантний ефект
Карбоцистеїн також має протизапальну й антиоксидантну дію. У доклінічних і клінічних дослідженнях доведено, що карбоцистеїн зменшує інфільтрацію нейтрофілів у просвіт дихальних шляхів [19], знижує рівні прозапальних цитокінів — IL-1b, IL-8, IL-6 і 8-ізопростану [14, 20] (рис. 3), а також рівні аномальних глікопротеїнів слизу, вільних радикалів та активність еластази в бронхоальвеолярному лаважі [21].
Оскільки хемотаксичне залучення мононуклеарних клітин периферичної крові в легені, опосередковане IL-8, відіграє вирішальну роль у розвитку й підтриманні низки запальних захворювань, пригнічення продукування IL-8 може бути компонентом терапевтичного ефекту карбоцистеїну. Карбоцистеїн також може модулювати запалення дихальних шляхів, зменшуючи вироблення цитокінів при вірусних інфекціях, як уже було вказано раніше. Також карбоцистеїн ефективно пригнічує запалення в клітинах шляхом впливу на сигнальні шляхи NF-kB і ERK1/2 MAPK [22].
Протизапальні ефекти також безпосередньо пов’язують з ефектом «пастки» активних форм кисню (АФК), притаманним тіоефірним препаратам [23, 24]. Активні форми кисню можуть генеруватися запальними клітинами, що беруть участь у запаленні дихальних шляхів. Метаболіти кисню можуть сприяти пошкодженню епітелію і активувати тучні клітини в слизовій оболонці дихальних шляхів. АФК можуть викликати бронхоконстрикцію, секрецію слизу, впливати на судинну систему дихальних шляхів, а також збільшувати чутливість дихальних шляхів. Якщо активні види кисню беруть участь у запальній реакції при захворюванні дихальних шляхів, то «пастки» радикалів або антиоксиданти відіграють корисну роль при терапії [25]. S. Pinamonti et al. [23] провели серію експериментів із трьома радикал-продукуючими системами й продемонстрували, що карбоцистеїн дозозалежно зменшує активність оксидації та ушкодження ДНК, спричинене вільними радикалами. Японські [26] і китайські [22] вчені підтвердили, що карбоцистеїн пригнічує генерацію АФК у нейтрофілах, внутрішньоклітинний окисний стрес і вивільнення IL-8 і IL-6 із клітин. Також було доведено, що карбоцистеїн забезпечує захисний вплив на респіраторні клітини людини під час окисного стресу [27]. У цьому дослідженні клітини піддавали окисному стресу, а потім обробляли карбоцистеїном. Було показано, що карбоцистеїн стимулює потік глутатіону (основна система антиоксидантного захисту в організмі), збільшує концентрацію глутатіону й збільшує нейтралізацію АФК у клітинах, що експресують канал трансмембранної провідності CF. Ці висновки дають підставу для подальших уявлень про те, яким чином карбоцистеїн може чинити свої антиоксидантні захисні ефекти.
Під час нещодавно проведеного рандомізованого клінічного дослідження були отримані цікаві дані про те, що здатність карбоцистеїну послаблювати оксидативний стрес є корисною при такій поширеній патології, як синдром обструктивного апное сну (СОАС). Пацієнти із середньотяжким і тяжким СОАС (n = 40) отримували або карбоцистеїн у дозі 1500 мг на добу, або нічну СРАР-терапію (постійний позитивний тиск у дихальних шляхах) протягом 6 тижнів. Усім учасникам дослідження виконували полісомнографію. У групі пацієнтів, які отримували карбоцистеїн, було продемонстровано вірогідне покращення оцінки за Епвортською шкалою сонливості (10,18 ± 4,28 порівняно з 6,82 ± 3,66; P ≤ 0,01), індексу апное-гіпопное (55,34 ± 25,03 порівняно з 47,56 ± 27,32; P ≤ 0,01), часу й частки 90% десатурації кисню (12,66 (2,81; 50,01) порівняно з 8,9 (1,41; 39,71); P ≤ 0,01) і найнижчого рівня сатурації кисню (65,88 ± 14,86 порівняно з 70,41 ± 14,34; P ≤ 0,01). Аналогічні зміни також спостерігалися в групі CPAР-терапії. Проте частка пацієнтів, які відповідали критеріям доброго комплаєнсу, у групі, що отримувала карбоцистеїн, була вищою (n = 17), ніж у групі CPAP-терапії (n = 11; 100 порівняно з 64,7 %). Автори дослідження встановили, що пероральна терапія карбоцистеїном дещо покращує стан пацієнтів із середньотяжким і тяжким СОАС шляхом послаблення оксидативного стресу. Отже, карбоцистеїн може відігравати роль у лікуванні пацієнтів з СОАС, які мають незадовільну прихильність до СРАР-терапії [28].
Посилення місцевого імунітету
Важливою властивістю карбоцистеїну, яка, зокрема, зумовлює доцільність призначення цього препарату вже з перших днів респіраторного інфекційного захворювання, є його здатність відновлювати секрецію в дихальних шляхах імунологічно активного IgA. Останній забезпечує реалізацію специфічного гуморального імунного захисту, нейтралізуючи інфекційні агенти безпосередньо у воротах інфекції. Цей ефект був переконливо підтверджений у клінічних дослідженнях за участю дітей із ГРВІ та бронхітом (рис. 4) [29].
Антиапоптотичний ефект
З-поміж інших протизапальних ефектів карбоцистеїн стимулює очищення легень від загиблих клітин. У здорових людей щодня шляхом апоптозу гинуть мільярди клітин. Видалення цих апоптозних клітин, що називають ефероцитозом, повинно бути ефективним, щоб запобігти вторинному некрозу й вивільненню вмісту прозапальних клітин, що порушує гомеостаз тканин і потенційно сприяє автоімунній активності. Під час запалення більшість апоптотичних клітин видаляються макрофагами, ефероцитозний процес активно індукує фенотип макрофагів, що сприяє відновленню тканини й пригніченню запалення [30]. Карбоцистеїн значно знижує кількість нейтрофілів в органах дихання на стадії розрішення запалення, що означає сприяння кліренсу нейтрофілів. Цей препарат сприяє не тільки фагоцитозу, а й зв’язуванню апоптотичних клітин з альвеолярними макрофагами (АМ). Крім того, карбоцистеїн зменшує залишки фукози на клітинній поверхні АМ. Доведено, що видалення залишків фукози з клітинних поверхонь AM за допомогою фукозидази помітно посилює як зв’язування, так і фагоцитоз апоптичних клітин. Ці результати свідчать, що карбоцистеїн сприяє кліренсу АМ апоптотичних клітин у дихальних шляхах [31].
Захист епітелію дихальних шляхів і вплив на гіперреактивність бронхів
Дані, отримані в експериментальних дослідженнях на моделях відновлення респіраторного епітелію у тварин, свідчать про здатність карбоцистеїну позитивно впливати на рівні нейтральних ендопептидаз і зменшувати кашльову чутливість при моделюванні антигенного пошкодження епітелію трахеї в гризунів [32]. Нейтральні ендопептидази — це зв’язані з клітинною мембраною ферменти, що модулюють тахікінін-індуковане потенціювання холінергічної моторної трансмісії, скорочення гладкої мускулатури, секрецію слизу, кашель і збільшують судинну проникність у дихальних шляхах. У випробуваннях на тваринах і в дослідженнях за участю людей продемонстрували, що рівні нейтральних ендопептидаз є зниженими за наявності ураження респіраторного епітелію та асоціюються з бронхіальною гіперреактивністю [33, 34]. Подвійне сліпе плацебо-контрольоване перехресне дослідження продемонструвало вірогідне зниження кашльової чутливості під час тесту з інгаляційним капсаїцином (стимулятор кашльових рецепторів бронхів) у пацієнтів з астмою після 4-тижневого курсу прийому карбоцистеїну [35]. На думку дослідників, цей ефект карбоцистеїну пояснюється саме підвищенням рівня нейтральних ендопептидаз, і препарат може відігравати роль у лікуванні кашльового варіанта астми та інших запальних захворювань дихальних шляхів, основною характеристикою яких є кашель, який складно контролювати.
Підвищення ефективності антибіотикотерапії
У певних клінічних ситуаціях доводиться одночасно призначати пацієнту антибіотики й мукоактивні препарати. Зрозуміло, що якщо в лікаря є підстави вважати, що респіраторна інфекція має бактеріальну етіологію або ж на тлі первинної вірусної ГРІ розвинулися бактеріальні ускладнення, то він обов’язково буде призначати антибіотикотерапію. При цьому поєднання антибактеріальних засобів із призначенням саме карбоцистеїну може розглядатися як доцільна фармакотерапевтична стратегія. Зокрема, у літературі є дані про те, що карбоцистеїн підсилює проникнення амоксициліну в бронхіальний секрет у пацієнтів із бактеріальними загостреннями хронічного бронхіту при одночасному застосуванні цих препаратів. Цей ефект, імовірно, обумовлений змінами глікопротеїнового складу мокротиння [36]. Покращення доставки антибіотика безпосередньо до вогнища бактеріальної інфекції може дати цінний клінічний ефект [6].
Висновки
Підсумовуючи, треба ще раз наголосити, що карбоцистеїн — давно відомий препарат, який упродовж десятиріч підтверджував свою ефективність і безпеку. Але тільки останніми роками вивчені нові механізми дії препарату й поглиблене наше розуміння його добре відомих ефектів, а саме:
— перешкоджання адгезії патогенних мікроорганізмів (Streptococcus pneumoniae, Moraxella catarrhalis, Haemophilus influenzae, віруси грипу, риновіруси) до епітеліальних клітин носоглотки й респіраторного епітелію дихального тракту;
— виражена протизапальна й антиоксидантна активність: препарат зменшує міграцію клітин запалення, вироблення основних прозапальних цитокінів (IL-1, ІL-8 та ін.); пригнічує активність вільних радикалів і еластази в легеневій тканині, нормалізує активність a1-антитрипсину;
— нормалізація секреції імунологічно активного IgА (специфічний захист) і вмісту сульфгідрильних груп (неспецифічний захист);
— відновлення структури слизової оболонки бронхів за рахунок зменшення кількості келихоподібних клітин і гіпертрофії слизових залоз, ці зміни призводять до зниження обсягу вироблюваного слизу;
— відновлення кількісного співвідношення кислих і нейтральних муцинів у бронхіальному секреті за рахунок внутрішньоклітинного впливу на сіалову трансферазу келихоподібних клітин, у результаті чого нормалізується в’язкість і еластичність слизу; прискорення транспорту хлоридів через епітелій дихальних шляхів, що також сприяє мукорегуляції;
— стимуляція мукоциліарного кліренсу за рахунок активації війок миготливого епітелію.
Отже, карбоцистеїн — мультимодальний препарат, що характеризується високою ефективністю й безпекою у лікуванні захворювань органів дихання. Карбоцистеїн виявляє широкий діапазон протизапальної і потужної антиоксидантної дії, здатний послаблювати міграцію у дихальні шляхи клітин запалення, зменшувати ураження ендотелію і кашльову чутливість. Ці ефекти, паралельно з провідною дією препарату як мукорегулятора, безумовно, відіграють значну роль у терапії запальних захворювань дихальних шляхів [6].
Завдяки протимікробній, протизапальній і мукорегуляторній активності доцільне застосування карбоцистеїну (Лангес) вже з перших днів захворювання. Це допоможе запобігти збільшенню тяжкості захворювання, приєднанню інших інфекцій і виникненню ускладнень, а отже, погіршенню стану хворого. Застосування карбоцистеїну допоможе уникнути поліпрагмазії (призначення низки непотрібних протизапальних препаратів, імуномодуляторів та інших засобів), покращить прихильність хворого до лікування і, що важливо, зменшить вартість терапії.
Конфлікт інтересів. Не заявлений.
1. Антипкін Ю.Г., Чумаченко Н.Г., Лапшин В.Ф., Уманець Т.Р. Динаміка захворюваності та поширеності бронхолегеневої патології у дітей. Современная педиатрия. 2016. 2(74). С. 73-77.
2. Уніфікований клінічний протокол первинної медичної допомоги дорослим та дітям «Гострі респіраторні інфекції». Наказ Міністерства охорони здоров’я України від 16 липня 2014 р. № 499 (у редакції наказу Міністерства охорони здоров’я України від 11.02.2016 № 85).
3. Бекетова Г.В., Солдатова О.В. Можливості місцевої імуномодулюючої та репаративної терапії в дітей з рекурентними захворюваннями респіраторного тракту і порожнини рота. Современная педиатрия. 2018. 2(90). С. 110-115.
4. Servin A., Garcet S., Huyen N. et al. Comparative pharmacokinetics of L-cysteine and one of its S-substituted derivatives, S-carboxymethylcysteine. J. Pharmacol. (Paris). 1976. 7. 275-86.
5. Braga P.C., Borsa M., De Anglis L. et al. Pharmacokinetic behavior of S-carboxymethyl-cysteine-lys in patients with chronic bronchitis. Clin Ther. 1982. 4. 480-8.
6. Hooper C., Calvert J. The role for S-carboxymethylcysteine (carbocisteine) in the management of chronic obstructive pulmonary disease. International Journal of COPD. 2008. 3(4). 659-669.
7. Edwards G.F., Steel A.E., Scott J.K. et al. 1976. S-carboxy-methyl-cysteine in the humidifi cation of sputum and treatment of chronic airways disease. Chest. 70. 505-13.
8. Braga P.C., Allegra L., Rampoldi C. et al. Long-lasting effects on rheology and clearance of bronchial mucus after short term administration of high doses of carbocysteine lysine to patients with chronic bronchitis. Respiration. 1990. 57. 353-8.
9. Braga P.C., Allegra L., Bossi R. et al. Identification of subpopulations of bronchitic patients for suitable therapy by a dynamic rheological test. Int. J. Clin. Pharm. Res. 1989. 9. 175-82.
10. Kohler D., Siebold A., Daikeler G. The influence of carbocysteine on mucociliary clearance. Atamweg — Lungenkrankankh. 1982. 8. 201-4.
11. Chalumeau M., Duijvestijn Y.C. Acetylcysteine and carbocysteine for acute upper and lower respiratory tract infections in paediatric patients without chronic broncho-pulmonary disease. Cochrane Database Syst. Rev. 2013 May 31. (5). CD003124. doi: 10.1002/14651858.CD003124.pub4.
12. Yasuda H., Yamaya M., Sasaki T., Inoue D., Nakayama K., Yamada M., Asada M., Yoshida M., Suzuki T., Nishimura H., Sasaki H. Carbocisteine inhibits rhinovirus infection in human tracheal epithelial cells. Eur. Respir. J. 2006 Jul. 28(1). 51-8.
13. Yamaya M., Nomura K., Arakawa K., Nishimura H., Lusamba Kalonji N., Kubo H., Nagatomi R., Kawase T. Increased rhinovirus replication in nasal mucosa cells in allergic subjects is associated with increased ICAM-1 levels and endosomal acidification and is inhibited by L-carbocisteine. Immun Inflamm Dis. 2016 Apr 15. 4(2). 166-181.
14. Asada M., Yoshida M., Hatachi Y., Sasaki T., Yasuda H., Deng X., Nishimura H., Kubo H., Nagatomi R., Yamaya M.M. L-carbocisteine inhibits respiratory syncytial virus infection in human tracheal epithelial cells. Respir Physiol Neurobiol. 2012 Jan 15. 180(1). 112-8. doi: 10.1016/j.resp.2011.10.017.
15. Yamaya M., Nishimura H., Shinya K., Hatachi Y., Sasaki T., Yasuda H., Yoshida M., Asada M., Fujino N., Suzuki T., Deng X., Kubo H., Nagatomi R. Inhibitory effects of carbocisteine on type A seasonal influenza virus infection in human airway epithelial cells. Am J. Physiol. Lung Cell Mol. Physiol. 2010 Aug. 299(2). L160-8. doi: 10.1152/ajplung.00376.2009.
16. Cakan G., Turkoz M., Turan T. et al. S-carboxymethylcysteine inhibits the attachment of Streptococcus pneumoniae to human pharyngeal epithelial cells. Microbial pathogenesis. 2003. 34. 261-5.
17. Sumitomo T., Nakata M., Yamaguchi M., Terao Y., Kawabata S. S-carboxymethylcysteine inhibits adherence of Streptococcus pneumoniae to human alveolar epithelial cells. J. Med. Microbiol. 2012 Jan. 61 (Pt 1). 101-8. doi: 10.1099/jmm.0.033688-0.
18. Zheng C.H., Ahmed K., Rikitomi N. et al. The effects of S-carboxymethylcysteine and N-acetylcysteine on the adherence of Moraxella catarrhalis to human pharyngeal epithelial cells. Microbiol Immunol. 1999. 43. 107-13.
19. Asti C., Melillo G., Caselli G.F., Daffonchio L., Hernandez A., Clavenna G., Omini C. Effectiveness of carbocysteine lysine salt monohydrate on models of airway inflammation and hyperresponsiveness. Pharmacol Res. 1995 Jun. 31(6). 387-92.
20. Carpagnano G.E., Resta O., Foschino-Barbaro M.P., Spanevello A., Stefano A., Di Gioia G., Serviddio G., Gramiccioni E. Exhaled interleukine-6 and 8-isoprostane in chronic obstructive pulmonary disease: effect of carbocysteine lysine salt monohydrate (SCMC-Lys). Eur. J. Pharmacol. 2004 Nov 28. 505(1-3). 169-75.
21. Ishibashi Y., Okamura T., Masumoto Y. et al. Effects of carbocysteine on airway inflammation and related events in SO2-exposed rats. Nihon Kokyuki Gakkai Zasshi. 2001. 39. 17-23.
22. Wang W., Zheng J.P., Zhu S.X., Guan W.J., Chen M., Zhong N.S. Carbocisteine attenuates hydrogen peroxide-induced inflammatory injury in A549 cells via NF-kB and ERK1/2 MAPK pathways. Int. Immunopharmacol. 2015 Feb. 24(2). 306-313. doi: 10.1016/j.intimp.2014.12.018.
23. Pinamonti S., Venturoli L., Leis M., Chicca M., Barbieri A., Sostero S., Ravenna F., Daffonchio L., Novellini R., Ciaccia A. Antioxidant activity of carbocysteine lysine salt monohydrate. Panminerva Med. 2001 Sep. 43(3). 215-20.
24. Brandolini L., Allegretti M., Berdini V., Cervellera M.N., Mascagni P., Rinaldi M., Melillo G., Ghezzi P., Mengozzi M., Bertini R. Carbocysteine lysine salt monohydrate (SCMC-LYS) is a selective scavenger of reactive oxygen intermediates (ROIs). Eur. Cytokine Netw. 2003 Jan-Mar. 14(1). 20-6.
25. Barnes P.J. Reactive oxygen species and airway inflammation. Free Radic. Biol Med. 1990. 9(3). 235-43.
26. Nogawa H., Ishibashi Y., Ogawa A., Masuda K., Tsubuki T., Kameda T., Matsuzawa S. Carbocisteine can scavenge reactive oxygen species in vitro. Respirology. 2009 Jan. 14(1). 53-9. doi: 10.1111/j.1440-1843.2008.01424.x.
27. Garavaglia M.L., Bononi E., Dossena S., Mondini A., Bazzini C., Lanata L., Balsamo R., Bagnasco M., Conese M., Bottà G., Paulmichl M., Meyer G. S-CMC-Lys protective effects on human respiratory cells during oxidative stress. Cell. Physiol. Biochem. 2008. 22(5-6). 455-64. doi: 10.1159/000185494.
28. Wu K., Su X., Li G., Zhang N. Antioxidant Carbocysteine Treatment in Obstructive Sleep Apnea Syndrome: A Randomized Clinical Trial. PLoS One. 2016 Feb 5. 11(2). e0148519. doi: 10.1371/journal.pone.0148519. eCollection 2016.
29. Мизерницкий Ю.Л., Ермакова И.Н. Современные мукоактивные препараты в терапии острых респираторных заболеваний у детей. Consilium medicum. 2007. Т. 9. № 1. С. 53-56.
30. McCubbrey A.L., Curtis J.L. Efferocytosis and lung disease. Chest. 2013 Jun. 143(6). 1750-1757. doi: 10.1378/chest.12-2413.
31. Inoue M., Ishibashi Y., Nogawa H., Yasue T. Carbocisteine promotes phagocytosis of apoptotic cells by alveolar macrophages. Eur. J. Pharmacol. 2012 Feb 29. 677(1-3). 173-9. doi: 10.1016/j.ejphar.2011.12.026.
32. Katayama N., Fujimura M., Ueda A. et al. Effects of carbocysteine on antigen-induced increases in cough sensitivity and bronchial responsiveness in guinea pigs. J. Pharmacol. Exp. Ther. 2001. 297. 975-80.
33. Cheung D., Bel E.F., Hartigh J.D. et al. The effect of an inhaled neutral endopeptidase inhibitor, thiorphan on airway responses to neurokinin A in normal human in vivo. Am. Rev. Respir. Dis. 1992. 145. 1275-80.
34. Cheung D., Timmers M.C., Zwinderman A.H. et al. Neural endopepidase activity and airway hyperresponsiveness to neurokinin A in asthmatic subjects in vivo. Am. Rev. Respir. Dis. 1993. 148. 1467-73.
35. Ischiura Y., Fujimura M., Yamamori C. et al. Effect of carbocysteine on cough reflex to capsaicin in asthmatic patients. Br. J. Clin. Pharmacol. 2003. 55. 504-10.
36. Braga P.C., Scaglione F., Scarpazza G. et al. Comparison between penetration of amoxicillin combined with carbocysteine and amoxicillin alone in pathological bronchial secretions and pulmonary tissue. Int. J. Clin. Pharm. Res. 1985. 5. 331-40.

/67-1.jpg)
/68-1.jpg)
/69-1.jpg)