Вступ
На сьогодні проблема мозкового інсульту є однією з найбільш актуальних в ангіоневрології та продовжує зберігати надзвичайну медичну й соціальну значимість в усіх країнах світу. Це зумовлено значною частотою розвитку інсульту, високим відсотком інвалідизації пацієнтів і показників смертності від гострих цереброваскулярних захворювань.
Щорічно у США реєструється понад 800 тис. інсультів, у країнах об’єднаної Європи — 1,75 млн [37]. Згідно з даними ВООЗ, інсульт щорічно вражає у світі близько 20 млн людей, із яких 5 млн помирає внаслідок інсульту. Із 15 млн, які виживають, приблизно третина пацієнтів стають інвалідизованими внаслідок інсульту й потребують сторонньої допомоги в повсякденному житті [22]. Поширеність мозкових інсультів збільшується в основному за рахунок країн, що розвиваються [31]. Прогнозується зростання випадків інсульту й летальності від них у всіх країнах: у 2030 році — відповідно до 23 млн та 7,8 млн. Це значною мірою зумовлене постарішанням населення та зростанням поширеності в популяції таких васкулярних факторів ризику інсульту, як атеросклероз судин, артеріальна гіпертензія, гіподинамія, ожиріння, тютюнопаління тощо.
В Україні за рік реєструється близько 100 тис. мозкових інсультів, у 40 тис. випадків хвороба закінчується летально, тобто смертність перевищує відповідні показники розвинених країн Європи. У структурі мозкових інсультів переважають ішемічні порушення мозкового кровообігу. За даними міжнародних мультицентрових досліджень, відношення ішемічних інсультів до геморагічних у європейських країнах становить відповідно 7 : 1, а в Україні — 4 : 1. Безумовно, це визначає високий показник смертності від інсультів, переважають особи, які перенесли його геморагічний варіант.
За даними офіційної статистики Київського міського наукового інформаційно-аналітичного центру медичної статистики, у 2016 р. у м. Києві були зареєстровані 5079 осіб із первинним мозковим інсультом. Порівняно з 2012 і 2013 роками (відповідно 4544 і 4576 осіб) спостерігалася тенденція до збільшення випадків інсульту [18]. У м. Києві у 2016 р. летальність при ішемічному інсульті становила 15,7 %, при геморагічному — 39,74 %. Слід зазначити, що останніми роками відзначалася тенденція до зменшення числа фатальних наслідків після ішемічного інсульту (у 2014 р. — 15,95 %; у 2015 р. — 15,8 %), а при геморагічному їх кількість утримується на високому рівні (у 2014 р. — 41,52 %, у 2015 р. — 37,56 %) [15].
Наведені дані свідчать про актуальність проблеми мозкових інсультів, їх соціально-економічну значущість і важливість поліпшення якості медичної допомоги хворим на гострі цереброваскулярні захворювання в м. Києві.
Сучасна стратегія лікування гострого ішемічного інсульту передбачає два основних підходи, які діють синергічно:
— відновлення адекватної перфузії ішемізованої тканини мозку в межах терапевтичного вікна [28];
— захист нейронів від ушкоджуючої дії ішемічного каскаду, тобто медикаментозна нейропротекція (цитопротекція) ішемічної напівтіні [26].
Безумовно, для відновлення функціонування ней-ронів у ділянці пенумбри найуспішнішим методом є відновлення мозкової перфузії в ішемізованій ділянці за допомогою системного тромболізису. Це розширює можливості медикаментозної терапії гострого ішемічного інсульту, однак до кінця не вирішує цю проблему. Проведення системної тромболітичної терапії (ТЛТ) з використанням рекомбінантного тканинного плазміногену обмежене вузькими рамками 4,5-годинного терапевтичного вікна, необхідністю надійної верифікації тромботичного характеру інсульту, жорсткими протипоказаннями до застосування. Тому терапію з використанням системного тромболізису може отримати невелика кількість хворих із гострим ішемічним інсультом. Уважають, що число таких пацієнтів становить 18–20 % від загальної кількості осіб, які перенесли інсульт і надходили в спеціалізовані інсультні центри [38].
В Україні впродовж 2007–2019 рр. ТЛТ із використанням рекомбінантного тканинного плазміногену альтеплази дозою 0,9 мг/кг проведена 2909 хворим із гострим ішемічним інсультом, із них у м. Києві — лише 117 пацієнтам. За попередніми розрахунками, необхідність у такому виді невідкладної терапії в м. Києві становить мінімум 150 пацієнтів за один рік. Тому залишається актуальною організація спеціалізованих інсультних центрів, що передбачено програмою «Здоров’я киян» на 2016–2018 рр.
До цього часу в лікувально-профілактичних закладах м. Києва ТЛТ проводиться лише в окремих випадках [17]. Серед причин недостатньо активного її застосування — пізня госпіталізація хворих, відсутність можливості проведення нейровізуалізації цілодобово в комунальних лікарнях міста, тяжкий неврологічний дефіцит у пацієнтів та наявність декомпенсованих супутніх захворювань. Це зумовлює необхідність вибору інших лікувальних підходів, зокрема захисних препаратів. Проте тривалий пошук ефективних препаратів із заявленою нейропротекторною активністю не забезпечив однозначних позитивних результатів у мультицентрових дослідженнях: установлено, що більшість із них були ефективними лише в експерименті, у клінічних випробуваннях ІІІ фази виявляли їх неефективність [30, 35].
Водночас помилково було б ставити під сумнів значення й корисність нейропротекції для терапії гострого ішемічного інсульту. За останнє десятиріччя зусилля клініцистів, патофізіологів, фармакологів і представників інших медичних спеціальностей спрямовані на розробку і впровадження у клінічну практику препаратів нового покоління з помірно гальмівним впливом на активність катаболічних ферментів (фосфоліпаз, ліпоксигеназ, циклооксигеназ), тобто засобів, що мають мембранопротекторні й антиоксидантні властивості. До таких препаратів відноситься біофлавоноїд кверцетин (Корвітин).
Мішені терапевтичного впливу кверцетину при ішемічному інсульті різні: гальмування активності та експресії катаболічних прооксидантних і протеолітичних ферментів, інгібіція ліпоксигеназного шляху метаболізму арахідонової кислоти та синтезу лейкотрієнів; регуляція (пригнічення/стимуляція) активності ферментів фосфоліпази С, протеїнкінази С; запобігання біотрансформації фосфатидилінозиту, часткове відновлення його рівня; вплив на процеси перекисного окиснення ліпідів, гальмування продукції вільних радикалів кисню, підвищення системи антиоксидантного захисту нейронів [3, 8, 10, 34].
Таким чином, застосування кверцетину (Корвітину) при лікуванні гострого ішемічного інсульту зумовлює такі терапевтичні ефекти: стабілізацію клітинних біомембран; антиоксидантну дію; протизапальний ефект; сповільнює апоптозну дію; поліпшує мікроциркуляцію, запобігає внутрішньосудинному тромбоутворенню.
Терапевтична ефективність внутрішньовенної форми кверцетину (Корвітину) в лікуванні гострого ішемічного інсульту оцінювалась у відкритому рандомізованому клінічному дослідженні, що проводилося на базі трьох клінік Києва і Харкова з 2006 по 2009 рік за участю 186 хворих (111 чоловіків та 75 жінок) віком від 40 до 65 років (середній вік — 52,0 ± 5,7 року).
Результати проведеного клінічного дослідження показали, що використання внутрішньовенної форми кверцетину (Корвітину) порівняно зі стандартною терапією зумовлювало вірогідне відновлення втрачених неврологічних функцій за шкалою NIHSS уже на 6-й день (р < 0,05) з подальшим регресом неврологічного дефіциту на 11-ту і 21-шу добу спостереження. Відновлення функціональної спроможності за модифікованою шкалою Ренкіна (мШР) (0–2 бали) у групі пацієнтів, які лікувалися кверцетином, зареєстроване у 82,9 % хворих (в групі контролю — у 77,8 %). Аналіз функціональної незалежності за індексом Бартел (ІБ) показав, що на 90-ту добу у хворих групи кверцетину виявили більш значний порівняно з групою стандартної терапії приріст частки пацієнтів, які не потребували сторонньої допомоги в повсякденному житті (відповідно 43,9 і 27,8 %) [3, 14, 16].
У рандомізованому клінічному дослідженні, проведеному І.С. Зозулею та співавторами (2013) [7], виявлено статистично вірогідне поліпшення когнітивної функції за даними шкали MMSE, тесту Ісаака в пацієнтів з 10-го дня лікування кверцетином. До того ж автори відмічають зменшення рівня збуджувальних і збільшення гальмівних нейроамінокислот у пацієнтів основної групи з 10-го дня терапії, у групі контролю — лише з 21-го дня лікування.
Успішний терапевтичний ефект застосування внутрішньовенної форми кверцетину при гострому ішемічному інсульті ґрунтовно висвітлено і в публікаціях інших авторів. Зокрема, у роботі Х.М. Халілової та спів-авторів (2011) [20] проводилась оцінка ефективності кверцетину у хворих із гострим ішемічним інсультом і серцево-судинними порушеннями. Автори виявили активніше відновлення втрачених неврологічних функцій у групі пацієнтів, які отримували в комплексному лікуванні кверцетин.
В іншому клінічному дослідженні [9] доведено, що лікування кверцетином хворих з атеротромботичним підтипом ішемічного інсульту вірогідно поліпшує функцію короткострокової та довгострокової пам’яті, підвищує α-активність та сприяє організації біопотенціалів головного мозку при електроенцефалографії.
Згідно з даними Б.Г. Гафурова та співавторів [5], застосування внутрішньовенної форми кверцетину в лікуванні гострого ішемічного інсульту уже на 3-тю добу вірогідно підвищує рівень свідомості, поліпшує мовленнєву функцію, сприяє регресу рухового неврологічного дефіциту. Крім того, за результатами КТ-морфометричних досліджень, у більшості випадків на 10-ту добу автори відмічали зменшення об’єму інфарктного вогнища.
У роботі Ю.І. Горанського та співавторів [6] вивчався нейропротекторний ефект кверцетину в умовах ішемії/реперфузії в гострий період ішемічного інсульту. Автори показали, що за такої клінічної ситуації внутрішньовенне введення кверцетину одночасно зі стандартною терапією позитивно впливає на відновлення втрачених неврологічних функцій, оцінене з використанням шкали NIHSS та індексу Бартел.
Позитивна оцінка терапевтичної ефективності внутрішньовенного використання кверцетину при лікуванні хворих із гострим ішемічним інсультом, за результатами наукових досліджень, опублікованих за останні роки, викликає оптимізм і дає надію лікарям на можливість застосування нейропротекторного препарату широкого спектра фармакологічної дії.
Однак більшість проведених клінічних досліджень (за винятком рандомізованих) ґрунтувалися на оцінці терапевтичних ефектів внутрішньовенного введення кверцетину в ранній період гострого ішемічного інсульту, тобто впродовж перших трьох тижнів від початку захворювання. У літературі недостатньо вивчені та висвітлені особливості та закономірності відновлення втрачених неврологічних функцій після інсульту при лікуванні кверцетином у ранній і віддалений періоди проспективного спостереження. На наш погляд, ці питання потребують подальшого клінічного аналізу.
З огляду на наведені дані подальше клінічне дослідження безпечності та ефективності тромболітичної терапії та оцінка терапевтичної ефективності препарату нейропротекторної дії біофлавоноїду кверцетину в ранній, пізній і віддалений періоди, безумовно, сприятимуть поліпшенню програми терапії гострого ішемічного інсульту.
Мета роботи — провести аналіз системи надання невідкладної медичної допомоги хворим на мозковий інсульт у м. Києві, оцінити безпечність і ефективність системного тромболізису, а також клінічну ефективність біофлавоноїду кверцетину (Корвітину) в лікуванні гострого ішемічного інсульту, темпи відновлення втрачених неврологічних функцій, якість життя пацієнтів і наслідки інсульту в ранній, пізній та віддалений (10 років) періоди проспективного спостереження.
Матеріали та методи
Аналітичний огляд системи надання невідкладної медичної допомоги хворим із гострим ішемічним інсультом у м. Києві нами проведений із використанням рекомендацій авторського комітету Європейської інсультної організації (ESO, 2008), Американської асоціації інсульту (ASA, 2010), а також на підставі уніфікованого клінічного протоколу медичної допомоги хворим на ішемічний інсульт (2012), наказів про організацію медичної допомоги дорослому населенню Департаменту охорони здоров’я Київської міської державної адміністрації (2018, 2019).
Усі клініко-неврологічні та нейровізуалізаційні обстеження 102 хворих із гострим ішемічним інсультом проведені у відділенні цереброваскулярної патології Олександрівської клінічної лікарні м. Києва. Залежно від застосованої терапії пацієнти були рандомізовані на дві групи: 1-шу становили 25 пацієнтів (15 чоловіків і 10 жінок) віком від 42 до 80 років (середній вік — 61,7 ± 1,8 року), які отримували внутрішньовенно рекомбінантний людський активатор плазміногену тканинного типу (альтеплаза) — препарат Актилізе; 2-га група — 41 хворий (21 чоловік і 20 жінок) віком від 44 до 63 років (середній вік — 55,1 ± 5,3 року), яким призначали внутрішньовенно водорозчинну форму кверцетину (препарат Корвітин) додатково до стандартної терапії. До контрольної групи, рандомізованої методом випадкової вибірки, увійшли 36 пацієнтів (19 чоловіків і 17 жінок) віком від 40 до 64 років (середній вік — 54,2 ± 5,5 року), які отримували лише стандартну терапію.
Критеріями включення пацієнтів до групи з можливим застосуванням тромболітичної терапії були особи віком до 80 років із верифікованим за даними комп’ютерного/магнітно-резонансно-томографічного обстеження діагнозом гострого ішемічного інсульту, тяжкістю неврологічного дефіциту за шкалою NIHSS на рівні 5–20 балів; рандомізація в межах ≤ 4,5 год після появи перших симптомів інсульту, а також урахування відомих протипоказань до застосування та інформована згода пацієнтів або родичів на виконання процедури системного тромболізису (ТЛТ).
Критеріями включення пацієнтів до 2-ї групи (застосування кверцетину) й контрольної були пацієнти із ішемічним інсультом середньої тяжкості та тяжким, з неврологічним дефіцитом за шкалою NIHSS від 9 до 16 балів, рандомізація в межах 5–11 год після розвитку перших проявів інсульту.
Оцінку неврологічного дефіциту за шкалою NIHSS у хворих, яким призначали альтеплазу, проводили при рандомізації, під час ТЛТ, а потім кожну годину протягом перших 24 год, здійснювали контроль артеріального тиску. У подальшому оцінювали неврологічний дефіцит за шкалою NIHSS на 2-гу, 6-ту, 14-ту добу та після закінчення лікування — на 21-шу добу. Пізні наслідки аналізували через 3 міс. після проведеної ТЛТ.
У хворих 2-ї групи, які отримували внутрішньовенно водорозчинний кверцетин (Корвітин), оцінювали неврологічний дефіцит за шкалою NIHSS також при рандомізації, на 6-ту та 11-ту добу й після закінчення лікування — на 21-шу добу. Пізні наслідки аналізували на 90-ту добу та через один рік, віддалені — через 10 років проспективного спостереження. За аналогічним алгоритмом проводили обстеження пацієнтів конт-рольної групи, яким призначали стандартну терапію.
Обстеження всіх хворих включало оцінку суб’єк-тивних даних, неврологічного статусу за такими шкалами: шкала тяжкості інсульту Національного інституту здоров’я США (National Institute of Health Stroke Scale) — NIHSS; модифікована шкала Ренкіна (Modified Rankin Scale) — для оцінки функціональної неспроможності, ступеня інвалідизації; індекс Бартел (Barthel Іndex) — для характеристики соціальної дезадаптації пацієнта. Також використовували комбінації показників шкал NIHSS, мШР, ІБ. Функціональний стан магістральних артерій голови в екстракраніальному відділі та інтракраніальних артерій досліджували за допомогою транскраніальної допплерографії і триплексного допплерівського сканування (Ultima, «Радмір» (L = 5–10/40E; р = 2–3/20Е)) за стандартними методиками. Локалізацію та розмір інфарктного вогнища верифікували за допомогою комп’ютерного/магнітно-резонансно-томографічного дослідження з напругою поля 1,5 Тл, яке виконували в стандартних Т1-, Т2-режимах при надходженні (до рандомізації), за необхідності — у динаміці. Усім хворим проводили моніторинг артеріального тиску, кардіологічне обстеження з використанням 12-канальної електрокардіографії.
Системну ТЛТ проводили з використанням препарату Актилізе в рекомендованій дозі — 0,9 мг/кг маси тіла з дотриманням усіх вимог: 10 % дози препарату вводили болюсно, решту — за допомогою інфузомату.
Хворі 2-ї групи отримували водорозчинну форму кверцетину (препарат Корвітин) у дозі 7–10,5 г на курс лікування протягом 10 днів за розробленою схемою [3] в поєднанні зі стандартною терапією. Хворим конт-рольної групи призначали лише стандартну терапію, вона включала: ацетилсаліцилову кислоту 325 мг перорально в перші дні, а потім по 100 мг/добу, інгібітори АПФ, β-адреноблокатори, натрію хлориду розчин ізотонічний 0,9%; в амбулаторний період пацієнти отримували препарати ацетилсаліцилової кислоти, статини, підтримуючі дози гіпотензивних засобів. Ефективність і результати лікування оцінювали за рівнем відновлення втрачених неврологічних функцій за шкалою NIHSS, динамікою інвалідизації за мШР у балах: сприятливим результатом лікування вважали досягнення показника 0–2 бали, несприятливим — 3–5 балів, смерть — 6 балів. Ступінь функціональної незалежності вважали мінімальним при досягненні показника ≥ 95 балів, помірним — 94–75 балів, вираженою залежністю — 74–50 балів.
Оцінка віддалених (через 10 років) наслідків лікування пацієнтів 2-ї та контрольної груп передбачала з’ясування виникнення гострих церебральних і серцевих подій (повторний інсульт, розвиток інфаркту міокарда, тромбоемболії легеневої артерії, фатальні наслідки). У хворих, які вижили, з’ясовували суб’єктивні скарги, самопочуття, наявні супутні захворювання, неврологічний дефіцит, ступінь інвалідизації та функціональної спроможності. Виясняли коло функціональних обов’язків на роботі, якщо пацієнт працює, або в домашніх умовах, можливість самостійної ходи або з використанням допоміжних засобів (тростина, ходунки), ведення домашнього господарства. У випадках смерті пацієнтів з’ясовували її причини. Оцінку перерахованих функціональних можливостей проводили за мШР та ІБ. Слід зауважити, що всі пацієнти та їх рідні давали згоду на проведення даного опитування й дослідження.
Статистичний аналіз отриманих даних проводили за допомогою непараметричних тестів і програм Microsoft Office Excel 2007, програми SPSS Statistics 170 та Stata 10. Порівняння динаміки неврологічного дефіциту здійснювали за допомогою критерію Вілкоксона: статистично значущою вважали різницю при р < 0,05.
Результати та обговорення
Аналіз системи надання медичної допомоги хворим із гострим ішемічним інсультом, проблеми удосконалення
Напрямки національної системи надання невідкладної допомоги хворим у разі ішемічного інсульту мають випливати із всебічних рекомендацій Європейської організації боротьби з інсультом (2008) і Американської асоціації інсульту (2010) щодо лікування гострого ішемічного інсульту і внутрішньомозкового крововиливу та Плану дій боротьби з інсультом у Європі на 2018–2030 рр. (ESO, SAFE, 2018), що передбачає стратегічні цілі первинної профілактики, організації допомоги, лікування, вторинної профілактики й реабілітації.
Згідно з цими рекомендаціями Міністерство охорони здоров’я України розробило програму лікувальних заходів у випадках ішемічного інсульту, транзиторних ішемічних атак і геморагічного інсульту. Система невідкладного лікування гострих цереброваскулярних захворювань, зокрема ішемічного інсульту, визначена відповідними наказами МОЗ України, клінічними настановами, що ґрунтуються на засадах доказової медицини. Це такі накази, уніфіковані клінічні протоколи медичної допомоги і розробки: адаптована клінічна настанова «Сучасні принципи діагностики та лікування хворих із гострим ішемічним інсультом та ТІА»; уніфікований клінічний протокол медичної допомоги «Системний тромболізис при ішемічному інсульті (екстрена, вторинна (спеціалізована) медична допомога)», Наказ МОЗ № 602 від 03.08.2012 р. [19].
Департаментом охорони здоров’я розроблена й функціонує програма «Здоров’я киян» на 2016–2018 рр.
У розділі Б «Розвиток вторинної (спеціалізованої) медичної допомоги» виділений перший підрозділ «Лікування серцево-судинних і судинно-мозкових захворювань», у якому передбачається створення в закладах охорони здоров’я спеціалізованих інсультних центрів і закупка ліків для лікування хворих із гострим мозковим інсультом. Шляхом централізованого постачання комунальним закладам охорони здоров’я виділяється тканинний активатор плазміногену — препарат альтеплаза для проведення ТЛТ хворим на гострий ішемічний інсульт.
Організаційні питання на етапі екстреної медичної допомоги хворим із гострим ішемічним інсультом регламентуються виконанням уніфікованого клінічного протоколу надання медичної допомоги хворим, перший розділ якого присвячений організації екстреної допомоги службою швидкої медичної допомоги, а другий — обсягу обстеження пацієнта, системному тромболізису.
У 2018 році в м. Києві зареєстровано 147 136 осіб із різними формами судинних захворювань головного мозку, із них 53 213 хворих — із первинними проявами гострих порушень мозкового кровообігу, у тому числі 4753 інсульти (усі форми). Поширеність мозкових інсультів у м. Києві становить 223,4 на 100 тис. населення.
Серед усіх видів інсульту у м. Києві переважають ішемічні порушення мозкового кровообігу — 88,9 %, крововиливи в мозок — 11,1 % випадків. Летальність при ішемічному інсульті становить 14,74 %, у випадках геморагічного інсульту — 41,58 % [15].
Тому для поліпшення системи надання невідкладної допомоги хворим із мозковим інсультом Департамент охорони здоров’я КМДА видав новий наказ № 1059 від 13.09.2019 р. «Про організацію надання стаціонарної медичної допомоги дорослому населенню» [11]. Його зміст стосується екстреної госпіталізації хворих із мозковим інсультом у м. Києві, у тому числі проведення тромболітичної терапії хворим з ішемічним інсультом. У наказі затверджені 10 комунальних лікарень міста (неврологічні відділення), що в дні чергувань зобов’язані приймати хворих на гострий мозковий інсульт. У визначених лікарнях пацієнтам проводитимуть цілодобово нейровізуалізацію головного мозку (безкоштовно), відразу після госпіталізації їх оглядатимуть спеціалісти інсультної (мультидисциплінарної) бригади. Після аналізу даних клініко-неврологічного, нейровізуалізаційного та лабораторного обстеження призначатиметься адекватна інтенсивна терапія, у разі необхідності — системний тромболізис.
На жаль, із 10 визначених для чергування лікарень лише в 5 можуть здійснювати лікувальний захід — системний тромболізис. Пацієнтів з інших закладів охорони здоров’я для проведення ТЛТ необхідно перевозити в одну з 5 визначених для цього лікарень. Безумовно, це втрата важливого часу терапевтичного вікна, що не сприяє успішному лікуванню хворого.
З існуючих неврологічних відділень у м. Києві функціонує лише два відділення цереброваскулярної патології на 60 ліжок (Олександрівська клінічна лікарня і міська клінічна лікарня № 1), у яких здійснюється цілодобове чергування лікаря-анестезіолога й невролога в палатах інтенсивної терапії. В інших неврологічних відділеннях міста організовані палати інтенсивної терапії, у яких курація хворих здійснюється лише черговим лікарем-неврологом, однак більшість із них пройшли навчання на курсах з анестезіології й невідкладної допомоги.
Епідеміологічна ситуація з гострих цереброваскулярних захворювань у м. Києві вимагає негайної організації хоча б двох спеціалізованих інсультних центрів — це веління часу. Медичну допомогу хворим в інсультному центрі здійснюватимуть спеціалісти мультидисциплінарної команди, ключову роль у якій повинні відігравати невропатологи (EFNS, 1997). Ці дані підтверджені результатами досліджень провідних неврологів світу [23, 24, 32]. Фактично в багатьох країнах Європи інсультні центри формуються при неврологічних відділеннях.
Інші клінічні порівняльні дослідження показали, що функціональні наслідки після інсульту були кращими у хворих, лікування яких проводили неврологи, порівняно з тими, кого лікували лікарі інших спеціальностей [27, 36]. Наведені авторитетні клінічні дослідження вносять ясність у дискусію стосовно того, лікар якої спеціальності повинен відігравати провідну роль у наданні медичної допомоги хворим із мозковим інсультом. Саме лікарі-неврологи найуспішніше використовують принцип системної методології, інтегративного підходу до вивчення проблеми мозкового інсульту, вирішення практичних питань у плані не тільки діагностики, але й терапії, оцінки терапевтичної ефективності тромболізису та інших застосованих лікувальних заходів при інсульті.
Неврологічний і функціональний аналіз ефективності системного тромболізису та оцінка наслідків тромболітичної терапії
У відділенні цереброваскулярної патології Олександрівської клінічної лікарні м. Києва проведено системний тромболізис 25 хворим із гострим ішемічним інсультом — 15 чоловікам і 10 жінкам віком від 42 до 80 років (середній вік — 61,7 ± 1,8 року); оцінено неврологічні/функціональні результати лікування — їх ранні та пізні наслідки.
Тяжкість неврологічного дефіциту в обстежених пацієнтів за шкалою NIHSS варіювала від 5 до 20 балів: у 3 пацієнтів діагностували легкий ступінь тяжкості; в 11 — середній, ще в 11 — тяжкий інсульт. Необхідно зазначити, що у 8 з 11 пацієнтів із тяжким інсультом бал за шкалою NIHSS становив від 18 до 20. Вихідний рівень неврологічного дефіциту хворих за шкалою NIHSS у середньому був 16,3 ± 2,0 бала, що відповідало тяжкому інсульту. У 24 пацієнтів верифікували півкульний ішемічний інсульт, і лише в одного хворого ішемічне вогнище локалізувалося у ділянці варолієвого моста.
Із васкулярних факторів ризику розвитку інсульту в усіх 25 хворих реєстрували артеріальну гіпертензію (із них лише 12 вживали гіпотензивні заходи), у 22 (80,0 %) — відповідно гіперліпідемію та ішемічну хворобу серця, миготливу аритмію — у 6 (24,0 %), цукровий діабет — у 5 (20,0 %), ТІА в анамнезі — у 6 (24,0 %), надлишкову вагу тіла — у 3 (12,0 %), тютюнопаління — у 6 (24,0 %).
За патогенетичним підтипом у переважної більшості (19) пацієнтів виявляли атеротромботичний, у 6 — кардіоемболічний підтип ішемічного інсульту.
Пацієнтів госпіталізували у клініку в перші 1,5–3,5 год після розвитку інсульту, у межах загальноприйнятого терапевтичного вікна (≤ 4,5 год). Середнє значення показника «симптом — двері» становило 120 хв, а середнє значення показника «двері — голка» — 30 хв (як відомо, рекомендований показник — 60 хв) [33]. Усім пацієнтам терміново проводили комп’ютерну томографію головного мозку, виконували лабораторні дослідження. Усі хворі відповідали критеріям проведення ТЛТ. Цей лікувальний захід здійснювали після підписання інформованої згоди. Дотримувалися вимог уніфікованого клінічного протоколу медичної допомоги хворим, другий розділ якого, як відомо, присвячений системному тромболізису при ішемічному інсульті.
Саму ТЛТ в умовах палати інтенсивної терапії відділення цереброваскулярної патології проводили з дотриманням прийнятих вимог: 10 % дози препарату вводили болюсно, решту — за допомогою інфузомату внутрішньовенно краплинно. У відділенні проводили моніторинг неврологічного та соматичного статусу. Контрольну комп’ютерну томографію головного мозку здійснювали через 24 години. Враховуючи перенесену гостру цереброваскулярну подію й наявну в пацієнтів супутню патологію, після проведеного тромболізису пацієнти протягом стаціонарного лікування отримували ацетилсаліцилову кислоту чи антикоагулянти (варфарин, НОАК), гіпотензивні препарати, β-адреноблокатори, осмотичні діуретики, сульфат магнію, гіпоглікемічні препарати, статини. Проводили ранню медичну реабілітацію, масаж. Обов’язкові реабілітаційні заходи: лікування положенням, дихальні вправи, лікувальна гімнастика (пасивна й активна); рання мобілізація та сприяння активності щодо самообслуговування, реабілітація мовних порушень, психоемоційна підтримка. Після проведеної ТЛТ, звичайно, ліпше відновлення втрачених неврологічних функцій було у 3 хворих із легким інсультом порівняно з пацієнтами із захворюванням середньої тяжкості. Досить швидко регресували скарги на затерпання в кінцівках, поліпшилася функція мовлення. Позитивне функціональне поліпшення було також у 2 пацієнтів з інсультом середньої тяжкості.
На 2-гу добу спостереження загальний неврологічний дефіцит за шкалою NIHSS зменшився на 4,3 бала (у середньому становив 12,0 ± 3,1 бала; р < 0,5). Водночас в однієї пацієнтки з тяжким інсультом (20 балів за шкалою NIHSS) на 3-й день після ТЛТ наросли ознаки набряку головного мозку, вираженість якого не зменшувалася на тлі проведеної дегідратаційної терапії. Тому у зв’язку з наростанням ознак внутрішньочерепної гіпертензії, наявними ознаками дислокації структур стовбура головного мозку з метою декомпресії хворій проведена гемікраніотомія. Стан пацієнтки в післяопераційний період поступово поліпшувався: появилися незначні рухи в нозі, зменшувалася вираженість асиметрії обличчя, а при виписуванні з відділення неврологічний дефіцит регресував з 20 до 17 балів за шкалою NIHSS.
Ще у 2 пацієнтів із тяжким ішемічним інсультом на 5-й день клінічного спостереження виявили ознаки реперфузійного ушкодження ішемізованої тканини мозку, а в одного з них за даними повторного комп’ютерного дослідження головного мозку діагностували ознаки геморагічної трансформації у вигляді зливної петехії без мас-ефекту, тому наростання неврологічного дефіциту не спостерігалося. Водночас обидва хворі залишалися в тяжкому стані (неврологічний дефіцит — 20 балів за шкалою NIHSS).
На 6-ту добу після системного тромболізису середній клінічний бал неврологічного дефіциту за шкалою NIHSS у хворих досліджуваної групи зменшився на 5,9 (у середньому 10,4 ± 3,3 бала) порівняно з фоновим рівнем (р < 0,2). У цей період спостереження в одного пацієнта з легким інсультом настало повне відновлення втрачених неврологічних функцій, зростав темп регресу неврологічного дефіциту у хворих з інсультом середньої тяжкості, дещо пасивніше — у пацієнтів з тяжким інсультом.
На 7-й день клінічного спостереження у 2 пацієнтів із тяжким кардіоемболічним підтипом ішемічного інсульту (17 балів за шкалою NIHSS) раптово сталася рання смерть. Її причиною була тромбоемболія легеневої артерії, хоча хворі з другого дня після ТЛТ приймали антикоагулянтну терапію.
На 14-й день спостереження в 5 пацієнтів повністю відновилися втрачені неврологічні функції: у 3 — із легким інсультом, у 2 — з інсультом середньої тяжкості (показник за шкалою NIHSS — 0–1 бал, а за мШР — 0–2 бали). У 9 пацієнтів з інсультом середньої тяжкості також активніше регресували ознаки неврологічного дефіциту, тобто спостерігалася позитивна динаміка. У випадках тяжкого інсульту відновлення функцій наставало повільніше, утримувалася функціональна неспроможність хворих, показник мШР у них був у діапазоні 4–5 балів.
На 14-й день показник середнього неврологічного дефіциту за шкалою NIHSS у 23 хворих (крім 2 померлих) у середньому становив 7,2 ± 1,9 бала, тобто статистично вірогідно знизився на 9,1 бала порівняно з вихідним рівнем (р < 0,01).
З метою визначення наслідків ТЛТ після розвитку гострого ішемічного інсульту ми провели проспективне спостереження хворих на 21-шу й 90-ту добу курації. Аналіз впливу лікування на показники неврологічного/функціонального відновлення, повсякденну життєву активність показав, що на 21-шу добу спостереження повне функціональне відновлення (мШР = 0–2 бали, ІБ ≥ 95 балів) досягнуте у 8 (32,0 %) пацієнтів, помірне (мШР ≤ 2 балів, ІБ ≥ 80 балів) — у 10 (40,0 %), ще в 5 (20,0 %) обстежених залишалася інвалідизація, вони потребували сторонньої допомоги в повсякденному житті (4–5 балів за мШР, індекс Бартел — 30–50 балів); у 2 (8,0 %) випадках настала рання смерть.
Отже, після системного тромболізису кращий результат досягнуто в пацієнтів із фоновим неврологічним дефіцитом після інсульту легкої та середньої тяжкості. Часовий критерій також був важливим чинником темпу відновлення втрачених неврологічних функцій. Зокрема, ліпші результати спостерігали після системного тромболізису, проведеного в межах 2–3,5 год від появи перших симптомів інсульту. Темпи відновлення втрачених неврологічних функцій були активнішими в пацієнтів з атеротромботичним підтипом інсульту.
Безумовно, сприятливіші результати простежувалися на 90-ту добу проспективного спостереження: повне неврологічне/функціональне відновлення настало в 13 (52,0 %) пацієнтів, помірне відновлення функцій — у 6 (24 %), залишалася тяжка інвалідизація, залежність від сторонньої допомоги в повсякденному житті у 4 (16,0 %) хворих (мШР = 4 бали, індекс Бартел < 50 балів). Випадків смерті у віддалений період (після 2 тижн.) не спостерігалося. Темпи неврологічного/функціонального відновлення протягом 21-добового та 3-місячного проспективного спостереження були статистично значущими (р < 0,05) в пацієнтів з ішемічними інсультами легкого та середнього ступеня тяжкості порівняно з тяжкими інсультами, особливо з показником фонового неврологічного дефіциту 18–20 балів.
З огляду на дані проведеного аналізу неврологічних/функціональних наслідків гострого ішемічного інсульту після тромболітичної терапії застосований лікувальний захід розширює можливості медикаментозної терапії ішемічного інсульту. Водночас проведення системного тромболізису в комунальних лікарнях м. Києва потребує вдосконалення роботи всіх ланок системи невідкладної медичної допомоги при гострому ішемічному інсульті; необхідні вдосконалення просвітницької роботи серед населення щодо ранніх проявів та ознак мозкового інсульту, здійснення контролю артеріального тиску, системний прийом відповідних гіпотензивних препаратів, проведення корекції інших факторів ризику розвитку мозкового інсульту; слід використовувати різні методи просвітницької роботи — лекції для населення, виступи на телебаченні, освітні публікації в засобах масової інформації.
Лікарям первинної ланки охорони здоров’я необхідно навчати пацієнтів, їх родичів, населення виявлення та оцінки ранніх ознак інсульту, у разі появи таких проявів терміново викликати швидку медичну допомогу; важливо акцентувати, що для досягнення кращого результату лікування інсульту необхідно здійснювати госпіталізацію пацієнта в перші 4,5 год від початку захворювання, тобто основний критерій ефективності лікування — час.
Для удосконалення системи організації надання невідкладної допомоги хворим на мозковий інсульт у м. Києві необхідні відкриття запланованих на 2016–2018 рр. спеціалізованих інсультних центрів та організація мультидисциплінарних бригад спеціалістів.
На догоспітальному етапі важливо дотримуватися тісної співпраці колективу швидкої медичної допомоги, лікарів чергових неврологічних відділень, визначених для проведення тромболізису. В умовах стаціонару має значення дотримання чіткого плану обстеження хворого, цілодобового лабораторного і нейровізуалізаційного обстеження. Безумовно, важливе значення має оцінка показань/протипоказань для проведення системного тромболізису кожного конкретного хворого.
Оцінка терапевтичної ефективності застосування кверцетину в лікуванні хворих із гострим ішемічним інсультом та аналіз ранніх, пізніх і віддалених наслідків
Із загальної кількості обстежених 2-ї групи (41 хворий) 20 пацієнтам призначали 7 г препарату, 21 — 10 г на курс лікування. Оскільки ефективність застосовуваних схем лікування була ідентичною, а пацієнти цих підгруп були порівнянні за основними демографічними та клінічними характеристиками, в подальшому вони аналізуються в одній клінічній групі прийому кверцетину. Між групами хворих, які отримували кверцетин і стандартну терапію, не виявлено статистично значущої різниці за основними демографічними параметрами й васкулярними факторами ризику розвитку інсульту (табл. 1).
/42.jpg)
У 31 (75,6 %) хворого, які лікувалися кверцетином, діагностували півкульний ішемічний інсульт: у 15 (36,6 %) пацієнтів вогнище ураження локалізувалося в басейні лівої середньої мозкової артерії (СМА), у 9 (21,9 %) — правої СМА, у 7 (17,1 %) — в обох півкулях головного мозку, у 10 (24,4 %) — у судинах вертебробазилярного басейну. Серед обстежених контрольної групи у 27 (75,0 %) хворих вогнище ішемії локалізувалося в басейні СМА (лівої — у 13 (36,1 %), правої — у 10 (27,8 %), в обох півкулях головного мозку — у 4 (11,4 %), у 9 (25,0 %) — у судинах задньої циркуляції. Слід зазначити, що у пацієнтів досліджуваних груп переважали хворі з атеротромботичним підтипом ішемічного інсульту: у групі, яку лікували кверцетином, — 33 (80,5 %), у контрольній групі — 19 (80,6 %); значно рідше виявляли кардіоемболічний патогенетичний підтип інсульту — відповідно у 8 (19,5 %) і 7 (19,4 %) обстежених. Вихідний рівень неврологічного дефіциту за шкалою NIHSS у пацієнтів групи кверцетину в середньому становив 10,1 ± 0,14 бала, у групі стандартної терапії — 10,6 ± 2,0 бала, що відповідало інсульту середньої тяжкості.
Аналіз динаміки середнього бала неврологічного дефіциту за шкалою NIHSS на тлі лікування показав, що статистично значуще за критерієм Вілкоксона зменшення середньої суми балів за шкалою NIHSS відмічене на 6-ту добу в обох групах. До того ж ступінь відновлення неврологічних функцій у хворих досліджуваних груп був різним: у групі кверцетину середній бал неврологічного дефіциту знижувався до 5,40 ± 1,74, а в групі стандартної терапії — до 7,40 ± 2,28 (р < 0,05). Тенденція до зменшення бала неврологічного дефіциту зберігалася на 11-ту добу, досягала максимальних значень до кінця курсу лікування (на 21-шу добу). Водночас зберігалася статистично значуща різниця темпів відновлення неврологічних функцій між групами кверцетину та контрольною. Статистичне порівняння регресу неврологічного дефіциту виявило не лише швидше відновлення втрачених функцій у хворих, які лікувалися кверцетином, але й вірогідну різницю в показнику неврологічного дефіциту за шкалою NIHSS між досліджуваними групами з 6-ї по 21-шу добу спостереження. Неврологічний/функціональний результат на 21-шу добу був кращим у хворих групи кверцетину (3,70 ± 1,75 бала), ніж у контрольній групі (4,2 ± 2,1 бала).
Проспективне спостереження за хворими на 90-ту добу та через один рік не виявило суттєвої різниці в темпах відновлення втрачених неврологічних функцій, не було також вірогідної різниці середньої кількості балів за шкалою NIHSS між хворими групи кверцетину й контрольною (р < 0,05).
До лікування в досліджуваних групах не було пацієнтів із показниками 0–2 бали за мШР. Переважали хворі з функціональною неспроможністю, оскільки показник за мШР був у діапазоні 3–5 балів. Середній бал у пацієнтів групи кверцетину становив 4,00 ± 0,65, у групі стандартної терапії — 3,80 ± 0,70.
На тлі лікування показник мШР статистично значуще зменшувався у хворих обох груп. Однак у хворих із фоновою функціональною неспроможністю (4–5 балів за мШР) більш значуще відновлення втрачених функцій спостерігали на тлі терапії з використанням кверцетину.
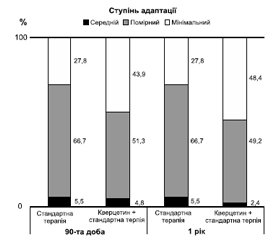
Функціональні можливості хворих, оцінених за індексом Бартел у групах до лікування, відповідали дезадаптації середнього ступеня: група кверцетину — 53,6 ± 15,6 (діапазон 30–40), група стандартної терапії — 55,6 ± 17,8 (35–75). Аналіз функціонального наслідку лікування показав, що на 90-ту добу й через один рік у хворих групи кверцетину спостерігався значніший порівняно з групою стандартної терапії приріст частки пацієнтів, які не потребували сторонньої допомоги (ІБ ≥ 95 балів) (рис. 2).
Таким чином, проведений клінічний і статистичний аналіз показників окремих шкал свідчить про меншу вираженість неврологічних порушень, збільшення рівня функціональних можливостей пацієнтів групи кверцетину порівняно з групою стандартної терапії на 21-шу добу, особливо на 90-ту добу й через один рік проспективного спостереження (рис. 1, 2).
Порівняння терапевтичної ефективності різних методів лікування хворих з урахуванням показників NIHSS, мШР, ІБ (глобальний тест) показало, що терапія з використанням водорозчинного кверцетину (Корвітину) супроводжувалася кращим відновленням функцій через 90 діб — 26,8 % пацієнтів порівняно з 19,4 % хворих, які отримували стандартну терапію (р < 0,05) (відношення шансів — 1,3801; 95% довірчий інтервал — 1,10–1,52).
Оцінка терапевтичної ефективності різних методів лікування за NIHSS і мШР показала, що вірогідно ефективнішим було застосування парентерального кверцетину в поєднанні зі стандартною терапією: високу ефективність на 21-шу добу лікування спостерігали у 78,2 % обстежених, на 90-ту добу — у 84,9 %, через один рік — у 87,6 %, у групі стандартної терапії — відповідно у 56,1; 75,4 і 83,6 % (р < 0,05).
Отже, терапія гострого ішемічного інсульту з внутрішньовенним застосуванням водорозчинної форми кверцетину (Корвітину) протягом перших 12 год після розвитку симптомів збільшує ймовірність відновлення втрачених неврологічних функцій у гострий період захворювання і через 3 міс. і один рік проспективного спостереження.
Повний однорічний протокол обстеження завершили 75 (97,4 %) із 77 пацієнтів: в 1 випадку (група кверцетину) була рання смерть (перші 2 тижні), ще в одному (група стандартної терапії) — на 60-ту добу спостереження.
/43_2.jpg)
Через 10 років спостереження було отримано інформацію про 49 пацієнтів (65,3 %) рандомізованого дослідження: 35 пацієнтів (85,4 %) — група кверцетину, 14 (38,9 %) — контрольна група; серед них живих було 26 і 4, померло 9 і 10 відповідно. Якщо припустити, що не виявлені пацієнти були живі, то частка фатальних наслідків становила би 21,95 % у групі кверцетину і 27,8 % — у контрольній групі. Якщо припустити, що всі невиявлені пацієнти померли, то летальність становила б 34,1 і 88,9 % відповідно. Отже, в обох випадках показники фатальних наслідків будуть кращими для групи кверцетину, що дає підставу зробити висновок про те, що навіть за такої неповної статистики лікування у групі кверцетину було ефективнішим, ніж у контрольній групі. Серед хворих, які померли (9 — група кверцетину, 10 — група контролю) протягом цього періоду спостереження, шляхом інтерв’ю у рідних з’ясовували причини смерті. Причинами летальності пацієнтів досліджуваних груп був розвиток повторного мозкового інсульту (по 6 випадків), інсульт-інфарктна подія (2 випадки) і тромбоемболія легеневої артерії (1 випадок) у групі традиційної терапії; інші захворювання: пухлина головного мозку (1 випадок) і перелом шийки стегна (1 випадок) у хворих групи кверцетину. Серед померлих в обох групах переважали особи чоловічої статі, середній вік яких був практично однаковим (відповідно 63,4 ± 7,4 року і 63,6 ± 8,3 року).
Оцінений клініко-неврологічний і функціональний статус живих пацієнтів у віддалений період. Вихідний рівень неврологічного дефіциту за шкалою NIHSS у 26 пацієнтів групи кверцетину в середньому становив 2,10 ± 1,79 бала (діапазон 0–7 балів), у групі стандартної терапії — 3,00 ± 1,86 бала (діапазон 0–7 балів), що відповідало інсульту легкого ступеня тяжкості.
Середній бал за мШР на період обстеження в групі кверцетину становив 1,5 ± 1,4 (діапазон 0–4 бали), у групі стандартної терапії — 2,2 ± 1,5 (діапазон 0–4 бали). До того ж у досліджуваних групах були пацієнти з показниками за мШР 0–2 бали: у групі кверцетину — 22, ще у 4 хворих показник за мШР був у діапазоні 3–4 бали; у групі традиційної терапії рівномірно розподілені по 2 пацієнти з відповідними показниками 0–2 і 3–4 бали за мШР.
Результати проведеного дослідження показали, що застосування внутрішньовенної форми кверцетину (Корвітину) впродовж перших 12 год після розвиту симптомів у пацієнтів із гострим середньотяжким і тяжким ішемічним інсультом вірогідно збільшує ймовірність повного відновлення втрачених неврологічних функцій протягом не тільки раннього, але й пізнього й віддаленого періодів проспективного спостереження.
На наш погляд, такі обнадійливі результати лікування хворих із гострим ішемічним інсультом водорозчинним кверцетином (Корвітином) досягнуті завдяки широкому спектру терапевтичної дії препарату на різні патофізіологічні механізми ішемізованого ураження тканини мозку (стабілізація функції клітинних біомембран; антиоксидантна й протизапальна дія; поліпшення мікроциркуляції, запобігання внутрішньосудинному тромбоутворенню завдяки помірній антикоагуляції; забезпечення нейронального захисту і сповільнення апоптозної дії).
Висновки
Результати проведеного аналізу системи надання невідкладної медичної допомоги хворим із гострим ішемічним інсультом у м. Києві показали, що це комплекс системних заходів, визначений відповідними наказами Міністерства охорони здоров’я України і Департаменту охорони здоров’я Київської міської державної адміністрації. На сьогодні виділені 10 комунальних лікарень, що в день чергування по місту прийматимуть хворих із гострим ішемічним інсультом, цілодобово проводитимуть безкоштовну нейровізуалізацію головного мозку, клінічне обстеження пацієнта спеціалістами інсультної команди, відповідні лабораторні дослідження, призначатимуть відповідну адекватну інтенсивну терапію.
Водночас система організації ургентної медичної допомоги пацієнтам із гострим ішемічним інсультом у м. Києві потребує вдосконалення й доопрацювання: зокрема, необхідно в усіх визначених для чергування неврологічних відділеннях створити реальні передумови для проведення пацієнту системного тромболізису; у даний час лише у 5 комунальних закладах (неврологічні відділення) проводять такий невідкладний лікувальний захід, хворих з інших 5 неврологічних відділень для проведення системного тромболізису транспортують у визначені для цього лікувальні установи, а це втрата часу й можливостей. У Києві існує нагальна потреба створення мережі спеціалізованих інсультних центрів з повноцінними мультидисциплінарними командами; таких центрів у місті має бути 2–3. В інших же лікарнях мають функціонувати повноцінні інсультні блоки з можливостями для проведення тромболітичної терапії.
Для поліпшення функціонування системи організації невідкладної допомоги хворим із гострим ішемічним інсультом важливе проведення додаткових заходів на рівні первинної ланки охорони здоров’я:
— активізація просвітницької роботи серед населення щодо корекції факторів ризику розвитку цереброваскулярних захворювань, ранніх проявів мозкового інсульту, тактики термінової госпіталізації пацієнта з підозрою на інсульт у відповідно оснащені лікарні з використанням для цього різних методів — лекцій, публікацій у пресі, профілактичної роботи серед населення;
— лікарям первинної ланки посилити роботу з прикріпленим населенням для виявлення пацієнтів із факторами ризику цереброваскулярних захворювань (в першу чергу з гіпертонічною хворобою) з подальшим динамічним наглядом за такою групою хворих;
— організація тісної, чіткої співпраці стаціонарів зі службою швидкої медичної допомоги; уникнення внутрішньолікарняної затримки обстеження та лікування також є запорукою успішного результату після інсульту.
Упровадження в клінічну практику визначених неврологічних відділень міста для системного тромболізису свідчить про позитивні зміни в організації невідкладної допомоги хворим із гострим ішемічним інсультом, розширює можливості медикаментозної терапії, хоча до кінця не вирішує цю проблему.
Результати аналізу ефективності тромболітичної терапії з використанням препарату Актилізе у проведеному нами лікуванні 25 хворих із гострим ішемічним інсультом показали, що відновлення втрачених неврологічних функцій у пацієнтів активніше настає протягом перших годин після внутрішньовенної інфузії препарату й перших 2 тижнів спостереження; показник неврологічного дефіциту у хворих за шкалою NIHSS знизився на 9,1 бала і в середньому становив 7,2 ± 1,9 (р < 0,01). На 21-шу добу повне відновлення неврологічних функцій настало у 8 (32,0 %) пацієнтів, помірне — у 10 (40,0 %), ще в 5 (20,0 %) хворих утримувалася інвалідизація, ще у 2 (8,0%) випадках настав летальний кінець.
Додатковий аналіз неврологічних/функціональних результатів засвідчив, що кращий терапевтичний ефект після тромболітичної терапії був у хворих з інсультом легкої та середньої тяжкості; у пацієнтів із неврологічним дефіцитом за шкалою NIHSS 17–20 балів відновлення функцій було незначним, до того ж у 2 хворих реперфузія зумовлювала реперфузійне пошкодження ішемізованої тканини мозку, в одного з них виникла геморагічна трансформація, ще у 2 випадках була рання смерть. На 90-й день проспективного спостереження у 13 (52,0 %) хворих спостерігалося повне відновлення втрачених неврологічних функцій, у 6 (24,0 %) — помірне, у 4 (16,0 %) — утримувалася інвалідизація (4 бали за мШР).
Застосування водорозчинної форми кверцетину (Корвітину) в лікуванні середньотяжкого й тяжкого гострого ішемічного інсульту уже на 6-ту добу спостереження зумовлювало статистично значущу динаміку середнього клінічного бала за шкалою NIHSS (5,2 ± 1,7) порівняно з групою стандартної терапії (7,40 ± 2,28). Тенденція до зменшення показника неврологічного дефіциту досягала максимальних значень на 21-шу добу стаціонарного лікування. До того ж зберігалася статистично значуща різниця в темпі відновлення неврологічних функцій між групою кверцетину й контрольною.
Аналіз пізніх наслідків лікування гострого ішемічного інсульту кверцетином на 90-ту добу проспективного спостереження показав, що терапія з використанням водорозчинного кверцетину зумовлювала вищий показник повного відновлення неврологічних функцій — 26,8 % пацієнтів порівняно з 19,4 % хворих групи стандартної терапії (р < 0,05). Кращим був також віддалений прогноз (через 10 років) у пацієнтів, що лікувались кверцетином.
Наші дані, які ґрунтуються на попередніх і сучасних клінічних спостереженнях, свідчать про ймовірну доцільність застосування препарату кверцетин (Корвітин) і тим хворим, яким проводитимуть системний тромболізис, що може значно нівелювати ушкоджувальну дію реперфузії та реперфузійне ушкодження ішемізованої тканини мозку, поліпшуватиме колатеральний кровообіг.
Конфлікт інтересів. Не заявлений.
/43_2.jpg)

/42.jpg)
/43.jpg)