Журнал «Здоровье ребенка» Том 14, №7, 2019
Вернуться к номеру
Медикаментозное влияние на диспергирование биопленки. Доноры оксида азота
Авторы: Абатуров А.Е.(1), Крючко Т.А.(2)
(1) — ГУ «Днепропетровская медицинская академия МЗ Украины», г. Днепр, Украина
(2) — ВГУЗУ «Украинская медицинская стоматологическая академия», г. Полтава, Украина
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
У науковому огляді відображені сучасні уявлення про значення низьких концентрацій оксиду азоту в процесі диспергування та ерадикації бактеріальної біоплівки. Для написання статті здійснювався пошук інформації з використанням баз даних Scopus, Web of Science, MedLine, PubMed, Google Scholar, EMBASE, Global Health, The Cochrane Library, CyberLeninka. Охарактеризовано значення оксиду азоту в розвитку рецидивів інфекційно-запальних захворювань респіраторного тракту. Підкреслена здатність оксиду азоту при високих (мікромолярних) концентраціях бути високотоксичною сполукою для бактерій і найважливішим компонентом неспецифічного захисту макроорганізму від патогенних мікроорганізмів, а при низьких (наномолярних) концентраціях виконувати роль сигнальної молекули. Відображено здатність монооксиду азоту диспергувати біоплівку бактерій через посилення експресії або активності протеїнів, пов’язаних із рухливістю бактерій: пілі, рамноліпідів. Надана характеристика основних донорів оксиду азоту та молекулярних платформ, що можуть бути використані для їх доставки в макроорганізм. Наведені основні групи донорів оксиду азоту, такі як органічні нітрати, сполуки нітрозильованих металів, діолати діазенія (N-diazeniumdiolate — NONOate) і S-нітрозотіоли (S-nitrosothiol — RSNO). Зазначено, що донори оксиду азоту підсилюють диспергування біоплівки і сприяють підвищенню антибактеріальної активності антибіотиків. Охарактеризовані молекулярні платформи доставки й оптимізації режиму вивільнення оксиду азоту: неорганічні і полімерні наночастинки, металоорганічні координаційні полімери, дендримери, ліпосоми, міцели. Підкреслена можливість використання даних сполук для розробки нових препаратів, що будуть ефективні при лікуванні захворювань, асоційованих із формуванням біоплівок патогенними бактеріями.
В научном обзоре отражены современные представления о значении низких концентраций оксида азота в процессе диспергирования и эрадикации бактериальной биопленки. Для написания статьи осуществлялся поиск информации с использованием баз данных Scopus, Web of Science, MedLine, PubMed, Google Scholar, EMBASE, Global Health, The Cochrane Library, CyberLeninka. Охарактеризовано значение оксида азота в развитии рецидивов инфекционно-воспалительных заболеваний респираторного тракта. Подчеркнута способность оксида азота при высоких (микромолярных) концентрациях быть высокотоксичным соединением для бактерий и важнейшим компонентом неспецифической защиты макроорганизма от патогенных микроорганизмов, а при низких (наномолярных) концентрациях выполнять роль сигнальной молекулы. Отражена способность монооксида азота диспергировать биопленку бактерий через усиление экспрессии или активности протеинов, связанных с подвижностью бактерий: пили, рамнолипидов. Представлена характеристика основных доноров оксида азота и молекулярных платформ, которые могут быть использованы для их доставки в макроорганизм. Описаны основные группы доноров оксида азота, такие как органические нитраты, соединения нитрозилированных металлов, диолаты диазения (N-diazeniumdiolate — NONOate) и S-нитрозотиолы (S-nitrosothiol — RSNO). Указано, что доноры оксида азота усиливают диспергирование биопленки и способствуют повышению антибактериальной активности антибиотиков. Охарактеризованы молекулярные платформы доставки и оптимизации режима высвобождения оксида азота: неорганические и полимерные наночастицы, металлорганические координационные полимеры, дендримеры, липосомы, мицеллы. Подчеркнута возможность использования данных соединений для разработки новых препаратов, которые будут эффективны при лечении заболеваний, ассоциированных с формированием биопленок патогенными бактериями.
The scientific review deals with the modern ideas about the importance of low concentrations of nitric oxide in the process of dispersing and eradicating of bacterial biofilms. For writing the article, information was searched using Scopus, Web of Science, MedLine, PubMed, Google Scholar, EMBASE, Global Health, The Cochrane Library, CyberLeninka. The paper highlights the value of nitric oxide in the development of relapses of respiratory infectious-inflammatory diseases. It is emphasized that the ability of nitric oxide at high (micromolar) concentrations can become a highly toxic compound for bacteria and an important component of the nonspecific protection of a macroorganism from pathogenic microorganisms, and at low (nanomolar) concentrations can act as a signaling molecule. The ability of nitrogen monoxide to disperse the biofilm of bacteria through increased expression or activity of proteins associated with the motility of bacteria pili, rhamnolipids is described. The characteristics of the main donors of nitric oxide and molecular platforms that can be used for their delivery to the macroorganism are presented. The main groups of nitric oxide donors are described, such as organic nitrates, nitrosylated metal compounds, diazenium diolates (N-diazeniumdiolate — NONOate) and S-nitrosothiols (S-nitrosothiol — RSNO). It is indicated that nitric oxide donors enhance the dispersion of biofilms and contribute to an increase in the antibacterial activity of antibiotics. The paper characterizes the molecular platforms for the delivery and optimization of the nitric oxide release regime: inorganic and polymer nanoparticles, organometallic coordination polymers, dendrimers, liposomes, micelles. The possibility of using these compounds to develop new drugs that will be effective in treating diseases associated with the formation of biofilms by pathogenic bacteria is underlined.
диспергування біоплівки; респіраторний тракт; донори оксиду азоту; рецидивуючі та хронічні інфекційно-запальні захворювання; огляд
диспергирование биопленки; респираторный тракт; доноры оксида азота; рецидивирующие и хронические инфекционно-воспалительные заболевания; обзор
biofilm dispersion; respiratory tract; nitric oxide donors; recurrent and chronic infectious and inflammatory diseases; review
Введение
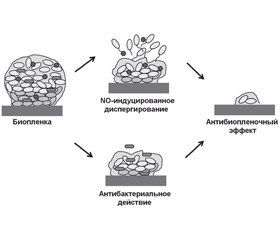
Формирование биопленки патогенными бактериальными агентами ассоциировано с рецидивирующим и хроническим течением воспалительного процесса респираторного тракта. Жизненный цикл бактериальной биопленки характеризуется наличием диспергирования и отсева патогенов в неколонизированные регионы систем макроорганизма. Монооксид азота (NO) является одним из мощных триггеров диспергирования бактериальной биопленки, усиление его продукции может инициировать как рецидив, так и завершение инфекционно-воспалительного процесса [7]. В настоящее время разработано несколько технологий диспергирования биопленки, основанных на использовании антибиопленочной активности NO. Созданы соединения, которые генерируют NO, обеспечивают целенаправленную доставку NO и биоматериалы, высвобождающие NO [34]. Nicolas Barraud и соавт. [10] считают, что использование низкого уровня концентрации NO представляет собой одну из самых перспективных стратегий, обеспечивающих контроль развития биопленок в контексте врачебной практики.
Монооксид азота и бактериальные биопленки
Метаболизм многочисленных микроорганизмов включает реакции азотного цикла (N-цикл), степень окисления атома азота в котором колеблется от +5 в нитратах до –3 в аммиаке [47]. Бактерии образуют NO в процессе восстановления нитритов, в частности ферментом бактерий Pseudomonas aeruginosa, ответственным за генерацию NO, является цитохром cd1-нитритредуктаза [18].
При высоких концентрациях (микромолярных) NO является высокотоксичным соединением для бактерий и представляет собой важнейший компонент неспецифической защиты макроорганизма от патогенных микроорганизмов [41]. Бактерии при высоких концентрациях NO предупреждают его токсическое действие за счет функционирования механизмов денитрификации и детоксикации [48]. На действие высоких концентраций NO реагирует группа NO-чувствительных бактериальных протеинов: FNR-подобные транскрипционные факторы (регуляторные белки фумарата и нитрата — fumarate and nitrate regulatory proteins — FNR), активатор транскрипции NorR (регулятор NO-редуктазы — regulator of NO reductase) и NO-чувствительный репрессор NsrR (репрессор нитрозативного стресса — repressor of nitrosative stress) [27].
Однако при низких (наномолярных) концентрациях NO является сигнальной молекулой. У млекопитающих она связывается со своим специфическим рецептором — солютабной гуанилатциклазой (soluble guanylyl cyclase — sGC). Комплекс NO/sGC при участии железа протопорфирина IX конверсирует гуанозинтрифосфат во вторичный мессенджер — циклический гуанозин 3',5'-монофосфат (цГМФ), что приводит к увеличению концентрации последнего в несколько сот раз выше базального уровня. цГМФ участвует в регуляции тонуса гладких мышц, миокардиоцитов, активности агрегации тромбоцитов, ангиогенеза и др. [1, 2, 26]. При низких (наномолярных) концентрациях NO взаимодействует со специфическими бактериальными сенсорами, активация которых опосредует диспергирование бактериальной биопленки за счет увеличения деградирующей активности бактериальных фосфодиэстераз (phosphodiesterase — PDE), что приводит к последующему уменьшению концентрации внутриклеточного вторичного мессенджера и регулятора развития биопленки — циклического дигуанозинмонофосфата (cyclic diguanyl monophosphate — c-di-GMP/ц-ди-ГМФ) [7, 10].
Одним из классов сенсоров NO являются протеины семейства гем оксид азота или кислородсвязывающего домена (heme-nitric oxide or oxygen binding domain — H-NOX), которые влияют на формирование биопленки за счет изменения внутрибактериальной концентрации ц-ди-ГМФ [27]. Лигандом представителей семейства H-NOX, кроме NO, также является молекулярный кислород [52]. Гены протеинов семейства Н-NOX идентифицированы в геномах более чем 300 видов бактерий. NO-связывающие протеины H-NOX непосредственно регулируют как синтез ц-ди-ГМФ, так и активность фосфодиэстераз бактерий. Снижение концентрации ц-ди-ГМФ приводит к подавлению биопленки при наличии NO [7].
Однако многие сенситивные к действию NO бактерии не кодируют ген H-NOX. Для рекогниции NO они используют другие семейства бактериальных сенсоров NO (nitric oxide sensing protein — NosP).
В частности, у бактерий Pseudomonas aeruginosa NO-чувствительными сенсорами NosP являются: цитоплазматический хемотаксический протеин BdlA (biofilm dispersal locus A), мембранный протеин NbdA (nitric oxide induced biofilm dispersal locus A) и система Lap [19].
Протеин BdlA является ключевым компонентом процесса диспергирования биопленки. Его молекула состоит из двух смежных доменов PAS (Per Arnt Sim), предположительно участвующих в связывании кофактора гема и С-терминального домена ТарН, соединяющегося с лигандсвязывающими доменами метилакцепторными хемотаксичными рецепторами [45]. Протеин BdlA является контролером диспергирования, чувствительным к действию не только NO, но и глутамата, серебра, ртути, мышьяка и сукцинатов. Циклаза BdlA фосфорилируется только при наличии фактора NicD, и активность фосфорилирования BdlA обратно пропорциональна фосфорилированию NicD. Делеция гена bdlA сопровождается уменьшением активности образования биопленок приблизительно в четыре раза и увеличением концентрации ц-ди-ГМФ приблизительно в шесть раз [54].
Наномолярные концентрации NO способствуют активации хемотаксического протеина BdlA у бактерий Pseudomonas aeruginosa, ген которого располагается в локусе A диспергирования биопленки [43]. После активации протеин BdlA стимулирует фосфодиэстеразу DipA (dispersal induced phosphodiesterase) и рекрутирует регулятор фосфодиэстеразу RbdA (regulator of biofilm dispersal), что обусловливает снижение уровня ц-ди-ГМФ и диспергирование бактериальной биопленки [54, 59].
Транскрипционная активность протеина NbdA, индуцированная действием NO, приводит к повышению каталитической активности PDE и, как следствие, снижению концентрации ц-ди-ГМФ [35].
Система Lap представлена рецептором LapD, протеазой LapG и адгезином LapA. Рецепторный протеин LapD — мембранный белок, состоящий из доменов HAMP, GGDEF (без консервативных I- или A-сайтов) и EAL, которые не обладают каталитической активностью. Однако протеин LapD при помощи домена EAL непосредственно связывается ц-ди-ГМФ [41] и, изменяя свою конформацию, взаимодействует с мембранно-связанной протеазой LapG, что предотвращает расщепление поверхностного адгезина LapA протеазой LapG, способствует прогрессированию развития биопленки [14, 23]. По всей вероятности, периплазматическая протеаза LapG участвует в NO-ассоциированной реакции диспергирования биопленки бактерий Pseudomonas aeruginosa, так как биопленки, организованные лишенными LapG бактериями, не диспергируют на воздействие NO [10].
Монооксид азота также приводит к диспергированию биопленки за счет модуляции активности факторов транскрипции: OxyR, SoxR, NsrR, NorR, FhpR, DNR и других регуляторов транскрипции фумарат-нитратредуктазы (fumarate nitrate reductase — FNR). Молекулы данных факторов транскрипции связаны с железосодержащими кофакторами, которые реагируют с NO, тем самым изменяя их сродство к ДНК-мишеням. Монооксид азота усиливает экспрессию или активность протеинов, связанных с подвижностью бактерий: пили (PilA), рамнолипидов (RhlAB) [19], способствуя диспергированию биопленки (рис. 1).
Рамнолипиды являются экстрацеллюлярными метаболитами, обладающими поверхностно-активными свойствами. Низкая концентрация рамнолипидов увеличивает гидрофобность мембраны бактерии, что способствует адгезии микроорганизма с поверхностью слизистых оболочек и формированию биопленки. Однако избыток рамнолипидов ингибирует образование биопленки, блокирует клеточную агрегацию и уменьшает вторичную колонизацию микроорганизмов на предварительно сформированные биопленки планктонными бактериями. Активный процесс диспергирования на поздних стадиях жизни биопленки опосредуется рамнолипидами [11].
Доноры монооксида азота
Соединения, которые являются NO-донорами, представляют собой вещества, несущие стабилизированную молекулу NO, которая высвобождается при определенных условиях. Высвобождение молекулы NO индуцируется самыми разнообразными триггерами: светом, теплом, изменением рН или наличием некоторых активных ферментов, тиолов, металлов. Основными группами NO-доноров являются органические нитраты, соединения нитрозилированных металлов, диолаты диазения (N-diazeniumdiolate — NONOate) и S-нитрозотиолы (S-nitrosothiol — RSNO) [53].
Соединения, дотирующие NO, способны усиливать диспергирование биопленки и способствовать повышению антибактериальной активности антибиотиков (рис. 2).
Органические нитраты
Одним из наиболее известных нитратов, антибиопленочное действие которого достаточно изучено, является изосорбид мононитрат [24]. Sayeed Hasan и соавт. [24] продемонстрировали, что изосорбида мононитрат вызывает диспергирование биопленки бактерий Staphylococcus aureus. Применение изосорбида мононитрата в концентрации 60 мг/мл индуцирует увеличение количества колониеобразующих единиц планктонных бактерий через 6 и 24 часа экспозиции в 3 и 5 раз соответственно, что, по мнению авторов, свидетельствует о способности изосорбида мононитрата стимулировать переход «оседлых» бактерий биопленки в планктонные формы. Также показано, что изосорбида мононитрат повышает эффективность антибактериального действия ципрофлоксацина.
Соединение нитрозилированных металлов
Железосодержащие нитрозилированные комплексы представляют собой давно известные доноры NO. Например, нитропруссид натрия (sodium nitroprusside (Na2[Fe(CN)5NO]•2H2O) — SNP), который широко используется во врачебной практике в качестве эффективного быстродействующего сосудорасширяющего препарата для лечения легочной гипертензии [17]. Продемонстрировано, что применение SNP сопровождается индукцией перехода патогенных бактерий от биопленочного состояния к планктонной форме жизни за счет снижения внутриклеточной концентрации ц-ди-ГМФ [10, 33]. Спектр действия SNP в основном ограничивается бактериями родов Pseudomonas, Bacillus и Clostridium [9, 21, 39], несмотря на то, что низкая концентрация NO не изменяет уровень диспергирования биопленки бактерий Streptococcus pneumoniae, но способствует усилению активности киллинга пневмококков на фоне применения амоксициллина/клавуланата [6].
Диолаты диазения
Диолаты диазения представляют собой ионаты, которые характеризуются наличием димера NO-NO, связанного с нуклеофилом через атом азота [3]. Группа соединений NONOate, наиболее исследованных доноров NO, включает NONOate-спермин, NONOate-диэтиламин, NONOate-диэтилентриамин, NONOate-дипропилентриамин и NONOate-пролин [57]. Установлено, что NONOate-соединения, инкапсулированные в наночастицы, способны эффективно диспергировать биопленки, сформированные микроорганизмами, в частности бактериями Pseudomonas aeruginosa, уменьшая ее биомассу на 79 % [4].
S-нитрозотиолы
В отличие от соединений NONOate генерация RSNO требует взаимодействия тиолов (R-SH) с нитрозилирующими агентами, такими как алкилнитрит, триоксид динитроген и азотистая кислота. В доклинических исследованиях in vivo из семейства RSNO наиболее часто используют S-нитрозо-N-ацетилпеницилламин (S-nitroso-N-acetylpenicillamine — SNAP) и S-нитрозо-L- глутатион (S-nitroso-L-glutathione — GSNO) [22, 40]. Соединения RSNO высвобождают NO при наличии каталитических агентов, таких как ионы переходных металлов: Cu2+, Hg2+, Fe2+, Ag+, Se 2+ и Te2+ [28].
Молекулярные платформы доставки доноров монооксида азота
Для доставки и оптимизации режима высвобождения NO были предложены различные молекулярные платформы: неорганические и полимерные наночастицы, металлорганические координационные полимеры, дендримеры, липосомы, мицеллы [16, 43, 56, 57].
Неорганические наночастицы
Из широкого спектра неорганических наночастиц для доставки NO чаще всего используют наночастицы кремния и золота [43]. Полагают, что неорганические наночастицы являются идеальным транспортным средством для лекарственных соединений, поскольку они являются инертными, биосовместимыми, биоразлагаемыми, термически и химически стабильными [13]. Yuan Lu и соавт. [37] продемонстрировали, что кремниевые наностержни являются отличной платформой для доставки NONOate-соединений. NO-высвобождающие мезопористые кремниевые наностержни проявляют бактерицидную и антибиопленчатую активность против грамположительных бактерий Staphylococcus aureus и грамотрицательных бактерий Pseudomonas aeruginosa.
Полимерные наночастицы
Поли(молочно-со-гликолевая кислота) (poly(lactic-co-glycolic-acid) PLGA) представляет собой биосовместимый полимер, наночастицы которого одобрены FDA для применения во врачебной практике в качестве носителей для доставки лекарственных средств в макроорганизм [32, 33, 46].
Показано, что PLGA действует как промотор и регулятор высвобождения NO из NO-донора. Высвобождающие молекулы NO проявляют достоверное антибиопленочное действие против биопленок, сформированных бактериями Staphylococcus aureus и Escherichia coli. В частности, применение дибутигексилдиамина диолата диазения (dibutyhexyldiamine diazeniumdiolate — DBHD/N2O2), инкапсулированного в наночастицы PLGA, сопровождается уменьшением биомассы биопленки бактерий Staphylococcus aureus на 98,4 % и бактерий Escherichia coli на 99,9 % при температуре 37 °C [12].
Металлорганические координационные полимеры
Металлорганические координационные полимеры (metal-organic framework — MOF) представляют собой трехмерные структурные пористые соединения, которые состоят из ионов металлов или кластеров, соединенных между собой жесткими органическими молекулами [29, 38]. В настоящее время показано, что использование MOF в качестве платформы для доставки антибиотиков усиливает антибиопленочную эффективность последних [20]. Особый интерес данные соединения представляют как системы хранения и доставки NO [58].
Дендримеры
Дендримеры представляют собой растворимые в воде глобулярные макромолекулы размером от 1 до 100 нм c гиперразветвленной трехмерной структурой, которая состоит: 1) из центрального ядра, 2) гиперразветвленной мантии и 3) короны с множественными поверхностными функциональными группами. Дендримеры могут использоваться в качестве носителя для различных терапевтических агентов. Различают несколько генераций дендримеров: первая генерация характеризуется наличием одной точки, вторая генерация — двух, третья генерация — трех точек ветвления каждой ветви и т.д. [15, 49]. Различные NO-высвобождающие поли (амидоамин) (poly(amidoamine) — PAMAM) дендримеры 1-й генерации отличаются длиной алкильной цепи (пропил, бутил, гексил, октил и додецил), и чем длиннее цепь, тем больше период полувыведения NO [8, 36]. Установлено, что октил- и додецил-модифицированные PAMAM-дендримеры обладают наиболее выраженным антибактериальным и антибиопленчатым действием против бактерий Streptococcus mutans [8].
Однако NO-высвобождающие PAMAM-дендримеры оказывают разное по силе действие на формирование биопленки у различных микроорганизмов. Так, NO-высвобождающие PAMAM-дендримеры 1-й генерации через 2 часа экспозиции вызывают существенные деструктивные изменения биопленки, сформированной бактериями Pseudomonas aeruginosa, в то время как структура биопленки, сформированной бактериями Staphylococcus aureus, практически не чувствительна к их влиянию. Brittany V. Worley и соавт. [55] считают, что отличия действия NO-высвобождающих PAMAM-дендримеров обусловлены особенностями строения биопленки различных бактерий. Также продемонстрировано, что гексилмодифицированные дендримеры независимо от степени генерации обладают превосходной антибактериальной активностью против бактерий Pseudomonas aeruginosa. Следует отметить, что NO-высвобождающие дендримеры 2-й генерации проявляют наименьшую антибиопленочную активность.
Bin Sun и соавт. [51] созданы NO-высвобождающие поли (пропиленоиновые) (poly(propylene imine) — PPI) дендримеры. Авторами установлено, что данные дендримеры, особенно 5-й генерации, высокоэффективны в подавлении биопленок, сформированных бактериями Pseudomonas aeruginosa и Staphylococcus aureus.
Липосомы
Липосомы представляют собой сферы, образованные амфифильными липидами, которые состоят из гидрофобной оболочки и гидрофильного ядра. Липосомы способствуют повышению специфичности, снижению дозы, уменьшению риска неблагоприятных лекарственных средств. Показано, что доставка антибактериальных препаратов в липосомах увеличивает их эффективность при сформированной бактериальной биопленке [25].
Продемонстрировано, что изосорбид мононитрат, одобренный для клинического использования NO-донор и инкапсулированный в различные анионные одно- и многослойные липосомальные композиции, индуцирует объемное диспергирование in vitro биопленок бактерий Staphylococcus aureus [30].
Dakota J. Suchyta и Mark H. Schoenfisch инкапсулировали в липосомы такие доноры NO, как спермин NONOate и дипропилентриамин NONOate [50].
Мицеллы
Полимерные мицеллы (размером от 10 до 200 нм) состоят из амфифильных полимеров, в частности из поли(2-гидроксиэтилметакрилата) (poly(2-hydroxyethyl methacrylate) — PHEMA), метоксиполи(этиленгликоля) и поли(молочной кислоты) (poly(ethylene glycol) and poly(lactic acid) — m-PEG-PLA) или сукцината d-a-токоферила полиэтиленгликоля (d-a-tocopheryl polyethylene glycol succinate — TPGS), которые образуют гидрофобное внутреннее ядро, стабилизированное гидрофильной внешней оболочкой [57]. Однако до настоящего времени не проведены исследования антибиопленочного действия NO-генерирующих соединений на платформе мицелл.
Экспериментальные и клинические исследования NO-высвобождающих соединений
В настоящее время разрабатываемые NO-высвобождающие соединения, ассоциированные с молекулярными формами доставки, проходят испытания, преимущественно in vitro (табл. 1), а из коммерческих препаратов существуют только средства, рекомендованные для наружного применения при лечении ожоговых поверхностей [31, 56].
Необходимо учитывать, что NO при наличии кислорода образует диоксид азота (NO2), что может привести к повреждению легких и развитию их отека [5].
Выводы
Таким образом, низкая концентрация NO вызывает диспергирование биопленки, сформированной практически любыми бактериальными патогенами. Монооксид азота при низкой концентрации индуцирует снижение концентрации ц-ди-ГМФ, что приводит к усилению подвижности бактерий и деградации матрикса биопленки. По всей вероятности, реактивные состояния человека, которые сопровождаются усилением продукции NO, могут привести к развитию рецидива именно за счет усиления дисперсии биопленки и колонизации новых регионов органов и систем. Применение NO-доноров сопровождается уменьшением массы биопленки патогенных бактерий и повышением эффективности действия антибактериальных средств. Разработка лекарственных средств, способных к длительному высвобождению стабильного уровня NO, будет способствовать решению задачи по достижению эффективности киллинга антибиотикорезистентных бактерий, способных быстро формировать биопленки.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.
1. Абатуров А.Е., Волосовец А.П., Борисова Т.П. Активированные азотсодержащие метаболиты организма человека при заболеваниях органов дыхания. Генераторы и генерация (часть 1). Здоровье ребенка. 2015. № 6(66). С. 136-140.
2. Абатуров А.Е., Волосовец А.П., Борисова Т.П. Активированные азотсодержащие метаболиты организма человека при заболеваниях органов дыхания. Генераторы и генерация (часть 2). Здоровье ребенка. 2015. № 7(67). С. 127-131.
3. Граник В.Г., Рябова С.Ю., Григорьев Н.Б. Экзогенные доноры оксида азота и ингибиторы его образования (химический аспект). Успехи химии. 1997. 66(8). С. 717-731. doi: 10.1070/RC1997v066n08ABEH000317.
4. Adnan N.N.M., Sadrearhami Z., Bagheri A. et al. Exploiting the Versatility of Polydopamine-Coated Nanoparticles to Deliver Nitric Oxide and Combat Bacterial Biofilm. Macromol. Rapid Commun. 2018 Jul. 39(13). e1800159. doi: 10.1002/marc.201800159.
5. Akter F., Coghlan G., de Mel A. Nitric oxide in paediatric respiratory disorders: novel interventions to address associated vascular phenomena? Ther. Adv. Cardiovasc. Dis. 2016 Aug. 10(4). Р. 256-70. doi: 10.1177/1753944716649893.
6. Allan R.N., Morgan S., Brito-Mutunayagam S. et al. Low Concentrations of Nitric Oxide Modulate Streptococcus pneumoniae Biofilm Metabolism and Antibiotic Tolerance. Antimicrob. Agents Chemother. 2016, Mar 25. 60(4). Р. 2456-66. doi: 10.1128/AAC.02432-15.
7. Arora D.P., Hossain S., Xu Y., Boon E.M. Nitric Oxide Regulation of Bacterial Biofilms. Biochemistry. 2015, Jun 23. 54(24). Р. 3717-28. doi: 10.1021/bi501476n.
8. Backlund C.J., Worley B.V., Schoenfisch M.H. Anti-biofilm action of nitric oxide-releasing alkyl-modified poly(amidoamine) dendrimers against Streptococcus mutans. Acta Biomater. 2016, Jan. 29. Р. 198-205. doi: 10.1016/j.actbio.2015.10.021.
9. Barraud N., Hassett D.J., Hwang S.H. et al. Involvement of nitric oxide in biofilm dispersal of Pseudomonas aeruginosa. J. Bacteriol. 2006 Nov. 188(21). Р. 7344-53. PMID: 17050922.
10. Barraud N., Kelso M.J., Rice S.A., Kjelleberg S. Nitric oxide: a key mediator of biofilm dispersal with applications in infectious diseases. Curr. Pharm. Des. 2015. 21(1). Р. 31-42. doi: 10.2174/1381612820666140905112822.
11. Berlanga M., Guerrero R. Living together in biofilms: the microbial cell factory and its biotechnological implications. Microb. Cell. Fact. 2016, Oct 1. 15(1). Р. 165. doi: 10.1186/s12934-016-0569-5.
12. Cai W., Wu J., Xi C., Meyerhoff M.E. Diazeniumdiolate-doped poly(lactic-co-glycolic acid)-based nitric oxide releasing films as antibiofilm coatings. Biomaterials. 2012 Nov. 33(32). Р. 7933-44. doi: 10.1016/j.biomaterials.2012.07.027.
13. Chan A.C., Bravo M. Cadena, Townley H.E. et al Effective delivery of volatile biocides employing mesoporous silicates for treating biofilms. J. R. Soc. Interface. 2017 Jan. 14(126). pii: 20160650. doi: 10.1098/rsif.2016.0650.
14. Chatterjee D., Cooley R.B., Boyd C.D. et al. Mechanistic insight into the conserved allosteric regulation of periplasmic proteolysis by the signaling molecule cyclic-di-GM. Elife. 2014, Sep 2. 3. e03650. doi: 10.7554/eLife.03650.
15. Choudhary S., Gupta L., Rani S. et al. Impact of Dendrimers on Solubility of Hydrophobic Drug Molecules. Front. Pharmacol. 2017 May 16. 8. Р. 261. doi: 10.3389/fphar.2017.00261.
16. Claes B., Boudewijns T., Muchez L. et al Smart Metal-Organic Framework Coatings: Triggered Antibiofilm Compound Release. ACS Appl Mater Interfaces. 2017, Feb 8. 9(5). Р. 4440-4449. doi: 10.1021/acsami.6b14152.
17. Cobb A., Thornton L. Hyperinflation of Nitroprusside. J. Pharm. Pract. 2018 Aug. 31(4). Р. 382-389. doi: 10.1177/0897190018762182.
18. Cutruzzolà F., Rinaldo S., Centola F., Brunori M. NO production by Pseudomonas aeruginosa cd1 nitrite reductase. IUBMB Life. 2003 Oct-Nov. 55(10–11). Р. 617-21. doi: 10.1080/15216540310001628672.
19. Cutruzzolà F., Frankenberg-Dinkel N. Origin and Impact of Nitric Oxide in Pseudomonas aeruginosa Biofilms. J. Bacteriol. 2016 Jan 1. 198(1). Р. 55-65. DOI: 10.1128/JB.00371-15.
20. Duan F., Feng X., Jin Y. et al. Metal-carbenicillin framework-based nanoantibiotics with enhanced penetration and highly efficient inhibition of MRSA. Biomaterials. 2017 Nov.144. Р. 155-165. doi: 10.1016/j.biomaterials.2017.08.024.
21. Fida T.T., Voordouw J., Ataeian M. et al. Synergy of Sodium Nitroprusside and Nitrate in Inhibiting the Activity of Sulfate Reducing Bacteria in Oil-Containing Bioreactors. Front. Microbiol. 2018 May 16. 9. 981 р. doi: 10.3389/fmicb.2018.00981.
22. Ganzarolli de Oliveira M. S-Nitrosothiols as Platforms for Topical Nitric Oxide Delivery. Basic Clin. Pharmacol. Toxicol. 2016 Oct. 119, Suppl. 3. Р. 49-56. doi: 10.1111/bcpt.12588.
23. Giacalone D., Smith T.J., Collins A.J. et al. Ligand-Mediated Biofilm Formation via Enhanced Physical Interaction between a Diguanylate Cyclase and Its Receptor. MBio. 2018, Jul 10. 9(4). pii: e01254-18. doi: 10.1128/mBio.01254-18.
24. Hasan S., Albayaty Y.N.S., Thierry B. Mechanistic studies of the antibiofilm activity and synergy with antibiotics of isosorbide mononitrate. Eur. J. Pharm. Sci. 2018, Mar 30. 115. Р. 50-56. doi: 10.1016/j.ejps.2018.01.003.
25. Hemeg H.A. Nanomaterials for alternative antibacterial therapy. Int. J. Nanomedicine. 2017, Nov 10. 12. Р. 8211-8225. doi: 10.2147/IJN.S132163.
26. Horst B.G., Marletta M.A. Physiological activation and deactivation of soluble guanylate cyclase. Nitric Oxide. 2018 Jul 1. 77. Р. 65-74. doi: 10.1016/j.niox.2018.04.011.
27. Hossain S., Nisbett L.M., Boon E.M. Discovery of Two Bacterial Nitric Oxide-Responsive Proteins and Their Roles in Bacterial Biofilm Regulation. Acc. Chem. Res. 2017, Jul 18. 50(7). Р. 1633-1639. doi: 10.1021/acs.accounts.7b00095.
28. Hwang S., Cha W., Meyerhoff M.E. Polymethacrylates with a covalently linked CuII-cyclen complex for the in situ generation of nitric oxide from nitrosothiols in blood. Angew Chem. Int. Ed. Engl. 2006, Apr 21. 45(17). Р. 2745-8. doi: 10.1002/anie.200503588.
29. Indra A., Song T., Paik U. Metal Organic Framework Derived Materials: Progress and Prospects for the Energy Conversion and Storage. Adv. Mater. 2018, Jul 8. e1705146. doi: 10.1002/adma.201705146.
30. Jardeleza C., Thierry B., Rao S. et al. An in vivo safety and efficacy demonstration of a topical liposomal nitric oxide donor treatment for Staphylococcus aureus biofilm-associated rhinosinusitis. Transl. Res. 2015 Dec. 166(6). Р. 683-92. doi: 10.1016/j.trsl.2015.06.009.
31. Kang Y., Lee Y.M., Kim J. еt al. Nitric oxide-releasing polymer incorporated ointment for cutaneous wound healing. J. Control. Release. 2015, Dec 28. 220(Pt B). Р. 624-30. doi: 10.1016/j.jconrel.2015.08.057.
32. Khan I., Gothwal A., Sharma A.K. et al. PLGA Nanoparticles and Their Versatile Role in Anticancer Drug Delivery. Crit. Rev. Ther. Drug. Carrier Syst. 2016. 33(2). Р. 159-93. doi: 10.1615/CritRevTherDrugCarrierSyst.2016015273.
33. Li X., Jiang X. Microfluidics for producing poly (lactic-co-glycolic acid)-based pharmaceutical nanoparticles. Adv. Drug. Deliv. Rev. 2018, Mar 15. 128. Р. 101-114. doi: 10.1016/j.addr.2017.12.015.
34. Li X.H., Lee J.H. Antibiofilm agents: A new perspective for antimicrobial strategy. J. Microbiol. 2017 Oct. 55(10). Р. 753-766. doi: 10.1007/s12275-017-7274-x.
35. Li Y., Heine S., Entian M. et al. NO-induced biofilm dispersion in Pseudomonas aeruginosa is mediated by an MHYT domain-coupled phosphodiesterase. J. Bacteriol. 2013 Aug. 195(16). Р. 3531-42. doi: 10.1128/JB.01156-12.
36. Lu Y., Slomberg D.L., Shah A., Schoenfisch M.H. Nitric oxide-releasing amphiphilic poly(amidoamine) (PAMAM) dendrimers as antibacterial agents. Biomacromolecules. 2013, Oct 14. 14(10). Р. 3589-98. doi: 10.1021/bm400961r.
37. Lu Y., Slomberg D.L., Sun B., Schoenfisch M.H. Shape- and nitric oxide flux-dependent bactericidal activity of nitric oxide-releasing silica nanorods. Small. 2013, Jun 24. 9(12). Р. 2189-98. doi: 10.1002/smll.201201798.
38. Metal-Organic Frameworks (MOF), или металлорганические координационные полимеры (МКОП) (Методическое пособие). Казань, 2013. 41 с.
39. Moore C.M., Nakano M.M., Wang T. et al. Response of Bacillus subtilis to nitric oxide and the nitrosating agent sodium nitroprusside. J. Bacteriol. 2004 Jul. 186(14). Р. 4655-64. PMID: 15231799.
40. Naghavi N., de Mel A., Alavijeh O.S. et al. Nitric oxide donors for cardiovascular implant applications. Small. 2013, Jan 14. 9(1). Р. 22-35. doi: 10.1002/smll.201200458.
41. Nairz M., Dichtl S., Schroll A. et al. Iron and innate antimicrobial immunity-Depriving the pathogen, defending the host. J. Trace Elem. Med. Biol. 2018 Jul. 48. Р. 118-133. doi: 10.1016/j.jtemb.2018.03.007.
42. Newell P.D., Monds R.D., O’Toole G.A. LapD is a bis-(3',5')-cyclic dimeric GMP-binding protein that regulates surface attachment by Pseudomonas fluorescens Pf0-1. Proc. Natl Acad. Sci. USA. 2009, Mar 3. 106(9). Р. 3461-6. doi: 10.1073/pnas.0808933106.
43. Pelgrift R.Y., Friedman A.J. Nanotechnology as a therapeutic tool to combat microbial resistance. Adv. Drug Deliv. Rev. 2013 Nov. 65(13–14). Р. 1803-15. doi: 10.1016/j.addr.2013.07.011.
44. Petrova O.E., Cherny K.E., Sauer K. The diguanylate cyclase GcbA facilitates Pseudomonas aeruginosa biofilm dispersion by activating BdlA. J. Bacteriol. 2015 Jan 1. 197(1). Р. 174-87. doi: 10.1128/JB.02244-14.
45. Petrova O.E., Sauer K. PAS domain residues and prosthetic group involved in BdlA-dependent dispersion response by Pseudomonas aeruginosa biofilms. J. Bacteriol. 2012 Nov. 194(21). Р. 5817-28. doi: 10.1128/JB.00780-12.
46. Ramezani M., Ebrahimian M., Hashemi M. Current Strategies in the Modification of PLGA-based Gene Delivery System. Curr. Med. Chem. 2017. 24(7). Р. 728-739. doi: 10.2174/0929867324666161205130416.
47. Rinaldo S., Giardina G., Mantoni F. et al. Beyond nitrogen metabolism: nitric oxide, cyclic-di-GMP and bacterial biofilms. FEMS Microbiol Lett. 2018, Mar 1. 365(6). doi: 10.1093/femsle/fny029.
48. Rinaldo S., Brunori M., Cutruzzolà F., Giardina G. N-oxide sensing and denitrification: the DNR transcription factors. Biochem. Soc. Trans. 2006 Feb. 34(Pt 1). Р. 185-7. doi: 10.1042/BST0340185.
49. Sherje A.P., Jadhav M., Dravyakar B.R., Kadam D. Dendrimers: A versatile nanocarrier for drug delivery and targeting. Int. J. Pharm. 2018, Sep 5. 548(1). Р. 707-720. doi: 10.1016/j.ijpharm.2018.07.030.
50. Suchyta D.J., Schoenfisch M.H. Encapsulation of N-Diazeniumdiolates within Liposomes for Enhanced Nitric Oxide Donor Stability and Delivery. Mol. Pharm. 2015, Oct 5. 12(10). Р. 3569-74. doi: 10.1021/acs.molpharmaceut.5b00248.
51. Sun B., Slomberg D.L., Chudasama S.L. et al. Nitric oxide-releasing dendrimers as antibacterial agents. Biomacromolecules. 2012, Oct 8. 13(10). Р. 3343-54. doi: 10.1021/bm301109c.
52. Tsai A.L., Martin E., Berka V., Olson J.S. How do heme-protein sensors exclude oxygen? Lessons learned from cytochrome c', Nostoc puntiforme heme nitric oxide/oxygen-binding domain, and soluble guanylyl cyclase. Antioxid. Redox Signal. 2012, Nov 1. 17(9). Р. 1246-63. doi: 10.1089/ars.2012.4564.
53. Wo Y., Brisbois E.J., Bartlett R.H., Meyerhoff M.E. Recent advances in thromboresistant and antimicrobial polymers for biomedical applications: just say yes to nitric oxide (NO). Biomater. Sci. 2016, Aug 19. 4(8). Р. 1161-83. doi: 10.1039/c6bm00271d.
54. Wood T.K. Biofilm dispersal: deciding when it is better to travel. Mol. Microbiol. 2014 Nov. 94(4). Р. 747-50. doi: 10.1111/mmi.12797.
55. Worley B.V., Schilly K.M., Schoenfisch M.H. Anti-Biofilm Efficacy of Dual-Action Nitric Oxide-Releasing Alkyl Chain Modified Poly(amidoamine) Dendrimers. Mol. Pharm. 2015, May 4. 12(5). Р. 1573-83. doi: 10.1021/acs.molpharmaceut.5b00006.
56. Yang L., Feura E.S., Ahonen M.J.R., Schoenfisch M.H. Nitric Oxide-Releasing Macromolecular Scaffolds for Antibacterial Applications. Adv. Healthc. Mater. 2018 Jul. 7(13). e1800155. doi: 10.1002/adhm.201800155.
57. Yang T., Zelikin A.N., Chandrawati R. Progress and Promise of Nitric Oxide-Releasing Platforms. Adv. Sci. (Weinh). 2018, Apr 23. 5(6). Р. 1701043. doi: 10.1002/advs.201701043.
58. Zhang H., Tian X.T., Shang Y. et al. Theranostic Mn-Porphyrin Metal-Organic Frameworks for Magnetic Resonance Imaging-Guided Nitric Oxide and Photothermal Synergistic Therapy. ACS Appl Mater Interfaces. 2018, Aug 29. 10(34). Р. 28390-28398. doi: 10.1021/acsami.8b09680.
59. Zheng Y., Tsuji G., Opoku-Temeng C., Sintim H.O. Inhibition of P. aeruginosa c-di-GMP phosphodiesterase RocR and swarming motility by a benzoisothiazolinone derivative. Chem. Sci. 2016, Sep 1. 7(9). Р. 6238-6244. doi: 10.1039/c6sc02103d.

/81-1.jpg)
/82-1.jpg)
/84-1.jpg)