Журнал "Гастроэнтерология" Том 53, №4, 2019
Вернуться к номеру
Агресивні і протективні фактори шлункового соку у хворих зі стенозом пілородуоденальної зони виразкового генезу
Авторы: Ратчик В.М., Тарабаров С.О., Руденко А.І., Пролом Н.В.
ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
Мета: оцінити агресивні і протективні властивості шлункового соку у хворих зі стенозом пілородуоденальної зони виразкового генезу залежно від його ступеня. Матеріали та методи. У відділенні хірургії органів травлення ДУ «Інститут гастроентерології НАМН України» за 2014–2019 роки обстежено 157 хворих із різним ступенем стенозу пілородуоденальної зони виразкового генезу. Із них для вивчення шлункової кислото- і слизопродукції було відібрано 92 пацієнти з компенсованим і субкомпенсованим ступенем стенозу, серед яких 71 чоловік, 21 жінка віком від 38 до 56 років, середній вік (45,3 ± 5,2) року. Хворі були розподілені на 2 групи залежно від ступеня стенозу: 1 група — 57 хворих із компенсованим стенозом, 2 група — 35 хворих із субкомпенсованим стенозом. Контрольну групу становили 20 практично здорових осіб. У шлунковому вмісті визначали: рівень pH, концентрацію пепсину, глікопротеїнів, гексозамінів, фукози, сіалових кислот. Результати. Аналіз вивчення рівнів кислото- і слизопродукції у хворих зі стенозом пілородуоденальної зони різної вираженості показав, що у пацієнтів із субкомпенсованим стенозом відмічалось збільшення частоти гіперацидної секреції на 21,1 % (р < 0,05), суттєве підвищення рівня пепсину (р < 0,05), зменшення концентрації загальних глікопротеїнів (р < 0,05) (за рахунок суттєвого зменшення концентрації фукози та гексозамінів) порівняно з пацієнтами з компенсованим стенозом, для яких була більш притаманна нормацидна секреція. Отримані нами дані щодо дисбалансу факторів агресії та захисту шлункового вмісту дозволили нам сформувати різні адаптаційно-компенсаторні варіанти їх співвідношень: 1 (гіперреактивний) — одночасне підвищення факторів агресії і захисту; 2 (компенсаторний) — підвищення рівня агресивних факторів, нормальна концентрація захисних факторів; 3 (декомпенсаторний) — підвищення рівня агресивних факторів, зниження рівня факторів захисту. Висновки. Виявлено, що прогресування ступеня стенозу пілородуоденальної зони виразкового генезу з компенсованого в субкомпенсований супроводжується вірогідним превалюванням факторів агресії над факторами захисту шлункового соку і виснаженням функціональних можливостей слизопродукуючого апарату шлунка. В результаті виділення трьох варіантів співвідношення факторів агресії та захисту шлункового соку (гіперреактивний, компенсаторний, декомпенсаторний) встановлено, що декомпенсаторний варіант вірогідно частіше зустрічається у пацієнтів із субкомпенсованим стенозом пілородуоденальної зони, а отже, ризик прогресування ступеня стенозу у таких хворих значно вищій порівняно з іншими варіантами співвідношень. Виявлені варіанти співвідношень факторів агресії та захисту у пацієнтів зі стенозом дають можливість диференційованого підходу до вибору тактики лікування (мініінвазивного ендоскопічного або комбінованого ендо- та лапароскопічного методу).
Цель: оценить агрессивные и протективные свойства желудочного сока у больных со стенозом пилородуоденальной зоны язвенного генеза в зависимости от его степени. Материалы и методы. В отделении хирургии органов пищеварения ГУ «Институт гастроэнтерологии НАМН Украины» за 2014–2019 годы обследовано 157 больных с различной степенью стеноза пилородуоденальной зоны язвенного генеза. Из них для изучения желудочной кислото- и слизепродукции было отобрано 92 пациента с компенсированным и субкомпенсированным стенозом, среди которых 71 мужчина, 21 женщина в возрасте от 38 до 56 лет, средний возраст (45,3 ± 5,2) года. Больные были разделены на 2 группы в зависимости от степени стеноза: 1 группа — 57 больных с компенсированным стенозом, 2 группа — 35 больных с субкомпенсированным стенозом. Контрольную группу составили 20 практически здоровых лиц. В желудочном содержимом определяли: уровень pH, концентрацию пепсина, гликопротеинов, гексозаминов, фукозы, сиаловых кислот. Результаты. Анализ изучения уровней кислото- и слизепродукции у больных со стенозом пилородуоденальной зоны различной выраженности показал, что у пациентов с субкомпенсированным стенозом отмечалось увеличение частоты гиперацидной секреции на 21,1 % (р < 0,05), существенное повышение уровня пепсина (р < 0,05), уменьшение концентрации общих гликопротеинов (р < 0,05) (за счет существенного уменьшения концентрации фукозы и гексозаминов) по сравнению с пациентами с компенсированным стенозом, которым была более свойственна нормацидная секреция. Полученные нами данные о дисбалансе факторов агрессии и защиты желудочного содержимого позволили нам сформировать различные адаптационно-компенсаторные варианты их соотношения: 1 (гиперреактивный) — одновременное повышение факторов агрессии и защиты; 2 (компенсаторный) — повышение уровня агрессивных факторов, нормальная концентрация защитных факторов; 3 (декомпенсаторный) — повышение уровня агрессивных факторов, снижение уровня факторов защиты. Выводы. Выявлено, что прогрессирование степени стеноза пилородуоденальной зоны язвенного генеза из компенсированного в субкомпенсированный сопровождается достоверным преобладанием факторов агрессии над факторами защиты желудочного сока и истощением функциональных возможностей слизепродуцирующего аппарата желудка. В результате выделения трех вариантов соотношения факторов агрессии и защиты желудочного сока (гиперреактивный, компенсаторный, декомпенсаторный) установлено, что декомпенсаторный вариант достоверно чаще встречается у пациентов с субкомпенсированным стенозом пилородуоденальной зоны, а значит, риск прогрессирования степени стеноза у таких больных значительно выше по сравнению с другими вариантами соотношений. Обнаруженные варианты соотношений факторов агрессии и защиты у пациентов со стенозом дают возможность дифференцированного подхода к выбору тактики лечения (мини-инвазивного эндоскопического или комбинированного эндо- и лапароскопического метода).
Background. The purpose was to evaluate the aggressive and protective properties of gastric juice depending on the severity of pyloroduodenal stenosis in patients with severe peptic ulcer disease. Materials and methods. In 2014–2019, 157 patients with different degrees of pyloroduodenal stenosis of ulcerative origin were examined at the Department of Surgery of the Digestive Organs of the State Institution “Institute of Gastroenterology of the National Academy of Medical Sciences of Ukraine”. Of these, 92 patients with compensated and subcompensated degree of stenosis were selected for the study of gastric acid and mucus production, among which there were 71 men and 21 women aged 38–56 years, mean age (45.3 ± 5.2) years. Patients were divided into 2 groups depending on the degree of stenosis: group 1 — 57 persons with compensated stenosis, group 2 — 35 patients with subcompensated stenosis. The control group consisted of 20 apparently healthy individuals. In gastric contents, we determined: pH level, concentration of pepsin, glycoproteins, hexosamines, fucose, sialic acids. Results. Analysis of the levels of acid and mucus production in piloroduodenal stenosis of varying severity showed that in patients with subcompensated stenosis, there was an increase in the frequency of hyperacid secretion by 21.1 % (p < 0.05), a significant increase in pepsin level (p < 0.05), a reduced concentration of total glycoproteins (p < 0.05) (due to a significant decrease in fucose and hexosamine levels), compared to patients with compensated stenosis for whom normacid secretion was more characteristic. The data we received regarding the imbalance of factors of aggression and protection of gastric contents allowed us to form various adaptation-compensatory variants of their ratios: 1 (hyperreactive) — simultaneous increase in the factors of aggression and protection; 2 (compensatory) — increased level of aggressive factors, normal concentration of protective factors; 3 (decompensatory) — increased level of aggressive factors, decreased content of protection factors. Conclusions. It is revealed that the progression of pyloroduodenal stenosis of ulcerative origin from compensated to subcompensated is accompanied by a reliable prevalence of aggression factors over the factors of protection of gastric juice and the depletion of the functional capabilities of the mucus-producing apparatus of the stomach. As a result of isolation of three variants of the ratio of the factors of aggression and protection of gastric juice (hyperreactive, compensatory, decompensatory), it is found that decompensatory type is more often found in patients with subcompensated pyloroduodenal stenosis, and thus the risk of stenosis progression in such patients is significantly higher than with other variants. The identified ratios of aggression and protection factors in patients with stenosis allow for a differentiated approach to the choice of treatment (minimally invasive endoscopic or combined endolaparoscopic method).
стеноз пілородуоденальної зони виразкового генезу; агресивні і протективні фактори шлункового соку
стеноз пилородуоденальной зоны язвенного генеза; агрессивные и протективные факторы желудочного сока
ulcerative stenosis of the pyloroduodenal zone; aggressive and protective factors of gastric juice
Вступ
Пілородуоденальний стеноз — одне з найсерйозніших ускладнень виразкової хвороби, при якому порушується евакуація вмісту з шлунка або дванадцятипалої кишки (ДПК), що призводить до порушення нутритивного статусу пацієнтів і розвитку тяжких розладів гомеостазу. Останніми роками частота пілородуоденального стенозу серед пацієнтів з виразковою хворобою варіює від 10 до 63,5 % випадків і в середньому становить 15–30 % [1, 2]. За даними різних авторів, грубі рубцеві ураження саме воротаря зустрічаються лише у 5–7 % випадків [1, 2], що потребує пілороруйнуючих або резекційних хірургічних втручань, в інших випадках є шанс для збереження пілоруса, що дає принципову можливість застосування органозберігаючих хірургічних втручань [2]. Завдяки сучасному розвитку ендоскопічних і лапароскопічних технологій стало можливим виконувати таким пацієнтам ізольовані ендоскопічні або мініінвазивні комбіновані втручання. Але все це потребує визначення показань щодо вибору методів хірургічного лікування таких пацієнтів з урахуванням патогенетичних особливостей цих ускладнень.
Відомо, що одним з факторів патогенезу виразкової хвороби і її ускладнень є порушення співвідношення агресивних і протективних факторів шлункового соку. Вивчення цього питання у хворих зі стенозом пілородуоденальної зони виразкового генезу викликає зацікавлення в плані сприяння диференційованому підходу до визначення методу лікування.
До основних факторів агресії шлункового соку відносять продукцію соляної кислоти (кислотопродукцію) та ферментопродукцію (вміст пепсину) [3–6, 11].
Основний фактор захисту в шлунковому соку — глікопротеїни, складовими яких є гексозаміни, фукози, сіалові кислоти. Основна їх роль полягає в захисті слизової оболонки шлунка (СОШ) від пошкоджуючої дії факторів агресії шлункового соку (соляної кислоти та ферментів) [7–10]. Але звертає на себе увагу той факт, що співвідношення компонентів глікопротеїнів при стенозах пілородуоденальної зони виразкового генезу залишається вивченим недостатньо. Робіт, присвячених цьому аспекту, в літературі вкрай мало, а ті, що надані, стосуються неускладнених форм виразкової хвороби, що спонукало нас провести комплексне вивчення функціонального стану секретопродукції СОШ, у тому числі дослідити агресивні та протективні компоненти шлункового соку у пацієнтів зі стенозом пілородуоденальної зони виразкового генезу, що дозволить визначитись з адекватним вибором тактики лікування пацієнтів з цією патологією.
Мета: оцінити агресивні і протективні властивості шлункового соку у хворих зі стенозом пілородуоденальної зони виразкового генезу залежно від його ступеня.
Матеріали та методи
У відділенні хірургії органів травлення ДУ «Інститут гастроентерології НАМН України» за 2014–2019 роки обстежено 157 хворих зі стенозом пілородуоденальної зони виразкового генезу. Із них 92 — із компенсованим та субкомпенсованим стенозом, 65 — із декомпенсованим стенозом. У зв’язку з тим, що при декомпенсованому стенозі дослідження секреторної функції є неможливим через велику кількість застійного вмісту в порожнині шлунка, нами проведено вивчення кислотопродукції у 92 пацієнтів із компенсованим і субкомпенсованим стенозом.
Серед обстежених 71 чоловік і 21 жінка віком від 38 до 56 років (середній вік (45,3 ± 5,2) року). Ступінь стенозу визначали на основі комплексної оцінки ендоскопічних, рентгенологічних і клінічних обстежень з використанням клінічної класифікації ступеня стенозу Ю.М. Панцирєва та А.А. Грінберга (1979) [2].
Залежно від ступеня стенозу хворі були розподілені на 2 групи: 1 група — 57 пацієнтів із компенсованим стенозом, 2 група — 35 хворих із субкомпенсованим стенозом. Контрольну групу становили 20 практично здорових осіб.
Під час виконання відеоезофагогастродуоденоскопії проводились огляд СОШ та аспірація шлункового соку в градуйовану пробірку.
У шлунковому вмісті визначали кислотопродукцію, яку вивчали за рівнем pH (норма якого становить 2,0–5,0) [3, 5, 6], концентрацію пепсину (норма 0,25–0,45 мг/мл) [11], концентрацію загальних глікопротеїнів (норма 0,10–0,25 мг/мл) та їх компонентів (сіалові кислоти, фукоза, гексозаміни) [12]. Рівень сіалових кислот вивчали за методом I. Warren, вміст фукози — за методом L. Dische, концентрацію гексозамінів у шлунковому соку — за методом R. Palmer [13, 14].
Статистичну обробку результатів досліджень проводили за допомогою комп’ютерних програм Statistica 6.0 та Microsoft Exсel 7.0. Оцінку статистичної значущості відмінностей між розподіленням результатів у групах порівняння здійснювали з використанням критерію Стьюдента і критерію χ2 [15, 16].
Результати та обговорення
Виявлено, що у більшості хворих зі стенозами пілородуоденальної зони (89,1 %) переважала гіперацидна і нормацидна секреція. РH шлункового соку в середньому становив (1,40 ± 0,15), що в 1,8 раза (р < 0,01) менше за контрольні величини (2,51 ± 0,35). Слід відзначити, що анацидна секреція з pH 7,5–7,9 спостерігалась у 10 пацієнтів (10,9 %), що у 3,1 раза більше порівняно з контрольною групою (р < 0,01) і може свідчити про функціональну виснаженість парієтальних клітин в умовах стенозу.
При порівнянні результатів між двома групами пацієнтів (табл. 1) відмічалось збільшення частоти гіперацидної секреції (рН < 2) у хворих 2 групи з субкомпенсованим стенозом на 21,1 % (р < 0,05) порівняно з пацієнтами 1 групи. У той же час частота нормацидної секреції при порівняльній оцінці за групами була більш характерною для хворих 1 групи.
Аналіз результатів вивчення концентрації пепсину у шлунковому соку виявив, що ферментоутворююча функція головних клітин була підвищеною більш ніж у 52 % хворих зі стенозом пілородуоденальної зони. При порівнянні результатів між двома групами пацієнтів (табл. 2) виявлено, що у хворих із субкомпенсованим стенозом підвищення концентрації пепсину відмічалось вірогідно частіше (р < 0,05).
При вивченні концентрації глікопротеїнів у шлунковому соку виявлено зростання їх рівня в 3,6 раза (р < 0,05) у 24 (26,1 %) пацієнтів зі стенозом. На нашу думку, це пов’язано з компенсаторним механізмом захисних факторів СОШ у відповідь на зростання факторів агресії. Однак у хворих з субкомпенсованим стенозом (табл. 3) відмічалось зменшення концентрації глікопротеїнів у середньому на 17,0 % (р < 0,05) порівняно з пацієнтами 1 групи. Це може свідчити про розвиток декомпенсації механізмів захисту СОШ при прогресуванні ступеня стенозу із компенсованого в субкомпенсований.
Що стосується кількісного вмісту складових глікопротеїнів у шлунковому соку (фукоз, сіалових кислот, гексозамінів), то відмічалось вірогідне зниження в 1,8 раза концентрації фукози до (0,62 ± 0,03) ммоль/л проти (1,14 ± ± 0,03) ммоль/л у групі контролю (р < 0,05). Рівень загальних глікопротеїнів знижувався до (0,61 ± 0,07) ммоль/л відносно контролю — (0,89 ± 0,03) ммоль/л.
Узагальнені результати дослідження змін концентрації фукози, сіалових кислот, глікопротеїнів у шлунковому соку у пацієнтів зі стенозом пілородуоденальної зони виразкового генезу і контрольної групи наведені на рис. 1.
Виявлено що рівень сіалових кислот був вірогідно вищим у всіх обстежених хворих, тоді як концентрація фукози зменшувалась майже в 2,2 раза (р < 0,04). Концентрація гексозамінів у шлунковому соку також зменшувалась у всіх обстежених хворих.
Така диспропорція компонентів глікопротеїнів може призводити до зменшення стійкості їх до дій протеолітичних ферментів та сприянню формуванню патологічного процесу в СО гастродуоденальної зони, а саме більш вираженому запаленню та формуванню виражених рубцевих змін. При порівнянні результатів між двома групами вірогідної різниці в кількісному складі глікопротеїнових компонентів не визначалось.
При аналізі співвідношення факторів агресії та захисту шлункового соку нами були сформовані такі адаптаційно-компенсаторні варіанти: 1 (гіперреактивний) — одночасне підвищення факторів агресії і захисту; 2 (компенсаторний) — підвищення рівня агресивних факторів, нормальна концентрація захисних факторів; 3 (декомпенсаторний) — підвищення рівня агресивних факторів, зниження рівня факторів захисту.
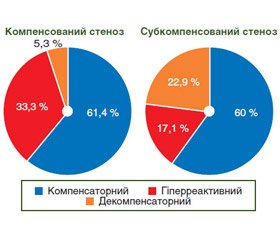
Аналіз частоти варіантів співвідношень агресивних та захисних факторів показав, що в обох групах досліджених хворих зі стенозом пілоробульбарної зони переважав компенсаторний варіант співвідношень факторів агресії та захисту (61,4 і 60,0 % відповідно) (рис. 2).
У той же час виявлено, що прогресування рівня стенозу пілородуоденальної зони супроводжується зменшенням в 2 рази кількості хворих з гіперреактивним варіантом співвідношень агресивних і захисних факторів (33,3 і 17,1 % відповідно) та збільшенням в 4 рази частоти декомпенсаторного варіанта (5,3 і 22,9 % відповідно). До того ж наявність у пацієнтів зі стенозом декомпенсаторного варіанта співвідношень збільшує у 5 разів ризик розвитку декомпенсованого стенозу пілородуоденальної зони (OR = 5,33, p < 0,05).
Отже, дефіцит і диспропорція агресивних і захисних компонентів шлункового соку у пацієнтів зі стенозом пілородуоденальної зони виразкового генезу може призводити до зменшення стійкості глікопротеїнів до дій протеолітичних ферментів та сприяти формуванню патологічного процесу в СО шлунка та ДПК, про що свідчить вірогідність існування у таких пацієнтів декомпенсації функціонального стану покривного епітелію СОШ, який втратив свої захисні адаптаційні властивості.
Таким чином, виявлені варіанти співвідношень факторів агресії та захисту шлункового соку у пацієнтів зі стенозом пілородуоденальної зони виразкового генезу дають можливість визначитись з вибором методу мініінвазивного лікування. Так, у хворих із декомпенсаторним варіантом співвідношень у зв’язку з високим ризиком рецидиву виразкової хвороби та можливим прогресуванням ступеня стенозу за рахунок підвищення рівня агресивних факторів та зниження рівня факторів захисту шлункового соку є доцільним вибирати комбінований лапаро- та ендоскопічний метод лікування. Пацієнтам з іншими варіантами співвідношень можливо використовувати ізольований ендоскопічний метод лікування, такий як ендоскопічна балонна пілородуоденопластика.
Висновки
1. Порівняльна характеристика компонентів шлункового соку хворих зі стенозом пілородуоденальної зони показала вірогідне превалювання факторів агресії над факторами захисту в шлунковому соку пацієнтів із субкомпенсованим стенозом.
2. Виснаження функціональних можливостей слизопродукуючого апарату шлунка, про що свідчить зменшення концентрації фукози та гексозамінів, вірогідно частіше спостерігалося у пацієнтів із субкомпенсованим стенозом пілородуоденальної зони.
3. У результаті виділення трьох варіантів співвідношення факторів агресії та захисту шлункового соку (гіперреактивний, компенсаторний, декомпенсаторний) встановлено, що декомпенсаторний варіант вірогідно частіше зустрічався у пацієнтів із субкомпенсованим стенозом пілородуоденальної зони, а отже, ризик прогресування ступеня стенозу у таких хворих є значно вищим порівняно з іншими варіантами співвідношень.
4. Виявлені варіанти співвідношень факторів агресії та захисту у пацієнтів зі стенозом дають можливість диференційованого підходу до вибору методу лікування (мініінвазивного ендоскопічного або комбінованого).
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
1. Дурлештер В.М. Тактика лечения больных декомпенсированным рубцово-язвенным стенозом двенадцатиперстной кишки. Кубанский научный медицинский вестник. 2013. № 7(142). С. 81-86.
2. Дидигов М.Т., Ключников О.Ю. Хирургическое лечение декомпенсированного рубцово-язвенного стеноза двенадцатиперстной кишки: резекция желудка или дуоденопластика. В мире научных открытий. 2013. № 11–2(47). С. 175-196.
3. Mittal R.K. Pathophysiolоgy of gastroesophageal reflux: motility factors. Journal of Gastroenterology. 2003. Vol. 38(Suppl. 15). P. 7-12.
4. Ramkumar D., Schulze K.S. Gastroduodenal motility. Сol. Opin. оf Gastroenterol. 2003. Vol. 19(6). P. 540-545.
5. Yandrapu H., Sarosiek J. Protective Factors of the Gastric and Duodenal Mucosa: An Overview. Curr. Gastroenterol. Rep. 2015. Vol. 17(6). P. 24.
6. Лазебник Л.Б., Лычкова А.Э. К вопросу о патогенезе гастроэзофагеальной рефлюксной болезни. Успехи физиологических наук. 2006. Т. 37, № 4. С. 57-81.
7. Кононов А.В. Цитопротекция слизистой оболочки желудка: молекулярно-клеточные механизмы. Рос. журн. гастроэнтерол., гепатол., колопроктол. 2010. № 3. С. 12-16.
8. Yusuf S., Nok A.J., Ameh D.A. et al. Correlation of gasric mucosal damage with sialic acid profile in rats: effect of hydrochloric acid, pepsin and hypertonic saline. Cell Biochem. Funct. 2004. Vol. 28(10). P. 263-284.
9. Aase S. Disturbances in the Balance Between Aggressive and Protective Factors in the Gastric and Duodenal Mucosa. Scandinavian Journal of Gastroenterology. 2016. Vol. 24. Р. 163.
10. Allen A., Flemstrom G. Gastroduodenal mucus bicarbonate barrier: protection against acid and pepsin. Am. J. Physiol. Cell Physiol. 2005. Vol. 288(1). Р. 1-19.
11. Milyukov V.E., Dolgov E.N., Nguen K.K., Polunin S.V. Factors of aggression and protection of the gastric mucosa in case of acute intestinal obstruction. Bulletin of experimental and clinical surgery. 2017. Vol. 5(3). P. 596-600.
12. Шелекетина И.И., Кожухарь Н.П., Минько А.Ф., Руденко А.И. Количественный метод определения гастромукопротеидов: Инф. письмо. К., 1983. Вып. 63. С. 3.
13. Руденко А.І., Майкова Т.В., Мосійчук Л.М. та ін. Клініко-лабораторна оцінка функціонального стану секреторних залоз шлунка: методичні рекомендації. К., 2004. С. 23.
14. Методы биохимических исследований / Под ред. М.И. Покровской. Л.: Ленинградский ун-т, 1982. 272 с.
15. Ланг Т.А., Сесик М. Как описывать статистику в медицине. Руководство для авторов, редакторов и рецензентов: пер. с англ. В.П. Леонова. М.: Практическая медицина, 2010. 485 с.
16. Мамаев А.Н. Основы медицинской статистики. М.: Практическая медицина, 2011. 128 с.

/9-1.jpg)
/10-1.jpg)
/10-2.jpg)