Журнал "Гастроэнтерология" Том 53, №3, 2019
Вернуться к номеру
Механизмы действия семикомпонентного растительного препарата Гастритол при лечении гастритов, язв и функциональной диспепсии. Часть 1. Эффекты в пределах пищеварительной системы
Авторы: А.В. Савустьяненко к.м.н.
Рубрики: Гастроэнтерология
Разделы: Справочник специалиста
Версия для печати
Мета даного огляду зводилася до того, щоб висвітлити механізми дії препарату Гастритол, виходячи з результатів експериментальних і клінічних досліджень 7 його рослинних компонентів. В огляд було включено 60 досліджень, переважно з бази Pubmed, що охоплювали період з 1975 до 2018 року включно. Критерії включення: 1) досліджується одна рослина, а не комбінації, щоб чіткіше простежити ефекти кожної конкретної рослини; 2) ефекти реалізуються в межах травної системи. Критерії виключення: дослідження серед пацієнтів із хіміо- та радіотерапією. Ефективність препарату Гастритол при лікуванні гастритів, виразок і функціональної диспепсії пов’язана з прямими ефектами в шлунково-кишковому тракті. Панель «Боротьба з виразкою» представлена здатністю препарату проявляти анти-H.pylori активність за рахунок пригнічення уреази, адгезії і зростання бактерії; зменшувати секрецію соляної кислоти (HCl) і збільшувати продукцію муцину; загоювати виразки, про що зазвичай судили по зниженню виразкового індексу. Панель «Боротьба з диспепсією» представлена спазмолітичним ефектом (боротьба з болем), антигіперперистальтичною і антисекреторною дією щодо кишкової рідини (боротьба з діареєю). Холеретичний ефект препарату, посилення секреції панкреатичних ферментів і постпрандіальної гіперемії сприяють нормалізації травлення. Крім того, ефективність препарату Гастритол при лікуванні гастритів, виразок і функціональної диспепсії пов’язана з непрямими ефектами в шлунково-кишковому тракті — зменшенням запальних процесів у ротовій порожнині та гепатопротекцією. Вплив препарату Гастритол на прямі й непрямі ефекти посилюється здатністю 7 трав, що входять до його складу, надавати протизапальну, антиоксидантну, імуномодулюючу дію, а також впливати на метаболізм амінокислот. Висновки. Багатогранні механізми дії препарату Гастритол дозволяють з успіхом включати його у схеми лікування гастритів, виразок і функціональної диспепсії у дорослих і дітей.
Целью данного обзора является рассмотрение механизмов действия препарата Гастритол, исходя из результатов экспериментальных и клинических исследований 7 его растительных компонентов. В обзор было включено 60 исследований, преимущественно из базы Pubmed, охватывавших период с 1975 до 2018 г. включительно. Критерии включения: 1) исследуется одно растение, а не комбинации, чтобы четче проследить эффекты каждого конкретного растения; 2) эффекты реализуются в пределах пищеварительной системы. Критерии исключения: исследования среди пациентов с химио- и радиотерапией. Результаты. Эффективность препарата Гастритол при лечении гастритов, язв и функциональной диспепсии связана с прямыми эффектами в желудочно-кишечном тракте. Панель «Борьба с язвой» представлена способностью препарата проявлять анти-H.pylori активность за счет ингибирования уреазы, адгезии и роста бактерий; уменьшать секрецию соляной кислоты (HCl) и увеличивать продукцию муцина; заживлять язвы, о чем обычно судили по снижению язвенного индекса. Панель «Борьба с диспепсией» представлена спазмолитическим эффектом (борьба с болью), антигиперперистальтическим и антисекреторным действием (борьба с диареей). Холеретический эффект препарата, усиление секреции панкреатических ферментов и постпрандиальной гиперемии способствуют нормализации пищеварения. Кроме того, эффективность препарата Гастритол при лечении гастритов, язв и функциональной диспепсии связана с непрямыми эффектами в желудочно-кишечном тракте — уменьшением воспалительных процессов в ротовой полости и гепатопротекцией. Влияние препарата Гастритол на прямые и непрямые эффекты усиливается способностью 7 входящих в его состав трав оказывать противовоспалительное, антиоксидантное, иммуномодулирующее действие, а также влиять на метаболизм аминокислот. Выводы. Многогранные механизмы действия препарата Гастритол позволяют с успехом включать его в схемы лечения гастритов, язв и функциональной диспепсии.
The purpose of this review was to consider the mechanisms of action of Gastritol based on the results of experimental and clinical studies of its 7 plant components. The review included 60 studies, mainly from the PubMed database, covering the period until the beginning of 2018. Inclusion criteria: 1) one herb is studied, not a combination, in order to trace the effects of each particular plant more clearly; 2) the effects are realized within the digestive system. Exclusion criteria: studies carried out among patients with chemo- and radiotherapy. Results. The effectiveness of Gastritol in the treatment of gastritis, ulcers and functional dyspepsia is associated with direct effects in the gastrointestinal tract. The panel “Management of ulcer” is presented by the ability of the drug to exhibit anti-H.pylori activity due to urease, adhesion and bacterial growth inhibition; to reduce secretion of hydrochloric acid and increase mucin production; to heal ulcers, which was usually judged by the reduction of the ulcer index. The panel “Management of dyspepsia” is presented by spasmolytic effect (pain control), antihyperperistaltic and antisecretory action (control of diarrhea). Choleretic effect of the drug, increased secretion of pancreatic enzymes and postprandial hyperemia contribute to the normalization of digestion. In addition, the effectiveness of Gastritol in the treatment of gastritis, ulcers and functional dyspepsia is associated with indirect effects in the gastrointestinal tract — a reduction of inflammatory processes in the oral cavity and hepatoprotection. The impact of Gastritol on direct and indirect effects is enhanced by the ability of 7 herbs included in its composition to have anti-inflammatory, antioxidant, immunomodulatory effects, and also to influence the metabolism of amino acids. Conclusions. Multifaceted mechanisms of Gastritol action allow us to include it successfully in the treatment regimens in gastritis, ulcers and functional dyspepsia in adults and children.
фітотерапія; Гастритол; гастрит; виразкова хвороба; функціональна диспепсія
фитотерапия; Гастритол; гастрит; язвенная болезнь; функциональная диспепсия
phytotherapy; Gastritol; gastritis; peptic ulcer; functional dyspepsia
Не многие растительные препараты широко изучены в клинических исследованиях. В этом смысле выгодное положение занимает Гастритол — комплексный препарат из 7 растений, производимый немецкой фармацевтической компанией «Доктор Густав Кляйн» (препарат представлен в Украине фармацевтической компанией «Альпен Фарма АГ»). В состав препарата Гастритол входят солодка голая (экстракт из корней), ромашка лекарственная (экстракт из цветков), полынь горькая (экстракт из травы), зверобой продырявленный (экстракт из травы), дягель лекарственный (экстракт из корней), лапчатка гусиная (экстракт из травы), кардобенедикт (экстракт из травы); его применяют при функциональной диспепсии, метеоризме, гастритах, включая хронический гиперацидный гастрит, а также в составе комплексного лечения язвенной болезни желудка и двенадцатиперстной кишки.
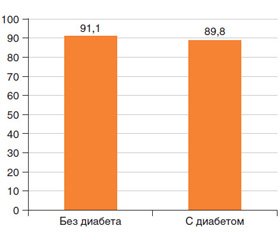
В 2016 г. в журнале «Phytotherapy Research» была опубликована работа исследователей из Германии, посвященная применению препарата Гастритол у пациентов с симптомами со стороны желудочно-кишечного тракта (ЖКТ): ощущением быстрого насыщения, вздутием живота, легкими спастическими болями в животе [1]. Исследование носило открытый характер, включало амбулаторных больных без сахарного диабета (n = 90) и с сахарным диабетом (n = 59). Авторы сообщают, что спустя 2 недели лечения препаратом Гастритол было отмечено значимое улучшение всех симптомов во всех исследуемых группах. Отвечая на вопрос относительно изменений выраженности симптомов со стороны органов ЖКТ («улучшение», «без изменений», «ухудшение»), очень высокий процент пациентов обеих групп охарактеризовал динамику своего состояния как «улучшение» — 91,1 % в группе без диабета и 89,8 % в группе с диабетом (рис. 1).
При проведении общей оценки эффективности лечения (5-балльная шкала от «очень хорошо» до «никакого эффекта») врачи отметили результаты лечения как «очень хорошо» и «хорошо» у 75,6 % пациентов в группе без диабета и 76,3 % в группе с диабетом. Аналогичные цифры в том случае, когда сами пациенты давали оценку, составили 76,7 и 67,8 % соответственно.
При проведении общей оценки переносимости (5-балльная шкала от «очень хорошо» до «очень плохо») отметку «очень хорошо» и «хорошо» в обеих группах выставили 84–88 % врачей и пациентов.
Учитывая высокую эффективность препарата Гастритол, обнаруживаемую в клинической практике, мы выполнили обзор с целью осветить механизмы действия Гастритола, исходя из результатов экспериментальных и клинических исследований 7 его растительных компонентов.
В обзор было включено 60 релевантных исследований, преимущественно из базы Pubmed, охватывавших период с 1975 по 2018 г. включительно [2–61]. Основное требование к статьям — чтобы исследовалось одно растительное средство, а не комбинации, чтобы легче было проследить эффекты каждого конкретного растения. Учитывались только те механизмы действия, которые реализовывались в пределах пищеварительной системы (то есть не затрагивали, например, нервную систему, эндокринную систему и т.д.). В обзор не включали исследования среди пациентов с химио- и радиотерапией.
Основные эффекты
На рис. 2 перечислены фармакологические эффекты препарата Гастритол, позволяющие успешно применять его при гиперацидном гастрите, язвенной болезни и функциональной диспепсии. В табл. 1 и 2 для каждого эффекта перечислены растения, которые его вызывают.
Панель «Борьба с язвой»
Анти-H.pylori эффект обеспечивается тремя основными механизмами — ингибированием уреазы, адгезии и роста H.pylori. Известно, что H.pylori использует аммиак, продукт одного из своих ферментов — уреазы — для того, чтобы нейтрализовать и защитить себя от кислой среды желудка. Поэтому ферментативная активность уреазы является эссенциальной для колонизации слизистой оболочки. Компоненты препарата Гастритол угнетают уреазу, препятствуя колонизации слизистой (дягель, кардобенедикт). В дополнение к этому Гастритол ингибирует адгезию H.pylori к слизистой оболочке желудка (солодка, дягель). Еще один механизм сводится к тому, что Гастритол оказывает тормозящее влияние на рост H.pylori (солодка, зверобой). Интересно, что флавоноиды, содержащиеся в солодке, — глабридин и глабрен — проявляли активность даже в отношении кларитромицин- и амоксициллин-резистентных штаммов данной бактерии.
Компоненты препарата Гастритол уменьшают секрецию соляной кислоты (HCl), препятствуя ее агрессивному воздействию на слизистую оболочку. Кроме того, повышается продукция муцина, который является естественным барьером для защиты слизистой от HCl и пепсина. В одной из работ сообщается, что влияние разных растений на содержание пепсина было скорее вариабельным и, по-видимому, не вносило вклада в антиульцерогенную активность.
Для многих компонентов препарата Гастритол была подтверждена непосредственная способность препятствовать образованию язв. Наиболее часто судили об этом по уменьшению язвенного индекса. В ходе выполнения этих исследований был обнаружен ряд интересных находок. Так, не было обнаружено достоверных лечебных различий в отношении H.pylori-ассоциированного гастрита между 18β-глицирретиновой кислотой (GRA), содержащейся в солодке, и комбинацией кларитромицин/амоксициллин/эзомепразол. Экстракт солодки проявлял противоязвенный эффект, сравнимый с таковым у циметидина, а в самой высокой дозе даже превосходил эффект омепразола. Экстракт зверобоя продемонстрировал противоязвенный эффект, аналогичный таковому у ранитидина.
Панель «Борьба с диспепсией»
Компоненты препарата Гастритол эффективно расслабляют гладкую мускулатуру желудка и кишечника, что позволяет бороться с болью и неприятными ощущениями в животе. Это действие может развиваться за счет блокады Са2+-каналов (солодка), активации К+-каналов вместе со слабой блокирующей активностью в отношении Са2+-каналов (ромашка), ингибирования кальциевого тока и фосфодиэстеразоподобных механизмов (зверобой). У лапчатки механизм этого эффекта продолжает изучаться.
Известно также, что спазмолитический эффект вносит вклад в уменьшение боли при язве.
Антигиперперистальтический эффект вместе с антисекреторным действием позволяет препарату Гастритол оказывать лечебное влияние при таких состояниях, как диарея и синдром раздраженного кишечника. Интересно, что экстракт полыни проявлял антигиперперистальтический эффект, равный таковому (или больше) у лоперамида, а экстракт зверобоя — равный лоперамиду.
Из табл. 2 видно, что некоторые из компонентов препарата Гастритол обладают холеретической активностью (увеличение выведения желчи и концентрации ее компонентов) и увеличивают секрецию панкреатических ферментов. Вместе с усилением постпрандиальной гиперемии это способствует нормализации процессов пищеварения.
В связи с увеличением притока крови к желудочно-кишечному тракту постпрандиальная гиперемия имеет также важное значение для заживления язв.
Панель «Борьба с патогенетическими механизмами»
Как указывалось выше, мы планируем подготовить отдельный обзор, который бы комплексно характеризовал противовоспалительные, антиоксидантные и иммуномодулирующие механизмы (рис. 2) компонентов препарата Гастритол. Однако некоторые из них, встретившиеся нам при подготовке настоящего обзора и касающиеся желудочно-кишечного тракта, приведены ниже.
Компоненты препарата Гастритол оказывают противовоспалительный эффект, проявляющийся уменьшением инфильтрации нейтрофилами и мононуклеарами, снижением уровня фактора некроза опухоли альфа (TNF-α), интерлейкина-1β (IL-1β), циклооксигеназы-2 (COX-2), индуцибельной синтазы оксида азота (iNOS) в тканях желудочно-кишечного тракта; снижением уровня TNF-α в крови.
Отдельно хотелось бы отметить, что Гастритол изменяет баланс между простагландином Е2 (PGE2) и лейкотриенами в тканях желудочно-кишечного тракта: увеличивает содержание PGE2, способствующего заживлению язв, и уменьшает концентрацию лейкотриенов, способствующих язвообразованию (солодка, ромашка, дягель).
Компоненты препарата Гастритол проявляют антиоксидантный эффект, выражающийся в уменьшении образования активных форм кислорода (ROS), перекисного окисления липидов (LPO), увеличении антиоксидантной мощности (AP), активности каталазы (CAT), повышении уровня гемоксигеназы-1 (HO-1), восстановленного глутатиона (GSH) в тканях желудочно-кишечного тракта; в уменьшении перекисного окисления липидов (LPO), повышении уровня восстановленного глутатиона (GSH), бета-каротина, ретинола в крови.
Важный вклад в поддержание целостности слизистой оболочки вносит способность компонентов Гастритола влиять на аминокислотный метаболизм (солодка) (рис. 2).
Дополнительные эффекты
Взаимосвязь между заболеваниями печени и болезнями желудочно-кишечного тракта
По состоянию на сегодняшний день выполнен ряд исследований, в которых подтверждена взаимосвязь между заболеваниями печени и болезнями желудочно-кишечного тракта. Ниже мы приводим пример одного такого исследования.
Авторы приводимой работы [62] осуществили проспективное исследование, направленное на оценку частоты пептических язв у пациентов с различными хроническими заболеваниями печени (n = 163). При проведении эндоскопии в общей сложности было обнаружено 24 пептические язвы (14,7 %), 12 дуоденальных, 8 желудочных и 4 препилорических. Язвы были обнаружены у 5 из 15 (33 %) пациентов с хроническим активным гепатитом В (с позитивными пробами на HBs-антиген), 10 из 46 (22 %) пациентов с алкогольной болезнью печени, 5 из 35 (14 %) пациентов с первичным билиарным циррозом, 2 из 19 (10 %) со смешанными хроническими заболеваниями печени, 2 из 25 (8 %) с криптогенным циррозом. Язвы не были обнаружены ни у кого из 23 пациентов с хроническим активным гепатитом В (с негативными пробами на HBs-антиген).
Гепатопротекторные эффекты препарата Гастритол
Несмотря на то что Гастритол разрабатывали и регистрировали для лечения заболеваний желудочно-кишечного тракта, он обладает также гепатопротективной активностью.
Компоненты препарата Гастритол уменьшают гистопатологические изменения в ткани печени (солодка), включая воспалительно-клеточную инфильтрацию (полынь), гепатоцеллюлярный апоптоз (солодка), гепатоцеллюлярный некроз (полынь); увеличивают митохондриальную активность и пролиферацию печеночных клеток (дягель).
Компоненты препарата Гастритол увеличивают активность аденозинтрифосфатазы (полынь), глюкозо-6-фосфатазы (полынь) в ткани печени; уменьшают активность аланинаминотрансферазы (ALT) (солодка, полынь, зверобой, дягель), аспартатаминотрансферазы (AST) (солодка, полынь, зверобой, дягель), щелочной фосфатазы (ALP) (солодка), лактатдегидрогеназы (LDH) (зверобой), понижают уровень билирубина (солодка) в крови.
Выше мы писали, что планируем подготовить отдельный обзор, который бы комплексно охватывал противовоспалительные, антиоксидантные и иммуномодулирующие механизмы компонентов препарата Гастритол. Однако некоторые из них, встретившиеся нам при подготовке настоящего обзора и касающиеся печени, приведены ниже.
Компоненты препарата Гастритол проявляют противовоспалительный эффект, проявляющийся снижением уровня TNF-α, IL-1β, IL-6, IFN-γ, COX-2, iNOS, ядерной транслокации NF-κB в ткани печени; снижением уровня TNF-α, IL-1 в крови.
Компоненты препарата Гастритол проявляют антиоксидантный эффект, проявляющийся уменьшением образования активных форм кислорода (ROS), перекисного окисления липидов (LPO), увеличением общей антиоксидантной способности (TAC), активности супероксиддисмутазы (SOD), глутатионпероксидазы (GPx), каталазы (CAT), понижением уровня гемоксигеназы-1 (HO-1), общего содержания тиоловых молекул (TTG), восстановленного глутатиона (GSH) в ткани печени.
Взаимосвязь между воспалительными заболеваниями полости рта и болезнями желудочно-кишечного тракта
К сегодняшнему дню выполнено большое количество исследований, в которых подтверждена взаимосвязь между воспалительными заболеваниями полости рта и болезнями желудочно-кишечного тракта. Ниже мы приводим пример одного такого исследования.
Авторы цитируемой работы [63] провели проспективное когортное исследование 49 120 мужчин в возрасте 40–75 лет, занятых в сфере медицины, ветеринарии или фармации (начало отслеживания когорты — 1986 г.). Раз в два года у них оценивали наличие периодонтита, утраты зубов и других факторов риска развития язвы желудка и двенадцатиперстной кишки. По результатам исследования в общей сложности было документировано 138 случаев язвы желудка и 124 случая язвы двенадцатиперстной кишки с доступной информацией о наличии/отсутствии H.pylori в течение 24 лет наблюдения. После поправки на факторы риска, включая курение и регулярное использование аспирина и нестероидных противовоспалительных средств, мужчины с периодонтитом и утратой костной ткани имели многофакторное отношение рисков (ОР) развития язв на уровне 1,62 (95% доверительный интервал (ДИ) 1,24–2,12). Периодонтит был связан с аналогичным риском развития язв, которые были скорее H.pylori-отрицательными (ОР 1,75; 95% ДИ 1,26–2,43), нежели H.pylori-положительными (ОР 1,40; 95% ДИ 0,87–2,24), а также скорее желудочными (ОР 1,75; 95% ДИ 1,21–2,53), чем двенадцатиперстной кишки (ОР 1,47; 95% ДИ 0,98–2,19). Был сделан вывод о том, что периодонтит связан с повышенным риском развития язв желудка и двенадцатиперстной кишки. Эта взаимосвязь может быть опосредована изменениями микробиома ротовой полости или желудочно-кишечного тракта и/или с системными воспалительными факторами (периодонтит связан с более высокими уровнями воспалительных факторов).
Влияние препарата Гастритол на воспалительные заболевания полости рта
Несмотря на то что Гастритол разрабатывали и регистрировали для лечения заболеваний желудочно-кишечного тракта, он обладает также способностью бороться с воспалительными процессами в полости рта. В отличие от обычно применяемых для этой цели местных средств, например ополаскивателей и гелей, Гастритол действует системно, всасываясь после перорального приема. Это не представляет большую проблему — к примеру, в одном из исследований было показано, что эффективность растительных препаратов после перорального приема может не только не снижаться, но даже превышать таковую при местном применении [64].
Компоненты препарата Гастритол уменьшают адгезию Streptococcus mutans (лапчатка), Porphyromonas gingivalis (солодка), ингибируют рост Streptococcus mutans (солодка, зверобой), Streptococcus sobrinus (зверобой), Streptococcus sanguis, Actinomyces viscosus (солодка), Enterococcus faecalis (солодка, зверобой), Lactobacillus spp., включая Lactobacillus plantarum (зверобой).
Компоненты препарата Гастритол уменьшают образование зубного налета (ромашка, полынь, лапчатка), кровоточивость десен (ромашка, полынь), отек (полынь, зверобой), жжение, боль (ромашка), повреждение гингивомукозальных тканей (зверобой), образование афтозных язв (ромашка), утрату костной ткани (солодка); увеличивают микроциркуляцию в периодонтальных тканях (полынь).
Компоненты препарата Гастритол проявляют противовоспалительный эффект, проявляющийся уменьшением нейтрофильной инфильтрации периодонтальных тканей, уровня провоспалительных цитокинов, iNOS, ядерной транслокации NF-κB в периодонтальных тканях.
Компоненты препарата Гастритол проявляют антиоксидантный эффект, проявляющийся уменьшением нитрирования тирозиновых мест в периодонтальных тканях.
Продолжение в следующем номере
1. Wegener T., Heimueller E. Treatment of Mild Gastrointestinal Disorders with a Herbal Combination: Results of a Non-interventional Study with Gastritol® Liquid. Phytother. Res. 2016. V. 30, № 1. P. 72-77.
2. Sasaki H., Suzuki N., Alshwaimi E. et al. 18β-glycyrrhetinic acid inhibits periodontitis via glucocorticoid-independent nuclear factor-κB inactivation in interleukin-10-deficient mice. J. Periodontal Res. 2010. V. 45, № 6. P. 757-763.
3. Sedighinia F., Safipour Afshar A., Soleimanpour S. et al. Antibacterial activity of Glycyrrhiza glabra against oral pathogens: an in vitro study. Avicenna J. Phytomed. 2012. V. 2, № 3. P. 118-124.
4. Hwang J.K., Shim J.S., Chung J.Y. Anticariogenic activity of some tropical medicinal plants against Streptococcus mutans. Fitoterapia. 2004. V. 75, № 6. P. 596-598.
5. Chen G., Zhu L., Liu Y. et al. Isoliquiritigenin, a flavonoid from licorice, plays a dual role in regulating gastrointestinal motility in vitro and in vivo. Phytother. Res. 2009. V. 23, № 4. P. 498-506.
6. Prajapati S.M., Patel B.R. A comparative clinical study of Jethimala (Taverniera nummularia Baker.) and Yashtimadhu (Glycyrrhiza glabra Linn.) in the management of Amlapitta. Ayu. 2015. V. 36, № 2. P. 157-162.
7. Khayyal M.T., el-Ghazaly M.A., Kenawy S.A. et al. Antiulcerogenic effect of some gastrointestinally acting plant extracts and their combination. Arzneimittelforschung. 2001. V. 51, № 7. P. 545-553.
8. Memariani Z., Hajimahmoodi M., Minaee B. et al. Protective Effect of a Polyherbal Traditional Formula Consisting of Rosa damascena Mill., Glycyrrhiza glabra L. And Nardostachys jatamansi DC., Against Ethanol-induced Gastric Ulcer. Iran J. Pharm. Res. 2017. V. 16, № 2. P. 694-707.
9. Cao D., Jiang J., You L. et al. The Protective Effects of 18β-Glycyrrhetinic Acid on Helicobacter pylori-Infected Gastric Mucosa in Mongolian Gerbils. Biomed. Res. Int. 2016. V. 2016. Article ID 4943793.
10. Jalilzadeh-Amin G., Najarnezhad V., Anassori E. et al. Antiulcer properties of Glycyrrhiza glabra L. extract on experimental models of gastric ulcer in mice. Iran J. Pharm. Res. 2015. V. 14, № 4. P. 1163-1170.
11. Yang Y., Wang S., Bao Y.R. et al. Anti-ulcer effect and potential mechanism of licoflavone by regulating inflammation mediators and amino acid metabolism. J. Ethnopharmacol. 2017. V. 199. P. 175-182.
12. Choi Y.H., Kim Y.J., Chae H.S., Chin Y.W. In vivo gastroprotective effect along with pharmacokinetics, tissue distribution and metabolism of isoliquiritigenin in mice. Planta Med. 2015. V. 81, № 7. P. 586-593.
13. Wittschier N., Faller G., Hensel A. Aqueous extracts and polysaccharides from liquorice roots (Glycyrrhiza glabra L.) inhibit adhesion of Helicobacter pylori to human gastric mucosa. J. Ethnopharmacol. 2009. V. 125, № 2. P. 218-223.
14. Fukai T., Marumo A., Kaitou K. et al. Anti-Helicobacter pylori flavonoids from licorice extract. Life Sci. 2002. V. 71, № 12. P. 1449-1463.
15. Kuang Y., Lin Y., Li K. et al. Screening of hepatoprotective compounds from licorice against carbon tetrachloride and acetaminophen induced HepG2 cells injury. Phytomedicine. 2017. V. 34. P. 59-66.
16. Nakagiri R., Oda H., Kamiya T. Small scale rat hepatocyte primary culture with applications for screening hepatoprotective substances. Biosci. Biotechnol. Biochem. 2003. V. 67, № 8. P. 1629-1635.
17. Lee C.H., Park S.W., Kim Y.S. et al. Protective mechanism of glycyrrhizin on acute liver injury induced by carbon tetrachloride in mice. Biol. Pharm. Bull. 2007. V. 30, № 10. P. 1898-1904.
18. Yang G., Wang L., Yu X. et al. Protective Effect of 18β-Glycyrrhetinic Acid against Triptolide-Induced Hepatotoxicity in Rats. Evid. Based Complement. Alternat. Med. 2017. V. 2017. Article ID 3470320.
19. Sharma A., Rathore H.S. Prevention of acetaminophen induced hepatorenal damage in mice with rhizomes of Glycyrrhiza glabra A histophysiological study. Anc. Sci. Life. 2011. V. 30, № 3. P. 72-77.
20. Wang C., Duan X., Sun X. et al. Protective effects of glycyrrhizic acid from edible botanical glycyrrhiza glabra against non-alcoholic steatohepatitis in mice. Food Funct. 2016. V. 7, № 9. P. 3716-3723.
21. Sil R., Ray D., Chakraborti A.S. Glycyrrhizin ameliorates metabolic syndrome-induced liver damage in experimental rat model. Mol. Cell Biochem. 2015. V. 409, № 1, 2. P. 177-189.
22. Raggi M.A., Bugamelli F., Nobile L. et al. The choleretic effects of licorice: identification and determination of the pharmacologically active components of Glycyrrhiza glabra. Boll. Chim. Farm. 1995. V. 134, № 11. P. 634-638.
23. Goes P., Dutra C.S., Lisboa M.R. et al. Clinical efficacy of a 1 % Matricaria chamomile L. mouthwash and 0.12 % chlorhexidine for gingivitis control in patients undergoing orthodontic treatment with fixed appliances. J. Oral Sci. 2016. V. 58, № 4. P. 569-574
24. Seyyedi S.A., Sanatkhani M., Pakfetrat A., Olyaee P. The therapeutic effects of chamomilla tincture mouthwash on oral aphthae: A Randomized Clinical Trial. J. Clin. Exp. Dent. 2014. V. 6, № 5. P. e535-e538.
25. Anheyer D., Frawley J., Koch A.K. et al. Herbal Medicines for Gastrointestinal Disorders in Children and Adolescents: A Systematic Review. Pediatrics. 2017. V. 139, № 6. PII: e20170062.
26. Mehmood M.H., Munir S., Khalid U.A. et al. Antidiarrhoeal, antisecretory and antispasmodic activities of Matricaria chamomilla are mediated predominantly through K(+)-channels activation. BMC Complement. Altern. Med. 2015. V. 15. Numb. of publ. 75.
27. Cemek M., Yilmaz E., Büyükokuroğlu M.E. Protective effect of Matricaria chamomilla on ethanol-induced acute gastric mucosal injury in rats. Pharm. Biol. 2010. V. 48, № 7. P. 757-763.
28. Moura Rocha N.F., Venâncio E.T., Moura B.A. et al. Gastroprotection of (–)-alpha-bisabolol on acute gastric mucosal lesions in mice: the possible involved pharmacological mechanisms. Fundam. Clin. Pharmacol. 2010. V. 24, № 1. P. 63-71.
29. Zaidi S.F., Muhammad J.S., Shahryar S. et al. Anti-inflammatory and cytoprotective effects of selected Pakistani medicinal plants in Helicobacter pylori-infected gastric epithelial cells. J. Ethnopharmacol. 2012. V. 141, № 1. P. 403-410.
30. Tavakol H.S., Farzad K., Fariba M. et al. Hepatoprotective effect of Matricaria chamomilla.L in paraquat induced rat liver injury. Drug Res. (Stuttg). 2015. V. 65, № 2. P. 61-64.
31. Krechina E.K., Belorukov V.V. Artemisia absinthium L. in complex treatment of inflammatory periodontal disease. Stomatologiia (Mosk). 2012. V. 91, № 4. P. 22-24.
32. McMullen M.K., Whitehouse J.M., Whitton P.A., Towell A. Bitter tastants alter gastric-phase postprandial haemodynamics. J. Ethnopharmacol. 2014. V. 154, № 3. P. 719-727.
33. Calzada F., Arista R., Pérez H. Effect of plants used in Mexico to treat gastrointestinal disorders on charcoal-gum acacia-induced hyperperistalsis in rats. J. Ethnopharmacol. 2010. V. 128, № 1. P. 49-51.
34. Shafi N., Khan G.A., Ghauri E.G. Antiulcer effect of Artemisia absinthium L. in rats. Pak. J. SciInd. Res. 2004. V. 47, № 2. P. 130-134.
35. Krebs S., Omer T.N., Omer B. Wormwood (Artemisia absinthium) suppresses tumour necrosis factor alpha and accelerates healing in patients with Crohn's disease. A controlled clinical trial. Phytomedicine. 2010. V. 17, № 5. P. 305-309.
36. Saxena M., Shukla S. Reversal of carbon tetrachloride-induced hepatic injury by aqueous extract of Artemisia absinthium in Sprague-Dawley rats. J. Environ. Pathol. Toxicol. Oncol. 2012. V. 31, № 4. P. 325-334.
37. Amat N., Upur H., Blazeković B. In vivo hepatoprotective activity of the aqueous extract of Artemisia absinthium L. against chemically and immunologically induced liver injuries in mice. J. Ethnopharmacol. 2010. V. 131, № 2. P. 478-484.
38. Gilani A.H., Janbaz K.H. Preventive and curative effects of Artemisia absinthium on acetaminophen and CCl4-induced hepatotoxicity. Gen. Pharmacol. 1995. V. 26, № 2. P. 309-315.
39. Baumann I.C., Glatzel H., Muth H.W. Studies on the effects of wormwood (Artemisia absinthium L.) on bile and pancreatic juice secretion in man. Z. Allgemeinmed. 1975. V. 51, № 17. P. 784-791.
40. Textbook of Natural Medicine / Edited by Pizzorno J.E., Murray M.T. Churchill Livingstone, an imprint of Elsevier Inc., 2013. 4th edition. 1944 p.
41. Paterniti I., Briguglio E., Mazzon E. et al. Effects of Hypericum Perforatum, in a rodent model of periodontitis. BMC Complement Altern. Med. 2010. V. 10. Numb. of publ. 73.
42. Süntar I., Oyardı O., Akkol E.K., Ozçelik B. Antimicrobial effect of the extracts from Hypericum perforatum against oral bacteria and biofilm formation. Pharm. Biol. 2016. V. 54, № 6. P. 1065-1070.
43. Khadem Nezhad S., Taghavi Zenouz A., Aghazadeh M., Samadi Kafil H. Strong antimicrobial activity of Hypericum perforatum L. against oral isolates of Lactobacillus spp. Cell. Mol. Biol. (Noisy-le-grand). 2017. V. 63, № 11. P. 58-62.
44. Gilani A.H., Khan A.U., Subhan F., Khan M. Antispasmodic and bronchodilator activities of St John's wort are putatively mediated through dual inhibition of calcium influx and phosphodiesterase. Fundam Clin Pharmacol. 2005. V. 19, № 6. P. 695-705.
45. Capasso R., Borrelli F., Aviello G. et al. Inhibitory effect of the herbal antidepressant St. John's wort (Hypericum perforatum) on rat gastric motility. Naunyn-Schmiedeberg's Arch. Pharmacol. 2008. V. 376, № 6. P. 407-414.
46. Mozaffari S., Esmaily H., Rahimi R. et al. Effects of Hypericum perforatum extract on rat irritable bowel syndrome. Pharmacogn. Mag. 2011. V. 7, № 27. P. 213-223.
47. Cayci M.K., Dayioglu H. Hypericum perforatum extracts healed gastric lesions induced by hypothermic restraint stress in Wistar rats. Saudi Med. J. 2009. V. 30, № 6. P. 750-754.
48. Zdunić G., Godevac D., Milenković M. et al. Evaluation of Hypericum perforatum oil extracts for an antiinflammatory and gastroprotective activity in rats. Phytother. Res. 2009. V. 23, № 11. P. 1559-1564.
49. Yeşilada E., Gürbüz I., Shibata H. Screening of Turkish anti-ulcerogenic folk remedies for anti-Helicobacter pylori activity. J. Ethnopharmacol. 1999. V. 66, № 3. P. 289-293.
50. Dost T., Ozkayran H., Gokalp F. et al. The effect of Hypericum perforatum (St. John's Wort) on experimental colitis in rat. Dig. Dis. Sci. 2009. V. 54, № 6. P. 1214-1221.
51. Hohmann M.S., Cardoso R.D., Fattori V. et al. Hypericum perforatum Reduces Paracetamol-Induced Hepatotoxicity and Lethality in Mice by Modulating Inflammation and Oxidative Stress. Phytother Res. 2015. V. 29, № 7. P. 1097-1101.
52. Bayramoglu G., Bayramoglu A., Engur S. et al. The hepatoprotective effects of Hypericum perforatum L. on hepatic ischemia/reperfusion injury in rats. Cytotechnology. 2014. V. 66, № 3. P. 443-448.
53. Genovese T., Mazzon E., Di Paola R. et al. Hypericum perforatum attenuates the development of cerulein-induced acute pancreatitis in mice. Shock. 2006. V. 25, № 2. P. 161-167.
54. Hensel A., Deters A.M., Müller G. et al. Occurrence of N-phenylpropenoyl-L-amino acid amides in different herbal drugs and their influence on human keratinocytes, on human liver cells and on adhesion of Helicobacter pylori to the human stomach. Planta Med. 2007. V. 73, № 2. P. 142-150.
55. Biglar M., Sufi H., Bagherzadeh K. et al. Screening of 20 commonly used Iranian traditional medicinal plants against urease. Iran J. Pharm. Res. 2014. V. 13 (Suppl.). P. 195-198.
56. Yeh M.L., Liu C.F., Huang C.L., Huang T.C. Hepatoprotective effect of Angelica archangelica in chronically ethanol-treated mice. Pharmacology. 2003. V. 68, № 2. P. 70-73.
57. Tomczyk M., Pleszczyńska M., Wiater A. Variation in total polyphenolics contents of aerial parts of Potentilla species and their anticariogenic activity. Molecules. 2010. V. 15, № 7. P. 4639-4651.
58. Youngken Jr. H.W., Neva A.C., Dauben Jr. H.J. et al. The muscle relaxant effects produced by Potentilla anserina extracts; fractionation studies. J. Am. Pharm. Assoc. 1949. V. 38, № 8. P. 448-451.
59. Morikawa T., Ninomiya K., Imura K. et al. Hepatoprotective triterpenes from traditional Tibetan medicine Potentilla anserina. Phytochemistry. 2014. V. 102. P. 169-181.
60. Morikawa T., Imura K., Akagi Y. et al. Ellagic acid glycosides with hepatoprotective activity from traditional Tibetan medicine Potentilla anserina. J. Nat. Med. 2018. V. 72, № 1. P. 317-325.
61. Can Z., Baltaş N., Keskin S. et al. Properties of Antioxidant and Anti-Inflammatory Activity and Phenolic Profiles of Şevketi Bostan (Cnicus benedictus L.) Cultivated in Aegean Region from Turkey. Turkish Journal of Agriculture. Food Science and Technology. 2017. V. 5, № 4. P. 308-314.
62. Kirk A.P., Dooley J.S., Hunt R.H. Peptic ulceration in patients with chronic liver disease. Dig. Dis. Sci. 1980. V. 25, № 10. P. 756-760.
63. Boylan M.R., Khalili H., Huang E.S. et al. A prospective study of periodontal disease and risk of gastric and duodenal ulcer in male health professionals. Clin. Transl. Gastroenterol. 2014. V. 5. Numb. of publ. e49.
64. Tanideh N., Namazi F., Andisheh Tadbir A. et al. Comparative assessment of the therapeutic effects of the topical and systemic forms of Hypericum perforatum extract on induced oral mucositis in golden hamsters. Int. J. Oral Maxillofac. Surg. 2014. V. 43, № 10. P. 1286-1292.

/68-1.jpg)
/69-1.jpg)
/68-2.jpg)