Журнал "Гастроэнтерология" Том 53, №3, 2019
Вернуться к номеру
Хвороби гепатобіліарної системи: фокус на раціональну гепатотропну терапію
Авторы: Філіппова О.Ю.
ДЗ «Дніпропетровська медична академія МОЗ України», м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Справочник специалиста
Версия для печати
Стаття присвячена огляду даних сучасної літератури і власних досліджень комбінованого використання урсодезоксихолевої кислоти й аргініну глутамату при патології гепатобіліарної системи. Хвороби гепатобіліарної системи сьогодні залишаються серйозною соціально-економічною проблемою охорони здоров’я в усьому світі. Вони посідають значне місце в структурі загальносоматичної патології в клініці внутрішньої медицини. Незважаючи на очевидні успіхи, досягнуті за останні десятиріччя в діагностиці й лікуванні захворювань гепатобіліарної системи, до сьогодні деякі питання остаточно не вирішені або є протиріччя з приводу їх лікування. Відомо, що не всі гепатотропні препарати відповідають вимогам до активних компонентів, що патогенетично впливають на ланки патологічних процесів в гепатобіліарному тракті. Обґрунтувати й систематизувати лікування захворювань гепатобіліарної системи при такому розмаїтті причин, що викликають ураження, досить важко. Принципи сучасної терапії більшості захворювань гепатобіліарної системи передбачають призначення комбінацій лікарських гепатотропних засобів. Одними з найбільш раціональних комбінацій фармакологічних агентів є препарати урсодезоксихолевої кислоти і аргініну глутамату. Дані фармакологічні засоби є препаратами з найбільшою доказовою базою клінічної ефективності, що значно перевищує таку в гепатотропних препаратів інших груп.
Статья посвящена обзору данных современной литературы и собственных исследований комбинированного использования урсодезоксихолевой кислоты и аргинина глутамата при патологии гепатобилиарной системы. Болезни гепатобилиарной системы сегодня остаются серьезной социально-экономической проблемой здравоохранения во всем мире. Они занимают значительное место в структуре общесоматической патологии в клинике внутренней медицины. Несмотря на очевидные успехи, достигнутые за последние десятилетия в диагностике и лечении заболеваний гепатобилиарной системы, до сих пор некоторые вопросы окончательно не решены или есть противоречия по поводу их лечения. Известно, что не все гепатотропные препараты соответствуют требованиям к активным компонентам, которые патогенетически влияют на звенья патологических процессов в гепатобилиарном тракте. Обосновать и систематизировать лечение заболеваний гепатобилиарной системы при таком разнообразии причин, вызывающих поражение, довольно трудно. Принципы современной терапии большинства болезней гепатобилиарной системы предусматривают назначение комбинаций лекарственных гепатотропных средств. Одними из наиболее рациональных комбинаций фармакологических агентов являются препараты урсодезоксихолевой кислоты и аргинина глутамата. Данные фармакологические средства являются препаратами с наибольшей доказательной базой клинической эффективности, значительно превышающей таковую гепатотропных препаратов других групп.
The article presents data of the modern literature and our studies on the combined use of ursodeoxycholic acid and arginine glutamate in the pathology of the hepatobiliary system. Hepatobiliary diseases today remain a major socio-economic health problem worldwide, occupying a significant place in the structure of general somatic pathology in the clinic of internal medicine. Despite the apparent successes achieved over the past decades in the diagnosis and treatment of diseases of the hepatobiliary system, some issues are still not entirely resolved or there are contradictions about their treatment. It is known that not all hepatotropic drugs meet the requirements for active components that pathogenetically affect the links of pathological processes, which occur in the hepatobiliary tract. It is rather difficult to justify and systematize the treatment of hepatobiliary diseases with such a variety of causes of damage. The principles of modern therapy for most diseases of the hepatobiliary system include the administration of combinations of hepatotropic drugs. One of the most rational combinations of pharmacological agents for these purposes are preparations of ursodeoxycholic acid and arginine glutamate. These pharmacological agents are the drugs with the most substantial evidence base of clinical efficacy, significantly exceeding that of hepatotropic medications of other groups.
гепатобіліарна система; гепатотропна терапія; урсодезоксихолева кислота; аргініну глутамат
гепатобилиарная система; гепатотропная терапия; урсодезоксихолевая кислота; аргинина глутамат
hepatobiliary system; hepatotropic therapy; ursodeoxycholic acid; arginine glutamate
Патологія гепатобіліарної системи (ГБС) на даний час залишається серйозною соціально-економічною проблемою охорони здоров’я в усьому світі. Вона посідає значне місце в структурі загальносоматичної патології в клініці внутрішньої медицини [1–3]. На сьогодні у світі кількість пацієнтів із різними проблемами ГБС перевищує 2 млрд осіб [4]. В Україні, як і в усьому світі, відзначається тенденція до неухильного зростання захворюваності ГБС [5–7]. Захворювання гепатобіліарного тракту різної етіології нерідко супроводжуються розвитком не тільки стеатогепатиту, фіброзу й цирозу печінки, а й кардіоваскулярними проблемами з порушенням ліпідного обміну. Це призводить до зниження професійної працездатності, загальної інвалідизації і смертності [8–10].
Центральною ланкою в розвитку патології ГБС є гепатоцит — основна клітина печінкової паренхіми. Негативний вплив на гепатоцити чинять такі патогенетичні фактори, як метаболічні порушення, віруси, токсичні речовини, автоімунні процеси. У більшості випадків зазначених ушкоджень печінкової паренхіми на роль відновлювачів гепатоцитів сьогодні претендують гепатотропні препарати [11, 12].
Незважаючи на очевидні успіхи, досягнуті за останні десятиріччя в діагностиці й лікуванні захворювань ГБС, до сьогодні деякі питання остаточно не вирішені, тривають дискусії щодо терапії. Розлади гепатобіліарного тракту є глобальною проблемою сучасної медицини. Це спонукає до створення нових лікарських препаратів, здатних впливати на різні патогенетичні ланки формування і хронізації хвороб ГБС [4, 6]. Загальновизнано, що далеко не всі гепатотропні препарати відповідають вимогам до активних компонентів, що патогенетично впливають на ланки патологічних процесів в гепатобіліарному тракті [12]. Безумовно, сучасна гепатотропна терапія повинна впливати на стеатоз, сприяти запобіганню оксидативного стресу, пригнічувати фіброгенез, стимулювати регенерацію печінки й фізіологічні процеси метаболізму. Оскільки при ураженні ГБС порушуються всі її функції, то доцільно використовувати комплексний підхід, що впливає на всі ключові ланки патогенезу при різних захворюваннях ГБС — і при цьому не відбувається антагоністичної взаємодії з препаратами базисної терапії [13–15]. Тому пошук нових комбінованих підходів до лікування хвороб ГБС є актуальною проблемою не лише сучасної гастроентерологічної практики, але й внутрішньої медицини в цілому.
У наш час серед хвороб ГБС неалкогольна жирова хвороба печінки (НАЖХП) посідає одне з провідних місць в усьому світі [16–18]. НАЖХП розглядається в рамках печінкового компонента метаболічного синдрому й асоційована з абдомінальним ожирінням, інсулінорезистентністю, дисліпідемією [10, 19, 20]. Підвищення індексу маси тіла понад 30 кг/м2 у 95–100 % випадків супроводжується розвитком стеатозу печінки і в 20–47 % — неалкогольного стеатогепатиту (НАСГ) [20, 21]. Спектр клініко-морфологічних захворювань, що вкладаються в поняття жирової хвороби печінки (ЖХП), — від стеатозу печінки, стеатогепатиту до фіброзу печінки (ФП), цирозу печінки (ЦП) і гепатоцелюлярної карциноми (ГЦК). НАЖХП посідає важливе місце в структурі не лише гастроентерологічної, але і загальнотерапевтичної патології в цілому [12]. Розвиток НАЖХП на тлі ожиріння і біліарної патології поглиблює розлад морфологічних параметрів. У зв’язку з цим своєчасне розпізнавання стеатозу, запобігання його трансформації в стеатогепатит, який може прогресувати з формуванням фіброзу й цирозу печінки й призводити до печінковоклітинної недостатності і навіть до ГЦК, є однією з актуальних медико-соціальних проблем [22, 23].
Сьогодні діагностика хронічних дифузних захворювань печінки в умовах терапевтичного або гастроентерологічного стаціонару становить певні труднощі. Частою складовою клінічної картини пацієнтів даної когорти є наявність симптомокомплексу дисфункціональних розладів біліарного тракту. При НАЖХП у 70 % пацієнтів відсутні відхилення в лабораторних аналізах [16, 18]. Оскільки печінкові тести неспецифічні й не завжди корелюють з гістологічними змінами (ушкодження, запалення, фіброз), біопсія печінки, точніше, її адекватна оцінка, посідає центральне місце в діагностиці ЖХП і визначенні ефективності терапевтичної дії гепатотропних препаратів. На даний час біопсія печінки є методом підтвердження або спростування стеатозу й залишається золотим стандартом визначення гістологічної активності НАЖХП і ступеня фіброзу [14, 22].
Серед уражень ГБС алкогольна хвороба печінки (АХП) посідає 2-ге місце після НАЖХП, випереджаючи навіть вірусні гепатити. У країнах Східної Європи ризик смертності від дії алкоголю в 7 разів перевищує аналогічний показник середземноморських країн, тож ця патологія має величезні медичні й соціальні наслідки [24]. Перебіг АХП суттєво не відрізняється від перебігу НАЖХП, поступово прогресуючи від стеатозу до різних стадій фіброзу, розвитку цирозу печінки й ГЦК. Спільними ланками патогенезу ЖХП неалкогольної і алкогольної етіології є реакції оксидативного стресу, ураження фосфоліпідів мембран мітохондрій, порушення ліпідного обміну на клітинному й системному рівнях [23]. Ожиріння й інсулінорезистентність посилюють прояви токсичних властивостей етанолу. Особливо несприятливий перебіг АХП відзначають у хворих на цукровий діабет, оскільки алкоголь впливає на метаболізм глюкози, збільшує кількість епізодів гіпоглікемії [25, 26].
Вірусні гепатити мають значну поширеність, украй високий відсоток хронізації, багаторічний безсимптомний або малосимптомний перебіг з подальшим бурхливим фіналом, відзначаються складністю терапії і відсутністю засобів специфічної профілактики [27]. Наріжним каменем проблеми вірусних гепатитів є індукований вірусами фіброз печінки як результат відкладення в ній позаклітинного матриксу внаслідок активації зірчастих клітин з подальшою трансформацією в ЦП і ГЦК. Останні стають безпосередньою причиною смерті хворого [28, 29]. На перше місце в лікуванні хворих на хронічні вірусні гепатити, які з яких-небудь причин не отримують етіотропну терапію, виходять гепатотропні препарати. Однією з істотних вимог до цієї групи препаратів є їх здатність чинити сприятливий вплив на процеси ФП [28].
Захворювання біліарного тракту (БТ) — надзвичайно поширена патологія внутрішніх органів. Вона спостерігається в 10–15 % населення розвинутих країн [1, 4]. Біліарна патологія в Україні посідає перше місце в структурі гастроентерологічних захворювань, при цьому щороку зростає кількість оперативних втручань на жовчному міхурі [5]. За поширеністю захворювання біліарної системи посідають друге місце після атеросклеротичних уражень [3]. БТ являє собою складну систему жовчовиділення. Вона включає загальний печінковий протік, жовчний міхур зі сфінктером Люткенса, загальний жовчний протік і біліарно-панкреатичну ампулу зі сфінктером Одді. Відмітною особливістю процесу жовчоутворення є його безперервність. Однак надходження жовчі в кишечник відбувається лише в процесі травлення. Порушення синхронності в роботі жовчного міхура й сфінктерного апарату лежать в основі дисфункціональних розладів БТ. Зміни пасажу жовчі втягують у патологічний процес печінку. Це може призводити до розвитку запального процесу, фіброзу, а при хронізації процесу — до розвитку гепатиту й ЦП [17].
Серед біліарної патології одне з головних місць посідає хронічний безкам’яний холецистит (ХБХ). ХБХ зазвичай є наслідком перенесеного гострого холециститу, проте часто відбувається формування хронічного уповільненого запального процесу в жовчному міхурі за наявності постійного вогнища інфекції або подразнення. У значній частці випадків це камені жовчного міхура, у 25–30 % випадків хронічний холецистит діагностується за відсутності каменів [5, 30]. Існують також додаткові фактори, що мають значення в розвитку ХБХ. Це функціональні порушення нервово-м’язового апарату жовчного міхура і жовчовивідних шляхів з явищами гіпо- і атонії, нервово-психічне перенапруження, гіподинамія, нерегулярний прийом їжі й незбалансоване харчування [31, 32].
Найчастіше виявляють холелітіаз і холестероз жовчного міхура. Основним методом їх лікування залишається холецистектомія. Потенційно оборотна початкова стадія холелітіазу характеризується підвищенням літогенності жовчі й зниженням скорочувальної здатності жовчного міхура — це біліарний сладж, який виявляється в загальній популяції без холелітіазу приблизно в 4 % населення [31]. Щороку у світі виконують 2,5 млн оперативних втручань з приводу патології БТ, що за частотою поступається місцем лише апендектомії [33]. Головною проблемою хірургічної тактики лікування є висока частота збереження скарг гастроентерологічного характеру після проведення операції: за даними різних авторів, їх відзначають у 5–74 % хворих. У середньому скарги залишаються в кожного другого пацієнта. Здебільшого подібні симптоми не пов’язані з хірургічними помилками або ускладненнями операції, а пояснюються розвитком постхолецистектомічного синдрому. Останній, за сучасними уявленнями, є аналогом функціональних порушень біліарного сфінктера Одді й спричинений розладами його скорочувальної функції, що перешкоджають нормальному відтоку жовчі й панкреатичного секрету за відсутності органічних перешкод [31, 33].
Останніми роками відзначається тенденція до збільшення захворюваності й поширеності первинного біліарного холангіту (ПБХ) [34]. За даними численних досліджень, ПБХ зустрічається переважно серед жінок. Результати досліджень показують, що по всьому світу приблизно 1 зі 1000 жінок понад 40 років має ПБХ [35, 36]. Співвідношення жінок і чоловіків варіює, у середньому воно становить 10 : 1. Поширеність ПБХ, а також захворюваність нерівномірно розподілені по всьому світу. Останнім часом провідну роль у виникненні ПБХ відводять взаємодії генетичних і епігенетичних факторів ризику з екологічними тригерами, що приводить до імуноопосередкованого пошкодження жовчних проток з подальшим розвитком холестазу. Усе це в підсумку викликає фіброз і ЦП [37, 38].
Первинний склерозуючий холангіт (ПСХ) — хронічне холестатичне захворювання печінки, що характеризується запаленням, облітерацією і фіброзом внутрішньо- і позапечінкових жовчних проток, розвитком біліарного цирозу, портальної гіпертензії і печінкової недостатності. Етіологія ПСХ невідома [35]. Припускається участь як генетичних, так і набутих факторів. Можливі етіопатогенетичні чинники — портальна бактеріємія, кишкові токсини, токсичні жовчні кислоти, токсичний вплив міді, вірусна інфекція, генетична схильність, імунні механізми, ішемічне пошкодження артеріол [39]. У хворих на ПСХ підвищений рівень IgМ, збільшений вміст циркулюючих імунних комплексів і знижене їх виведення, прискорений обмін комплементу, підвищена автореактивність супресорів/цитотоксичних Т-лімфоцитів периферичної крові і експресія антигенів HLA II класу на епітелії жовчних проток [40].
Обґрунтувати й систематизувати лікування захворювань ГБС при такому розмаїтті причин, що викликають ураження, досить складно. Сучасна тактика лікування захворювань ГБС недосконала, існує необхідність вибору різних варіантів, які ґрунтуються на наявності або відсутності протоколу для даної патології, а також на індивідуальному підході до кожного пацієнта. Тому очевидний науковий інтерес до оптимального комбінування гепатотропних засобів, здатних уповільнити прогресування захворювань ГБС. Принципи сучасної терапії більшості захворювань ГБС передбачають призначення комбінацій лікарських гепатотропних засобів [14, 15]. Одними з найбільш раціональних комбінацій фармакологічних агентів при патології ГБС є препарати урсодезоксихолевої кислоти (УДХК) і аргініну глутамату. Дані фармакологічні засоби є препаратами з найбільшою доказовою базою клінічної ефективності, що значно перевищує таку в гепатотропних препаратів інших груп [41, 42].
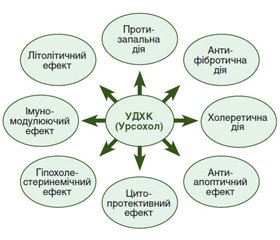
Без сумніву, препарати УДХК відіграють значну роль у лікуванні захворювань ГБС, за властивостями вони максимально наближені до «універсальних» гепатотропних препаратів. Пріоритетність використання УДХК як особливого компонента терапії обумовлена не тільки доведеною високою клінічною ефективністю застосування. УДХК за своїми властивостями є ендогенним гепатотропним засобом. На частку УДХК як жовчної кислоти припадає до 5 % пулу жовчних кислот в організмі людини. Призначення пацієнтові УДХК забезпечує надходження в організм фізіологічної гепатотропної біологічної субстанції, а не чужорідної речовини. Цим можна пояснити високий профіль безпеки препарату [43]. За 60 років клінічного використання показання до призначення УДХК значно розширилися. Спочатку УДХК була рекомендована для хімічної літотрипсії та лікування рефлюкс-гастриту. У даний час УДХК вважається стандартом терапії багатьох хронічних дифузних захворювань печінки і, звичайно, холестатичних захворювань печінки з автоімунним компонентом, а також вірусних гепатитів у комплексному лікуванні гострих і хронічних форм, при первинному біліарному холангіті, первинному склерозуючому холангіті [44]. Великої клінічної значимості препарати УДХК набули в лікуванні й профілактиці токсичних уражень печінки, зокрема лікарських. Включення УДХК як гепатотропного препарату в терапію основного захворювання може сприяти запобіганню наслідкам ксенобіотичного лікарського навантаження на гепатоцити й підвищувати ефективність лікування в цілому [45].
У пацієнтів з ожирінням УДХК у дозі 500 мг/добу і більше протягом 3–6 місяців прийнята як засіб профілактики холестеринового холелітіазу на тлі низькокалорійної дієти, після баріатричних втручань [46].
Останніми роками при злоякісних новоутвореннях печінки отримані дані, які демонструють, що профілактичний курс лікування до променевого впливу, який включає препарати УДХК, захищає печінку від променевого ураження, значно й вірогідно знижуючи розміри й поширеність фокусної радіаційної печінкової паренхіми [47].
При лікуванні гастритів з рефлюксом жовчі необхідно пам'ятати, що на відміну від таблетованих форм УДХК, Урсохол® в капсулах може застосовуватись при цій патології. З огляду на це обґрунтованим є призначення лікарського засобу Урсохол® виробництва фармацевтичної фірми «Дарниця» (рис. 1).
Отже, завдяки купіруванню клінічної симптоматики, а також цілій низці біохімічних ефектів, спрямованих на цитопротекцію, призначення УДХК (Урсохолу®) слід вважати патогенетично обґрунтованим при патології ГБС. Цитопротективний ефект у поєднанні з антиапоптичним ефектом, у тому числі завдяки стабілізації мембран мітохондрій, робить застосування УДХК при патологічних станах особливо привабливим як спробу нівелювати можливі канцерогенні проблеми гепатобіліарного тракту.
Дози УДХК залежать від індексу маси тіла й можуть варіювати залежно від патології ГБС від 5 до 30 мг/кг маси тіла на добу. Тривалість терапії визначається окремо залежно від нозології.
Гепатотропні препарати з антиоксидантними властивостями покращують функціональний стан печінки і посідають головне місце в лікуванні хворих із патологією ГБС. Вони являють собою комплексні препарати, що складаються з декількох речовин [42, 50]. Головними властивостями препаратів, що складаються з амінокислот, є корекція печінкового білкового й жирового обміну, а також відновлення процесів мікроциркуляції в печінці. Їх застосування показане в першу чергу при алкогольному й неалкогольному ураженні печінки, причому на стадії не тільки жирового гепатозу, але й гепатиту і навіть цирозу [51]. Завдяки участі амінокислот (аргініну) в нейтралізації аміаку підвищується детоксикаційна функція печінки, зменшується накопичення метаболітів у печінці. Завдяки участі аргініну в синтезі аденозинтрифосфату накопичується енергія в тканинах, посилюється регенерація в печінці. Аргінін виявляє антиоксидантну дію — зменшуються процеси перекисного окислення ліпідів, покращується мікроциркуляція й збільшується портальний кровотік, прискорюється виведення кінцевих ендотоксинів [50]. Глутамінова кислота — замінна амінокислота, що бере участь у процесах переамінування амінокислот в організмі, у вуглеводному обміні, стимулює окиснювальні процеси, запобігає зниженню окисно-відновного потенціалу, сприяє знешкодженню й виведенню з організму аміаку, підвищує стійкість організму до гіпоксії, проявляє гепатопротекторну дію [42]. Разом з цим глутамінова кислота й аргінін вступають у процес утворення піримідинів, пуринів і поліамінів, опосередковано стимулюють синтез нуклеїнових кислот і білка [51]. Аргініну глутамат має гепатотропні й антитоксичні властивості, надає антиоксидантний, антигіпоксичний і мембраностабілізуючий ефекти, позитивно впливає на процеси енергозабезпечення в гепатоцитах. Вивчалася роль аргініну глутамату у хворих на жирову хворобу печінки на тлі хронічних холециститів [50]. У роботах дослідників було переконливо доведено, що аргініну глутамат є ефективним засобом патогенетичної терапії стеатогепатитів, оскільки йому притаманні потужні мембраностабілізуючі властивості, він усуває прояви цитолітичного, холестатичного, мезенхімально-запального синдромів, підсилює білоксинтезуючу й дезінтоксикаційну функції печінки завдяки антигіпоксантним, ліпідокоригувальним властивостям, здатності усунути ендотеліальну дисфункцію, інсулінорезистентність і загальмувати прогресування ФП [42, 51]. Отримано переконливі докази гіпохолестеринемічної дії, що зумовлено властивостями аргініну як джерела оксиду азоту [50]. Включення аргініну глутамату вважається патогенетично обґрунтованим, доцільним і клінічно перспективним, що дозволяє рекомендувати застосування цього засобу в комплексній терапії хворих із поєднаною хронічною патологією ГБС [51].
Аргітек (аргініну глутамат), лікарський засіб від фармацевтичної фірми «Дарниця», що впливає на всі основні ланки патогенезу гепатитів алкогольної та неалкогольної етіології, печінкової енцефалопатії. Це потужний антиоксидант, здатний нормалізувати енергетичні й метаболічні порушення, чинити гепатотропну дію, що в результаті проявляється цитопротекторним ефектом (рис. 2).
Завдяки лікарській формі у вигляді готової стерильної інфузії для парентерального введення застосування Аргітеку є більш зручним для медичного персоналу порівняно з аналогами в ампулах [52]. Лікарський засіб признається дорослим внутрішньовенно краплинно 2 рази на добу по 1 флакону (2 г) зі швидкістю 60–70 крапель за хвилину. У тяжких випадках добову дозу лікарського засобу підвищують до 3–4 флаконів (що відповідає 6–8 г), розподілених на 2 введення. Аргітек має добру переносимість і практично не викликає розвитку побічних ефектів. Аргітек покращує перебіг вірусного гепатиту: нівелюються прояви цитолітичного синдрому, знижується рівень білірубіну й трансаміназ у сироватці крові, нормалізується синтез білка в печінці. Комплексна терапевтична дія препарату при гострому гепатиті перешкоджає хронізації запального процесу. Аргітек запобігає розвитку печінкової коми у хворих на ЦП [52].
Аргітек рекомендований до застосування в комплексній терапії гострих і хронічних станів різної етіології — вірусних гепатитів, отруєнь гепатотропними речовинами, цирозу печінки, печінкової енцефалопатії, прекоми й коми, що супроводжуються порушенням обміну азоту й гіперамоніємією [52].
Аргітек показаний у терапії гострої алкогольної інтоксикації середнього й тяжкого ступеня, у тому числі алкогольної енцефалопатії. Також він застосовується в складі комплексної терапії розладів, що виникли внаслідок гострого алкогольного отруєння. Крім того, що Аргітек є безпечним і ефективним лікарським засобом з підтвердженою лікувальною дією, він також відзначається економічною доступністю.
За результатами власних досліджень: у 100 хворих на НАСГ у поєднанні з патологією БТ (хронічний безкам’яний холецистит, хронічний калькульозний холецистит, постхолецистектомічний синдром) і ожирінням (рис. 3) на тлі модифікації способу життя і стандартного лікування згідно з протоколами надання медичної допомоги при НАСГ і хронічних холециститах були призначені УДХК у дозі 15 мг · кг–1 · д–1 і аргініну глутамат у перші 5 днів внутрішньовенно краплинно по 2 г двічі на добу, наступні 20 днів пацієнти вживали таблетовані форми. Повна клініко-біохімічна ремісія спостерігалася в 78,8 % хворих 3л групи (n = 33).
Водночас у пацієнтів інших груп повна клініко-біохімічна ремісія відбувалася в 20,6 % на тлі стандартного лікування в 1л групі (n = 34) і в 54,5 % у 2л групі (n = 33) при одночасному застосуванні стандартного лікування і УДХК у дозі 15 мг · кг–1 · д–1. Динамічне спостереження за хворими проводили 6 місяців: медикаментозне лікування в усіх групах хворих тривало 30 днів, модифікація способу життя (фізичні навантаження й дієтичні рекомендації) — протягом 6 місяців. Отримані власні дані свідчать про високу ефективність приєднання до стандартної терапії УДХК, аргініну глутамату, добру ефективність при застосуванні УДХК і стандартної терапії та тенденцію до покращення здоров’я хворих на тлі стандартної терапії порівняно з хворими інших груп [15].
Отже, подібна стратегія комплексної етіотропної, гепатотропної, антигіпоксичної, дезінтоксикаційної, антиоксидантної фармакотерапії при хворобах ГБС різної етіології з включенням препаратів УДХК (Урсохолу®) і аргініну глутамату (Аргітек) дозволить оптимізувати терапевтичні схеми й покращити якість життя і прогноз пацієнтів із хворобами ГБС.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів і власної фінансової зацікавленості при підготовці даної статті.
1. Peery A.F., Dellon E.S., Lund J. et al. Burden of gastrointestinal disease in the United States: 2012 update. Gastroenterology. 2012 Nov. 143(5). 1179-1187.e3. doi: 10.1053/j.gastro.2012.08.002.
2. Organisation for Economic Cooperation and Development (OECD). OECD Reviews of Health Systems: Kazakhstan 2018. Paris, France: OECD Publishing; 2018. 220 p.
3. Петрунько И.Л., Соклакова В.И., Черкасова А.А., Сергеева Н.В. Заболевания органов пищеварения: первичная инвалидность в Иркутской области. Acta Biomedica Scientifica. 2017. 2(113). 44-47.
4. Беляева Ю.Н. Болезни органов пищеварения как медико-социальная проблема. Бюллетень медицинских интернет-конференций. 2013. 3(3). 566-568.
5. Степанов Ю.М., Скирда И.Ю., Петишко О.П. Болезни органов пищеварения: актуальная проблема клинической медицины. Гастроэнтерология. 2019. 53(1). 1-6. doi: 10.22141/2308-2097.53.1.2019.163450.
6. Чепелевська Л.А., Слабкий В.Г. Роль хвороб органів травлення в падінні трудового потенціалу України. Економіка і право охорони здоров’я. 2017. 1(5). 10-17.
7. Чепелевська Л.А., Крапівіна А.А. Особливості смертності населення України від окремих хвороб органів травлення. Україна. Здоров’я нації. 2013. 1. 54-58.
8. Дзюба А.Н., Чепелевська Л.А., Карамзіна Л.А. Сучасні тенденції смертності населення працездатного віку від хвороб органів травлення. Вісник соціальної гігієни та організації охорони здоров’я України. 2016. 1. 24-29.
9. Iqbal U., Perumpail B.J., Akhtar D., Kim D., Ahmed A. The epidemiology, risk profiling and diagnostic challenges of nonalcoholic fatty liver disease. Medicines (Basel). 2019 Mar 18. 6(1). pii: E41. doi: 10.3390/medicines6010041.
10. Grechanyk M., Grechanyk N., Kuryata A. Lipid metabolism, endothelial function, parameters of elastic properties and inflammation in patients with coronary heart disease combined with hepatic steatosis depending from body mass index. Atherosclerosis. 2018. 275. 148. DOI: https://doi.org/10.1016/j.atherosclerosis.2018.06.438.
11. Hadizadeh F., Faghihimani E., Adibi P. Nonalcoholic fatty liver disease: diagnostic biomarkers. World J. Gastrointest Pathophysiol. 2017. 8(2). 11-26. doi: 10.4291/wjgp.v8.i2.11.
12. European Association for the Study of the Liver (EASL); European Association for the Study of Diabetes (EASD); European Association for the Study of Obesity (EASO). EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. J. Hepatol. 2016 Jun. 64(6). 1388-402. doi: 10.1016/j.jhep.2015.11.004.
13. Konerman M.A., Walden P., Joseph M., Jackson E.A., Lok A.S., Rubenfire M. Impact of a structured lifestyle programme on patients with metabolic syndrome complicated by non-alcoholic fatty liver disease. Aliment. Pharmacol. Ther. 2019 Feb. 49(3). 296-307. doi: 10.1111/apt.15063.
14. Chalasani N., Younossi Z., Lavine J.E. et al. The diagnosis and management of nonalcoholic fatty liver disease: practice guidance from the American Association for the Study of Liver Diseases. Hepatology. 2018 Jan. 67(1). 328-357. doi: 10.1002/hep.29367.
15. Філіппова О.Ю. Динаміка антропометричних і біохімічних показників під впливом різних схем лікування у хворих на неалкогольну жирову хворобу печінки у поєднанні з ожирінням і патологією біліарного тракту. Врачебное дело. 2017. 5–6(1143). 54-61.
16. Nan Y.M., Fu N., Li W.C., Kong L.L. et al. An interpretation of the AASLD practice guideline on the diagnosis and management of nonalcoholic fatty liver disease in 2017. Zhonghua Gan. Zang. Bing. Za. Zhi. 2017. 25(9). 687-694. doi: 10.3760/cma.j.issn.1007-3418.2017.09.008.
17. Степанов Ю.М., Філіппова А.Ю. Вплив маси тіла та супутньої патології біліарного тракту на розвиток і прогресування ліпідних порушень у хворих на неалкогольну жирову хворобу печінки в поєднанні з ожирінням. Сучасна гастроентерологія. 2016. 4(90). 7-15.
18. Ahmed A., Wong R.J., Harrison S.A. Nonalcoholic Fatty Liver Disease Review: Diagnosis, Treatment, and Outcomes. Clin. Gastroenterol. Hepatol. 2015. 13(12). 2062-2070. doi: 10.1016/j.cgh.2015.07.029.
19. Bekaert M., Verhelst X., Geerts A., Lapauw B., Calders P. Association of recently described adipokines with liver histology in biopsy-proven non-alcoholic fatty liver disease: a systematic review. Obes. Rev. 2016 Jan. 17(1). 68-80. doi: 10.1111/obr.12333.
20. Wong R.J., Ahmed A. Obesity and non-alcoholic fatty liver disease: Disparate associations among Asian populations. World J. Hepatol. 2014 May 27. 6(5). 263-73. doi: 10.4254/wjh.v6.i5.263.
21. Della Corte C., Mazzotta A.R., Nobili V. Fatty liver disease and obesity in youth. Curr. Opin. Endocrinol. Diabetes Obes. 2016. 23(1). 66-71. doi: 10.1097/MED.0000000000000221.
22. Степанов Ю.М., Філіппова А.Ю. Морфологічні основи оцінки стеатозу, стеатогепатиту та фіброзу у хворих на неалкогольну жирову хворобу печінки в поєднанні з ожирінням і патологією біліарного тракту. Гастроентерологія. 2017. 3(51). 196-204. doi: 10.22141/2308-2097.51.3.2017.112636 (in Ukrainian).
23. Filippova A. Non-alcoholic and alcoholic fatty liver disease in patients suffering from biliary tract pathology and obesity: clinical and functional aspects. Modern Science — Moderni vĕda. 2015. 4. 134-149.
24. Thiele M., Rausch V., Fluhr G. Controlled attenuation parameter and alcoholic hepatic steatosis: Diagnostic accuracy and role of alcohol detoxification. J. Hepatol. 2018. pii: S0168-8278(18)30016-3. doi: 10.1016/j.jhep.2017.12.029.
25. Lau K., Baumeister S.E., Lieb W. The combined effects of alcohol consumption and body mass index on hepatic steatosis in a general population sample of European men and women. Aliment. Pharmacol. Ther. 2015. 41(5). 467-476. doi: 10.1111/apt.13067.
26. Toshikuni N., Tsutsumi M., Arisawa T. Clinical differences between alcoholic liver disease and nonalcoholic fatty liver disease. World J. Gastroenterol. 2014. 20(26). 8393-8406. doi: 10.3748/wjg.v20.i26.8393.
27. Allen A.M., Kim W.R. Epidemiology and Healthcare Burden of Acute-on-Chronic Liver Failure. Semin. Liver Dis. 2016. May. 36(2). 123-6. doi: 10.1055/s-0036-1583201.
28. Simon T.G., King L.Y., Zheng H., Chung R.T. Statin use is associated with a reduced risk of fibrosis progression in chronic hepatitis C. J. Hepatol. 2015 Jan. 62(1). 18-23. doi: 10.1016/j.jhep.2014.08.013.
29. Диденко В.И., Ошмянская Н.Ю., Кленина И.А. Морфологическая и биохимическая оценка прогрессирования хронического гепатита, ассоциированного с вирусом С. Гастроэнтерология. 2014. 52. 37-41. doi: 10.22141/2308-2097.2.52. 2014.81949.
30. Завгородня Н.Ю., Лук’яненко Ю.О., Ягмур В.Б., Коненко І.С. Характеристика функціонального стану жовчного міхура і структурних змін печінки при неалкогольній жировій хворобі печінки у дітей. Гастроентерологія. 2016. 2(60). 38-43. doi: 10.22141/2308-2097.2.60.2016.74731.
31. Cotton P.B., Elta G.H., Carter C.R., Pasricha P.J., Corazziari E.S. Gallbladder and Sphincter of Oddi Disorders. Gastroenterology. 2016 May. 150(6). 1420-9.e2. doi: 10.1053/j.gastro.2016.02.033.
32. Di Ciaula A., Wang D.Q., Portincasa P. Gallbladder and gastric motility in obese newborns, pre-adolescents and adults. J. Gastroenterol. Hepatol. 2012. 27. 1298-1305. doi: 10.1111/j.1440—1746.2012.07149.x.
33. Cotton P.B., Durkalski V., Romagnuolo J. et al. Effect of endoscopic sphincterotomy for suspected sphincter of Oddi dysfunction on pain-related disability following cholecystectomy: the EPISOD randomized clinical trial. JAMA. 2014 May. 311(20). 2101-9. doi: 10.1001/jama.2014.5220.
34. Vinnitskaya E.V., Absandze K.G., Arkhipova E.V., Ivanov A.N., Sbikina E.S., Sandler Yu.G. Primary Biliary Cholangitis and Ursodeoxycholic Acid: Therapy Progress and Challenges. Doktor. Ru. 2019. 3(158). 33-39. doi: 10.31550/1727-2378-2019-158-3-33-39. (in Russian).
35. Jepsen P., Grønbæk L., Vilstrup H. Worldwide incidence of autoimmune liver disease. Dig. Dis. 2015. 33(2). 2-12. doi: 10.1159/000440705
36. Griffiths L., Dyson J.K., Jones D.E. The new epidemiology of primary biliary cirrhosis. Semin. Liver Dis. 2014. 34(3). 318-28. doi: 10.1055/s-0034-1383730.
37. Boonstra K., Kunst A.E., Stadhouders P.H., Tuynman H.A., Poen A.C., van Nieuwkerk K.M. et al. Rising incidence and prevalence of primary biliary cirrhosis: a large population-based study. Liver Int. 2014. 34(6). 31-8. doi: 10.1111/liv.1243414.
38. European Association for the Study of the Liver. EASL Clinical Practice Guidelines: The diagnosis and management of patients with primary biliary cholangitis. J. Hepatol. 2017. 67(10). 145-72. doi: 10.1016/j.jhep.2017.03.022.
39. Dahlqvist G., Gaouar F., Carrat F., Meurisse S., Chazouillères O., Poupon R. et al. Large-scale characterization study of patients with antimitochondrial antibodies but nonestablished primary biliary cholangitis. Hepatology. 2017. 65(1). 152-63. doi: 10.1002/hep.28859.
40. Hirschfield G.M., Liu X., Xu C., Lu Y., Xie G., Lu Y. et al. Primary biliary cirrhosis associated with HLA, IL12A, and IL12RB2 variants. N. Engl. J. Med. 2009. 360(24). 2544-55. doi: 10.1056/NEJMoa0810440.
41. Steinacher D., Claudel T., Trauner M. Therapeutic Mechanisms of Bile Acids and Nor-Ursodeoxycholic Acid in Non-Alcoholic Fatty Liver Disease. Dig. Dis. 2017. 35(3). 2822-87. doi: 10.1159/000454853.
42. Горошко O.A., Kукес В.Г., Прокофьев А.В., Архипов В.В., Демченкова Ю.Е. Клинико-фармакологические аспекты применения антиоксидантных лекарственных средств. Международный журнал прикладных и фундаментальных исследований. 2016. 4–5. 905-912.
43. Махов В.М., Володина Т.В., Панферов А.С., Турко Т.В. Полинозологический эффект урсодезоксихолевой кислоты. Опыт применения. Медицинский совет. 2016. 14. 62-67.
44. Kim D.J., Yoon S., Ji S.C. et al. Ursodeoxycholic acid improves liver function via phenylalanine/tyrosine pathway and microbiome remodelling in patients with liver dysfunction. Sci Rep. 2018 Aug 8. 8(1). 11874. doi: 10.1038/s41598-018-30349-1.
45. Степанов Ю.М., Косинська С.В. Особливості застосування урсодезоксихолевої кислоти при широкому спектрі патології гепатобіліарного тракту та інших органів і систем. Гастроентерологія. 2014. 4(54). 129-135. doi: 10.22141/2308-2097.4.54.2014.82088.
46. Stokes C.S., Gluud L.L., Casper M., Lammert F. Ursodeoxycholic acid and diets higher in fat prevent gallbladder stones during weight loss: a meta-analysis of randomized controlled trials. Clin. Gastroenterol. Hepatol. 2014 Jul. 12(7). 1090-1100.e2. quize61. doi: 10.1016/j.cgh.2013.11.031.
47. Mueller M., Castro R.E., Thorell A. et al. Ursodeoxycholic acid: Effects on hepatic unfolded protein response, apoptosis and oxidative stress in morbidly obese patients. Liver Int. 2018 Mar. 38(3). 523-531. doi: 10.1111/liv.13562.
48. Kong X., Kong Y., Zhang F. et al. Evaluating the effectiveness and safety of ursodeoxycholic acid in treatment of intrahepatic cholestasis of pregnancy: a meta-analysis (a prisma-compliant study). Medicine (Baltimore). 2016. 95(40). e4949.
49. Чистик T. Современный поход к терапии гастрита, ассоциированного с рефлюксом желчи: в фокусе Урсохол (урсодезоксихолевая кислота). Новини медицини і фармації. 2014. 18(514). 10-11.
50. Бабак О.Я., Фадєєнко Г.Д., Фролов В.М., Круглова О.В. Патогенетичне обґрунтування використання метаболічно активного засобу L-аргініну-L-глутамат при неалкогольній жировій хворобі печінки, поєднаній з хронічним некалькульозним холециститом. Ліки України. 2013. 2(168). 29-33.
51. Харченко Н.В., Анохіна Г.А., Харченко В.В. Печінкові та позапечінкові ефекти лікувального комплексу з L-аргініном та бетаїном у хворих із метаболічним синдромом. Сучасна гастроентерологія. 2015. 3(83). 42-49.
52. Применение готовой инфузии L-аргинина глутамата «Аргитек» в интенсивной терапии неотложных состояний. Здоровье Украины. 2019. 1. 1-3.

/62-1.jpg)
/63-1.jpg)