Журнал «» №3-4 (65-66), 2019
Вернуться к номеру
Роль и место Метакартина (L-карнитин) в цитопротекции и коррекции метаболических процессов у пациентов с ишемической болезнью сердца и инфарктом миокарда
Рубрики: Кардиология
Разделы: Справочник специалиста
Версия для печати
Ішемічна хвороба серця займає одне з провідних місць у структурі звернень до лікаря, інвалідизації та смертності при серцево-судинних захворюваннях. У зв’язку з цим актуальною проблемою є оптимізація лікування даної патології. На сьогодні важливе місце в терапії ішемічної хвороби серця (ІХС) займає L-карнітин (Метакартин, World Medicine), що дозволяє відновити енергетичний обмін у кардіоміоцитах, забезпечити їх захист від оксидативного стресу і запобігти апоптозу. В огляді розглянуті рандомізовані клінічні дослідження із застосуванням L-карнітину в пацієнтів із різними формами ІХС. Показано, що L-карнітин при ІХС зменшує частоту нападів стенокардії, потребу в короткодіючих нітратах, покращує толерантність до фізичного навантаження, збільшує фракцію викиду лівого шлуночка, нормалізує ліпідний профіль. Призначення L-карнітину при гострому інфаркті міокарда зменшує обсяг зони некрозу, попереджає розвиток серцевої недостатності, перешкоджає ремоделюванню лівого шлуночка і розвитку аритмій, покращує прогноз і виживаність пацієнтів.
Ишемическая болезнь сердца занимает одно из ведущих мест в структуре обращаемости к врачу, инвалидизации и смертности при сердечно-сосудистых заболеваниях. В связи с этим актуальной проблемой является оптимизация лечения данной патологии. На сегодняшний день важное место в терапии ишемической болезни сердца (ИБС) занимает L-карнитин (Метакартин, World Medicine), позволяющий восстановить энергетический обмен в кардиомиоцитах, обеспечить их защиту от оксидативного стресса и предотвратить апоптоз. В обзоре рассмотрены рандомизированные клинические исследования с применением L-карнитина у пациентов с различными формами ИБС. Показано, что L-карнитин при ИБС уменьшает частоту приступов стенокардии, потребность в короткодействующих нитратах, улучшает толерантность к физической нагрузке, увеличивает фракцию выброса левого желудочка, нормализует липидный профиль. Назначение L-карнитина при остром инфаркте миокарда уменьшает объем зоны некроза, предупреждает развитие сердечной недостаточности, препятствует ремоделированию левого желудочка и развитию аритмий, улучшает прогноз и выживаемость пациентов.
Coronary heart disease is on the one of the leading places in the structure of doctor’s visits, disability and mortality in cardiovascular diseases. In this regard, an urgent problem is the optimization of the treatment of this pathology. Today, L-carnitine (Metacartin, World Medicine) plays an important role in the treatment of coronary heart disease, which allows you to restore energy metabolism in cardiomyocytes, to ensure their protection against oxidative stress and to prevent apoptosis. The review examines randomized clinical trials with the use of L-carnitine in patients suffering from various forms of coronary heart disease. It was shown that L-carnitine in coronary heart disease reduces the incidence of angina attacks, the need for short-acting nitrates, improves exercise tolerance, increases left ventricular ejection fraction, and normalizes the lipid profile. Administration of L-carnitine in acute myocardial infarction reduces the volume of necrosis zone, prevents the development of heart failure, left ventricular remodeling and arrhythmias, improves the prognosis and survival of patients.
ішемічна хвороба серця; інфаркт міокарда; L-карнітин; Метакартин
ИБС; инфаркт миокарда; L-карнитин; Метакартин
coronary heart disease; myocardial infarction; L-carnitine; Metacartin
В последние десятилетия ишемическая болезнь сердца (ИБС) занимает одно из ведущих мест в структуре обращаемости к врачу, инвалидизации и смертности при сердечно-сосудистых заболеваниях (ССЗ). Согласно данным эпидемиологических исследований, в развитых странах Европы и Северной Америки на 1 млн населения приходится 30–40 тысяч больных, страдающих данной патологией [1]. Среди них первым проявлением ИБС в 46 % случаев является стенокардия напряжения, в 27 % — инфаркт миокарда (ИМ) [2].
Ежегодно в мире отмечается более 15 миллионов новых случаев инфаркта миокарда. При этом 35 % больных погибает в 1–7-е сутки; еще 15–20 % — в течение первого года. В течение последующих шести лет после ИМ 18 % мужчин и 35 % женщин переносят повторный инфаркт, 22 % мужчин и 46 % женщин становятся инвалидами вследствие развития тяжелой сердечной недостаточности [3].
В связи с этим актуальной проблемой современной медицины является оптимизация терапевтического и профилактического аспекта лекарственной терапии у пациентов с ИБС. На протяжении многих лет ее лечение рассматривалось только с точки зрения улучшения гемодинамики, а действие традиционных лекарственных средств было направлено в основном на снижение потребности миокарда в кислороде или на увеличение его поступления. Однако данные препараты не способны защитить клетки миокарда от метаболических изменений, составляющих основу прогрессирования патологического процесса.
Для решения этой проблемы перспективным направлением является применение метаболической терапии, обспечивающей защиту миокарда в условиях ишемии/реперфузии. В этом отношении особый интерес для клиницистов представляет L-карнитин, позволяющий оптимизировать энергетический обмен в кардиомиоцитах, обеспечить их защиту от оксидативного стресса и предотвратить апоптоз [4].
Общие сведения о L-карнитине
L-карнитин впервые выделен в 1905 г. В.С. Гулевичем и Р. Кримбергом из экстракта тканей мышц (из мышечной ткани). В 1927 г. с помощью химического синтеза была установлена его структура. С тех пор прошло более 100 лет, и за это время накоплен огромный фактический материал о распространенности в природе, биологических функциях, а также применении в медицине L-карнитина [17].
Известно, что карнитин — соединение, близкое к витаминам группы В. Биологической активностью обладает его L-изомер, или L-карнитин (левокарнитин). Структурно L-карнитин является разветвленной аминокислотой, которая поступает в организм человека из двух источников — с продуктами питания (преимущественно красное мясо) и в результате его синтеза в печени, почках и клетках мозга из двух незаменимых аминокислот — метионина и лизина, с участием кофакторов: витамина С, ионов железа, пироксидина, ниацина [19]. Транспорт его осуществляется в клетки, которые не синтезируют L-карнитин, — кардиомиоциты и скелетные миоциты. Процесс осуществляется через плазматическую мембрану пассивно по градиенту концентрации, без использования аденозинтрифосфорной кислоты (АТФ). В организме L-карнитин не подвергается катаболизму, а выделяется с мочой; в почках эффективно реабсорбируется, что и поддерживает достаточно высокий уровень L-карнитина в крови [18].
В организме человека основное количество карнитина содержится в мышцах и сердце, что обу-словлено высокой активностью в них липидного обмена. Именно поэтому главными органами-мишенями при недостаточности карнитина служат скелетные мышцы и миокард.
Энергетический обмен в кардиомиоцитах в физиологических условиях и условиях ишемии: роль L-карнитина
Для обеспечения сократимости и выживаемости кардиомиоцитов в условиях ишемии/реперфузии необходим достаточный синтез АТФ. В физиологических условиях в состоянии покоя молекулы АТФ в сердце образуются в результате окисления энергетических субстратов, главным образом длинноцепочечных жирных кислот (ДЦЖК), вклад которых в образование АТФ составляет около 70–80 %, а также глюкозы и лактата — 15–20 % [5]. Основной путь энергетического обмена связан с β-окислением ЖК в митохондриях (МХ), а вспомогательный путь представлен гликолизом с последующим окислением в МХ пирувата.
L-карнитин играет важную роль в энергетическом обмене сердца, так как участвует в транспорте ацильных остатков ЖК с помощью системы «карнитинового челнока». Ацильные остатки ЖК, соединяясь с L-карнитином, образуют ацилкарнитин, который поступает в МХ и превращается в ацил-КоА. Последний вступает в цикл β-окисления ЖК с образованием ацетил-КоА. Когда поступление ацил-КоА превосходит его потребление в цикле β-окисления, он вновь превращается в ацилкарнитины, которые удаляются из МХ в цитоплазму, а затем из клеток — в кровь. Этот процесс предупреждает накопление ацил-КоА в цитоплазме и тормозит развитие липотоксического эффекта [6].
Из ацетил-КоА, образовавшегося в МХ и выходящего в цитоплазму, синтезируется малонил-КоА, который тормозит транспорт ДЦЖК в МХ и их окисление, уменьшая вклад ЖК в синтез АТФ [6, 7]. Таким образом, L-карнитин контролирует скорость окисления ДЦЖК, выступая в качестве специфического кофактора, облегчающего их перенос через внутреннюю мембрану МХ.
Нарушение функциональной активности МХ играет ключевую роль при ряде патологических состояний, включая повреждения, вызываемые ишемией/реперфузией, наблюдающиеся при стенокардии, инфаркте миокарда, сердечной недостаточности [8, 9]. При ишемии в результате недостатка кислорода тормозится образование АТФ, снижается сократительная активность сердца, возникает симпатоадреналовый стресс, следствием которого является высвобождение из адипоцитов больших количеств ДЦЖК, поступающих из крови в кардиомиоциты. Избыточный уровень ацетил-КоА, образующегося в цикле β-окисления ЖК, затрудняет окисление пирувата в МХ и способствует его превращению в молочную кислоту. В результате развивается внутриклеточный ацидоз, нарушается ионный гомеостаз [10].
Удаление избытка ацетил-КоА из МХ с помощью образования ацетилкарнитина приводит к синтезу большого количества малонил-КоА, тормозящего окисление ДЦЖК в МХ. Помимо этого, L-карнитин участвует в удалении избытка ДЦЖК из МХ, а затем — из цитоплазмы, предупреждая их цитотоксический эффект. В этом состоит важная кардиопротекторная роль L-карнитина при ишемии [10].
Антиоксидантная и противовоспалительная активность L-карнитина при ишемической болезни сердца
Для сердца особое значение имеет влияние L-карнитина на внеклеточные радикалы кислорода, продуцируемые инфильтрированными фагоцитами крови, а также внутриклеточное образование радикалов кислорода, связанное с ферментативными комплексами дыхательной цепи МХ кардиомиоцитов. При ишемии/реперфузии миокарда генерация радикалов кислорода в МХ резко возрастает, формируется оксидативный стресс, радикалы повреждают белки, вызывают пероксидирование липидов, нарушают структуру ДНК МХ, что в конечном итоге приводит к нарушению структуры и уменьшению активности МХ [20], а также к гибели клеток [21].
Антиоксидантный эффект L-карнитина носит комплексный характер, обусловленный его способностью удалять уже образовавшиеся радикалы кислорода, выступая в качестве ловушки для них. Кроме того, L-карнитин подавляет активность ферментов, продуцирующих радикалы кислорода (НАДФН-оксидаза, ксантиноксидаза), и ингибирует спонтанное образование гидроксил-радикалов из пероксида водорода (реакция Фентона), тем самым осуществляя защиту кардиомиоцитов [22, 23].
Помимо антиоксидантных свойств, L-карнитин обладает противовоспалительным действием, что связано с его влиянием на функциональную активность провоспалительных клеток, важным этапом активации которых выступает стимуляция образования индуцибельной NOS (iNOS) — провоспалительного фермента, генерирующего большие количества радикалов NO, оказывающих цитотоксическое действие на чужеродные и собственные клетки человека. L-карнитин концентрационно-зависимым образом подавляет образование NO, снижает экспрессию белка iNOS и тормозит активность NF-κB в кардиомиоцитах [22, 23].
Антиапоптозный эффект L-карнитина в условиях ишемии миокарда
При ишемии/реперфузии миокарда происходит активация мегапоры МХ (надмолекулярной поры с транзиторной проницаемостью — mPTP), размер которой позволяет транспортироваться веществам с молекулярной массой 1500 Да. Переход mPTP в открытое состояние, когда проапоптозные митохондриальные белки выходят в цитоплазму и активируют ферментативный каскад каспаз, приводит к исчезновению градиентов ионов через внутреннюю мембрану МХ, торможению или полной остановке синтеза АТФ и гибели клеток по одному из двух механизмов — апоптозу или некрозу [11].
В ряде экспериментальных исследований было показано, что L-карнитин снижает набухание МХ и деполяризацию внутренней мембраны МХ, индуцированных ДЦЖК и пальмитоил-КоА [12], блокирует активацию mPTP, вызванную олеиновой кислотой, в результате усиления ее β-окисления [13], тормозит открывание mPTP благодаря снижению уровня радикалов кислорода, образующихся в МХ [14]. Установлено, что L-карнитин подавляет апоптоз, зависимый от МХ, как в условиях in vitro, так и in vivo [15, 16]. Кроме того, благодаря усилению окисления ЖК, L-карнитин предупреждает образование церамида — одного из наиболее сильных индукторов апоптоза.
Таким образом, можно полагать, что эффекты L-карнитина на уровне МХ или целой клетки происходят вследствие ингибирования повреждения мембран МХ, что связано с улучшением энергетического обмена и блокадой утечки электронов в транспортной цепи МХ, уменьшением генерации радикалов кислорода [10].
Эффективность и безопасность применения L-карнитина в терапии ишемической болезни сердца
Уровень L-карнитина в миокарде снижается при ишемической болезни сердца, остром инфаркте миокарда (ОИМ) и сердечной недостаточности различного генеза, что сопровождается глубокими нарушениями в энергетическом обмене, развитием лактатацидоза, накоплением токсических продуктов метаболизма [11, 25]. L-карнитин воздействует на процессы биоэнергетики клетки посредством коррекции узловых звеньев энергетического метаболизма. К настоящему времени накоплен значительный опыт его применения у пациентов с различными формами ишемической болезни сердца.
Обычно антиангинальную и противоишемическую эффективность того или иного средства оценивают по снижению частоты приступов стенокардии или потребности в короткодействующих нитратах, а также по изменению толерантности к физической нагрузке, времени возникновения депрессий сегмента ST или возникновению болей при нагрузочных пробах. Возможна также оценка по изменению локальной сократимости при нагрузочной эхокардиографии (ЭхоКГ) или нарушению перфузии миокарда при нагрузочной сцинтиграфии. Эффект L-карнитина изучен и подтвержден в нескольких рандомизированных плацебо-контролируемых исследованиях, различающихся по структуре, длительности приема препарата и используемым дозировкам. Число пациентов, включенных в эти исследования, колебалось от 12 до 200, используемые дозы составляли от 900 мг до 3 г/сут, продолжительность лечения — от 1 до 6 мес. Во всех исследованиях показано достоверное увеличение толерантности к физической нагрузке (в среднем на 14 %), времени до возникновения депрессий ST при проведении нагрузочных проб (15–25 %) и нагрузки до начала приступа стенокардии, уменьшение выраженности депрессии сегмента ST, оцененной на нагрузке, которая являлась максимальной до начала терапии, и времени восстановления депрессий после нагрузки [38–40].
В мультицентровом рандомизированном двойном слепом плацебо-контролируемом исследовании, проведенном A. Cherchi [26], эффективность L-карнитина была изучена у 44 пациентов со стабильной стенокардией. Все пациенты были разделены на 2 равные группы: 1-я группа получала L-карнитин по 1 г 2 раза в день, 2-я — плацебо. Курс лечения составил 4 недели. Результаты лечения оценивали по толерантности к физической нагрузке с использованием велоэргометрического теста, количеству приступов стенокардии и данным ЭКГ.
В ходе исследования была продемонстрирована эффективность применения L-карнитина в лечении пациентов со стабильной стенокардией: на 15 % увеличивалась толерантность к физической нагрузке, определялось уменьшение выраженности депрессии сегмента ST, снижалось количество приступов стенокардии, у 22,7 % пациентов приступы стенокардии исчезли.
В другом исследовании A. Cherchi [27] изучалась эффективность L-карнитина у 18 пациентов, страдающих стенокардией напряжения. Пациенты в возрасте 37–70 лет были рандомизированы на две равные группы, получающие L-карнитин по 500 мг 3 раза в день (1-я группа) и плацебо (2-я группа). Продолжительность наблюдения составила 75 дней.
При оценке результатов лечения отмечалось достоверное улучшение толерантности к физической нагрузке, снижение выраженности депрессии сегмента ST по данным ЭКГ, уменьшение потребности в кардиоактивных препаратах в группе пациентов, принимающих L-карнитин.
L. Cacciatore et al. [28] было проведено исследование терапевтического эффекта L-карнитина на базе трех центров с включением 200 пациентов в возрасте 40–65 лет, страдающих стабильной стенокардией. Все они случайным образом были рандомизированы на две группы. Пациенты 1-й группы (n = 100) получали по 2 г L-карнитина в сутки, 2-й группы (n = 100) — такую же дозу плацебо; курс лечения составил 6 месяцев.
Результаты исследования обнаружили несомненное превосходство L-карнитина в сравнении с плацебо. Отмечалось улучшение толерантности к физической нагрузке, снижение выраженности депрессии сегмента ST по данным ЭКГ, уменьшение приступов стенокардии. При этом большее число пациентов достигли I функционального класса стенокардии [28].
В сравнительном перекрестном исследовании (Bartels G.L.) с участием 46 пациентов со стабильной стенокардией оценивали эффективность приема 1,5 г L-карнитина в течение 6 недель и дилтиазема (3 недели в дозе 180 мг и последующие 3 недели — 360 мг). Показано, что оба типа терапии приводят к сопоставимому увеличению продолжительности нагрузки (582 ± 35 с для L-карнитина и 588 ± 33 с для дилтиазема), времени до появления депрессии ST (436 ± 38 с и 465 ± 36 с соответственно) и к увеличению времени до появления депрессии сегмента ST по сравнению с исходным (на 20 и 28 % соответственно). В обоих случаях значимо уменьшалась степень депрессии ST на максимуме нагрузки (на 23 и 35 %; р < 0,05). По данным суточного мониторирования ЭКГ, противоишемический эффект был более выражен при использовании L-карнитина. В период исследования отмечено уменьшение частоты приступов стенокардии на 70 и 57 %, в то же время потребность в приеме нитроглицерина снижалась на 57 и 70 % соответственно при приеме L-карнитина и дилтиазема. Следует отметить, что большее число пациентов предъявляли жалобы на сердцебиение при приеме дилтиазема, чем L-карнитина [30].
В работе C. Canale et al. [29] было показано, что лечение L-карнитином в течение 30 дней в суточной дозе 3 г у 16 пациентов со стабильной стенокардией приводило к улучшению параметров функции левого желудочка и меньшей распространенности проявлений ишемической дисфункции, что подтверждалось данными ЭхоКГ. При этом отмечалась хорошая переносимость L-карнитина и малое число нежелательных проявлений, сравнимое с частотой нежелательных явлений, возникающих при приеме плацебо.
Об эффективности L-карнитина у пациентов с ИБС, осложненной сердечной недостаточностью, свидетельствует крупное рандомизированное мультицентровое исследование с участием 51 кардиологического центра Европы [24]. В него были включены две группы пациентов с ИБС и хронической сердечной недостаточностью (фракция выброса 40 % или меньше), одна из которых получала на протяжении 6 месяцев L-карнитин в суточной дозе 2 г (n = 271), а другая — плацебо (n = 266). Положительное действие препарата оценивалось с помощью велоэргометрического теста и ЭхоКГ.
По результатам исследования отмечен статистически достоверный позитивный эффект у больных с фракцией выброса 30–40 %, что свидетельствует о положительном влиянии L-карнитина на толерантность к физической нагрузке при ИБС и хронической сердечной недостаточности с фракцией выброса выше 30 % [24].
L-карнитин улучшает липидный профиль у пациентов с ИБС. Такая оценка проводилась в рандомизированном плацебо-контролируемом исследовании B.J. Lee et al. [31]. В него были включены 47 пациентов со стабильной ИБС, подтвержденной катетеризацией сердца либо чрескожными коронарными вмешательствами. Все пациенты были распределены на две группы: для приема L-карнитина (1000 мг/сут, n = 23) или плацебо (n = 24) в течение 12 недель [31].
Уровень эндогенного L-карнитина в плазме крови определяли посредством метода иммуноферментного анализа (ELISA). Состояние естественной антиоксидантной защиты организма оценивали по активности фермента супероксиддисмутазы (СОД). Липидный спектр крови — с помощью стандартного метода на автоматическом биохимическом гемоанализаторе.
Измерения содержания L-карнитина в плазме крови подтвердили, что его прием в течение 12 недель приводит к достоверному повышению уровня этого вещества по сравнению с исходными показателями (с 33,6 ± 13,6 мкмоль/л до 40,0 ± ± 12,0 мкмоль/л; р = 0,04) и с финальными показателями группы плацебо (35,2 ± 12,0 мкмоль/л; р = 0,02). Активность СОД также достоверно вырос-ла по сравнению с исходной (с 14,8 ± 2,9 Ед/мг до 20,7 ± 4,2 Ед/мг белка; р < 0,01) и была выше, чем в группе плацебо (13,1 ± 2,9 Ед/мг белка; р < 0,01).
По результатам 12-недельной терапии у пациентов группы L-карнитина в сравнении с группой плацебо отмечено достоверное увеличение концентрации антиатерогенного холестерина липопротеидов высокой плотности (ЛПВП) (1,34 ± 0,42 ммоль/л против 1,16 ± 0,24 ммоль/л соответственно; р = 0,03) и аполипопротеина А1 (Апо-А1) (1,24 ± 0,18 г/л против 1,12 ± 0,13 г/л; р = 0,02).
После курсового приема L-карнитина несколько снизился, хотя и не достоверно, уровень триглицеридов (с 1,40 ± 0,74 ммоль/л до 1,35 ± 0,62 ммоль/л; р = 0,06). Без существенных изменений остались показатели общего холестерина, холестерина липопротеидов низкой плотности (ЛПНП) и аполипопротеина В (Апо-В).
Корреляционный анализ подтвердил достоверную взаимосвязь между приемом L-карнитина и наблюдавшимся улучшением липидного профиля пациентов. Уровень L-карнитина в плазме крови отрицательно коррелировал с уровнем триглицеридов (β = –0,14; р = 0,01), а также, хотя и без статистической достоверности, с содержанием Апо-В (β = –0,02; р = 0,08). Положительные корреляционные связи установлены с уровнем холестерина ЛПВП (β = 0,07; р = 0,07) и Апо-А1 (β = 0,01; р = 0,09). Повышение активности СОД на фоне приема L-карнитина достоверно коррелировало с положительными изменениями показателей липидограммы — общего холестерина (r = –0,41; р < 0,01), холестерина ЛПНП (r = –0,45; р < 0,01) и Апо-В (r = –0,32; р < 0,01).
Таким образом, доказана эффективность L-карнитина в лечении ИБС. Его прием уменьшает частоту приступов стенокардии, потребность в короткодействующих нитратах, улучшает толерантность к физической нагрузке, увеличивает фракцию выброса левого желудочка, нормализует липидный профиль.
Изученные эффекты L-карнитина в клинических исследованиях у пациентов с острым инфарктом миокарда
Большой объем зоны некроза при ОИМ является важным прогностическим индикатором развития осложнений и летального исхода. Доказательством того, что L-карнитин снижает объем пораженного миокарда при остром ИМ, могут служить данные, полученные в нескольких клинических исследованиях. Так, в плацебо-контролируемом рандомизированном исследовании введение L-карнитина (2 г/сут) к 28-му дню от начала заболевания (101 пациент) обеспечивало достоверно меньшие уровни креатинфосфокиназы (КФК), чем на фоне приема плацебо. Меньшим был и индекс QRS на ЭКГ, определенный как сумма зубцов Q и R в отведениях V1–V6 [32]. Аналогично в другом многоцентровом плацебо-контролируемом рандомизированном исследовании (351 пациент с ИМ) при введении L-карнитина в течение 48 ч, начатом через 8 ч от начала заболевания, снижение вольтажа зубца R оказалось на 15 % меньше, чем на фоне плацебо [16]. Кроме того, в группе больных, леченных L-карнитином, меньшим было число эпизодов ишемии (17,6 против 36 %) и число пациентов с сердечной недостаточностью III–IV функционального класса по классификации NYHA в сочетании с увеличением левого желудочка — 23,4 против 36 % пациентов [33].
В работе G. Tarantini, D. Scrutinio, P. Bruzzic et al. (2006) [35] установлено, что у больных с острым инфарктом миокарда назначение L-карнитина приводило к меньшей некротизации миокарда и улучшению клинического прогноза (число конечных точек в основной группе составило 15,6 %, в контрольной — 26 %).
Также в ряде исследований показано антиаритмическое действие L-карнитина при ОИМ. В параллельном двойном слепом плацебо-контролируемом исследовании P. Rizzon [36] с участием 56 пациентов с инфарктом миокарда было установлено, что назначение L-карнитина в дозе 100 мг/кг каждые 12 ч в период от 5 до 12 ч от начала заболевания достоверно уменьшает эпизоды нарушений ритма (на 80 %) и достоверно сокращает время регистрации мультиформных или парных экстрасистол [36].
Влияние L-карнитина на постинфарктное ремоделирование сердца было обнаружено в рандомизированном исследовании CEDIM. В нем приняли участие 472 пациента с ОИМ передней локализации, которым назначали L-карнитин или плацебо с первых суток заболевания. В первые 5 дней лечения L-карнитин вводили внутривенно по 9 г в сутки, затем по 6 г перорально курсом 12 месяцев. У всех пациентов выполнялось эхокардиографическое исследование при поступлении, в день выписки из стационара и затем через 3, 6 и 12 месяцев.
Исследование показало достоверное снижение объемов сердца в конце диастолы и систолы у больных, получающих L-карнитин (на 16 и 15 %), по сравнению с больными из контрольной группы. Также в рассматриваемом исследовании случаи хронической сердечной недостаточности (ХСН) развились у 1,7 % больных основной и у 4,2 % — контрольной группы. Это означало, что у больных, получавших L-карнитин, было частично предотвращено постинфарктное ремоделирование левого желудочка сердца, которое является основой возникновения ХСН и, возможно, гибели от нее.
В рандомизированное двойное слепое плацебоконтролируемое исследование CEDIM-2, проведенное итальянскими авторами, были включены 2330 пациентов с острым передним ИМ, рандомизированные на группу приема L-карнитина и плацебо. Результаты исследования продемонстрировали значимое снижение ранней смертности после ИМ — на 5-е сутки острого периода в группе пациентов, получающих L-карнитин (снижение смерт-ности составило 39 %) [34].
Кроме того, L-карнитин улучшает сократительную активность миокарда и увеличивает фракцию выброса левого желудочка при ОИМ. Так, в пилотном исследовании, проведенном Н.Ю. Семиголовским и соавт. (2012) [37], внутривенное введение L-карнитина при остром инфаркте миокарда в первые 5 дней достоверно увеличивало фракцию выброса левого желудочка по сравнению с пациентами контрольной группы (с 35,5 ± 0,9 % до 45,4 ± 1,2 % против с 35,8 ± 0,7 % до 40,1 ± 0,9 %; р < 0,05) и уменьшало среднюю продолжительность пребывания больных в отделении реанимации.
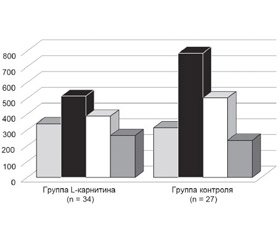
В работе В.В. Батушкина и соавт. изучалось влияние L-карнитина на предупреждение развития сердечной недостаточности и прогноз для пациентов после первичной транскутанной ангиопластики в острой стадии ИМ. В исследовании приняли участие 97 больных, госпитализированных в 1-й день ИМ. Случайным методом они были рандомизированы на 2 группы: 1-я группа (n = 47) получала L-карнитин в дополнение к базисной терапии, 2-я (n = 50) — только базисную терапию.
Было установлено, что кардиопротекторное лечение L-карнитином достоверно предупреждает развитие сердечной недостаточности после ОИМ. Так, при заднем инфаркте количество больных с СН І–ІІ ФК увеличивалось на 45,5 % — с 37,5 до 68,8 %, в группе контроля — только на 19,8 %. Количество больных с ІІІ–ІV ФК в группе L-карнитина уменьшилось вдвое. При передней локализации инфаркта число пациентов с СН І–ІІ ФК увеличилось в 2,12 раза в группе метаболической терапии, в группе контроля — только на 46,2 %. Одновременно количество больных СН ІІІ–ІV ФК уменьшалось в группе L-карнитина в 2,5 раза (с 65,3 до 26,3 %), в контрольной — с 68,2 до 40,8 %.
Кроме того, назначение L-карнитина препятствовало прогрессированию патологического ремоделирования ЛЖ: количество больных с критическим приростом конечного систолического индекса и конечного диастолического индекса было в 2,8 раза меньше. Улучшалась насосная функция сердца, полное восстановление сократимости определялось у 25,5 % пациентов уже через 1 месяц после ИМ.
Под влиянием метаболической терапии на 10-й день исследования определялся на 35,7 % более низкий рост значения NT-proBNP, что свидетельствовало о достоверно меньшем объеме некротизированного миокарда.
Таким образом, назначение L-карнитина при ОИМ уменьшает объем зоны некроза, предупреждает развитие сердечной недостаточности, препятствует ремоделированию ЛЖ и развитию аритмий, улучшает прогноз и выживаемость пациентов.
Выводы
Ишемическая болезнь сердца занимает одно из ведущих мест в структуре обращаемости к врачу, инвалидизации и смертности при сердечно-сосудистых заболеваниях.
Для защиты клеток миокарда от метаболических изменений, составляющих основу прогрессирования ИБС и инфаркта миокарда, перспективным направлением является применение L-карнитина, позволяющего оптимизировать энергетический обмен в кардиомиоцитах, обеспечить их защиту от оксидативного стресса и предотвратить апоптоз.
Прием L-карнитина при ИБС уменьшает частоту приступов стенокардии, потребность в короткодействующих нитратах, улучшает толерантность к физической нагрузке, увеличивает фракцию выброса левого желудочка, нормализует липидный профиль.
Назначение L-карнитина при ОИМ уменьшает объем зоны некроза, предупреждает развитие сердечной недостаточности, препятствует ремоделированию ЛЖ и развитию аритмий, улучшает прогноз и выживаемость пациентов.
В настоящее время на фармацевтическом рынке представлен L-карнитин компании World Medicine — Метакартин. Он выпускается в форме раствора для в/в инъекций — 1 ампула (5 мл) раствора для инъекций содержит 1 г L-карнитина. Рекомендуемая доза Метакартина при кардиологических заболеваниях составляет от 2 до 9 г в сутки (до 100 мг/кг массы тела).
1. Клюжев В.М., Ардашев В.Н., Брюховецкий А.Г., Михеев А.А. Ишемическая болезнь сердца. М.: Медицина, 2004.
2. Безюк Н.Н. Современные стандарты фармакотерапии стабильной стенокардии. Здоровье Украины.
2015. № 3.
3. Панина Ю.Н. Моделирование и прогнозирование острого инфаркта миокарда в зависимости от факторов риска, лабораторных параметров и качества жизни. Курск, 2013.
4. Ена Л.М., Чаяло П.П., Христофорова А.М. Механизмы действия и перспективы применения препаратов для метаболической терапии ишемической болезни сердца. http.//journal.ukrcardio.org/cardio_archive/2006/5/yena.htm.
5. Lopaschuk G.D., Ussher J.R., Folmes C.D.L. et al. Myocardial fatty acid metabolism in health and disease. Physiol. Rev. 2010. 90, 1. 207-258.
6. Lee K., Kerner J., Hoppel Ch.L. Mitochondrial camitinepalmitoyl-transferase 1a (CPT1a) is part of an outer membrane fatty acid transfer complex. J. Biol. Chem. 2011. 286, 29. 25655-25662.
7. Indiveri C., Iacobazzi V., Tonazzi A. et al. The mitochondrial carnitine/acylcarnitine carrier. Function, structure and physiopathology. Mol. Aspects Med. 2011. 32. 4-6. 223-233.
8. Brass E.P. Pivalate-generating prodrugs and carnitine homeostasis in man. Pharmacol. Rev. 2002. 54, 4. 589-598.
9. Flanagan J.L., Simmons P.A., Vehige J. et al. Role of carnitine in disease. Nutr. Metab. 2010. 7. 30-43.
10. Асташкин Е.И., Глезер М.Г. Роль L-карнитина в энергетическом обмене кардиомиоцитов и лечении заболеваний сердечно-сосудистой системы. Кардиология и сердечно-сосудистая хирургия. 2012. Т. 6, № 2. С. 58-65.
11. Асташкин Е.И., Глезер М.Г. Гибель клеток при ишемии/реперфузии сердца. Современные подходы к профилактике и лечению. М.: Медиком, 2012.
12. Furuno T., Kanno T., Arita K. et al. Roles of long chain fatty acids and carnitine in mitochondrial membrane permeability transition. Biochem. Pharmacol. 2001. 62, 8. 1037-1046.
13. Oyanagi E., Yano H., Kato Y. et al. L-Carnitine suppresses oleic acid-induced membrane permeability transition of mitochondria. Cell. Biochem. Funct. 2008. 26, 7. 778-786.
14. Zhu X., Sato E.F., Wang Y. et al. Acetyl-L-carnitine suppresses apoptosis of thioredoxin 2-deficient DT40 cells. Arch. Biochem. Biophys. 2008. 478, 2. 154-160.
15. Chang B., Nishikawa M., Sato E. et al. L-Carnitine inhibits cisplatin-induced injury of the kidney and small intestine. Arch. Biochem. Biophys. 2002. 405, 1. 55-64.
16. Sparagna G.C., Hickson-Bick D.L., Buja L.M., McMil-lin J.B. A metabolic role for mitochondria in palmitate-induced cardiac myocyte apoptosis. Am. J. Physiol. Heart Circ. Physiol. 2000. 279, 5. 2124-2132.
17. Верткин А.В. L-карнитин в медицинской практике: доказанные эффекты. Consilium Medicum. Неврология и ревматология. 2012. 1. 83-86.
18. vanVlies N., Ferdinandusse S., Turkenburg M. et al. PPAR-alpha activation results in enhanced carnitine biosynthesis and OCTN2-mediated hepatic carnitin accumulation. Biochem. Biophys. Acta. 2007. 1767, 9. 1134-1142.
19. Vaz F.M., Wanders R.J. Carnitine biosynthesis in mammals. Biochem. J. 2002. 361. Pt 3. 417-429.
20. West A.P., Shadel G.S., Ghosh S. Mitochondria in innate immune responses. Nat. Rev. Immunol. 2011. 11. 389-402.
21. Mittal M., Siddiqui M.R., Tran K., Reddy S.P., Ma-
lik A.B. Reactive Oxygen Species in Inflammation and Tissue
Injury. Antioxid. Redox Signal. 2014. 20. 1126-1167.
22. Gülgin I. Antioxidant and antiradical activities of L-carnitine. Life Sci. 2006. 78 (8). 803-811.
23. Solarska K., Lewinska A., Karowicz-Bilinska A., Bartosz Gr. The antioxidant properties of carnitine in vitro. Cell and Molecular Biology Letters. 2010. 15 (1). 90-97.
24. Study on propionyl-L-carnitine in chronic heart failure. The investigators of the study on propionyl-L-carnitine in chronic heart failure. Eur. Heart J. 1999. 20. 70-76.
25. Леонтьева И.В., Сухоруков В.С. Значение метаболических нарушений в генезе кардиомиопатий и возможности применения L-карнитина для терапевтической коррекции. Вестник педиатрической фармакологии и нутрициологии. 2006. 2. 12-4.
26. Cherchi A. Effects of L-carnitine on exercise tolerance in chronic stable angina: a multicenter, double-blind, randomized, placebo controlled crossover study. Int. J. Clin. Pharmacol. Ther. Toxicol. 1985. 23, 10. 569-572.
27. Cherchi A., Lai C., Onnis E. et al. Propionylcarnitine in stable effort angina. Cardiovasc. Drugs Ther. 1990. 4, 2. 481-486.
28. Cacciatore L., Cerio R., Ciarimboli M. et al. The therapeutic effect of L-carnitine in patients with exercise-induced stable angina: a controlled study. Drugs Exp. Clin. Res. 1991. 17, 4. 225-235.
29. Canale C., Terrachini V., Biagini A. et al. Bicycle ergome-ter and echocardiographic study in healthy subjects and patients with angina pectoris after administration of L-carnitine. Semiautomatic computerized analysis of M-mode tracings. Int. J. Clin. Pharmacol. Ther. Toxicol. 1988. 26, 4. 221-224.
30. Bartels G.L., Remme W.J., Holwerda K.J., Kruijssen D.A. Antiischaemic efficacy of L-propionylcarnitine. a promising novel metabolic approach to ischaemia? Eur. Heart J. 1996. 17, 3. 414- 420.
31. Lee B.J., Lin J.S., Lin Y.C., Lin P.T. Effects of L-carnitine supplementation on lipid profiles in patients with coronary artery disease. Lipids Health Dis. 2016 Jun. 17, 15. 107. doi: 10.1186/s12944-016-0277-5.
32. Singh R.B., Niaz M.A., Agarwal P. et al. A randomized, doubleblind, placebo controlled trial of L-carnitine in suspected myocardial infarction. Postgrad. Med. J. 1996. 72, 843. 45-50.
33. Chiariello M., Nrevetti G., Policicclio A. et al. L-Carnitine in acute myocardial infarction. A multicentre randomized trial. Clinical aspects of human carnitine deficiency. Ed. А. Borum. New York: Pergamon Press, 1986. 242-243.
34. Iliceto S., Scrutinio D., Bruzzi P. et al. Effect of L-carnitine administration on left ventricular remodeling after acute anterior myocardial infarction. the L-Carnitine Ecocardiografia Digitalizzata Infarto Miocardico (CEDIM) trial. J. Am. Coll. Cardiol. 1995. 26, 2. 380-387.
35. Tarantini G., Scrutinio D., Bruzzi P. et al. Metabolic treatment with L-carnitine in acute anterior ST segment elevation myocardial infarction. A randomized controlled trial. Cardiology. 2006. 106, 4. 215-223.
36. Rizzon P., Biasco G., Di Biase M. et al. High doses of L-carnitine in acute myocardial infarction. metabolic and antiarrhythmic effects. Eur. Heart J. 1989. 10, 6. 502-508.
37. Семиголовский Н.Ю., Верцинский Е.К., Азанов Б.А. и др. Опыт применения инфузионного отечественного препарата левокарнитина при синдроме малого выброса у больных острым инфарктом миокарда. Бюл. НЦССХ им. А.Н. Бакулева РАМН. 2012. 3. 69-72.
38. Iyer R.N., Khan A.A., Gupta A. et al. L-carnitine mode-rately improves the exercise tolerance in chronic stable angina.
J. Ass. Phys. India. 2000. 48, 1. 1050-1052.
39. Kamikawa T., Suzuki Y., Kobayashi A. et al. Effects of L-carnitine on exercise tolerance in patients with stable angina pectoris. Jpn. Heart J. 1984. 25, 4. 587-597.
40. Lagioia R., Scrutinio D., Mangini S.G. et al. Propionyl-L-carnitine. a new compound in the metabolic approach to the treatment of effort angina. Int. J. Cardiol. 1992. 34, 2.167-172.

/132-1.jpg)