Журнал «» №3-4 (65-66), 2019
Вернуться к номеру
Відкрите одноцентрове дослідження ефективності зниження артеріального тиску в ранкові години в пацієнтів із м’якою і помірною артеріальною гіпертензією з контрольованим офісним тиском і неконтрольованими піками артеріального тиску в ранкові години при переведенні на терапію телмісартаном (Телсартаном) у комбінації з гідрохлортіазидом і/або амлодипіном або без неї: результати дослідження РАНОК (контРоль Артеріального тиску в раНкові години у пацієнтів із неконтрОльованими піКами)
Авторы: Рековець О.Л., Сіренко Ю.М., Торбас О.О., Кушнір С.М., Примак Г.Ф.
ДУ «ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України, м. Київ, Україна
Рубрики: Кардиология
Разделы: Клинические исследования
Версия для печати
Метою нашого дослідження було оцінити ефективність зниження артеріального тиску (АТ) протягом останніх 6 годин із 24 після прийому останньої дози препарату за результатами добового моніторування артеріального тиску через 12 тижнів лікування в пацієнтів із м’якою і помірною артеріальною гіпертензією (АГ), які контролювали офісний тиск і мали неконтрольовані піки АТ протягом останніх 6 годин після прийому останньої дози антигіпертензивного препарату. Матеріали та методи. У дослідження було включено 67 пацієнтів із м’якою і помірною АГ. Пацієнтам виконували загальний аналіз крові, біохімічне дослідження крові, вимірювання офісного АТ, амбулаторне 24-годинне моніторування АТ з визначенням циркадності АТ, ранкового підйому АТ, визначення центрального АТ, швидкості поширення пульсової хвилі. У ранкові (1-ша підгрупа) або вечірні (2-га підгрупа) години призначали телмісартан у дозі 40 або 80 мг один раз на день (Телсартан, «Др. Редді’с Лабораторіз Лімітед») або фіксовану комбінацію телмісартану 40 або 80 мг із гідрохлортіазидом 12,5 мг (Телсартан-Н, «Др. Редді’с Лабораторіз Лімітед»); при недосягненні цільового рівня офісного АТ менше від 140/90 мм рт.ст. через 4 тижні додавали амлодипін 5 або 10 мг один раз на добу (Стамло, «Др. Редді’с Лабораторіз Лімітед»). Пацієнти проходили первинне обстеження й обстеження через 12 тижнів (3 місяці) терапії. Результати. Зменшення офісного систолічного АТ (САТ)/діастолічного АТ (ДАТ) у середньому становило через 8 тижнів 16,92/9,56 мм рт.ст. (р < 0,05), а через 12 тижнів лікування — 21,26/12,12 мм рт.ст. (p < 0,05). Офісна частота серцевих скорочень (ЧСС) достовірно не змінилася. У результаті проведеної терапії Телсартаном і Телсартаном-Н відбувалося достовірне зменшення середньодобового САТ (з 134,45 ± 1,39 мм рт.ст. до 122,01 ± 1,16 мм рт.ст., р < 0,05) і ДАТ (з 81,51 ± 1,15 мм рт.ст. до 71,62 ± 1,01 мм рт.ст., р < 0,05), що в середньому становило 12,44/9,89 мм рт.ст. Відзначено також достовірне зменшення середньоденних показників САТ і ДАТ з 138,92 ± 1,38 мм рт.ст. і 85,22 ± 1,20 мм рт.ст. до 126,35 ± 1,20 мм рт.ст. і 75,70 ± 1,11 мм рт.ст. (р < 0,05) відповідно, що в середньому становило 12,57 і 9,52 мм рт.ст., і середньонічних показників САТ і ДАТ — з 126,13 ± 1,18 мм рт.ст. і 74,28 ± ± 1,46 мм рт.ст. до 113,37 ± 1,40 мм рт.ст. і 63,73 ± 1,09 мм рт.ст. (р < 0,05) відповідно (12,76 і 11,05 мм рт.ст.). Достовірних змін добової ЧСС не було. Частка досягнення цільового АТ на фоні прийому Телсартану або Телсартану-Н самостійно або в комбінації з амлодипіном при офісному вимірюванні становила 80,6 %, а при добовому моніторуванні — 75,61 %. Отже, у хворих з м’якою і помірною артеріальною гіпертензією з контрольованим офісним тиском і неконтрольованими піками АТ протягом останніх 6 годин після прийому останньої дози антигіпертензивного препарату досліджувані препарати Телсартан і Телсартан-Н продемонстрували досить високий антигіпертензивний ефект як при використанні без амлодипіну, так і в комбінації з ним. Телмісартан більш ефективно знижував середньоденний і нічний САТ і ДАТ при ранковому прийомі порівняно з вечірнім. Відзначено достовірне зниження середнього САТ, ДАТ у ранкові години з 140,14 ± 1,51 мм рт.ст. і 87,19 ± 1,56 мм рт.ст. до 124,77 ± 1,40 мм рт.ст. і 73,23 ± 1,31 мм рт.ст. (р < 0,05), на 15,37 і 13,96 мм рт.ст. відповідно. Також відбувалося зниження швидкості підвищення САТ у ранкові години на 3,67 мм рт.ст/год на фоні терапії Телсартаном і Телсартаном-Н. Відбулося зменшення величини ранкового підйому САТ на 11,34 мм рт.ст. (р < 0,05). Висновки. Терапія Телсартаном і Телсартаном-Н як без комбінації з препаратом Стамло, так і в комбінації з ним у пацієнтів із мякою і помірною АГ з контрольованим офісним тиском і неконтрольованими піками АТ протягом останніх 6 годин після прийому останньої дози антигіпертензивного препарату достовірно знижувала як офісний АТ, так і АТ при добовому моніторуванні й сприяла зниженню величини АТ у ранкові години, зменшенню швидкості підвищення АТ у ранкові години.
Целью нашего исследования было оценить эффективность снижения артериального давления (АД) в течение последних 6 часов из 24 после приема последней дозы препарата по результатам суточного мониторирования артериального давления через 12 недель лечения у пациентов с мягкой и умеренной артериальной гипертензией (АГ), которые контролировали офисное давление и имели неконтролируемые пики АД в течение последних 6 часов после приема последней дозы антигипертензивного препарата. Материалы и методы. В исследование было включено 67 пациентов с мягкой и умеренной АГ. Пациентам выполняли общий анализ крови, биохимическое исследование крови, измерение офисного АД, амбулаторное 24-часовое мониторирование АД с определением циркадности АД, утреннего подъема АД, определение центрального АД, скорости распространения пульсовой волны. В утренние (1-я подгруппа) или вечерние (2-я подгруппа) часы назначали телмисартан в дозе 40 или 80 мг один раз в день (Телсартан, «Др. Редди’с Лабораториз Лимитед») или фиксированную комбинацию телмисартана 40 или 80 мг с гидрохлортиазидом 12,5 мг (Телсартан-Н, «Др. Редди’с Лабораториз Лимитед»); при недостижении целевого уровня офисного АД меньше 140/90 мм рт.ст. через 4 недели добавляли амлодипин 5 или 10 мг один раз в сутки (Стамло, «Др. Редди’с Лабораториз Лимитед»). Пациенты проходили первичное обследование и обследование через 12 недель (3 месяца) терапии. Результаты. Уменьшение офисного систолического АД (САД)/диастолического АД (ДАД) в среднем составило за 8 недель 16,92/9,56 мм рт.ст. (р < 0,05), а через 12 недель лечения — 21,26/12,12 мм рт.ст. (р < 0,05). Офисная частота сердечных сокращений (ЧСС) достоверно не изменилась. В результате проведенной терапии Телсартаном и Телсартаном-Н происходило достоверное уменьшение среднесуточного САД (с 134,45 ± 1,39 мм рт.ст. до 122,01 ± 1,16 мм рт.ст., р < 0,05) и ДАД (с 81,51 ± 1,15 мм рт.ст. до 71,62 ± 1,01, р < 0,05), что в среднем составило 12,44/9,89 мм рт.ст. Отмечено также достоверное уменьшение среднедневных показателей САД и ДАД с 138,92 ± ± 1,38 мм рт.ст. и 85,22 ± 1,20 мм рт.ст. до 126,35 ± 1,20 мм рт.ст. и 75,70 ± 1,11 мм рт.ст. (р < 0,05) соответственно, что в среднем составило 12,57 и 9,52 мм рт.ст., и середненочных показателей САД и ДАД с 126,13 ± 1,18 мм рт.ст. и 74,28 ± ± 1,46 мм рт.ст. до 113,37 ± 1,40 мм рт.ст. и 63,73 ± 1,09 мм рт.ст. (р < 0,05) соответственно (12,76 и 11,05 мм рт.ст.). Достоверных изменений суточной ЧСС не было. Доля достижения целевого АД на фоне приема Телсартана или Телсартана-Н самостоятельно или в комбинации с амлодипином при офисном измерении составила 80,6 %, а при суточном мониторировании — 75,61 %. Следовательно, у больных с мягкой и умеренной артериальной гипертензией с конт-ролируемым офисным давлением и неконтролируемыми пиками АД в течение последних 6 часов после приема последней дозы антигипертензивного препарата исследуемые препараты Телсартан и Телсартан-Н продемонстрировали достаточно высокий антигипертензивный эффект как при использовании без амлодипина, так и в комбинации с ним. Телмисартан более эффективно снижал среднедневное и ночное САД и ДАД при утреннем приеме по сравнению с вечерним. Отмечено достоверное снижение средних САД, ДАД в утренние часы с 140,14 ± 1,51 мм рт.ст. и 87,19 ± 1,56 мм рт.ст. до 124,77 ± 1,40 мм рт.ст. и 73,23 ± 1,31 мм рт.ст. (р < 0,05), на 15,37 и 13,96 мм рт.ст. соответственно. Также происходило снижение скорости повышения САД в утренние часы на 3,67 мм рт.ст/ч на фоне терапии Телсартаном и Телсартаном-Н. Произошло уменьшение величины утреннего подъема САД на 11,34 мм рт.ст. (р < 0,05). Выводы. Терапия Телсартаном и Телсартаном-Н как без комбинации с препаратом Стамло, так и в сочетании с ним у пациентов с мягкой и умеренной АГ с контролируемым офисным давлением и неконтролируемыми пиками АД в течение последних 6 часов после приема последней дозы антигипертензивного препарата достоверно снижала как офисное АД, так и АД при суточном мониторировании и способствовала снижению величины АД в утренние часы, уменьшению скорости повышения АД в утренние часы.
Background. The purpose of our study was to evaluate the effectiveness of reduction of morning blood pressure (BP) by ambulatory blood pressure monitoring (ABPM) after 12 weeks of treatment in patients with mild to moderate arterial hypertension, who had controlled office BP and uncontrolled morning BP surge. Materials and methods. The study involved 67 patients with mild to moderate hypertension who had controlled office BP and uncontrolled morning BP surge. General blood test, biochemical blood test, measurement of office blood pressure, outpatient 24-hour blood pressure monitoring, blood pressure measurement, morning blood pressure rise, determination of central blood pressure, PWV, were performed. Patients were switched to telmisartan 40 or 80 mg tablets (Telsartan, Dr. Reddy’s Laboratories Ltd), or to combined tablets of telmisartan 40 or 80 mg with hydrochlorothiazide 12.5 mg (Telsartan-H, Dr. Reddy’s Laboratories Ltd), for morning once daily intake (Subgroup 1) or evening once daily intake (Subgroup 2). If after 4 weeks of treatment BP was not controlled at the level less than 140/90 mm Hg, amlodipine 5 or 10 mg once daily was prescribed on top. Primary and final examination after 3 months of therapy was performed. Results. The office SBP/DBP at 8 weeks reduced at the average by 16.92/9.56 mm Hg (p < 0.05), and after 12 weeks of treatment — 21.26/12.12 mm Hg (p < 0.05). Office heart rate (HR) did not significantly change. The therapy with Telsartan and Telsartan-H was associated with a significant decrease in average daily SBP (from 134.45 ± 1.39 to 122.01 ± 1.16 mm Hg; p < 0.05) and DBP (from 81.51 ± 1.15 to 71.62 ± 1.01 mm Hg; p < 0.05), which averaged 12.44/9.89 mm Hg. The average daily SBP and DBP indicators significantly decreased from 138.92 ± 1.38 and 85.22 ± 1.20 to 126.35 ± 1.20 and 75.70 ± 1.11 mm Hg (p < 0.05), respectively, which averaged 12.57 and 9.52 mm Hg; and average nocturnal SBP and DBP lowered from 126.13 ± 1.18 and 74.28 ± 1.46 to 113.37 ± 1.40 and 63.73 ± 1.09 mm Hg (p < 0.05), respectively (12.76 and 11.05 mm Hg). There were no significant changes in 24-hour HR. The target blood pressure level by a switch to Telsartan or Telsartan-H alone or in combination with amlodipine at office measurement was achieved in 80.6 % of cases and at daily monitoring in 75.61 %. Thus, in patients with mild to moderate hypertension who had controlled office BP and uncontrolled morning BP surge, the treatment with studied drugs Telsartan and Telsartan-H showed high antihypertensive efficacy both in single-use and in combination with amlodipine. Telmisartan more effectively reduced both the daytime and nighttime SBP and DBP at morning intake compared to the evening. There was a significant decrease in the average SBP, DBP in the morning hours from 140.14 ± 1.51 and 87.19 ± 1.56 to 124.77 ± 1.40 and 73.23 ± 1.31 mm Hg (p < 0.05) by 15.37 and 13.96 mm Hg, respectively. There was also a reduction in the rate of increase of SBP in the morning by 3.67 mm Hg/h after therapy with Telsartan and Telsartan-H. There was a decrease in the value of the morning rise of SBP by 11.34 mm Hg (p < 0.05). Conclusions. Telsartan and Telsartan-H single-use or use in combination with Stamlo (amlodipine) in patients with mild to moderate hypertension who had controlled office BP and uncontrolled morning BP surge significantly reduced both office BP and BP at ABPM and contributed to the reduction of BP morning surge and a decrease of the rate of morning BP surge.
артеріальна гіпертензія; ранковий підйом артеріального тиску; центральний артеріальний тиск; хронотерапія; вечірній прийом; ранковий прийом; телмісартан; амлодипін; гідрохлортіазид
артериальная гипертензия; утренний подъем артериального давления; центральное артериальное давление; хронотерапия; вечерний прием; утренний прием; телмисартан; амлодипин; гидрохлортиазид
arterial hypertension; morning blood pressure surge; central blood pressure; chronotherapy; evening drug intake; mor-ning drug intake; telmisartan; amlodipine; hydrochlorothiazide
Вступ
Основною метою лікування хворих на артеріальну гіпертензію (АГ) залишається зниження рівня артеріального тиску (АТ). Результати останніх великих багатоцентрових досліджень (HOT, CAPPP, STOP–2, ISIGHT, NORDIL, ALLHAT, INVEST) ще раз переконливо довели, що найпростішим поясненням ефекту антигіпертензивної терапії є саме зниження початково підвищеного артеріального тиску [11, 13, 14, 22, 23]. Ефективний контроль артеріального тиску протягом доби без надмірної гіпотензії і додаткових його підйомів забезпечує найкращі результати терапії [4, 21].
Загальновідомо, що серцево–судинні ускладнення АГ найбільш часто виникають у ранкові години [28]. Ранковий підйом артеріального тиску є незалежним чинником, що впливає на розвиток ураження органів–мішеней, а також на виникнення серйозних ускладнень [7, 15]. Так, частота мозкових судинних катастроф вище в пацієнтів із ранковим підйомом артеріального тиску. Встановлено, що ранкове підвищення САТ на 10 мм рт.ст. збільшує ризик інсульту на 25 % [13, 14]. Загальне визнання й включення в міжнародні рекомендації сучасної концепції лікування АГ «одна таблетка; один раз на день» стимулювало використання препаратів із тривалістю антигіпертензивного ефекту 24 години і більше [16, 18, 26, 29]. Така схема лікування «один раз на день» значно збільшує прихильність хворих до тривалої терапії, що позитивно відбивається на кінцевому результаті лікування.
Згідно з рекомендаціями Європейського товариства кардіологів, першою лінією терапії неускладненої АГ, що також підходить більшості пацієнтів з ураженнями органів–мішеней, є комбінація антагоніста ренін–ангіотензинової системи (інгібітору ангіотензинперетворювального фермента або блокатора рецепторів ангіотензину) з блокатором кальцієвих каналів або тіазидним чи тіазидоподібним діуретиком. Блокатор рецепторів ангіотензину ІІ телмісартан і блокатор кальцієвих каналів амлодипін порівняно з іншими представниками своїх фармакотерапевтичних груп мають більші періоди напіввиведення (до 24 і 40 годин відповідно) і, таким чином, здатні забезпечити рівномірний контроль АТ протягом доби, включаючи вранішній період найвищого ризику розвитку серцево–судинних ускладнень.
Використання комбінацій телмісартану з амлодипіном або діуретиком гідрохлортіазидом є поширеною тактикою фармакотерапії АГ, однак їх вплив на згладжування ранкових піків АТ у пацієнтів, які не контролюють офісний тиск і мають неконт–рольовані піки АТ у ранкові години, в українській популяції не був досліджений [30].
Мета. Первинною метою дослідження РАНОК було оцінити ефективність зниження АТ протягом останніх 6 годин із 24 після прийому останньої дози препарату за результатами добового моніторування артеріального тиску (ДМАТ) через 12 тижнів лікування в пацієнтів із м’якою і помірною АГ, які не контролювали офісний тиск та мали неконтрольовані піки АТ протягом останніх 6 годин після прийому останньої дози антигіпертензивного препарату.
Вторинними цілями дослідження РАНОК були: оцінка впливу ранкового або вечірнього прийому препарату на динаміку контролю АТ; оцінка змін АТ при ДМАТ як за весь період, так і за денний і нічний період.
Матеріали та методи
Критерії включення: у дослідження були включені пацієнти (як чоловіки, так і жінки) віком понад 18 років з м’якою і помірною артеріальною гіпертензією згідно з класифікацією ВООЗ (1999) за таких умов: у кінці семиденного періоду відміни всіх антигіпертензивних препаратів середнє значення офісного артеріального тиску, виміряного в першій половині дня в положенні сидячи, було понад 140/90 мм.рт. (офісний АТ у межах 141–179/95–109 мм рт.ст.); середній добовий ДАТ при добовому моніторуванні понад 85 мм рт.ст.; попереднє лікування інгібітором ренін–ангіотензинової системи (раміприлом або валсартаном у монотерапії або в комбінації з гідрохлортіазидом); відсутність скарг на якість нічного сну; згода пацієнта на участь у дослідженні й відсутність критеріїв невключення [1].
Критеріями невключення в дослідження були: вік молодше від 18 і старше за 80 років; діагностована симптоматична АГ; серцева недостатність вище від II функціонального класу (за Нью–Йоркською класифікацією), перенесений упродовж останніх 6 місяців інфаркт міокарда або гостре порушення мозкового кровообігу, декомпенсована АГ, інсулінозалежний цукровий діабет (ЦД) або декомпенсований ЦД 2–го типу; гіперкаліємія, стани після хірургічних втручань; прийом корикостероїдних препаратів; постійна або персистуюча форма фібриляції передсердь (під час пароксизму); ураження нирок зі швидкістю клубочкової фільтрації < 30 мл/хв; психічні розлади, залежності, вагітність або планування вагітності, годування груддю, робота в нічний час.
Пацієнтам на початку дослідження й через 12 тижнів (3 місяці) лікування проводили такі обстеження: офісне вимірювання АТ, ДМАТ із визначенням ранкового підйому АТ, визначення жорсткості артерій, визначення центрального АТ, визначення швидкості поширення пульсової хвилі (ШППХ) по артеріях еластичного (ШППХе) і м’язового (ШППХм) типів, біохімічне дослідження крові, ехокардіографію (ЕхоКГ), проводили реєстрацію побічних явищ. Проміжне офісне вимірювання АТ, ДМАТ проводили також через 8 тижнів (2 місяці) лікування.
12–тижневе (3–місячне) відкрите спостереження включало 3 періоди: скринінгу, відміни всіх антигіпертензивних препаратів, прийому телмісартану (Телсартан, Телсартан–Н, «Доктор Редді’с Лабораторіз Лімітед», Індія) з поступовим збільшенням дози і/або додаванням препарату Стамло (амлодипін) залежно від рівня досягнутого офісного АТ [29]. У перший період проводилося визначення відповідності пацієнта критеріям включення за даними анамнезу, результатами об’єктивного обстеження, даними ДМАТ.
У другий період відміняли всі антигіпертензивні препарати й у кінці проводили повторний аналіз відповідності хворого критеріям включення, виконували загальний аналіз крові, сечі, біохімічне дослідження крові, вимірювання офісного АТ, амбулаторне 24–годинне моніторування АТ з визначенням циркадності АТ, ранкового підйому АТ, визначення центрального АТ, ШППХ. У третьому періоді в ранкові (1–ша підгрупа) або вечірні (2–га підгрупа) години призначали телмісартан у дозі 40 або 80 мг один раз на день (Телсартан, «Др. Редді’с Лабораторіз Лімітед») або фіксовану комбінацію телмісартану 40 або 80 мг із гідрохлортіазидом 12,5 мг (Телсартан–Н, «Др. Редді’с Лабораторіз Лімітед»); при недосягненні цільового рівня офісного АТ менше від 140/90 мм рт.ст. через 4 тижні додавали амлодипін 5 або 10 мг один раз на добу (Стамло, «Др. Редді’с Лабораторіз Лімітед»).
Протягом усього періоду лікування здійснювався контроль офісного АТ і частоти серцевих скорочень (ЧСС), оцінювалося співробітництво хворого з лікарем, ефективність проведеної терапії, реєструвалися випадки розвитку побічних реакцій.
Вимірювання систолічного АТ (САТ) і діастолічного АТ (ДАТ) проводили на початку дослідження, після семиденної (у разі необхідності) відміни всіх антигіпертензивних препаратів і в кінці лікування. Вимірювали АТ у положенні сидячи тричі з інтервалом 1–2 хвилини. Визначали середнє з трьох вимірів. ЧСС визначали після другого вимірювання.
Індекс маси тіла (ІМТ) визначали за формулою: ІМТ = маса тіла/(ріст)2, кг/м2.
Методика добового моніторування артеріального тиску. ДМАТ виконували за допомогою апаратів BPLab (BPLab GmbH) або АВРМ–04М (фірма «Медітек», Угорщина). Обробку даних проводили за допомогою програмного забезпечення апарату на ПК. Моніторування проводили в такому режимі: у денний час — кожні 15 хвилин, вночі (з 22:00 до 6:00) — кожні 30 хвилин. Хворі вели звичайний спосіб життя, з побутовими фізичними й психоемоційними навантаженнями. При цьому вивчали такі показники: середньодобовий, денний, нічний систолічний АТ (24САТ, САТ день, САТ ніч), середньодобовий, денний, нічний діастолічний АТ (24ДАТ, ДАТ день, ДАТ ніч), середньодобову, денну, нічну ЧСС (24ЧСС, ЧСС день, ЧСС ніч). При аналізі ДМАТ для САТ і ДАТ розраховували індекс часу, що характеризує часове перевантаження тиском протягом доби й визначається як відсоток вимірів АТ, що перевищує 140/90 мм рт.ст. вдень і 120/80 мм рт.ст. вночі. Також визначали індекс навантаження тиском, що є площею між кривою підвищеного АТ і лінією границі норми, а також індекс варіабельності, який обчислювали як стандартне відхилення (СВ) величини АТ. Крім того, за допомогою програмного забезпечення вираховували добовий індекс (ДІ) – відсоток зниження нічного АТ порівняно з денним. За норму прийняли значення артеріального тиску, рекомендовані у 2018 році АНА/АСС: для середнього денного САТ — 135 мм рт.ст., для середнього денного ДАТ — 85 мм рт.ст., для середнього добового САТ — 130 мм рт.ст., для середнього добового ДАТ — 80 мм рт.ст. [24].
При оцінці добового ритму АТ нормальним вважається зменшення АТ вночі під час сну на 10–20 % порівняно з денним періодом. Ступінь нічного зниження САТ і ДАТ, або добовий індекс, розраховували за формулою (окремо для САТ та ДАТ):
ДІ = (серАТд – серАТн) ´ 100 %/серАТд,
де серАТд — середньоденний АТ (САТ або ДАТ),
серАТн — середньонічний АТ (САТ або ДАТ).
Нормальне зниження АТ вночі (dipper) — 10–20 %; недостатнє зниження (non–dipper) — 0–10 %; підвищений ступінь нічного зниження (hyper–dipper) — понад 20 %; стійке підвищення АТ вночі (night–peaker) — нічний АТ більший за денний.
Крім даних за 24 години, активний і пасивний період, розраховували середні показники за спеціальний період (6:00–12:00), а також показники рівня підвищення САТ у ранкові години і швидкості максимального підвищення САТ у ранкові години за такою методикою: max САТ у ранкові години – min САТ у нічний час; (max САТ у ранкові години – min САТ у нічний час)/(t max САТ – t min САТ), де t — час, у який реєструвався САТ. Визначали рівень максимального підвищення САТ у ранкові години. Нормальною вважається величина різниці між максимальним ранковим САТ і мінімальним нічним САТ 34 ± 18 мм рт.ст. Показники ранкового підйому АТ визначаються тільки для САТ [5, 15, 29, 127].
Біохімічне дослідження крові виконували на автоматичному біохімічному аналізаторі А25 (BioSystems, Іспанія) в лабораторії ДУ «ННЦ «Інститут кардіології ім. акад. М.Д. Стражеска» НАМН України. За рівнем креатиніну розраховували ШКФ з використанням формули CKD–EPI, затвердженої рекомендаціями Kidney Disease Improving Global Outcomes (KDIGO) 2012 [17]:
ШКФ = 141 ´ мін(креатинін/k, 1)a ´ макс(креатинін/k, 1)–1,209 ´ 0,993Вік [´ 1,018 для жінок] [´ 1,159 для негроїдної раси],
де ШКФ — швидкість клубочкової фільтрації, креатинін — концентрація креатиніну в сироватці крові в мг/дл, k = 0,7 для жінок і 0,9 для чоловіків, a = –0,329 для жінок і –0,411 для чоловіків; мін — мінімальне значення показника креатинін/k або 1; макс — максимальне значення показника креатинін/k або 1.
Визначали рівень креатиніну, калію і натрію, глюкози, загального холестерину (ХС), тригліцеридів (ТГ), ХС ліпопротеїдів високої щільності (ХС–ЛПВЩ), ХС ліпопротеїдів низької щільності (ХС–ЛПНЩ), ХС ліпопротеїдів дуже низької щільності (ХС–ЛПДНЩ) сироватки крові. Рівень реніну, альдостерону крові, ренін–альдостеронове співвідношення й метанефрини в добовій сечі, рівень гормонів щитоподібної залози (Т3, Т4, тиреотропний гормон) визначали в лабораторії «ДІЛА». Вміст загального ХС, ТГ, ХС ЛПНЩ, ХС ЛПДНЩ визначали в ммоль, індекс атерогенності (ІА) — в умовних одиницях. Фракції ХС–ЛПНЩ, ХС–ЛПДНЩ та ІА розраховували за формулами W. Friedwald:
ХС–ЛПНЩ = ЗХ – (ХС–ЛПВЩ + ТГ/2,2), ммоль/л;
ХС–ЛПДНЩ = ТГ/2,2, ммоль/л;
ІА = (ЗХ – ХС–ЛПВЩ)/ХС–ЛПВЩ, ум.од.
ШППХ і центральний АТ визначалися на апараті Sphygmocor–PVx (AtCor Medical Pty Ltd, Австралія), з’єднаному із персональним комп’ютером, що дозволяє проводити аналіз форми пульсової хвилі й визначати ШППХ по артеріях еластичного і м’язового типу. П’єзодатчики встановлювали на загальній правій артерії, на стегновій артерії і радіальній артерії правого передпліччя під візуальним (на моніторі) й автоматичним контролем якості, що здійснювався за допомогою відповідної програми приладу. Час запізнювання і швидкість поширення пульсової хвилі, центральний АТ визначалися автоматично за допомогою програмного забезпечення приладу після введення величини відстані між датчиками, що вимірювалася сантиметровою смужкою. Для оцінки пружно–еластичних властивостей артерій еластичного типу ШППХ визначали на сегменті «сонна артерія — стегнова артерія», для оцінки пружно–еластичних властивостей артерій м’язового типу — на сегменті «сонна артерія — радіальна артерія». Окрім ШППХ, визначали також центральний АТ за допомогою програмного забезпечення приладу на основі артеріального тиску на плечовій артерії та форми отриманої пульсової хвилі у висхідній аорті (формула визначена виробником, проведена стандартизація при інтрааортальному вимірюванні артеріального тиску).
У роботі приладу Sphygmocor–PVx застосовується методика апланційної тонометрії, що дозволяє отримувати криву периферичної пульсової хвилі. Записана крива зміни тиску на а.radialis і а.carotis автоматично калібрувалася до АТ, що вимірюється на a.brachialis. При аналізі систолічної частини кривої наряду з центральним САТ визначали такий показник, як індекс приросту (АІх) і час вигнання (Ejection duration). Індекс приросту — це відношення різниці між другим і першим систолічним піком кривої пульсової хвилі до пульсового АТ, подане у відсотках. Він може мати негативне значення (із знаком мінус), частіше в дуже молодих людей з еластичними судинами. AIx залежить від інтенсивності відбивання пульсової хвилі, тривалості періоду вигнання крові зі шлуночків серця, часу відбивання пульсової хвилі (час поширення пульсової хвилі від серця на периферію і в зворотному напрямку). Останній фактор тісно пов’язаний із ШППХ. Чим більша швидкість, тим раніше зустрічається відбита пульсова хвиля із прямою, тим раніше виникає перший систолічний пік і тим більша різниця між другим і першим систолічним піком. Інтенсивність відбивання залежить від діаметра й еластичності малих артерій і артеріол.
Окрім того, AIx збільшується при збільшенні середнього АТ, адже при підвищенні АТ збільшується тиск розтягування артерій, зменшується амплітуда коливання їх стінок і підвищується швидкість поширення пульсової хвилі по них. AIx зменшується при збільшенні частоти серцевих скорочень, негативно корелює з ростом людини: чим більший зріст, тим менша величина індексу приросту. Останнім фактом пояснюється більше значення показника в осіб жіночої статі в популяції. Показано, що AІx, визначений за допомогою SphygmoCor, корелює з віком, зростом, ЧСС, САТ і ДАТ, середнім АТ, пульсовим тиском, а також масою тіла та статтю [12]. Дослідження з близнюками виявили, що величина індексу приросту частково успадковується. Час вигнання визначався у відсотках як співвідношення між тривалістю систоли і загальним періодом серцевого циклу (систола + діастола).
Зареєстрована форма контуру пульсової хвилі надалі калібрується відповідно до САТ і ДАТ на плечовій артерії з визначенням форми й розрахунком показників центральної пульсової хвилі. Прилад перетворює контур периферичної пульсової хвилі в центральний, використовуючи спеціальний алгоритм — трансферну функцію. Усереднений контур формується при накладанні контурів кількох послідовних пульсових хвиль, і результуючий контур виводиться на монітор комп’ютера, до якого під’єднаний прилад.
Тривалість викиду — це тривалість часу від початку пульсової хвилі до закриття аортального клапана, що на кривій контуру пульсової хвилі позначається дикротичною виїмкою. Знижена тривалість вигнання може бути показником систолічної дисфункції в пацієнтів із серцевою недостатністю.
Субендокардіальний індекс життєздатності (SEVR) відображає відношення перфузії міокарда до потреби в його постачанні. Цей показник визначає здатність артеріальної системи забезпечувати постачання серця енергією. Використовуючи показник тривалості вигнання периферичної пульсової кривої, розраховують площу під систолічною й діастолічною частинами аортальної пульсової кривої. Оцінюють 2 показники: індекс часу напруження (TTI), який відповідає систолічній частині пульсової кривої, та індекс часу діастолічного тиску (DPTI), що відповідає діастолічній частині пульсової кривої. Зниження SEVR вказує на зменшення міокардіальної перфузії.
ШППХ є вищою при більшій жорсткості стінки артерій, більшій їх товщині, меншій густині крові й меншому радіусі артерій. Для визначення ШППХ пульсова хвиля реєструється на проксимальній (спільна сонна) і дистальній (стегнова й променева) артеріях. За допомогою сантиметрової стрічки через поверхню тіла вимірюють відстань між місцями реєстрації пульсової хвилі (d), а прилад визначає час спізнення (t) появи пульсової хвилі в дистальній точці. Час спізнення визначається при синхронізації з електрокардіограмою. ШППХ розраховується за формулою: ШППХ = Δd/Δt.
ШППХ на сегменті «спільна сонна — стегнова артерія» відображає швидкість поширення пульсової хвилі по артеріях еластичного типу, на сегменті «спільна сонна — променева артерія» — по артеріях м’язового типу.
Отже, використання методики апланаційної тонометрії дозволяє оцінити ураження судин та інших органів–мішеней як в осіб із загальної популяції, так і, зокрема, у хворих з АГ.
За даними літератури, проведення аналізу пульсової хвилі в пацієнтів із різними факторами ризику виявило, що незалежно від рівня АТ індекс приросту підвищується з віком, у пацієнтів із цукровим діабетом першого типу і гіперхолестеринемією. У багатьох клінічних проспективних дослідженнях (ASCOT, SEARCH, FIELD та ін.) вивчалося прогностичне значення АІх. Виявилося, що приріст величини індексу на 10 % супроводжується збільшенням ризику виникнення серцево–судинних подій у 1,28 раза незалежно від інших факторів. При цьому в пацієнтів із кінцевою стадією ниркової недостатності вплив індексу приросту на прогноз не залежав від величини ШППХ [16, 17].
ЕхоКГ виконували за допомогою ультразвукового діагностичного апарату Imagic Agile (Kontron Medical, Франція) у М– і В–режимі за стандартним протоколом. Визначались: розмір аорти, лівого передсердя (ЛП), кінцево–діастолічний (КДР) і кінцево–систолічний розмір (КСР) лівого шлуночка (ЛШ), кінцево–систолічний (КСО) і кінцево–діастолічний (КДО) об’єми ЛШ і фракція викиду ЛШ. Маса міокарда лівого шлуночка (ММЛШ) розраховувалась за формулою Американського товариства ехокардіографії (American Society of Echocardiography), використання якої рекомендовано Європейським товариством гіпертензії (European Society of Hypertension) і Європейським товариством кардіологів (European Society of Cardiology):
ММЛШ (г) = 0,8 (1,04 [(КДР + ТЗСЛШ + ТМШП)³ – (КДР)³]) + 0,6 г,
де ММЛШ (г) — маса міокарда лівого шлуночка, КДР — кінцево–діастолічний розмір ЛШ, см; ТЗСЛШ — товщина задньої стінки лівого шлуночка в діастолу, см; ТМШП — товщина міжшлуночкової перегородки в діастолу, см; 1,04 — розрахунковий коефіцієнт; 0,8 — розрахунковий коефіцієнт.
Індекс маси міокарда лівого шлуночка (ІММЛШ) вираховувався за формулою: ІММЛШ (г/м²) = ММЛШ/площа поверхні тіла.
Ехокардіографічними критеріями гіпертрофії лівого шлуночка були: ІММЛШ для чоловіків — > 115 г/м2, для жінок — > 95 г/м2.
Статистичний аналіз результатів дослідження
На основі отриманих показників було створено базу даних у системі програми IBM SPSS Statistics 21. Статистичну обробку результатів здійснювали за допомогою програмного забезпечення IBM Statistics SPSS 21. Оскільки вибірка підлягала нормальному розподілу, для аналізу даних використовувались стандартні методи описової статистики з розрахунком таких показників: М — середня арифметична величина, m — похибка стандартного відхилення від середньої арифметичної величини, мода, медіана, розмах вибірки, максимальне та мінімальне значення величини, р — коефіцієнт достовірності. Достовірною вважали відмінність р < 0,05. Достовірність результатів визначали за допомогою парного двовибіркового тесту з використанням t–критерію Стьюдента для середніх величин, кореляційний аналіз для незалежних варіант, парний факторний кореляційний аналіз з розрахунком r — коефіцієнта кореляції за Спірменом і багатофакторний регресійний аналіз, критерій χ2 (хі–квадрат). Достовірною вважали кореляцію між двома варіантами при значенні р < 0,05.
Результати
У дослідження було включено 67 пацієнтів із м’якою і помірною артеріальною гіпертензією (28 чоловіків і 39 жінок), які отримували в ранкові (1–ша підгрупа) або вечірні (2–га підгрупа) години телмісартан у дозі 40–80 мг/добу (Телсартан, виробництво «Др. Редді’с Лабораторіз Лімітед», Індія) у монотерапії, або у вигляді фіксованої комбінації з гідрохлортіазидом 12,5 мг (Телсартан–Н), або у комбінації з амлодипіном, середній вік пацієнтів становив 52,31 ± ± 1,67 року. Термін спостереження становив 12 тижнів (3 місяці). Загальна вихідна характеристика пацієнтів, включених в дослідження, подана в табл. 1, 2.
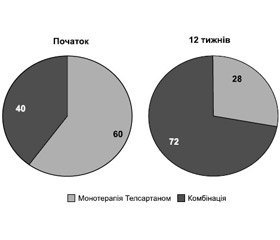
На початку терапії 40 % пацієнтів отримали монотерапію телмісартаном у дозі 40–80 мг один раз на добу (Телсартан), а 60 % — комбіновану терапію у вигляді фіксованої комбінації — Телсартан–Н (телмісартан 40 або 80 мг плюс 12,5 мг гідрохлортіазиду) або Телсартан–Н у комбінації з амлодипіном 5–10 мг (Стамло). Через 12 тижнів лікування вже 72 % пацієнтів приймали комбіновану терапію і тільки 28 % залишились на монотерапії телмісартаном. Дані подані на рис. 1.
У 3 пацієнтів на фоні лікування виникли побічні реакції, що потребували відміни препарату:
— 1 пацієнт — головний біль через 1 місяць терапії потрійною комбінацією «телмісартан 80 мг + + гідрохлортіазиду 12,5 мг + 10 мг амлодипіну», що був пов’язаний з неадекватним контролем АТ;
— 1 пацієнт — запаморочення через різке зниження АТ;
— 1 пацієнт — кашель.
Динаміка офісного АТ подана на рис. 2. Як бачимо, вихідний рівень офісного САТ/ДАТ становив 152,04/94,82 ± 1,45/0,85 мм рт.ст., ЧСС — 72,28 ± 1,22 уд/хв, що відповідає помірному ступеню тяжкості цих хворих. На тлі проведеної терапії Телсартаном і Телсартаном–Н відбувалося достовірне зменшення САТ (з 152,04 ± 1,45 мм рт.ст. до 135,12 ± 1,17 мм рт.ст. (р < 0,05) через 8 тижнів і до 130,78 ± 1,01 мм рт.ст. (р < 0,05) через 12 тижнів лікування) і ДАТ (з 94,82 ± 0,85 мм рт.ст. до 85,26 ± 0,92 мм рт.ст. (р < 0,05) через 8 тижнів лікування й до 82,70 ± 0,79 мм рт.ст. (р < 0,05) через 12 тижнів лікування), що в середньому становило через 8 тижнів 16,92/9,56 мм рт.ст., а через 12 тижнів лікування — 21,26/12,12 мм рт.ст. Офісна ЧСС достовірно не змінилася.
Динаміка досліджуваних показників за 24 години, активний і пасивний періоди подана в табл. 3. Як видно з табл. 3, вихідний середньодобовий рівень САТ становив 134,45 ± 1,39 мм рт.ст., ДАТ — 81,51 ± 1,15 мм рт.ст., ЧСС — 72,87 ± 1,24 уд/хв, що відповідає ступеню тяжкості цих хворих. На тлі проведеної терапії Телсартаном і Телсартаном–Н відбувалося достовірне зменшення середньодобового САТ (з 134,45 ± 1,39 мм рт.ст. до 122,01 ± 1,16 мм рт.ст., р < 0,05) і ДАТ (з 81,51 ± 1,15 мм рт.ст. до 71,62 ± 1,01 мм рт.ст., р < 0,05), що в середньому становило 12,44 і 9,89 мм рт.ст. відповідно.
Відзначено також достовірне зменшення середньоденних показників САТ і ДАТ: з 138,92 ± 1,38 мм рт.ст. і 85,22 ± 1,20 мм рт.ст. до 126,35 ± ± 1,20 мм рт.ст. і 75,70 ± 1,11 мм рт.ст. (р < 0,05) відповідно, що в середньому становило 12,57 і 9,52 мм рт.ст., і середньонічних показників САТ і ДАТ: з 126,13 ± 1,18 мм рт.ст. і 74,28 ± 1,46 мм рт.ст. до 113,37 ± 1,40 мм рт.ст. і 63,73 ± 1,09 мм рт.ст. (р < 0,05) відповідно (12,76 і 11,05 мм рт.ст.).
Достовірних змін ЧСС не було.
Досягнення цільового АТ на фоні прийому Телсартану або Телсартану–Н самостійно або в комбінації з амлодипіном (Стамло) при офісному вимірюванні становило 80,6 %, а при добовому моніторуванні — 75,61 %.
Отже, у хворих із м’якою і помірною артеріальною гіпертензією досліджувані препарати Телсар–тан і Телсартан–Н продемонстрували досить високий антигіпертензивний ефект як при використанні у вигляді монотерапії, так і в комбінації з амлодипіном (Стамло).
Були проаналізовані показники динаміки артеріального тиску протягом спеціального періоду з 6:00 до 12:00. Дані подані в табл. 4. Відзначено достовірне зниження середніх САТ, ДАТ у ранкові години з 140,14 ± 1,51 мм рт.ст. і 87,19 ± 1,56 мм рт.ст. до 124,77 ± 1,40 мм рт.ст. і 73,23 ± 1,31 мм рт.ст. (р < 0,05), на 15,37 і 13,96 мм рт.ст. відповідно. Також відбувалося зниження швидкості підвищення САТ у ранкові години на 3,67 мм рт.ст/год на фоні терапії Телсартаном і Телсартаном–Н. Дані подані на рис. 3. Відбулося зменшення величини ранкового підйому САТ на 11,34 мм рт.ст. (р < 0,05). Динаміка показника рівня підвищення САТ в ранкові години подана на рис. 4.
Отже, можна сказати, що терапія Телсартаном і Телсартаном–Н у комбінації з препаратом Стамло або без нього сприяла зменшенню величини АТ у ранкові години, зниженню швидкості підвищення АТ у ранкові години, що може сприяти зменшенню серцево–судинних подій, які частіше трапляються саме в ранкові години.
Оцінюючи вплив Телсартану й Телсартану–Н на зміни центрального тиску й пружно–еластичні властивості артерій, можна сказати, що терапія була ефективною. Так, зменшення центрального САТ через 3 місяці терапії становило 15,0 мм рт.ст. (р < 0,05), також спостерігалась тенденція до зменшення індексу аугментації. Дані подані на рис. 5.
Незважаючи на відносно короткий термін спостереження — 3 місяці, на фоні лікування Телсартаном і Телсартаном–Н спостерігалось зменшення жорсткості судин, що проявилось у зменшенні швидкості поширення пульсової хвилі по артеріях еластичного й м’язового типів з 11,45 до 10,12 м/с (р < 0,05) і з 9,79 до 9,09 м/с (р > 0,05) відповідно. Дані подані на рис. 6.
Ми оцінили, як змінювався АТ при добовому моніторуванні на фоні прийому телмісартану залежно від вечірнього чи ранкового прийому. Дані подані в табл. 5. Зниження 24САТ/24ДАТ на фоні прийому телмісартану було достовірно більш виражене при ранковому прийомі порівняно з вечірнім прийомом: 16,48 ± 2,86/12,56 ± 2,80 мм рт.ст. проти 4,93 ± 1,53/5,40 ± 1,89 мм рт.ст., р < 0,01. Отже, ранковий прийом телмісартану більш виражено знижував середньо– добовий АТ.
Оцінюючи зниження середньоденного САТ/ДАТ, ми відмітили, що достовірна різниця у вечірні й ранкові години була при прийомі телмісартану 16,55 ± 2,72/12,17 ± 2,01 мм рт.ст. проти 6,15 ± 2,10/5,55 ± 2,09 мм рт.ст., р < 0,05, тобто ранковий прийом телмісартану краще знижував середньо–денний САТ/ДАТ порівняно з вечірнім прийомом. За впливом на середньонічний САТ/ДАТ ми відмітили більш виражене зниження АТ при прийомі телмісартану в ранкові години порівняно з вечірнім прийомом: 16,08 ± 3,13/14,00 ± 3,64 мм рт.ст. проти 5,06 ± 2,74/5,25 ± 2,27 мм рт.ст., р < 0,05. Тобто при застосуванні телмісартану була різниця між ранковим і вечірнім прийомом за впливом на середньоденний САТ/ДАТ.
Телмісартан більш ефективно знижував як середньонічний САТ, так і середньонічний ДАТ при ранковому прийомі порівняно з вечірнім. Дані подані в табл. 6.
Нами не відмічено достовірної різниці в зміні лабораторних показників на фоні лікування. Дані подані в табл. 7.
Обговорення
Відомо, що контроль АТ у ранкові години може дати додаткові переваги в лікуванні хворих на АГ: знизити додатковий ризик розвитку серцево–судинних ускладнень [8–10, 22]. Важливо підкреслити, що чим довша тривалість дії антигіпертензивного препарату, тим краще буде контролюватися рівень артеріального тиску в ранкові години. Одним з механізмів, відповідальних за ранкове підвищення артеріального тиску, є підвищення активності симпатичної нервової системи, тому використання препаратів тривалої дії для цього є патогенетично обґрунтованим [6].
Відомо, що не всі антигіпертензивні препарати для одноразового прийому на добу забезпечують оптимальний контроль артеріального тиску в ранкові години. Отримані нами дані переконливо показують, що використання досліджуваних препаратів Телсартан і Телсартан–Н у комбінації зі Стамло 1 раз на добу або без нього дозволило знизити рівень артеріального тиску в період з 6–ї до 12–ї години (через добу після прийому препарату) навіть більшою мірою — на 15,37/13,96 мм рт.ст., ніж у середньому протягом доби (12,44/9,89 мм рт.ст.) або ж в активний (12,57/9,52 мм рт.ст.) і пасивний період (12,76/11,05 мм рт.ст.). Таким чином підтверджується контроль артеріального тиску телмісартаном протягом доби, у тому числі в ранкові години.
Крім того, важливим, на наш погляд, є зниження рівня підвищення САТ у ранкові години більше ніж на 10 мм рт.ст., що так само свідчить про достовірний вплив досліджуваного препарату на можливі патогенетичні механізми цього процесу — активацію симпатоадреналової системи [2, 3].
Отже, використання телмісартану — препарату з наближеним до тривалості доби періодом напіввиведення (близько 24 годин) у хворих з м’якою і помірною АГ 1 раз на добу за даними ДМАТ дозволило ефективно знизити рівень АТ протягом доби як у денний і нічний час, так і в ранкові години. При використанні зазначеного режиму терапії спостерігалося достовірне зниження ступеня підвищення САТ у ранкові години й зменшення швидкості підвищення САТ у ранкові години.
Висновки
1. Використання Телсартану і Телсартану–Н у дозі 40–80 мг 1 раз на добу у хворих з м’якою і помірною артеріальною гіпертензією з контрольованим офісним тиском і неконтрольованими піками АТ у ранкові години забезпечує достовірне рівномірне зниження систолічного й діастолічного артеріального тиску протягом усієї доби, включаючи ранкові години
2. У хворих з м’якою і помірною артеріальною гіпертензією з контрольованим офісним тиском і неконтрольованими піками АТ у ранкові години прийом Телсартану й Телсартану–Н у дозі 40–80 мг
1 раз на добу сприяв достовірному зниженню ступеня підвищення систолічного артеріального тиску й зменшенню швидкості підвищення його в ранкові години.
3. Телмісартан більш виражено знижував середньодобовий артеріальний тиск при прийомі в ранкові години порівняно з вечірнім прийомом.
4. Телмісартан більш ефективно знижував середньонічний САТ і ДАТ при ранковому прийомі порівняно з вечірнім.
5. Телмісартан як у моно–, так і в комбінованій терапії був ефективним і добре переносився хворими.
6. Переключення на телмісартан як в моно–, так і в комбінованій терапії можна рекомендувати пацієнтам з контрольованим офісним тиском і не–контрольованими піками АТ у ранкові години.
Конфлікт інтересів. Не заявлений.
1. 1999 WHO — ISH guidelines for the management of hypertension. J. Hypertension. 1999. Vol. 11. P. 905–916.
2. Bartter F.C., Delea C.S., Baker W. Chronobiology in the diagnosis and treatment of hypertension. Chronobiologia. 1976. Vol. 3(3). 199–213.
3. Bowles N.P., Thosar S.S., Herzig M.X., Shea S.A. Chronotherapy for Hypertension. Current Hypertension Reports. 2018. Vol. 20. Р. 97. URL: https://doi.org/10.1007/s11906–018–0897–4.
4. Elliott H.L. 24–hour control of cardiovascular disease. Science Press: London, 1995. P. 48.
5. Formes K.J., Wray D.W., O–Yurvati A.H., Weiss M.S., Shi X. Sympathetic cardiac influence and arterial blood pressure instability. Auton. Neurosci. 2005. Vol. 1–2. P. 116–124.
6. Genova G., Rabbia F., Milan A. et al. Autonomic nervous pattern influence before treatment, on the response to antihypertensive therapy in never treated mild hypertensive patients. J. Hypertens. 2001. Vol. 19. P. 128S.
7. Hansson L., Hedner T. Hypertension Manual 2000. Layout Bohlin Production AB, 2000. 128 p.
8. Hermida R.C., Ayala D.E., Mojón A., Fernández J.R. Effects of time of antihypertensive treatment on ambulatory blood pressure and clinical characteristics of subjects with resistant hypertension. Am. J. Hypertens. 2010. Vol. 23. Р. 432–439.
9. Hong S.J., Choi S.C., Ahn C.M., Park J.H., Kim J.S., Lim D.S. Telmisartan reduces neointima volume and pulse wave velocity 8 months after zotarolimus–eluting stent implantation in hypertensive type 2 diabetic patients. Heart. 2011. Vol. 97. Р. 1425–1432.
10. Hypertension Primer. The essentials of high blood pressure. From the council on high blood pressure research American Heart Association, 1999. P. 471.
11. Ishikawa J., Kario K., Hoshide S. еt al. Determinants of exaggerated difference in morning and evening blood pressure measured by self–measured blood pressure monitoring in medicated hypertensive patients: Jichi Morning Hypertension Research (J–MORE) Study. Am. J. Hypertens. 2005. Vol. 7. P. 958–965.
12. Jatoi N.A. Azra Mahmud, Kathleen Bennett, John Feely. Assessment of arterial stiffness in hypertension: comparison of oscillometric (Arteriograph), piezoelectronic (Complior) and tonometric (SphygmoCor) techniques. J. Hypertens. 2009. Vol. 27. № 11. P. 2186–2191.
13. Johannesson M., Dahlof B., Lindholm L.H. et al. The cost–effectiveness of treating hypertension in elderly people — an analysis of the Swedish Trial in Old Patients with Hypertension (STOP–Hypertension). J. Intern. Med. 1993. Vol. 234. P. 317–323.
14. Jonsson B., Hansson L., Stalhammar N.O. Health economics in the Hypertension Optimal Treatment (HOT) study: costs and cost–effectiveness of intensive blood pressure lowering and low–dose aspirin in patients with hypertension. J. Intern. Med. 2003. Vol. 253. P. 472–480.
15. Kario K. Early morning risk management in hypertension. London: Science press, 2004. P. 3–11.
16. Kasim N.A., Whitehouse M., Ramachandran C. еt al. Molecular properties of WHO essential drugs and provisional biopharmaceutical classification. Mol. Pharm. 2004. Vol. 1. P. 85–96.
17. Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2012 clinical practice guideline for the evaluation and management of chronic kidney disease. Kidney Int. Suppl. 2013. Vol. 3. Р. 100–150.
18. Marfella R., Siniscalchi M., Nappo F. еt al. Regression of carotid atherosclerosis by control of morning blood pressure peak in newly diagnosed hypertensive patients. Am. J. Hypertens. 2005. Vol. 3. P. 308–318.
19. Mitchell G.F., Hwang Shih–Jen, Vasan R.S. Arterial stiffness and cardiovascular events: the Framingham heart study. Circulation. 2010. Vol. 121. № 4. P. 505–511.
20. Sakima A., Takishita S. Therapeutic strategy for morning blood pressure elevation in elderly hypertensives. Nippon. Rinsho. 2005. Vol. 6. P. 1086–1090.
21. Shimamoto K., Ando K., Fujita T. еt al. Japanese Society of Hypertension Committee for Guidelines for the Management of Hypertension. The Japanese Society of Hypertension Guidelines for the Management of Hypertension (JSH 2014). Hypertens. Res. 2014. 37. Р. 253–390.
22. Sleight P. The HOPE Study (Heart Outcomes Prevention Evaluation). J. Renin Angiotensin Aldosterone Syst. 2000. Vol. 1(1). Р. 18–20.
23. Staessen J., Fagard R., Thijs L., O’Brien. Randomised double–blind comparison of placebo and active treatment for older patients with isolated systolic hypertension. The Systolic Hypertension in Europe (Syst–Eur) Trial Investigators. Lancet. 1997. 350(9080). Р. 757–764.
24. van der Steen M.S., Lenders J.W., Thien T. Side effects of ambulatory blood pressure monitoring. Blood Press. Monit. 2005. Vol. 3. P. 151–155.
25. Verdecchia P., Angeli F. How can we use the results of ambulatory blood pressure monitoring in clinical practice? Hypertension. 2005. Vol. 1. Р. 25–26.
26. White W. Blood pressure monitoring in cardiovascular medicine and therapeutics. New Jersey: Humana Press, 2001. Р. 308.
27. White W.B., Davidai G., Schumacher H. Impact of angiotensin receptor blockade in combination with hydrochlorothiazide 25 mg in 2121 patients with stage 1–2 hypertension. J. Hum. Hypertens. 2009. Vol. 23. Р. 817–825.
28. White W.B., Lacourciere Y., Davidai G. Effects of the angiotensin II receptor blockers telmisartan versus valsartan on the circadian variation of blood pressure: impact on the early morning period. Am. J. Hypertens. 2004. Vol. 17. Р. 347–353.
29. The Task Force for the management of arterial hypertension of the European Society of Cardiology (ESC) and the European Society of Hypertension (ESH). 2018 ESC/ESH Guidelines for the management of arterial hypertension. European Heart Journal. 2018. Vol. 39. Р. 3021–3104.
30. Gosse P. A review of telmisartan in the treatment of hypertension: blood pressure control in the early morning hours. Vascular Health and Risk Management. 2006. 2(3). Р. 195–201.

/118-1.jpg)
/119-1.jpg)
/120-1.jpg)
/121-1.jpg)
/121-2.jpg)
/122-1.jpg)