Журнал «» №3-4 (65-66), 2019
Вернуться к номеру
Прогноз та його предиктори при легеневій гіпертензії, асоційованій із захворюваннями сполучної тканини (дані першого українського реєстру)
Авторы: Сіренко Ю.М., Радченко Г.Д., Живило І.О., Тітов Є.Ю., Деяк С.І.
ДУ «ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України», м. Київ, Україна
Рубрики: Кардиология
Разделы: Клинические исследования
Версия для печати
Метою дослідження було: провести аналіз структури пацієнтів, які обстежувалися у спеціалізованому центрі; оцінити українську реальність щодо виживання хворих на легеневу артеріальну гіпертензію (ЛАГ) та хронічну тромбоемболічну легеневу гіпертензію (ХТЕЛГ), які проходили лікування в референтному центрі (раніше ми не мали українських даних); визначити предиктори смерті. Матеріали та методи. Проаналізовано дані 359 хворих із легеневою гіпертензією (ЛГ): з ідіопатичною ЛАГ — 72 (20,1 %), із ЛАГ, асоційованою із захворюванням сполучної тканини, — 20 (5,6 %), із ЛАГ, асоційованою з ВІЛ-інфекцією, — 8 (2,2 %), із ЛАГ, асоційованою з портальною гіпертензією, — 4 (1,1 %), із ЛАГ, асоційованою з уродженими вадами серця, — 171 (47,6 %), із ЛГ унаслідок захворювань лівих відділів серця — 8 (2,2 %), ЛГ унаслідок захворювань легень — 6 (1,7 %), із ХТЕЛГ — 62 (17,3 %), ЛГ змішаної етіології — 8 (2,2 %). Для оцінки виживання включений 281 пацієнт (52 (18,5 %) із ХТЕЛГ та 229 (81,5 %) із ЛАГ), які пройшли лікування в центрі легеневої гіпертензії ДУ «ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України». Діагноз легеневої гіпертензії встановлювався на основі даних катетеризації правих відділів серця. Виживання визначали за методом побудови кривих Kaplan — Meier. Строк спостереження становив 51 місяць. Предиктори визначалися за допомогою бінарної логістичної регресії та Сох-регресійного аналізу. Результати. Виживання загальної когорти пацієнтів становило 93,3; 86,8 та 81,5 % на етапах один, два та три роки відповідно. Найкраще виживання було в пацієнтів із ЛАГ, асоційованою з уродженими вадами серця (92,7 %) порівняно з ідіопатичною ЛАГ (67,5 %) (long rank P = 0,002), ЛАГ, асоційованою із захворюваннями сполучної тканини (49,7 %) (long rank P = 0,001), та ХТЕЛГ (83,2 %) (long rank P = 0,04). За даними уніваріантного Cox-аналізу предикторами смерті були: IV функціональний клас за ВООЗ (OR = 4,94; 95% ДІ 2,12–11,48), наявність асциту (OR = 4,52; 95% ДI 2,21–9,24), ЛАГ, асоційована із захворюванням сполучної тканини (OR = 3,07; 95% ДI 1,07–8,87), ЛАГ, асоційована із вродженою вадою серця (OR = 0,28; 95% ДI 0,11–0,68), ЧСС на фоні лікування > 105 уд/хв (OR = 7,85; 95% ДI 1,83–33,69), офісний систолічний АТ < 100 мм рт.ст. (OR = 2,78; 95% ДI 1,26–6,1), дистанція 6-хвилинного тесту на фоні лікування < 340 м (OR = 3,47; 95% ДІ 1,01–12,35), рівень NT-proBNP > 300 пг/мл (OR = 4,98; 95% ДI 1,49–16,6), площа правого передсердя > 22 см2 (OR = 14,2; 95% ДI 1,92–104,89), площа правого шлуночка в діастолу (OR = 1,08; 95% ДI 1,03–1,14), площа правого шлуночка в систолу (OR = 1,08; 95% ДI 1,02–1,11), середній тиск у правому передсерді на 1 мм рт.ст. підвищення (OR = 1,02; 95% ДI 1,02–1,19). При багатоваріантному Cox-регресійному аналізі незалежними предикторами смерті були наявність асциту, офісний систолічний АТ < 100 мм рт.ст. та рівень NT-proBNP > 300 пг/мл. ЛАГ, асоційована з уродженими вадами серця, зменшувала ймовірність смерті. Висновки. Це перші результати дослідження, що було проведене в єдиному українському центрі з діагностики та лікування легеневої гіпертензії. Показано, що структура хворих із ЛАГ в Україні суттєво відрізняється від такої в центрах інших країн, але показники виживання порівнянні. Найгірше виживання спостерігалося при ЛАГ, асоційованій із захворюваннями сполучної тканини, порівняно з усіма іншими її формами: виживання становило лише 49,7 % протягом 3 років. Виявлено достатньо прості показники, що можна оцінити в рутинній практиці та які є незалежними предикторами смерті.
Целью исследования было: провести анализ структуры пациентов, которые обследовались в специализированном центре; оценить украинскую реальность относительно выживаемости больных легочной артериальной гипертензией (ЛАГ) и хронической тромбоэмболической легочной гипертензией (ХТЭЛГ), которые проходили лечение в референтном центре (ранее у нас не было украинских данных); определить предикторы смерти. Материалы и методы. Проанализированы данные 359 больных с легочной гипертензией (ЛГ): с идиопатической ЛАГ — 72 (20,1 %), с ЛАГ, ассоциированной с заболеваниями соединительной ткани, — 20 (5,6 %), с ЛАГ, ассоциированной с ВИЧ-инфекцией, — 8 (2,2 %), с ЛАГ, ассоциированной с портальной гипертензией, — 4 (1,1 %), с ЛАГ, ассоциированной с врожденными пороками сердца, — 171 (47,6 %), с ЛГ вследствие заболеваний левых отделов сердца — 8 (2,2 %), ЛГ вследствие заболеваний легких — 6 (1,7 %), с ХТЭЛГ — 62 (17,3 %), ЛГ смешанной этиологии — 8 (2,2 %). Для оценки выживания включен 281 пациент (52 (18,5 %) с ХТЭЛГ и 229 (81,5 %) с ЛАГ), которые прошли лечение в центре легочной гипертензии ГУ «ННЦ «Институт кардиологии имени академика Н.Д. Стражеско» НАМН Украины». Диагноз легочной гипертензии устанавливался на основании данных катетеризации правых отделов сердца. Выживание определяли методом построения кривых Kaplan — Meier. Срок наблюдения составлял 51 месяц. Предикторы определяли с помощью бинарной логистической регрессии и Сох-регрессионного анализа. Результаты. Выживание общей когорты пациентов составляло 93,3; 86,8 и 81,5 % на этапах один, два и три года соответственно. Лучшее выживание было у пациентов с ЛАГ, ассоциированной с врожденными пороками сердца (92,7 %), по сравнению с идиопатической ЛАГ (67,5 %) (long rank P = 0,002), ЛАГ, ассоциированной с заболеваниями соединительной ткани (49,7 %) (long rank P = 0,001), и ХТЭЛГ (83,2 %) (long rank P = 0,04). По данным унивариантного Cox-анализа, предикторами смерти были: IV функциональный клас по ВОЗ (OR = 4,94; 95% ДИ 2,12–11,48), наличие асцита (OR = 4,52; 95% ДИ 2,21–9,24), ЛАГ, ассоциированная с заболеваниями соединительной ткани (OR = 3,07; 95% ДИ 1,07–8,87), ЛАГ, ассоциированная с врожденным пороком сердца (OR = 0,28; 95% ДИ 0,11–0,68), ЧСС на фоне лечения > 105 уд/мин (OR = 7,85; 95% ДИ 1,83–33,69), офисное систолическое АД < 100 мм рт.ст. (OR = 2,78; 95% ДИ 1,26–6,1), дистанция 6-минутного теста на фоне лечения < 340 м (OR = 3,47; 95% ДИ 1,01–12,35), уровень NT-proBNP > 300 пг/мл (OR = 4,98; 95% ДИ 1,49–16,6), площадь правого предсердия > 22 см2 (OR = 14,2; 95% ДИ 1,92–104,89), площадь правого желудочка в диастолу (OR = 1,08; 95% ДИ 1,03–1,14), площадь правого желудочка в систолу (OR = 1,08; 95% ДИ 1,02–1,11), среднее давление в правом предсердии на 1 мм рт.ст. повышения (OR = 1,02; 95% ДИ 1,02–1,19). При многовариантном Cox-регрессионном анализе независимыми предикторами смерти были наличие асцита, офисное систолическое АД < 100 мм рт.ст. и уровень NT-proBNP > 300 пг/мл. ЛАГ, ассоциированная с врожденными пороками сердца, уменьшала вероятность смерти. Выводы. Это первый результат исследования, которое было проведено в единственном украинском центре по диагностике и лечению легочной гипертензии. Показано, что структура больных с ЛАГ в Украине существенно отличается от таковой в центрах других стран, но показатели выживания сопоставимы. Наихудшее выживание отмечалось при ЛАГ, ассоциированной с заболеваниями соединительной ткани, в сравнении со всеми другими ее формами: выживание составляло лишь 49,7 % в течение 3 лет. Установлены достаточно простые показатели, которые можно оценить в рутинной практике и которые являются независимыми предикторами смерти.
Background. This study is the first analysis of patient survival after treatment in the only Ukrainian pulmonary hypertension (PH) referral center that was organized in 2014 and mainly focused on pulmonary arterial hypertension (PAH) and chronic thromboembolic pulmonary hypertension (CTEPH). The aim of the study was: to evaluate the structure of patients who were treated in referral center; to evaluate Ukrainian reality in surviving of patients with PAH and CTEPH (we did not have any Ukrainian data before); to determine predictors of death. Materials and methods. Tree hundred and fifty-nine patients with PH were included in database: with idiopathic PAH — 72 (20.1 %), PAH associated with connective tissue diseases (CTD) — 20 (5.6 %), PAH associated with HIV — 8 (2.2 %), PAH associated with portal hypertension — 4 (1.1 %), PAH associated with congenital heart diseases (CHD) — 171 (47.6 %), PH due to left heart diseases — 8 (2.2 %), PH associated with lung diseases — 6 (1.7 %), CTEPH — 62 (17.3 %), with multifactorial PH — 8 (2.2 %). Two hundred and eighty-one patients were enrolled (52 (18.5 %) with CTEPH, 229 (81.5 %) with PAH) in survival analysis. Long-term survival (Kaplan-Meier) and its predictors (Stepwise binary logistic regression and Cox’s proportional hazards analyses) were evaluated in adult patients with PH (diagnosed by right heart catheterization) within a prospective registry at a single referral center in Kyiv, Ukraine. Follow-up period was up to 51 (mean 23.6 ± 14.1) months. Only two specific drugs are available in Ukraine for the treatment of PH: inhaled iloprost and sildenafil. Results. The Kaplan-Meier survival rate for the total cohort was 93.3, 86.8, and 81.5 % at 1, 2 and 3 years, respectively. Survival was better in patients with CHD as compared to idiopathic PAH (log-rank P = 0.002), CTD (log-rank P = 0.001) and CTEPH (log-rank P = 0.04). Univariate Cox’s predictors of death were: functional class IV (odds ratio (OR) = 4.94; 95% confidence interval (CI) 2.12–11.48), pre-sence of ascites (OR = 4.52; 95% CI 2.21–9.24), CTD etiology of PAH (OR = 3.07; 95% CI 1.07–8.87), CHD etiology of PAH (OR = 0.28; 95% CI 0.11–0.68), heart rate during treatment > 105 bpm (OR = 7.85; 95% CI 1.83–33.69), office systolic blood pressure < 100 mmHg (OR = 2.78; 95% CI 1.26–6.1), 6-minute walk test during treatment < 340 m (OR = 3.47; 95% CI 1.01–12.35), NT-proBNP > 300 pg/ml (OR = 4.98; 95% CI 1.49–16.6), right atrial area > 22 cm2 (OR = 14.2; 95% CI 1.92–104.89), right ventricular area in diastole (OR = 1.08; 95% CI 1.03–1.14), right ventricular area in systole (OR = 1.08; 95% CI 1.02–1.11), mean pressure in right atrium per each 1-mmHg increase (OR = 1.02; 95% CI 1.02–1.19). In multivariate Cox regression analysis, only presence of ascites, office systolic BP < 100 mmHg, CHD etiology of PAH, NT-proBNP > 300 pg/ml were associated with survival. Conclusions. This is the first Ukrainian single-center PH cohort study results. It was shown that the structure of PAH patients in Ukraine was different from that in other countries. However, our data of survival are almost similar to data of centers from other countries. The worst survival was observed in PAH associated with CTD as compared to all other its forms: survival was only 49.7 % over 3 years. The simple indicators were revealed that can be evaluated in routine practice and are independent predictors of death: the presence of ascites and elevated levels of NT-proBNP.
легенева гіпертензія, асоційована із захворюваннями сполучної тканини; реєстр хворих на легеневу гіпертензію; виживання; предиктори прогнозу
легочная гипертензия, ассоциированная с заболеваниями соединительной ткани; реестр больных легочной гипертензией; выживание; предикторы прогноза
pulmonary hypertension associated with connective tissue diseases; register of patients with pulmonary hypertension; survival; predictors of poor prognosis
Вступ
Легенева гіпертензія (ЛГ) — це синдром, що характеризується порушеннями гемодинаміки малого кола кровообігу, при якому спостерігається підвищення середнього тиску (серТЛА) в легеневій артерії (ЛА) > 25 мм рт.ст. за даними катетеризації правих відділів серця (КПС) [1]. Існує понад 50 хвороб та патологічних станів, при яких може розвинутися ЛГ. Згідно із сучасною класифікацією, всі вони об’єднуються у п’ять етіопатогенетичних груп. Серед них розрізняють форми ЛГ, які потребують призначення препаратів для специфічного лікування (група 1 та 4), та ті, що його не потребують (група 2 та 3). Визначення групи та необхідності призначення специфічних препаратів пацієнтам групи 5 відбувається після обстеження в спеціалізованому відділенні, що обов’язково включає КПС.
Етіопатогенетична класифікація легеневої гіпертензії (згідно з ESC–2015)
Група 1. Легенева артеріальна гіпертензія.
1.1. Ідіопатична.
1.2. Спадкова:
1.2.1. Мутація гена, що кодує рецептори морфогенетичного протеїну кісткового мозку, — BMRP2.
1.2.2. Інші мутації.
1.3. ЛГ, асоційована з ліками або токсинами.
1.4. ЛГ, асоційована:
1.4.1. Із захворюваннями сполучної тканини.
1.4.2. ВІЛ–інфекціями.
1.4.3. Портальною гіпертензією.
1.4.4. Уродженими вадами серця.
1.4.5. Шистосомозом.
1’. Венооклюзивна хвороба легенів і/або гемангіоматоз легеневих капілярів.
1”. Персистуюча ЛГ немовлят.
Група 2. ЛГ, асоційована з ураженням лівої половини серця.
2.1. Систолічна дисфункція.
2.2. Діастолічна дисфункція.
2.3. Захворювання клапанів.
2.4. Вроджена/набута обструкція притоку/відтоку та вроджена кардіоміопатія.
2.5. Вроджений/набутий стеноз легеневих вен.
Група 3. ЛГ, асоційована із захворюваннями легенів та/або гіпоксією.
3.1. При хронічній обструктивній хворобі легенів.
3.2. При інтерстиціальних хворобах легенів.
3.3. При інших захворюваннях легенів зі змішаними обструктивно–рестриктивними причинами.
3.4. При порушенні дихання під час сну.
3.5. При гіповентиляційній патології альвеол.
3.6. При хронічному перебуванні на високогір’ї.
3.7. При вадах розвитку легень.
Група 4. Хронічна тромбоемболічна легенева гіпертензія та інші обструкції легеневої артерії.
4.1. Хронічна посттромбоемболічна легенева гіпертензія.
4.2. Інші обструкції легеневої артерії:
4.2.1. Ангіосаркома.
4.2.2. Інші інтраваскулярні пухлини.
4.2.3. Артеріїт.
4.2.4. Вроджений стеноз легеневих артерій.
4.2.5. Закупорка паразитами (гідатидоз).
Група 5. ЛГ із невідомими та/або багатофакторними механізмами.
5.1. Гематологічні захворювання: хронічна гемолітична анемія, мієлопроліферативні захворювання, спленектомія.
5.2. Системні захворювання, саркоїдоз, гістіоцитоз Х, лімфангіолейоміоматоз, нейрофіброматоз.
5.3. Метаболічні порушення: хвороби накопичення глікогену, хвороба Гоше, захворювання щитоподібної залози.
5.4. Інші причини: пухлинна тромботична мікроангіопатія, фіброзуючий медіастиніт, хронічна ниркова недостатність (з гемодіалізом або без нього), сегментарна ЛГ.
У структурі пацієнтів з усіма формами ЛГ переважають особи із захворюванням лівих відділів серця (понад 80 %), 10 % — пацієнти із захворюванням паренхіми легень, а на всі інші форми припадає 6–7 %, тому їх відносять до орфанних (рідкісних) захворювань. За даними епідеміологічного дослідження, у якому ЛГ визначалася за даними ехокардіографії (ЕхоКГ), із 480 пацієнтів, у яких був підвищеним розрахунковий систолічний тиск в легеневій артерії (рСТЛА), 78 % мали захворювання серця, 10 % — захворювання легень, 3,5 % — ЛАГ, 1,5 % — тромбоемболію легеневої артерії [2]. При зниженій фракції викиду лівого шлуночка встановити причину ЛГ нескладно, але при його діастолічній дисфункції діагностика ЛГ викликає певні труднощі й потребує консультації спеціаліста та, можливо, обстеження в референтному центрі.
За даними національного французького реєстру [3], поширеність легеневої артеріальної гіпертензії (ЛАГ) (1–ша група) cтановить 15 на 1 млн чоловік. Ідіопатична легенева артеріальна гіпертензія (ІЛАГ) зустрічається із частотою 5,9 випадку на 1 млн дорослого населення. Найнижчий показник виявлення ЛАГ — 2,4 випадку на 1 млн дорослого населення на рік. Дані французького реєстру було підтверджено в європейському епідеміологічному дослідженні 2007 року: поширеність ЛАГ становила 15–50 осіб на 1 млн населення [4]. Із групи ЛАГ ІЛАГ зустрічалася частіше за інших — 6 випадків на 1 млн осіб (39,2 % усіх випадків ЛАГ). Сімейна ЛАГ була діагностована в 3,9 % випадках ЛАГ, а асоційована із вродженими вадами серця (ВВС) — в 11,3 %. Вона частіше зустрічалася при синдромі Ейзенменгера, дефекті міжшлуночкової і міжпередсердної перегородки, загальному артеріальному стовбурі, при вадах серця з ЛГ після хірургічної корекції вади.
Традиційно ЛГ, асоційовану із захворюваннями сполучної тканини (ЗСТ), відносять до 1–ї групи — ЛАГ. Але внаслідок високої поширеності ураження як лівої половини серця, так і паренхіми легень при ЗСТ точна діагностика ЛАГ при таких станах є особливо складною. Хоча ЛАГ спостерігається і при інших ЗСТ, але найчастіше вона виникає при системній склеродермії, що й було основним напрямком цього дослідження. Поширеність системної склеродермії в загальній популяції коливається від 80 випадків на 1 млн населення у Великобританії до 240 на 1 млн населення у США [5]. Проспективні дослідження на основі даних КПС виявили поширеність ЛАГ у пацієнтів із системною склеродермією на рівні 7,8–12 %, за даними останнього метааналізу було підраховано, що її поширеність становить 9 % [5]. Французька група Itiner–Air спостерігала щорічну частоту розвитку ЛАГ у хворих на системну склеродермію 0,61 % [5]. На жаль, будь–які дані про поширеність ЛАГ в Україні досі відсутні.
У перших ранніх реєстрових дослідженнях, коли ще не було впроваджено застосування препаратів для специфічної терапії, виживання хворих на ІЛАГ становило 68, 48 і 34 % через 1, 3 і 5 років відповідно [6, 7]. Подальші спостереження при застосуванні специфічної терапії продемонстрували поліпшення виживання: протягом першого року воно збільшилося до 83 і навіть 91 % [8, 9]. Предикторами поганого прогнозу у хворих на ЛГ були старший вік, етіологія захворювання, функціональний стан (толерантність до фізичного навантаження, функціональний клас, синкопальні стани), біомаркери, показники гемодинаміки, оцінені за допомогою ехокардіографії (систолічна функція правого шлуночка, індекс ексцентричності, розмір правого передсердя) і результати КПС (середній тиск у правому передсерді (серТПП), серцевий індекс та рівень легеневого судинного опору) [10–14].
Лише у 2014 році в Україні на базі відділення симптоматичних артеріальних гіпертензій ДУ «ННЦ «Інститут кардіології імені М.Д. Стражеска» НАМН України» був організований перший спеціалізований центр для дорослих, які хворі на ЛГ, орієнтований головним чином на пацієнтів із ЛАГ та хронічною тромбоемболічною ЛГ (ХТЕЛГ). Починаючи з 2016 року розпочато державну програму з надання допомоги пацієнтам із ЛАГ та ХТЕЛГ, завдяки якій лікування деякими дорогими специфічними препаратами стало доступним для переважної більшості хворих. Це дослідження є першим аналізом даних пацієнтів, які пройшли амбулаторне або стаціонарне лікування в референтному центрі.
Метою даної роботи було: 1) провести аналіз структури пацієнтів, які обстежувалися в спеціалізованому центрі; 2) оцінити українську реальність щодо виживання хворих на ЛАГ, асоційовану із ЗСТ, порівняно з іншими групами хворих на ЛАГ та ХТЕЛГ, які проходили лікування у референтному центрі (раніше ми не мали українських даних); 3) визначити предиктори несприятливого прогнозу.
Матеріали та методи
Пацієнти та методи обстеження. За період з травня 2014 року до травня 2019 року амбулаторне або стаціонарне лікування в нашому центрі пройшли 359 хворих із ЛГ, їх дані були внесені в базу даних. Усі пацієнти були включені до реєстру лише після підписання форми інформованої згоди для обробки персональних даних. Структура хворих, включених до реєстру, була така: ІЛАГ — 72 (20,1 %) пацієнти, ЛАГ, асоційована із ЗСТ, — 20 (5,6 %), ЛАГ, асоційована з ВІЛ–інфекцією, — 8 (2,2 %), ЛАГ, асоційована з портальною гіпертензією, — 4 (1,1 %), ЛАГ, асоційована з ВВС, — 171 (47,6 %), ЛГ унаслідок захворювань лівих відділів серця — 8 (2,2 %), ЛГ унаслідок захворювань легень і/або гіпоксії — 6 (1,7 %), хронічна тромбоемболічна ЛГ — 62 (17,3 %), ЛГ змішаної етіології — 8 (2,2 %) (рис. 1). Серед пацієнтів було 258 (72 %) жінок та 101 (28 %) чоловік. Вік хворих — від 18 до 80 років (у середньому — 42,3 ± 0,8 року). Пацієнти, які були госпіталізовані, — 74 % (n = 264), амбулаторні — 26 % (n = 95).
Зрозуміло, що частка пацієнтів із захворюваннями лівої половини серця та паренхіми легень була дуже низькою через невключення до реєстру хворих із явними ознаками такої патології.
У нашому спостереженні групу хворих із ЛАГ, асоційованою із ЗСТ, становили пацієнти із склеродермією, серед яких дифузна форма системної склеродермії була у 18, а обмежена форма — у 2 хворих. Діагноз склеродермії встановлювали на основі критеріїв ACR і EULAR (2013) після відповідної консультації кваліфікованого ревматолога.
У ретроспективний аналіз виживання був включений 281 пацієнт віком від 18 років, які проходили лікування в референтному центрі в період із червня 2014 року по липень 2018 року. ЛГ була підтверджена КПС: серТЛА > 25 мм рт.ст., легеневий судинний опір (ЛСО) > 300 дин • с • см–5 і тиск заклинювання легеневої артерії (ТЗЛА) < 15 мм рт.ст. у спокої [1]. Пацієнти з ТЗЛА > 15 мм рт.ст. та/або ЛСО < 300 дин • с • см–5 (якщо вони знаходились не на специфічному лікуванні) були виключені з аналізу. КПС проводилися в нашому центрі (у переважній більшості випадків) або в деяких хірургічних центрах для пацієнтів із ВВС. Пацієнти були поділені на підгрупи згідно з етіологією ЛГ за результатами обстеження відповідно до вимог Уніфікованого клінічного протоколу екстреної, первинної, вторинної (спеціалізованої) та третинної (високоспеціалізованої) медичної допомоги «Легенева гіпертензія у дорослих» (на основі рекомендацій ESC/ERS 2015), затвердженого Наказом МОЗ України № 614 від 21.06.2016: IЛАГ (n = 68), ЛАГ, асоційована з ВВС (n = 136), ЛАГ, асоційована із ЗСТ (n = 15), ЛАГ, асоційована з портальною гіпертензією або ВІЛ–інфекцією (n = 10), ХТЕЛГ (n = 52). Деяким пацієнтам специфічну терапію ЛГ призначили ще до першого візиту до нашого центру, іншим діагноз ЛГ уперше був установлений у нашому центрі, у більшості розпочата специфічна терапія. Ознаки асциту оцінювалися під час медичного обстеження та ультразвукового дослідження органів черевної порожнини. Тест 6–хвилинної ходьби за стандартною методикою проводили двічі під час госпіталізації та двічі під час виписки (на фоні лікування), кращий результат вводили в базу даних. ЕхоКГ проводилася тими ж фахівцями із використанням стандартних протоколів та типових вимірювань для таких хворих (апарат Artida, Toshiba, Японія) [15].
Статус виживання визначали під час візиту пацієнта або за допомогою телефонного контакту з пацієнтом або його родичами. Дати та причини смерті були отримані зі свідоцтва про смерть. Якщо інформації не було, пацієнт був класифікований як втрачений для подальшого спостереження. Дата останнього візиту була визначена як кінцева дата спостереження. У даному дослідженні ми оцінювали лише загальну смертність. Демографічні показники, етіологія ЛГ, використання медикаментів, дані біохімічних аналізів, біомаркери (N–термінальний фрагмент мозкового натрійуретичного пропептиду — NТ–proBNP), рівень феритину, параметри ЕхоКГ, результати тесту 6–хвилинної ходьби і КПС вносилися до бази даних. Дата першого візиту до нашого центру була визначена як дата початку спостереження. Проведення дослідження було ухвалено локальним етичним комітетом ДУ «ННЦ «Інститут кардіології ім. академіка М.Д. Стражеска» Національної академії медичних наук України».
Лікування. На момент початку дослідження в Україні доступними були лише два препарати для специфічного лікування ЛАГ і ХТЕЛГ — силденафіл та інгаляційний ілопрост. Можливості в зміні терапії були обмежені комбінацією цих препаратів або, у разі непереносимості, заміною одного на інший. Переважно використовувалася монотерапія. Десять пацієнтів (крім хворих на ЗСТ) не приймали жодного препарату через особисті причини або через наявну непереносимість доступних на той час лікарських засобів. Пацієнти із ХТЕЛГ були направлені в референтний хірургічний центр. Шести хворим було проведено тромбендартеректомію: одна пацієнтка померла, двоє після оперативного втручання мали залишкову ЛГ та потребували специфічної медикаментозної терапії, у 3 пацієнтів результат хірургічного лікування був задовільний. Інші хворі на ХТЕЛГ оцінювалися як неоперабельні, або з високим ризиком несприятливого прогнозу, або відмовлялися від проведення операції через особисті причини, включаючи фінансові. Частині з цих пацієнтів можливо було б провести балонну ангіопластику легеневих артерій, але, на жаль, в Україні ця процедура не проводиться.
Для аналізу виживання всі пацієнти були розділені на 2 групи: ті, які вижили, та ті, які не вижили.
Статистичний аналіз. Абсолютні показники (безперервні змінні) подані у форматі середнє значення ± стандартне відхилення (M ± SD). Відносні показники (безумовні змінні) — у вигляді абсолютне число (n) і відсоток (%). Достовірність відмінностей між групами тих, хто вижив, і померлих оцінювали для безперервних змінних за допомогою незалежного t–тесту для середніх значень, для безумовних змінних — за допомогою χ2–аналізу. Виявлені параметри, за якими відрізнялися групи, були включені в покроковий бінарний логістичний регресійний аналіз для оцінки взаємозв’язків між параметром та виживанням. Аналіз виживання проводили з використанням кривих Kaplan — Meier, при цьому за дату початку дослідження брали дату першого відвідування центру. Логарифмічний тест (long–rank) використовували для порівняння виживання груп із різною етіологією. Статистично значущі змінні, виявлені під час бінарного логістичного регресійного аналізу, були включені до однофакторного пропор–ційного аналізу ризику Сох. Якщо ці змінні зберігали достовірність зв’язку із прогнозом, їх включали у багатофакторний Сох–регресійний аналіз для визначення незалежних предикторів смерті в обстежених пацієнтів.
Результати
Характеристика пацієнтів, включених у реєстр, залежно від етіології ЛГ подана в табл. 1. Як указувалося вище, переважну більшість пацієнтів становили хворі з ЛАГ, асоційованою із ВВС (47,6 %), вони були достовірно молодші, ніж пацієнти з іншими формами ЛГ. У загальній популяції 54 % хворих були молодші за 45 років. Від ЛГ переважно страждали жінки у співвідношенні 6 : 1 при ІЛАГ, 9 : 1 — при ЛАГ, асоційованій із ЗСТ, 3 : 1 — при ЛАГ, асоційованій із ВВС, 7 : 1 — при ЛГ унаслідок захворювань лівих відділів серця (ЗЛВС), 2 : 1 — при ЛГ унаслідок захворювань легень (ЗЛ) та/або гіпоксії, окрім пацієнтів із ХТЕЛГ, у яких співвідношення становило 1 : 1. Час від появи симптомів захворювання до внесення в реєстр у хворих з ІЛАГ та ЛАГ, асоційованою із ЗСТ, становив близько 3 років (33,6 ± 4,7 міс. та 33,8 ± 9,6 міс. відповідно), а в пацієнтів із ХТЕЛГ — майже 4 роки (47,5 ± 6,1 міс.). Найдовшу історію виникнення симптомів мали пацієнти із ВВС та захворюваннями лівих відділів серця — відповідно 140,9 ± 12,5 міс. та 116,1 ± ± 67,9 міс.
Клінічні дані пацієнтів з різними формами ЛАГ у загальній популяції обстежених пацієнтів подані в табл. 2. Як видно з табл. 2, серед пацієнтів з ІЛАГ та ХТЕЛГ переважали ті, які мали ІІ (серТЛА 45–64 мм рт.ст.) та ІІІ (серТЛА > 65 мм рт.ст.) ступінь підвищення тиску в легеневій артерії. У хворих із ВВС переважно був ІІІ ступінь підвищення серТЛА. У групі з ЛАГ, асоційованою із ЗСТ, підвищення серТЛА частіше відповідало І (серТЛА 25–44 мм рт.ст.) та ІІ ступеням, але при цьому клінічно пацієнти були більш тяжкими: стан 85 % із них відповідав ІІІ та ІV функціональному класу за ВООЗ. Серед пацієнтів груп 2 та 3 спостерігався майже однаковий розподіл за ступенем підвищення артеріального тиску (АТ). Фібриляція передсердь найчастіше супроводжувала ЛГ, асоційовану зі ЗЛВС. За даними літератури, фібриляція передсердь, ожиріння, цукровий діабет, артеріальна гіпертензія та їх поєднання значно збільшують імовірність виникнення ЛГ через формування діастолічної дисфункції лівого шлуночка.
Дані неінвазивних методів дослідження, за якими оцінювали функціональний стан пацієнтів із ЛГ та стан внутрішньосерцевої гемодинаміки, подані в табл. 3. Як видно з табл. 3, найкращі показники тесту з 6–хвилинною ходьбою мали пацієнти з ІЛАГ та ЛАГ, асоційованою із ВВС. Проте пацієнти групи ЛАГ, асоційованої з ВВС, як і слід було очікувати, мали достовірну нижчу сатурацію крові як у спокої, так і наприкінці 6–хвилинного тесту, ніж пацієнти з ІЛАГ, ХТЕЛГ та ЛГ, асоційованою із ЗЛВС. Вони не відрізнялися за цим показником у спокої та наприкінці 6–хвилинного тесту від пацієнтів груп із ЛАГ, асоційованою із ЗСТ та ЗЛ. Пацієнти із ЗСТ, ЗЛВС та ЗЛ мали найвищі бали при оцінці вираженості задишки за шкалою Borg. Середній рівень NT–proBNP у хворих із ВВС та ЗЛ був достовірно нижчим, ніж у хворих з ІЛАГ та ХТЕЛГ. У групах ЗСТ та ЗЛВС відмічався найвищий рівень цього біомаркера, але невелика кількість пацієнтів у цих групах не дозволила досягнути статистичної достовірності для цих відмінностей. За даними ЕхоКГ найменша середня величина площі правого передсердя спостерігалася в пацієнтів із ВВС та ЗСТ, але за індексом обсягу групи достовірно не відрізнялися. Середній показник TAPSE, що опосередковано характеризує функцію правого шлуночка, був найвищим серед пацієнтів із ЗЛ. Пацієнти з ВВС мали найбільший розмір стовбура легеневої артерії, і в них частіше виявляли аневризматичне роширення легеневих артерій. Також ця група пацієнтів характеризувалася найвищим рівнем рСТЛА за даними ЕхоКГ.
Таким чином, найгіршу функціональну спроможність мали пацієнти із ЗСТ, ЗЛВС та ЗЛ, найкращу — хворі з ВВС, незважаючи на те, що рівень систолічного АТ у легеневій артерії був у них достовірно вищим. Це підтверджує дані інших досліджень, що демонструють відсутність достовірної кореляції між рівнем АТ у легеневій артерії, з одного боку, та функціональними можливостями пацієнтів та прогнозом — з іншого [16, 17].
За вибраний період існування центру проведені 192 КПС, із них 20 були повторними (підтвердження вазореактивності або погіршення стану). Завдяки КПС діагноз ЛГ було знято в 14 хворих (вони не були включені у спостереження). Серед пацієнтів з ІЛАГ тест на вазореактивність проведено у 65 пацієнтів. За даними КПС (табл. 4), як і за даними ЕхоКГ, найвищий середній тиск у легеневій артерії спостерігався в пацієнтів із ВВС, найнижчий — у хворих із ЗСТ. Також у них достовірно нижчим був середній тиск у правому передсерді. Тиск заклинювання легеневої артерії, як і очікувалося, найвищим був у пацієнтів із ЗЛВС. У групі ІЛАГ цей показник був достовірно меншим за такий у групах ЛАГ, асоційованої з ВВС, та ХТЕЛ. Хвилинний об’єм крові був достовірно нижчим у пацієнтів з ІЛАГ порівняно із пацієнтами із ХТЕЛГ та ЗЛВС, але серцевий індекс в них достовірно не відрізнявся. Лише у хворих із ВВС достовірно вищим був серцевий індекс порівняно із пацієнтами з ІЛАГ. Опір легеневих судин був достовірно нижчим у пацієнтів із ЗЛВС, а найвищим — у групах ІЛАГ та ЛАГ, асоційованої з ВВС. Останні мали також найвищий рівень насичення крові киснем, як і слід було очікувати в пацієнтів із наявними артеріовенозними шунтами.
Оцінка виживання пацієнтів з ЛАГ та ХТЕЛГ. За період спостереження 51 міс. (середнє значення 23,6 ± 14,1 міс.) 31 пацієнт помер. Як зазначалося вище, усі пацієнти були розділені на дві групи: ті, які вижили (n = 250), та ті, які не вижили (n = 31). Базові характеристики груп наведені в табл. 5. Групи значимо не відрізнялися за віком, статтю, індексом маси тіла, наявністю фібриляції передсердь, наявністю синкопальних станів в анамнезі або залізодефіцитним станом/анемією. Ті пацієнти, які вижили, мали достовірно меншу частоту серцевих скорочень і більш високий рівень офісного артеріального тиску на момент виписки з центру, ніж ті, які померли. Базова середня сатурація кисню була меншою в групі пацієнтів, які померли. Серед тих, хто вижив, було більше пацієнтів і ВВС та іншими причинами ЛАГ (пов’язаними з ВІЛ або портальною гіпертен– зією), менше пацієнтів з ІЛАГ. Функціональний статус, визначений за результатом тесту 6–хвилинної ходьби, та функціональний клас ВООЗ були гірші в тих, хто помер. Також пацієнти, які померли, частіше мали ознаки асциту. Силденафіл, діуретики та пероральні антикоагулянти частіше використовувалися у тих, хто не вижив. У цій же групі середня доза силденафілу була більшою.
Результати аналізу крові, в тому числі біомаркерів, подані в табл. 6. У тих пацієнтів, які не вижили, відмічався достовірно більший рівень лейкоцитів і більше міжнародне нормалізаційне відношення (більше було на антикоагулянтах), ніж у тих, хто вижив. Середні рівні NT–proBNP і тиреотропного гормона були вищими в тих, хто помер. Істотних відмінностей у рівнях феритину та інших характеристиках між групами виявлено не було.
Дані гемодинаміки, оцінені за допомогою ЕхоКГ і КПС, подані в табл. 7. Пацієнти, які померли, мали значне збільшення правого передсердя і правого шлуночка. Також ми виявили тенденцію до погіршення систолічної функції правого шлуночка в цій групі, що оцінювалася за систолічною екскурсією площини трикуспідального кільця (TAPSE). У пацієнтів, які вижили, менший рівень рСТЛА, виявлений за допомогою ЕхоКГ, не був підтверджений при КПС: за рівнем серТЛА, виміряним прямим методом, групи достовірно не відрізнялися. Серед гемодинамічних параметрів, отриманих при КПС, тільки середній тиск у правому передсерді був вищим у групі пацієнтів, які померли.
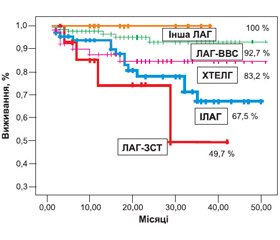
Крива виживання Kaplan — Meier для всієї когорти хворих показана на рис. 2. Показники виживання становили 93,3; 86,8 і 81,5 через 1, 2 і 3 роки відповідно. На рис. 3 проілюстровано ймовірне кумулятивне виживання обстежених пацієнтів залежно від етіології. Виживання було достовірно кращим у пацієнтів із ВВС порівняно з IЛАГ (P = 0,002), ЗСТ (P = 0,001) і ХТЕЛГ (P = 0,04). Найгіршим виживання було в пацієнтів із ЗСТ, але статистично значущі відмінності були лише із пацієнтами з ВВС (Р = 0,001) та пацієнтами з іншими формами ЛАГ (Р = 0,05).
Оцінка факторів, що асоціювалися із смертю. Результати покрокового бінарного логістичного регресійного аналізу наведені в табл. 8. Статистично значущими клінічними предикторами смерті були IV функціональний клас ВООЗ (OR = 6,34, P < 0,001), наявність асциту (OR = 5,65, P < 0,001), ЧСС при госпіталізації > 100 уд/хв (OR = 3,07, P = = 0,021) і на фоні лікування > 105 уд/хв (OR = 12,9, P = 0,039), офісний систолічний АТ на фоні лікування менше ніж 100 мм рт.ст. (OR = 3,34, P = 0,009). Величина дистанції при тесті 6–хвилинної ходьби при госпіталізації < 349 м (OR = 2,39, P = 0,042) і при виписці < 340 м (OR = 5,45, P = 0,01) також були предикторами смерті у наших пацієнтів. Маркери дисфункції правого шлуночка, такі як NT–proBNP > 300 пг/мл (OR = 5,26; P = 0,009), збільшення площі правого передсердя за даними ЕхоКГ > 22 см2 (OR = 3,6; P = 0,013) та площі правого шлуночка (OR = 1,12, P = 0,005 — під час систоли і OR = 1,12; P = 0,012 — під час діастоли) і підвищений тиск у правому передсерді > 10 мм рт.ст. за даними КПС. Рівень артеріального тиску в легеневій артерії абсолютно не корелював зі смертністю.
Деякі показники, що визначали при госпіталізації, втратили своє достовірне значення при включенні їх в однофакторний Сох–регресійний аналіз, а саме ЧСС та дистанція тесту 6–хвилинної ходьби (табл. 9). Наявність ЛАГ, асоційованої із ВВС, зменшувала (OR = 0,28; Р = 0,005), а ЛАГ, асоційованої з ЗСТ, збільшувала (OR = 3,07; P = 0,037) ймовірність смерті в наших пацієнтів. Проте вони втратили достовірність значення при багатофакторному Сох–регресійному аналізі, коли в регресійну модель додавали рівень NT–proBNP > 300 пг/мл (табл. 10). Параметри ЕхоКГ і КПС також не зберегли свою достовірну асоціацію із прогнозом при додаванні в багатофакторну регресійну модель.
Обговорення
Аналіз роботи центру легеневої гіпертензії ДУ «ННЦ «Інститут кардіології імені М.Д. Стражеска» НАМН України» показав, що за 5 років існування вдалося обстежити 359 хворих із ЛГ та на основі результатів обстеження створити реєстр. Проведені 192 КПС та 65 вазореактивних тестів. Це відповідає вимогам Європейського товариства кардіологів, згідно з якими референтним може називатися лише центр, у якому спостерігається не менше ніж 50 пацієнтів та проводиться не менше ніж 20 вазореактивних тестів на рік [1]. Проте в нашому центрі структура пацієнтів із ЛГ, а особливо з ЛАГ, дещо відрізнялася від структури пацієнтів у центрах інших країн. Так, ЛАГ мали 275 хворих, із них переважна більшість мали ЛАГ, асоційовану із ВВС (62,2 %), ІЛАГ — 26,2%, а ЛАГ, асоційовану із ЗСТ, — лише 7,3 %. Але за даними Американського коледжу кардіологів, у структурі хворих ІЛАГ становить 47 % пацієнтів із ЛАГ. Серед інших форм ЛАГ, асоційована із ЗСТ, становить 50 % (тобто серед всіх форм ЛАГ це майже 25 %), а асоційована із ВВС — лише 19 % (тобто серед усіх це лише 10 %) [18].
Недостатню кількість пацієнтів із ЗСТ у нашому центрі можна пояснити інертністю ревматологів в Україні, які не скринують усіх хворих на наявність ЛАГ або, навпаки, вважають, що даних ЕхоКГ достатньо для встановлення діагнозу ЛГ і призначення специфічної терапії. Як було зазначено вище, при ЗСТ до виникнення ЛГ можуть призводити декілька причин: 1) ураження судин легень — такі пацієнти відносяться до 1–ї групи та дійсно потребують призначення специфічної терапії; 2) ураження серця — такі пацієнти відносяться до групи 2 та призначення специфічної терапії їм протипоказане; 3) ураження легень (пневмофіброз) — такі пацієнти відносяться до групи 3 та також не потребують специфічної терапії; 4) тромбоемболії легеневої артерії — таким пацієнтам може призначатися специфічна терапія, і розглядається питання щодо можливого хірургічного лікування. Правильно визначити, яке ураження превалює в пацієнтів із ЗСТ, можна лише при проведенні всебічного обстеження, яке обов’язково включає КПС, що можливе лише в спеціалізованих центрах. Проте в певного числа пацієнтів розвиток ЛГ обумовлений складним комплексом взаємодії указаних причин, і можливо говорити тільки про провідний синдром на момент обстеження. У всіх хворих, які спостерігалися в нашому дослідженні, це був сидром прекапілярної ЛАГ.
Також слід підкреслити, що за даними гемодинамічних обстежень, як неінвазивних (ЕхоКГ), так і КПС, хворі із ЗСТ на перший погляд порівняно із хворими інших підгруп ЛАГ мали менш тяжкі порушення: більш низький тиск у ЛА, правому передсерді, менший ЛСО. У той же час у цих хворих спостерігалися більш виражені функціональні порушення: високий ФК ВООЗ, менша дистанція при 6–хвилинному тесті, більш виражена задишка за шкалою Borg та більший ступінь десатурації наприкінці навантаження, а також більш високий рівень NT–proBNP.
Достатньо велика кількість пацієнтів із ЛАГ, асоційованою із ВВС (переважна більшість некориговані системно–легеневі шунти або синдром Ейзенменгера), пояснюється наслідками недоліків організації дитячої діагностичної кардіологічної допомоги в минулому, коли ВВС діагностувалися на стадії вже сформованої високої ЛГ, та поганою обізнаністю українського населення (деякі батьки відмовлялися дати свою інформовану згоду на проведення оперативного втручання).
Це дослідження є першим аналізом виживання українських хворих на ЛГ, які проходили лікування лише в одному референтному центрі. Реалії специфічного лікування ЛГ в Україні на момент проведення аналізу (червень 2014 — липень 2018) були такими: не було багатьох схвалених специфічних препаратів (лише ілопрост та силденафіл), тривалий час пацієнти не отримували постійно специфічну терапію (лише з літа 2016 року затверджена державна програма щодо забезпечення пацієнтів із ЛГ безкоштовними специфічними препаратами, їх прийом пацієнтом часто був переривчастим через недоліки в організації закупівлі та розподілу препаратів).
Початкові характеристики нашої популяції пацієнтів, які були включені в аналіз виживання, показали, що більшість пацієнтів (74 %) були жінками молодого віку (середній вік — 43,8 ± 14,2 року). Найбільш поширеною причиною ЛГ, як і в загальній популяції, була ЛАГ, асоційована з ВВС (48,4 %), що аналогічно португальському [19] та китайському [20] реєстрам, але значно вище, ніж у французькому (11,3 %) [21], шотландському (23 %) [22], реєстрі центра в м. Гессен (13,3 %) [23] та чеському (21 %) [24]. Висока поширеність хворих із некоригованими ВВС могла б частково пояснити більш високе виживання наших пацієнтів на 3–му році порівняно з досліджуваною популяцією в інших країнах. Деякі дослідження продемонстрували краще виживання пацієнтів із ЛАГ, асоційованою із ВВС, ніж ІЛАГ або іншими ЛАГ у пацієнтів [1, 16, 19, 23]. A. Manes et al. повідомили, що виживання, яке оцінювалося за методом Kaplan — Meier, через 20 років у пацієнтів із синдромом Ейзенменгера і системно–легеневими шунтами становило 87 і 86 % відповідно. Найгірше виживання спостерігалось у хворих на ЛАГ після операції на дефекті або на невеликих дефектах. Більш високе виживання в пацієнтів із некоригованими ВВС пояснюється кращим збереженням функції правого шлуночка за рахунок відсутності ремоделювання після народження і стійкою гіпертрофією правого шлуночка [25]. У нашому дослідженні пацієнти з ВВС мали найкращу функціональну спроможність, незважаючи на те, що рівень систолічного АТ у легеневій артерії був у них достовірно вищим. Найгірші показники мали пацієнти із ЗСТ, ЗЛВС та ЗЛ.
В аналіз виживання був включений малий відсоток хворих на ЛАГ, асоційовану із ЗСТ, — лише 5,3 % порівняно з французьким (15,3 %) [21], шотландським (29,7 %) [22] та португальським (24,6 %) [19] реєстрами та реєстром центру в м. Гессен (21,2 %) [23]. Наші дані показали найгірше виживання пацієнтів із ЛАГ, асоційованою із ЗСТ, серед усіх інших форм ЛАГ. Оцінка виживання — лише 49,7 % за 3 роки. Це підтверджують дані інших досліджень [19, 23, 26]. В аналізі D. Launay et al. нескоригований ризик смерті при ЛАГ, асоційованій із системною склеродермією, порівняно з ІЛАГ становив 2,9 [27]. У нашому дослідженні він був схожий — 3,07. Враховуючи поганий прогноз у даної категорії пацієнтів, дуже важливо діагностувати ЛАГ при ЗСТ на ранніх стадіях та проводити агресивну комбіновану специфічну терапію.
До нескоригованих факторів, пов’язаних зі смертністю в нашій загальній популяції пацієнтів, відносилися низький функціональний статус (IV функціональний клас, наявність асциту, обмеження фізичної спроможності за даними тесту 6–хвилинної ходьби), етіологія ЛАГ, більш висока ЧСС і знижений офісний систолічний АТ при лікуванні, порушення функції правого передсердя і шлуночка (високий рівень NT–proBNP, дилатація правого передсердя і правого шлуночка, високий тиск у правому передсерді). Майже такі ж фактори впливали на виживання і в інших дослідженнях [9, 14, 17, 19, 21]. У нашій загальній групі пацієнтів чоловіча стать не була асоційована зі смертю на відміну від інших спостережень. Можливо, це пов’язано із малою кількістю хворих чоловічої статі (серед хворих на IЛАГ — 14,7 %, ЛАГ, асоційовану із ЗСТ, — 6,6 %), що не дозволило досягнути статистичної достовірності. Але серед 10 хворих чоловічої статі з IЛАГ 6 померли наприкінці дослідження, тоді як у групі ЛАГ, асоційованої з ВВС, із 37 чоловіків померли лише 3. Рівень NT–proBNP > 300 пг/мл і наявність асциту при первинному огляді були найбільш потужними незалежними прогностичними показниками смертності при багатофакторному Сох–регресійному аналізі. Їх можна вважати маркерами правошлуночкової серцевої недостатності. Прогностична роль NT–proBNP була доведена в деяких інших дослідженнях [28–30], а прогностична роль асциту раніше не оцінювалася.
У нашому дослідженні результат тесту 6–хвилинної ходьби < 340 м був предиктором смерті при однофакторному, але не при багатофакторному регресійному аналізі, на відміну від реєстра центру м. Гессен, у якому результат тесту зберігав значимість і при багатофакторному аналізі. Можливо, це пов’язано з особливостями проведення тесту. Так, у загальній популяції пацієнтів дослідження MAESTRO терапія мацитентаном не поліпшувала результати тесту 6–хвилинної ходьби, у той час як у пацієнтів референтних центрів, які брали участь у даному дослідженні, продемонстровано достовірне збільшення дистанції 6–хвилинного тесту [31]. Таку різницю в ефективності терапії залежно від кваліфікації центру, де проводився тест, деякі екс–перти пояснюють тим, що і пацієнт, і медичний персонал повинні бути добре навчені для проведення тесту. Більше тренувань — більш точні результати будуть отримані. Референтні центри, як правило, більш досвідчені. Ми включили в базу даних значення, які отримано ще на початку нашої роботи, коли ми були ще не дуже добре навчені. Тому, можливо, більш об’єктивні параметри (NT–proBNP і ультра–звукові ознаки асциту) виявилися більш значущими для прогнозу, ніж частково суб’єктивні результати тесту 6–хвилинної ходьби.
Гемодинамічні параметри як предиктори смерті при багатофакторному Сох–регресійному аналізі не досягали статистичної значущості в нашому дослідженні, що можна пояснити відсутністю статистичної потужності нашої досліджуваної популяції. Але нескоригований аналіз виживання показав дуже сильний зв’язок площі правого передсердя > 22 см² (OR = 14,2; P = 0,009) і підвищеного тиску у правому передсерді (OR = 1,02; P = 0,021) з поганим прогнозом. У дослідженні R.J. Raymond et al. із середнім періодом спостереження 36,9 ± 15,4 місяця перикардіальний випіт (р = 0,003) і індекс площі правого передсердя (> медіани) були предикторами смерті у хворих на IЛАГ [10]. C. Austin et al. показали, що площа правого передсердя більше 18 см² була пов’язана з поганим виживанням при проведенні однофакторного аналізу, але не при багатофакторному [32]. У той же час тиск у правому передсерді зберіг свою статистичну значимість при багатофакторному аналізі. У таїландському дослідженні рівень тиску в правому передсерді > 15 мм рт.ст. був потужним предиктором смерті в пацієнтів із системно–легеневими шунтами [33]. У нашому дослідженні ми виявили, що середній тиск у правому передсерді > 10 мм рт.ст. був асоційований із підвищенням ризику смерті (OR = 3,44; P < 0,023) при покроковому бінарному логістичному регресійному аналізі, але не при інших аналізах.
Враховуючи вкрай несприятливий прогноз виживання у хворих із ЛАГ, асоційованою із ЗСТ, підтверджений даними цього спостереження, на нашу думку, доцільно розробити комплекс заходів, направлених на більш раннє виявлення таких пацієнтів, забезпечення їм адекватної діагностики і ранній початок агресивного специфічного лікування. Зокрема, у цей комплекс слід включити проведення навчальних заходів щодо підвищення обізнаності ревматологів, терапевтів і сімейних лікарів щодо ЛАГ при ЗСТ; впровадження в стандартний протокол спостереження хворих на ЗСТ виконання діагностичних заходів, зокрема серійного скринінгу методом ЕхоКГ, та контроль за їх виконанням; покращення співпраці ревматологів та референтних центрів ЛГ щодо своєчасності направлення таких хворих та призначення специфічного лікування. Важливим моментом при оцінці клінічного статусу таких хворих є необхідність більшої уваги до моніторування результатів функціональних тестів та біомаркерів (NT–proBNP), ніж показників гемодинаміки. З іншого боку, несприятливий прогноз у таких пацієнтів вимагає призначення їм усім агресивної початкової дво– або трикомпонентної (upfront) терапії та більш ретельного спостереження (більш часті клінічні візити).
Обмеження дослідження
Основними обмеженнями нашого дослідження були: 1) невеликий розмір вибірки, який не дозволяв знайти більше статистично значущих предикторів смерті при багатофакторному Сох–регресійному аналізі; 2) у нашому спостереженні ми мали значно більшу частку пацієнтів із некоригованими ВВС, ніж в інших подібних дослідженнях, що могло вплинути на рівень смертності в загальній популяції, але аналіз виживання підгруп різної етіології показав, що трирічний рівень виживання для наших пацієнтів з IЛАГ (67,5 %) дещо нижчий, ніж в інших аналогічних спостереженнях: 75 % — у дослідженні T. Thenappan та ін. [26], 69 % — у швейцарському дослідженні (60 % ІЛАГ) [34], 76,2 % — у реєстрі ЛГ м. Гессен [23], 75 % — у португальському реєстрі [19]. Нижчий показник виживання наших пацієнтів можна пояснити проблемами з лікуванням (відсутність вибору препаратів, відсутність постійного лікування); 3) деякі вихідні дані не були повними, особливо дані КПС: частина пацієнтів (переваж–но з ВВС) вже прийшли до нашого центру з прийнятними результатами КПС, яку робили в інших центрах, проте ці дані не були повними (без тиску заклинювання легеневої артерії або величини серцевого викиду тощо). Ця відсутня інформація не була введена в базу даних і не була проаналізована, що є однією із причин, чому дані КПС (наприклад, серцевий викид) не були пов’язані з прогнозом в нашому дослідженні; 4) критерієм для включення в наш аналіз був ЛСО > 300 дин • с • см–5, що вище, ніж стандартні 240 дин • с• см–5. Цей поріг також міг вплинути на порівняння з даними інших реєстрових досліджень, але середній показник ЛСО наших хворих все ж таки був порівнянним із таким в інших спостереженнях; 5) частина пацієнтів, які почали брати участь у нашому реєстрі, вже приймали специфічну терапію, але окремого аналізу, як довго ця терапія тривала і чи вплинула вона на виживання, ми не проводили; 6) у роботі відображено дані одного експертного центру в Україні, але результати лікування можуть відрізнятися від загальної української популяції хворих із ЛГ.
Висновки
Дане дослідження є першим аналізом роботи єдиного центру ЛГ в Україні. Воно демонструє, що структура хворих із ЛАГ в Україні суттєво відрізняється від такої в центрах інших країн, але показники виживання порівнянні.
У цілому 1–, 2– і 3–річне виживання становило відповідно 93,3; 86,8 і 81,5 % і відрізнялося між різними етіологічними підгрупами з різною етіологією ЛГ.
Наші дані показали найгірше виживання ЛАГ, асоційованої із ЗСТ, серед усіх інших форм ЛАГ: лише 49,7 % за 3 роки.
Виявлено достатньо прості показники, які можна оцінити в рутинній практиці та які є незалежними предикторами смерті, а саме наявність асциту і підвищеного рівня NT–proBNP.
Для хворих на ЛАГ, асоційовану із ЗСТ, факторами несприятливого перебігу були низькі результати функціональних тестів (ФК ВООЗ, менша дистанція при 6–хвилинному тесті, більш виражена задишка за шкалою Borg та більший ступінь десатурації наприкінці навантаження).
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
1. Galie N., Humbert M., Vachiery J.L., Gibbs S., Lang I. et al.; ESC Scientific Document Group. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). Eur. Heart J. 2016. 37. 67–119.
2. Gabbay E., Yeow W., Playford D. Pulmonary arterial hypertension (PAH) is an uncommon cause of pulmonary hypertension (PH) in an unselected population: the Armadale echocardiography study. Am. J. Resp. Crit. Care Med. 2007. 175. A713.
3. Humbert M., Sitbon O., Chaouat A. et al. Pulmonary arterial hypertension in France: results from a national registry. Am. J. Respir. Crit. Care Med. 2006. 173(9). 1023–1030.
4. Peacock A.J., Murphy N.F., McMurray J.J.V., Caballero L., Stewart S. An epidemiological study of pulmonary arterial hypertension. Eur. Respir. J. 2007. 30(1). 104–109.
5. Condliffe R., Howard L.S. Connective tissue disease–associated pulmonary arterial hypertension. F1000 Prime Reports. 2015. 7. 06 (doi:10.12703/P7–06).
6. D’Alonzo G.E., Barst R.J., Ayres S.M. et al. Survival in patients with primary pulmonary hypertension. Results from a national prospective registry. Ann. Intern. Med. 1991. 115. 343–349.
7. Rich S., Dantzker D.R., Ayres S.M. et al. Primary pulmonary hypertension. A national prospective study. Ann. Intern. Med. 1987. 107. 216–223.
8. Benza R.L., Miller D.P., Gomberg–Maitland M. et al. Predicting survival in pulmonary arterial hypertension: insights from the Registry to Evaluate Early and Long–Term Pulmonary Arterial Hypertension Disease Management (REVEAL). Circulation. 2010. 122. 164–172.
9. Humbert M., Sitbon O., Chaouat A. et al. Survival in patients with idiopathic, familial, and anorexigen–associated pulmonary arterial hypertension in the modern management era. Circulation. 2010. 122. 156–163.
10. Raymond R.J., Hinderliter A.L., Willis P.W. et al. Echocardiographic predictors of adverse outcomes in primary pulmonary hypertension. J. Am. Coll. Cardiol. 2002 Apr 3. 39(7). 1214–1219.
11. Appelbaum L., Yigla M., Bendayan D. et al. Primary pulmonary hypertension in Israel: a national survey. Chest. 2001. 119. 1801–1806.
12. Miyamoto S., Nagaya N., Satoh T. et al. Clinical correlates and prognostic significance of six–minute walk test in patients with primary pulmonary hypertension. Comparison with cardiopulmonary exercise testing. Am. J. Respir. Crit. Care Med. 2000. 161. 487–492.
13. Sandoval J., Bauerle O., Palomar A. et al. Survival in primary pulmonary hypertension. Validation of a prognostic equation. Circulation. 1994. 89. 1733–1744.
14. Benza R., Lohmueller L., Kraisangka J., Kanwar M. Risk Assessment in Pulmonary Arterial Hypertension Patients: The Long and Short of it. Advances in Pulmonary Hypertension. 2018. 16. 125–135.
15. Markley R.R., Ali A., Potfay J., Paulsen W., Jovin I. Echocardiographic Evaluation of the Right Heart. J. Cardiovasc. Ultrasound. 2016 Sep. 24(3). 183–190.
16. Manes A., Palazzini M., Leci E. et al. Current era survival of patients with pulmonary arterial hypertension associated with congenital heart disease: a comparison between clinical subgroups. Eur. Heart J. 2014. 35(11). 716–24.
17. Benza R.L., Miller D.P., Barst R.J. et al. An evaluation of long–term survival from time of diagnosis in pulmonary arterial hypertension from the REVEAL registry. Chest. 2012. 142(2). 448–456.
18. ACCF/AHA 2009 Expert Consensus Document on Pulmonary Hypertension A Report of the American College of Cardiology Foundation Task Force on Expert Consensus Documents and the American Heart Association Developed in Collaboration With the American College of Chest Physicians; American Thoracic Society, Inc.; and the Pulmonary Hypertension Association. J. ACC. 2009. 53(17). 1573–1619. doi: 10.1016/j.jacc.2009.01.004.
19. Marques–Alvesa P., Baptista R., Marinho da Silva A. еt al. Real–world, long–term survival of incident patients with pulmonary arterial hypertension. Rev. Port. Pneumol. 2017. 23(3). 124–131.
20. Zhang R., Dai L.–Z., Xie W.–P. et al. Survival of Chinese patients with pulmonary arterial hypertension in the modern treatment era. Chest. 2011. 140. 301–309.
21. Humbert M., Sitbon O., Yaïci A. et al.; French Pulmonary Arterial Hypertension Network. Survival in incident and prevalent cohorts of patients with pulmonary arterial hypertension. Eur. Respir. J. 2010. 36. 549–555.
22. Peacock A.J., Murphy N.F., McMurray J.J.V. at al. An epidemiological study of pulmonary arterial hypertension. Eur. Respir. J. 2007. 30. 104–109.
23. Gall H., Felix J., Schneck F. еt al. The Giessen Pulmonary Hypertension Registry: Survival in pulmonary hypertension subgroups. J. Heart Lung Transplant. 2017. 36. 957–967.
24. Jansa P., Jarkovsky J., Al–Hiti H. et al. Epidemiology and long–term survival of pulmonary arterial hypertension in the Czech Republic: a retrospective analysis of a nationwide registry. BMC Pulm. Med. 2014. 14. 45.
25. Hopkins W.E. The remarkable right ventricle of patients with Eisenmenger syndrome. Coron. Artery Dis. 2005. 16. 19–25.
26. Thenappan T., Shah S.J., Rich S. еt al. Survival in pulmonary arterial hypertension: a reappraisal of the NIH risk stratification equation. Eur. Respir. J. 2010. 35. 1079–1087.
27. Launay D., Sitbon O., Hachulla E. et al. Survival in systemic sclerosis–associated pulmonary arterial hypertension in the modern management era. Ann. Rheum. Dis. 2013. 72. 1940–1946.
28. Yap L.B., Ashrafian H., Mukerjee D. et al. The natriuretic peptides and their role in disorders of right heart dysfunction and pulmonary hypertension. Clin. Biochem. 2004. 37. 847–856.
29. Andreassen A.K., Wergeland R., Simonsen S. et al.
N–terminal Pro–B–type natriuretic peptideas an indicator of dise–ase severity in a heterogeneous group of patients with chronic precapillary pulmonary hypertension. Am. J. Cardiol. 2006. 98. 525–529.
30. Park M.H., Scott R.L., Uber P.A. et al. Usefulness of B–type natriuretic peptide as a predictor of treatment outcome in pulmonary arterial hypertension. Congest. Heart Fail. 2004. 10. 221–225.
31. Galie N., Landzberg M., Beghetti M., Berger R.M., Efficace M., Gesang S., Papadakis K., Gatzoulis M.A. Evaluation of macitentan in patients with Eisenmenger syndrome: results from the randomised controlled MAESTRO study. P5462. European Heart Journal. 2017. 38(Suppl. 1). 1162–11631.
32. Austin C., Alassas K., Burger C. et al. Echocardiographic assessment of estimated right atrial pressure and size predicts mortality in pulmonary arterial hypertension. Chest. 2015. 147(1). 198–208.
33. Vijarnsorn C., Durongpisitkul K., Chungsomprasong P., Bositthipichet D., Ketsara S., Titaram Y., Chanthong P., Kanjanauthai S., Soongswang J. In Contemporary survival of patients with pulmonary arterial hypertension and congenital systemic to pulmonary shunts. PLoS ONE. 2018. 13(4). e0195092.
34. Mueller–Mottet S., Stricker H., Domeninghetti G. еt al. Long–Term Data from the Swiss Pulmonary Hypertension Registry. Respiration. 2015. 89. 127–140.

/97-1.jpg)
/99-1.jpg)
/100-1.jpg)
/101-1.jpg)
/102-1.jpg)
/97-2.jpg)
/98-1.jpg)
/103-1.jpg)
/104-1.jpg)
/105-1.jpg)