Журнал «Почки» Том 8, №3, 2019
Вернуться к номеру
Поражение почек на фоне антифосфолипидного синдрома
Авторы: Головач И.Ю.(1), Егудина Е.Д.(2), Рекалов Д.Г.(3)
(1) — Клиническая больница «Феофания» Государственного управления делами, г. Киев, Украина
(2) — Государственное учреждение «Днепропетровская медицинская академия Министерства здравоохранения Украины», г. Днепр, Украина
(3) — Запорожский государственный медицинский университет, г. Запорожье, Украина
Рубрики: Нефрология
Разделы: Справочник специалиста
Версия для печати
Антифосфоліпідний синдром (АФС) є поширеним автоімунним захворюванням, що викликається патогенними антифосфоліпідними антитілами та призводить до рецидивуючих тромбозів і/або акушерських ускладнень. Для нефрологів важливо знати, що сукупність наявності антифосфоліпідних антитіл, асоційованих з різними клінічними проявами ураження нирок, які зумовлені тромбозом великих ниркових судин, стенозом ниркової артерії та внутрішньонирковими ураженнями, призводить до розвитку антифосфоліпідної нефропатії. Цей стан асоційований з гострою тромботичною мікроангіопатією різного ступеня вираженості, проліферативними і фіброзними ураженнями внутрішньониркових судин і ішемічними змінами ниркової паренхіми. Перебіг захворювання може варіюватися від повільно прогресуючої нефропатії до загрожуючої життю гострої ниркової недостатності. Найбільш вивчений і широко відомий розвиток вторинної антифосфоліпідної нефропатії, пов’язаної з антифосфоліпідними антитілами в контексті системного червоного вовчака. Навпаки, клінічне значення ізольованої антифосфоліпідної нефропатії залишається невизначеним і малодослідженим. Доказова база препаратів, спрямованих на лікування ниркових ускладнень АФС, обмежена. Однак недавнє визнання гетерогенних молекулярних механізмів, що лежать в основі прогресування внутрішньониркових судинних уражень при АФС, відкрило багатообіцяючі шляхи для моніторингу пацієнтів і цільового терапевтичного втручання.
Антифосфолипидный синдром (АФС) является распространенным аутоиммунным заболеванием, вызываемым патогенными антифосфолипидными антителами и приводящим к рецидивирующим тромбозам и/или акушерским осложнениям. Для нефрологов важно знать, что совокупность наличия антифосфолипидных антител, ассоциированных с различными клиническими проявлениями поражения почек, обусловленными развитием тромбоза крупных почечных сосудов, стенозом почечной артерии и внутрипочечными повреждениями, приводит к развитию антифосфолипидной нефропатии. Это состояние ассоциировано с острой тромботической микроангиопатией различной степени выраженности, пролиферативными и фиброзными поражениями внутрипочечных сосудов и ишемическими изменениями почечной паренхимы. Течение заболевания может варьировать от медленно прогрессирующей нефропатии до угрожающей жизни острой почечной недостаточности. Наиболее изучено и широко известно развитие вторичной антифосфолипидной нефропатии, связанной с антифосфолипидными антителами в контексте системной красной волчанки. Напротив, клиническое значение изолированной антифосфолипидной нефропатии остается неопределенным и малоисследованным. Доказательная база препаратов, направленных на лечение почечных осложнений АФС, ограничена. Однако недавние исследования гетерогенных молекулярных механизмов, лежащих в основе прогрессирования внутрипочечных сосудистых поражений при АФС, открыло многообещающие пути для мониторинга пациентов и целевого терапевтического вмешательства.
Antiphospholipid syndrome (APS) is a common autoimmune disease caused by pathogenic antiphospholipid antibodies, leading to recurrent thrombosis and/or obstetric complications. It is important for nephrologists to know that the combination of the antiphospholipid antibody presence associating with various clinical manifestations of kidney damage caused by thrombosis of large renal vessels, renal artery stenosis and intrarenal lesions leads to the antiphospholipid nephropathy development. This condition is associated with acute thrombotic microangiopathy of varying severity, proliferative and fibrous lesions of the intrarenal vessels and ischemic changes in the renal parenchyma. The course of the disease can range from slow progressive nephropathy to life-threatening acute renal failure. The development of secondary antiphospholipid nephropathy associated with antiphospholipid antibodies in the context of systemic lupus erythematosus is the most studied and widely known. In contrast, the clinical significance of isolated antiphospholipid nephropathy remains uncertain and poorly understood. The evidence base for drugs aimed at treating renal complications of APS is limited. However, the recent recognition of heterogeneous molecular mechanisms underlying the progression of intrarenal vascular lesions in APS has opened up promising ways for monitoring patients and target therapeutic interventions.
антифосфоліпідний синдром; антифосфоліпідні антитіла; нефропатія; тромботична мікроангіопатія; тромбоз ниркових судин
антифосфолипидный синдром; антифосфолипидные антитела; нефропатия; тромботическая микроангиопатия; тромбоз почечных сосудов
antiphospholipid syndrome; antiphospholipid antibodies; nephropathy; thrombotic microangiopathy; renal thrombosis
Введение
Антифосфолипидный синдром (AФС) представляет собой аутоиммунное системное заболевание, характеризующееся рецидивирующими тромботическими событиями и/или патологией беременности, ассоциированное с наличием антифосфолипидных антител (aФЛ-АТ) [1]. Критерии диагноза АФС указаны в табл. 1. Диагноз определенного АФС устанавливается при наличии у пациента хотя бы одного клинического и одного лабораторного критерия. Предварительная классификация и диагностические критерии для верификации АФС были установлены международным консенсусом на конференции в городе Саппоро в 1999 году. С момента выхода работы появились новые клинические, лабораторные и экспериментальные данные, что послужило основанием для нового осмысления полученной научной и клинической информации. Диагностические критерии и классификация были пересмотрены и опубликованы в 2006 году и стали известны как Сиднейские критерии АФС [1].
Для диагностики АФС требуется присутствие комбинации по меньшей мере одного клинического и одного лабораторного критерия. Подчеркивается принципиальное значение длительности присутствия во времени положительных результатов лабораторных тестов. В критериях Саппоро (2006) для признания результатов лабораторных тестов положительными предлагалось использовать интервал не менее 6 недель, поскольку были высказаны существенные опасения, что из-за транзиторного повышения титра aФЛ-АТ, не имеющих патогенетической связи с АФС, что не является редкостью в клинической практике, а также возможных эпигенетических феноменов существует риск гипердиагностики АФС. Это исправлено в Сиднейских критериях, в которых интервал между повторными исследованиями удлинен до 12 недель. Таким образом, диагноза АФС следует избегать, если между результатами отдельных положительных тестов и клиническими признаками имеется интервал менее 12 недель и более 5 лет.
Клиническая картина АФС полиморфна, что связано с различной локализацией тромбов не только в крупных венах и артериях, но и в мелких внутриорганных сосудах. Сочетание тромботической окклюзии периферических сосудов и сосудов микроциркуляторного русла формирует клиническую картину полиорганной ишемии, приводящей к полиорганной недостаточности. АФС может быть первичным или вторичным, последний связан с основным аутоиммунным заболеванием, главным образом с системной красной волчанкой (СКВ). Клинические признаки АФС, не включенные в критерии классификации, — это поражение клапанов сердца, livedo reticularis, тромбоцитопения, нефропатия и неврологические проявления.
Поражение почек при АФС является главным образом результатом реноваскулярных тромбозов с вовлечением почечных артерий, внутрипаренхиматозных артерий, клубочковых капилляров или почечных вен с развитием так называемой тромботической микроангиопатии (ТМА) внутрипочечных сосудов [2]. Вышеперечисленные события приводят к развитию ишемии почек и прогрессирующей почечной недостаточности вследствие нарастающего нефросклероза. Диагностика АФС-нефропатии требует наличия одного или нескольких острых или хронических типичных внутрипочечных поражений по результатам гистологии [2] после исключения других причин почечной микроангиопатии [3]. Обострение нефропатии, связанной с СКВ, прогрессирующее хроническое заболевание почек и ранняя потеря функции почечного трансплантата также являются частью спектра клинических проявлений поражения почек при АФС [3] (табл. 2).
В данном обзоре обобщены современные научные данные поражения почек при АФС с акцентом на клинические, лабораторные и гистопатологические результаты и возможности лечения. Нами был проведен поиск англоязычных статей, посвященных поражению почек при АФС, за период 2008–2018 гг. в базах данных Medline/PubMed и Scopus с использованием ключевых слов «антифосфолипидный синдром», «антифосфолипидные антитела», «нефропатия» и «тромботическая микроангиопатия». Публикации включали серии клинических случаев, клинические исследования, обзорные работы. Была собрана информация о клинических проявлениях (клиническая картина нефропатии, эволюция), иммунологических маркерах, гистопатологических данных и лечении.
Ассоциация антифосфолипидных антител и поражение почек
В многочисленных исследованиях установлена сильная корреляция между наличием аФЛ-АТ и развитием нефропатии [2]. Волчаночный антикоагулянт (ВA) считается антителом, наиболее тесно связанным с АФС-нефропатией [4]; также есть данные о тесной корреляционной связи АФС-нефропатии с антикардиолипиновыми антителами (aКЛ-АТ) [5]. Более того, частота поражения почек значительно выше у пациентов с двойной или тройной позитивностью по аФЛ-АТ [6]. В подтверждение этих результатов R. Silvarino и соавт. (2011) обнаружили, что более высокая распространенность АФС-нефропатии наблюдалась у пациентов, позитивных по ВА и аКЛ-АТ IgG [6]. Одновременно Н. Zheng и соавт. (2009) пришли к выводу, что у пациентов с положительными антителами к ВА и b2-гликопротеину I (b2ГПI) чаще наблюдается микротромбоз клубочков [7].
АКЛ-АТ и ВА являются наиболее распространенными антителами у пациентов с АФС-нефропатией (50–100 %), однако они, как правило, встречаются в низких титрах [8]. Анти-b2ГПI, в свою очередь, являются наименее часто выявляемыми антителами при АФС-нефропатии. Как недавно сообщалось, повышенная регуляция экспрессии b2ГПI, наблюдаемая в почечных эндотелиальных клетках пациентов с волчаночным нефритом, играет роль в развитии АФС-нефропатии [9].
Системная артериальная гипертензия (АГ) при АФС является одним из основных клинических проявлений, ассоциированных с наличием аФЛ-АТ [10]. АГ особенно часто встречается у пациентов с первичным АФС, у аФЛ-АТ-позитивных пациентов с СКВ [10] и у аФЛ-позитивных беременных женщин [11]. Установлено, что АГ обусловлена внутрипочечным сосудистым тромбозом и последующей гломерулярной ишемией [10].
Присутствие АФС-ассоциированных антител даже при отсутствии определенного АФС-синдрома вызывает изменения в почечной физиологии вследствие тромботических явлений в почечных сосудах [2]. Увеличение частоты тромботических явлений, связанных с наличием аФЛ-АТ, также наблюдалось у пациентов с хронической болезнью почек (ХБП) [12]. При этом аФЛ-АТ-позитивность чаще встречается у пациентов с ХБП любой этиологии в сравнении с населением в целом [12]. Это способствовало росту заинтересованности исследователей и попыткам оценить влияние позитивности по аФЛ-АТ на распространенность гломерулярных поражений и прогноз ХБП. Обнаружено, что гломерулосклероз, формирование полулуний и некроз клубочков чаще встречаются у пациентов с аФЛ-положительным статусом, а тромбоз клубочковых капилляров с большей вероятностью прогрессирует в гломерулярный склероз у пациентов с СКВ с положительными титрами аФЛ-АТ [13]. Наблюдаемая связь предполагает, что аФЛ-АТ является независимым маркером-предиктором неблагоприятного почечного прогноза [13].
Еще одна ассоциация поражения почек и АФС-ассоциированных антител была обнаружена у реципиентов почечного трансплантата: аФЛ-позитивность была связана с повышенным риском раннего нарушения функции почек [14]. У пациентов с высокими титрами аКЛ-АТ до трансплантации чаще наблюдалась ранняя потеря функции трансплантата почки, была выше частота тромботических явлений и ниже выживаемость после трансплантации [14]. Позитивность по IgA b2ГПI является независимым фактором риска развития тромбоза трансплантата, ранней потери трансплантата и позднего восстановления функции почек после трансплантации [15]. Механизм вышеперечисленных явлений исследователи связывают с влиянием образованных этими антителами циркулирующих иммунных комплексов, что повышает риск развития тромбоза трансплантата [16].
Патофизиологические механизмы
Патофизиология тромбоза при АФС
При АФС антифосфолипидные антитела связываются с эндотелиальными клетками, тромбоцитами и моноцитами, формируя провоспалительную и протромботическую ситуацию, ответственную за тромботические осложнения. Большинство авторов поддерживают гипотезу о том, что аФЛ-АТ не являются прямой причиной тромбоза, но вызывают состояние прокоагуляции («первый удар»), при которой дополнительное повреждение («второй удар») вызывают тромботические явления [17]. Множественные молекулярные механизмы были использованы для объяснения «второго удара»; наибольшее количество данных касается липополисахаридного порога, благоприятствующего взаимодействию между аФЛ-АТ и эндотелиальными клетками. Современная парадигма развития тромбоза сосудов при АФС основана на двух механизмах: прямое взаимодействие между аФЛ-АТ и белками, регулирующими фибринолитические и коагуляционные пути [18], и активация эндотелиальных клеток, моноцитов и тромбоцитов посредством взаимодействия между аФЛ-АТ и фосфолипид-связывающими белками плазмы крови, взаимодействующими с мембранами и их рецепторами [19].
К фосфолипид-связывающим плазменным белкам в первую очередь относится b2ГПI, а также протромбин, тромбомодулин, кининогены, антитромбин III, белок С, белок S, аннексин I, II и V [20]. Наиболее важным фосфолипидом, с которым связываются эти белки, является фосфатидилсерин, расположенный на внутренней поверхности клеточной мембраны. Фосфатидилсерин появляется на поверхности мембран активированных или апоптотических клеток, в том числе трофобластов, моноцитов, эндотелиальных клеток и тромбоцитов [21]. В моноцитах и эндотелиальных клетках антитела против b2ГПI могут вызвать активацию тканевого фактора, который играет ключевую роль в инициации внешнего коагуляционного каскада [20].
Известно, что аФЛ-АТ связываются с активированными факторами свертывания, включая тромбин, активированные факторы IX и X, предотвращая их инактивацию и снижая фибринолиз, увеличивая тем самым вероятность тромботических событий [22]. АФА-АТ способны активировать тромбоциты, которые увеличивают экспрессию гликопротеина IIb/IIIa, синтез тромбоксана А2 и секрецию тромбоцитарного фактора-4, хемокина с прокоагулянтным и протромботическим эффектом [23]. Кроме того, в результате прямого или косвенного взаимодействия аФЛ-АТ с плазминогеном и/или активаторами плазминогена происходит нарушение фибринолиза и протромботического дисбаланса между коагуляцией и фибринолизом [23].
Еще один механизм, участвующий в тромбообразовании при АФС, — это активация антител, нацеленных на b2ГПI. Было показано, что присутствие антител, связывающихся с первым из пяти доменов b2ГПI, увеличивает риск тромбоза [25]. Связывание аФЛ-АТ с b2ГПI в эндотелиальных клетках, моноцитах и тромбоцитах индуцирует передачу клетками сигналов, способных стимулировать прокоагулянтные и провоспалительные изменения, экспрессию молекул адгезии и высвобождение тканевых факторов и ингибиторов фибринолиза [25].
Патофизиологические механизмы АФС-нефропатии
Несколько исследований указали на центральную роль пути комплемента в патогенезе аФЛ-индуцированной TMA и связанных с АФС тромботических и акушерских проявлений. Комплексы антител с b2ГПI могут генерировать образование С5а, который, в свою очередь, индуцирует развитие воспаления. С5а может также связывать и активировать нейтрофилы, что приводит к экспрессии тканевого фактора, взаимодействующего с фактором VIIa, активации фактора X, генерации тромбина и, в конечном итоге, к тромбообразованию [23].
У крыс, получавших очищенный IgG пациентов с аФЛ-АТ, развились ТМА клубочков, а повреждение почек было менее тяжелым у крыс с дефицитом рецептора C5a [25]. В исследованиях на людях использование моноклональных антител, ингибирующих расщепление C5 в комплексе мембраноатакующего комплемента (c5b-c9) и анафилатоксина C5a, уменьшало индуцированные аФЛ-АТ TMA поражения.
Применение экулизумаба, обладающего высокой аффинностью к С5-компоненту комплемента, ассоциировалось со значительным улучшением поражений при ТМА, что коррелировало со снижением как отложений C4d, так и апоптоза эндотелиальных клеток [26]. Экулизумаб впервые был протестирован на пациенте с терминальной стадией почечной недостаточности, вызванной катастрофическим АФС (КАФС), после трансплантации почки от живого донора [26]. Пациент получал профилактическое введение экулизумаба вместе с постоянной системной антикоагулянтной терапией и стандартной иммуносупрессией для предотвращения рецидива КАФС. Эта стратегия оправдала себя и оказалась успешной в этой очень рискованной ситуации. После первого случая последовали успешные сообщения о лечении экулизумабом посттрансплантационной аФЛ-индуцированной ТМА или рефрактерного КАФС [27–29]. Действительно, все эти данные подтверждают роль пути комплемента в аФЛ-индуцированной TMA и/или КАФС. Следует отметить, что экулизумаб вызывает ремиссию ТМА в случаях неэффективности плазмафереза. Несмотря на способность экулизумаба вызывать ремиссию ТМА, его использование не снижало уровень фиброзной гиперплазии интимы. Это указывает на то, что путь комплемента является не единственным компонентом в патогенезе таких поражений [27].
Недавно механистическая цель пути комплекса рапамицина (mTORC) была идентифицирована как потенциальный посредник нефропатии при АФС. АФЛ-АТ также связываются с рецепторами эндотелиальных клеток, вызывая рекрутирование сигнального пути AKT/(mTORC) и развитие фиброзной гиперплазии интимы [30]. Это вызывает постепенную обструкцию просвета сосуда и формирование ишемических зон с очаговой кортикальной атрофией и дилатацией канальцев. Важно отметить, что эти поражения могут рецидивировать на аллотрансплантированной почке, особенно у пациентов с наличием ВА [14]. Считается, что идентификация отложения комплемента и/или активации пути AKT/mTORC может помочь в будущем стратифицировать лечение АФС-нефропатии [30].
Клиническая картина
В зависимости от локализации тромбозов в сосудистом русле почек, протяженности и темпа развития процесса тромботической окклюзии клиническая картина АФС-ассоциированной нефропатии варьирует от острого повреждения почек (ОПП) и тяжелой, иногда злокачественной, артериальной гипертензии до минимального мочевого синдрома, мягкой или умеренной АГ и медленно прогрессирующего нарушения функции почек (табл. 3).
Тромбоз почечной вены
Тромбоз почечной вены вследствие АФС может проявляться протеинурией в нефротическом диапазоне, гематурией, олигурией и анурией вследствие острого повреждения почек. Следовательно, ухудшение течения нефропатии у пациентов с СКВ, позитивных по аФЛ- и аКЛ-АТ, в виде необъяснимо нарастающей протеинурии, гематурии или острой задержки мочи [31] должно насторожить врача в плане тромбоза почечной вены.
Тромбоз/стеноз почечной артерии
Наиболее частым клиническим проявлением тромбоза почечной артерии является тяжелая гипертензия или ухудшение течения предшествующей системной артериальной гипертензии. Сопутствующие симптомы включают почечный инфаркт с болью в пояснице, гематурию и появление острой или прогрессирование хронической почечной недостаточности [32]. Стеноз почечной артерии также является типичным поражением, ассоциированным с положительными аФЛ-АТ. Наиболее распространенным поражением при аФЛ-опосредованном стенозе почечной артерии является некритический стеноз, дистальный по отношению к устью почечной артерии [33]. Напротив, поражения проксимального сегмента или устья, как правило, обусловлены атеросклеротическими процессами, а поражения в среднем сегменте типичны для фибромышечной дисплазии [33]. Провоцирующими факторами для развития тромбоза почечных сосудов у пациентов с АФС являются инфекция, хирургические вмешательства, беременность, роды, отмена приема антикоагулянтов и/или гидроксихлорохина [31].
АФС-нефропатия
АФС-нефропатия — основная форма поражения почек при АФС, которая выявляется в 90–100 % случаев у пациентов с первичным АФС, имеющих признаки поражения почек [4].
Основными синдромами АФС-нефропатии являются:
1) Артериальная гипертензия. Как правило, умеренная или тяжелая, обусловленная активацией ренин-ангиотензин-альдостероновой системы в ответ на ишемию почек, причем у пациентов с КАФС возможно развитие злокачественной АГ.
2) Нарушение функции почек. Для АФС-нефропатии характерно раннее изолированное снижение СКФ; почечная недостаточность, как правило, имеет медленно прогрессирующий характер; распространенность острого повреждения почек до 20 % [4]. При КАФС в ряде случаев развивается необратимая острая почечная недостаточность.
3) Мочевой синдром. В большинстве случаев представлен умеренной изолированной протеинурией менее 1,5 г/сут [4]. Протеинурия нефротического диапазона наблюдается в редких случаях изолированной АФС-нефропатии, и эти лабораторные данные должны нацеливать врача на возможный стеноз почечной артерии, тромбоз больших почечных сосудов или сочетанную иммунную гломерулопатию [34]. Менее чем у 50 % пациентов отмечается микрогематурия [8].
АФС-нефропатия реже может проявляться и как острое заболевание. Острая почечная тромботическая микроангиопатия представляет собой, вероятно, наиболее тяжелую форму острой АФС-нефропатии [4]. Это клиническое проявление ассоциировано с быстрым снижением функции почек с различными степенями гематурии и протеинурии. Острое течение характеризуется развитием остронефритического синдрома с быстро нарастающей креатининемией. В наиболее тяжелых случаях возникает быстро прогрессирующая почечная недостаточность, как правило, в сочетании с тяжелой или злокачественной АГ. Острая анурия, вызванная кортикальным некрозом, представляет собой редкое, но драматическое проявление АФС, которое можно диагностировать с помощью компьютерной томографии или ренальной артериографии [35]. Подобно другим проявлениям АФС, АФС-нефропатия часто провоцируется началом приема контрацептивных препаратов, беременностью, родами или инфекцией [36].
Микротромботический процесс часто распространяется на другие органы, соответствуя критериям КАФС. Легкие, сердце, центральная нервная система и кожа — наиболее часто поражаемые органы. Интересно, что КАФС может проявляться как легочно-почечный синдром [37]. Наиболее ярко симптомы ТМА проявляются у больных КАФС, при котором частота поражения микроциркуляторного русла почек превышает 70 % [38].
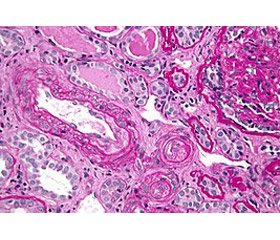
Гистопатологическая картина при нефробиопсии
В основе развития АФС-нефропатии лежит ТМА, которая характеризуется невоспалительной окклюзией почечных кровеносных сосудов. Для ТМА типично наличие фибриновых тромбов в клубочках и внутрипочечной сосудистой сети в отсутствие воспалительных клеток или иммунных отложений в сосудах. Острые поражения принимают форму ТМА, в то время как хронические поражения проявляются в виде артериосклероза артерий и артериол, фиброзной гиперплазии интимы, канальцевой тиреоидизации, фиброзной облитерации артерий и артериол и фокальной кортикальной атрофией [38]. Фиброзная гиперплазия интимы характеризуется интенсивной продукцией миофибробластов, приводящей к утолщению интимы и извилистости межлобулярных артерий. Фокальная кортикальная атрофия поражает участки на поверхности субкапсулярной коры с небольшими склеротическими или псевдокистозными клубочками (обычно в скоплениях), ассоциированными с канальцевой атрофией [38].
Фокальный сегментарный гломерулосклероз (ФСГС) (последствие клубочковой ТМА) является характерным признаком поздней стадии АФС-нефропатии [4].
К другим более редким гистопатологическим изменениям АФС-нефропатии относят мембранозную нефропатию, болезнь минимальных изменений, мезангиальную нефропатию и pauci-иммунный быстро прогрессирующий гломерулонефрит [39].
Поскольку гистологический паттерн ТМА сходен с гистологическим поражением почек, наблюдаемым при других микроангиопатиях, необходим тщательный сбор анамнеза и клиническое обследование. Более того, лабораторные данные, такие как тяжелая тромбоцитопения, шистоциты в мазке периферической крови, микроангиопатическая анемия и негативная реакция на аФЛ-АТ, являются важными факторами для определения этиологии этого гистологического паттерна [40].
Дифференциальная диагностика состояний с поражениями почек, соответствующих критериям ТМА, включает тромботическую тромбоцитопеническую пурпуру, гемолитико-уремический синдром, злокачественную и быстро прогрессирующую гипертензию и почечный склеродермический криз. Исследование на наличие аФЛ-АТ является обязательной скрининговой процедурой для диагностики или исключения АФС-ассоциированной ТМА [40].
При оценке гистопатологической картины поздней стадии АФС-нефропатии должна проводиться дифференциальная диагностика других состояний, приводящих к ФСГС: волчаночный нефрит, диабетическая нефропатия, серповидноклеточная анемия, ВИЧ, прием лекарственных препаратов (например, бисфосфонаты, ингибиторы кальциневрина) и патологическое ожирение [41].
Важно отметить, что АФС-нефропатия может возникать у пациентов с аФЛ-АТ при отсутствии критериев определенного АФС. Эти поражения почек могут быть неверно истолкованы как нефроангиосклероз [42] и требуют настороженности и осведомленности нефрологов в отношении АФС-нефропатии.
АФС-нефропатия при СКВ
Возникновение АФС-нефропатии при вторичном АФС на фоне СКВ было исследовано более широко, чем поражение почек при первичном АФС. Этому способствовало то обстоятельство, что в данном контексте биопсия почек проводится систематически. Распространенность поражений АФС-нефропатии на фоне СКВ варьирует в широких пределах — от 14 до 67 % [38]. По данным F.V. de Azevedo и соавт. (2018), поражение почек, ассоциированное с АФС-нефропатией, было диагностировано у 67 % пациентов с СКВ с вторичным АФС, причем 32 % пациентов были позитивны по аФЛ-АТ и 4 % — негативны [43]. У 94 % пациентов с СКВ и АФС-нефропатией, подтвержденной биопсией почки, были обнаружены аКЛ-АТ; у 50 % таких пациентов — ВА [43].
При вторичном АФС повреждение почек формируется за счет сочетания двух патофизиологических процессов: депозиции иммунных комплексов (что характерно для СКВ) и ТМА [38]. Хотя в большинстве случаев АФС-нефропатия сочетается с волчаночным нефритом (ВН), возможно изолированное ее развитие (около 3 %) в отсутствие гистологической картины ВН. У больных с сочетанием АФС-нефропатии и ВН чаще наблюдаются более тяжелая злокачественная АГ, острое повреждение почек и массивная протеинурия; отмечено также более быстрое прогрессирование почечной недостаточности с формированием терминальной хронической почечной недостаточности, а также большая выраженность гломерулосклероза и тубулоинтерстициального фиброза [44]. При проведении нефробиопсии у этих пациентов были обнаружены ишемические поражения в клубочках без пролиферативных изменений в дополнение к очаговому фиброзу интимы, связанному с внутрипочечным сосудистым тромбозом при отсутствии васкулита [44]. По сравнению с ВН АФС-нефропатия более ассоциируется с изменениями интимы, гипертензивными сосудистыми изменениями и тубулярной атрофией [38]. Фиброзная гиперплазия интимы была наиболее распространенной гистологической находкой при проведении нефробиопсии у пациентов с СКВ и АФС-нефропатией (46–100 %), тогда как распространенность ТМА была значительно ниже — 40 % [38]. Во многих исследованиях отмечается, что гломерулярный тромбоз у больных СКВ встречается при наличии аФЛ-АТ даже в отсутствие клиники определенного АФС [45].
Катастрофический АФС и почка
Катастрофический АФС — это особый, наиболее драматический вариант АФС, обусловленный острым тромбоокклюзивным поражением преимущественно сосудов микроциркуляторного русла (собственно ТМА) жизненно важных органов (не менее трех одновременно) с развитием полиорганной недостаточности в сроки от нескольких часов до 7 дней [46].
Диагностические критерии КАФС включают: 1) наличие в анамнезе АФС или стойкой положительной реакции на аФЛ-АТ; 2) развитие тромбоза в трех или более органах менее чем за неделю; 3) диагностику микротромбоза при биопсии [46]. Поражение почек является одним из наиболее частых проявлений КАФС, однако гистологические детерминанты еще четко не определены.
Обследуя пациентов с КАФС, M.G. Tektonidou и соавт. (2008) выявили ТМА при биопсии почки у 100 % больных, фиброзную гиперплазию интимы — у 67 % и очаговую кортикальную атрофию — у 50 % [8]. Кроме того, у всех пациентов наблюдалась протеинурия > 500 мг/дл, у 50 % — системная артериальная гипертензия, у 67 % — острое повреждение почки, и у 67 % пациентов развился нефротический синдром. Что касается антител, то 100 % пациентов были aКЛ-позитивными, 67 % — позитивными по ВА и 17 % — в отношении b2ГПI [8].
Эту острую форму АФС-нефропатии чрезвычайно трудно дифференцировать от других острых микрососудистых заболеваний, таких как атипичный гемолитический уремический синдром, тромботическая тромбоцитопеническая пурпура, гепарининдуцированная тромбоцитопения или диффузная внутрисосудистая коагуляция [37]. При быстром развитии ОПП КАФС следует дифференцировать с быстро прогрессирующим волчаночным нефритом и острой склеродермической нефропатией.
Хроническая болезнь почек и гемодиализ
Диализная ХБП является редкой формой АФС-нефропатии. Данные литературы, описывающие это клиническое проявление, в настоящее время достаточно скудны. Распространенность ХБП среди пациентов с АФС-нефропатией на фоне первичного АФС составляет 35–81 %, при этом у подавляющего большинства пациентов это состояние прогрессирует в стабильную ХБП, а у менее 10 % развивается ХБП, требующая заместительной терапии [47]. Несколько авторов обнаружили высокую распространенность АФС среди пациентов с ХБП, получавших гемодиализ, по сравнению с населением в целом [47]. На самом деле распространенность ВА и аКЛ-АТ выше у пациентов с ХБП, получавших гемодиализ, чем у пациентов на консервативной терапии, возможно, вследствие более частого использования купрофановых мембран [47]. Кроме того, аФЛ-АТ-позитивность выше среди лиц, получающих гемодиализ, чем у пациентов, подвергшихся перитонеальному диализу. Тем не менее роль этих антител при диализных формах ХБП остается неясной.
Беременность и АФС-нефропатия
Клинические проявления, связанные с АФС-нефропатией, во время беременности трудно отличить от преэклампсии и HELLP-синдрома (гемолиз, повышение уровня печеночных ферментов и тромбоцитопения), которые имеют общие проявления с АФС-нефропатией — гипертензия, протеинурия, тромбоцитопения. Тем не менее появление гипертензии и протеинурии до двадцатой недели беременности и наличие аФЛ-АТ должны наводить на мысль об АФС-нефропатии [48]. А. Smyth и соавт. (2010) обнаружили связь между АГ и послеродовым поражением почек у женщин с положительными титрами ВА во время беременности, и следует подчеркнуть, что гистопатологические изменения у этих пациенток, обнаруженные в образцах биопсии почки, были характерны для ТМА [11].
Лечение АФС-нефропатии и тромбоза почечных сосудов
Целями терапии АФС-нефропатии при остром течении являются устранение тромботической окклюзии мелких внутрипочечных сосудов, а при хроническом течении — профилактика рецидивов тромбообразования во внутрипочечном сосудистом русле для замедления прогрессирования поражения почек.
До настоящего времени ни одно крупное проспективное исследование не оценивало влияние антикоагулянтов и других форм терапии на внутрипочечную тромботическую нефропатию, связанную с АФС. Антикоагулянтная терапия является стандартным подходом к лечению тромботических событий, затрагивающих крупные почечные сосуды или клубочковую ТМА [39]. Нефракционированный и низкомолекулярный гепарины (НФГ, НМГ) используются при острых тромботических событиях, при этом продолжительность лечения и дозы лекарственных средств пока четко не определены. При остром течении АФС-нефропатии у пациентов с профилем аФЛ-АТ высокого риска (персистирование ВА и/или аКЛ в высоком и среднем титрах, наличие «тройной позитивности») антикоагулянты необходимо применять длительно (иногда в течение нескольких месяцев) из-за сохраняющегося гиперкоагуляционного состояния [39].
Интересно, что действие гепарина при АФС связано не только с его антикоагулянтными свойствами. Гепарин также напрямую взаимодействует с b2ГПI. Как известно, активация b2ГПI вызывает конформационное изменение (изменение формы белка с круговой на открытую и экспозиции доменов I и V на поверхности), тем самым подвергая его домены воздействию циркулирующих аФЛ-АТ. Первичным местом связывания гепарина является домен V, который также является точкой приложения аФЛ-АТ. Гепарин усиливает опосредованное плазмином расщепление Lys317-Thr318 в b2ГПI, тем самым нарушая его способность распознавать фосфолипиды, инактивируя протромботическую активность антител, направленных на b2ГПI [49].
У аФЛ-положительных пациентов с СКВ и АФС-нефропатией по данным биопсии (отдельно или в сочетании с ВН) необходимо проведение раннего лечения для предотвращения почечной недостаточности. Антикоагулянты в настоящее время являются препаратами выбора для пациентов с АФС-индуцированными поражениями почек при СКВ, но влияние этого типа терапии на функцию и предотвращение поражения почек все еще остается неопределенным. При остром течении АФС-нефропатии предпочтение следует отдавать НФГ или НМГ. Всем пациентам с СКВ и АФС-нефропатией, независимо от наличия или отсутствия ВН, следует назначать гидроксихлорохин [44]. При вторичном АФС, ассоциированном с СКВ, в качестве первичной тромбопрофилактики применяют низкие дозы ацетилсалициловой кислоты и гидроксихлорохин (200–400 мг/день).
Антитромботические механизмы гидроксихлорохина основаны на ингибировании тромбоцитов, уменьшении связывания комплексов b2ГПI с фосфолипидами, а также уменьшении титров аФА-АТ и их прокоагулянтного эффекта [23]. Больным с СКВ при сочетании ВН с АФС-нефропатией, кроме антикоагулянтов, необходимо назначение глюкокортикоидов и цитостатиков в дозах, определяемых активностью болезни и морфологическим классом ВН.
Как уже подчеркивалось, у пациентов с СКВ и аФЛ-АТ нефропатия вследствие люпус-нефрита (иммунокомплексное заболевание) должна быть четко отдифференцирована от изолированного поражения почек вследствие АФС (клубочковая ТМА). В таких случаях проведение нефробиопсии является критично необходимым. ВН требует обязательной иммуносупрессивной терапии цитотоксическими агентами, тогда как АФС-нефропатия предполагает применение антикоагулянтов [50].
Очень важно при проведении антикоагулянтной терапии на фоне АФС-нефропатии контролировать уровень антикоагуляции при помощи международного нормализованного отношения (МНО). Почечные исходы могут улучшиться при антикоагулянтной терапии с целевым диапазоном МНО 3,0–4,5. В исследовании D. Puente и соавт. (2009) у пациентов с уровнем МНО выше 3,0 наблюдалось снижение артериального давления, стабилизация или улучшение функции почек и, в некоторых случаях, обратимость стеноза [51]. Однако, учитывая количество нежелательных побочных эффектов на фоне приема антикоагулянтов с таким высоким МНО, пероральная терапия антагонистами витамина К (варфарин) с целевым диапазоном МНО 2,0–3,0 является более предпочтительным подходом при длительной вторичной тромбопрофилактике [52]. Относительное противопоказание к назначению варфарина, кроме тяжелой АГ, у больных АФС-нефропатией — это ХБП на преддиализной стадии. Всем пациентам с рецидивирующими тромботическими событиями необходима высокоинтенсивная терапия варфарином (диапазон МНО 3,0–4,0) [51]. Пациенты с АФС-ассоциированным стенозом почечной артерии должны получать терапию антикоагулянтами с целевым МНО > 3,0, кроме того, эффективными методами лечения являются чрескожная ангиопластика и иногда нефрэктомия [34].
При КАФС с поражением почек используется комбинация антикоагулянтов, глюкокортикоидов, плазмафереза и внутривенного иммуноглобулина, что обеспечивает наилучшую выживаемость больных (77,8 против 55,4 % при других методах лечения) [53]. Однако в момент острого эпизода наиболее предпочтительным подходом является пульс-терапия метилпреднизолоном и назначение НФГ. Использование ритуксимаба исследовалось и рекомендуется в случаях рефрактерного КАФС [54].
Перспективным направлением в лечении КАФС является применение экулизумаба — гуманизированного моноклонального антитела к белку комплемента С5 [55]. Ингибирование пути комплемента моноклональными антителами, нацеленными на белок C5, уменьшает выраженность поражения аФЛ-индуцированной TMA. Недавние исследования сообщают о случаях успешного использования экулизумаба и терапии антикоагулянтами для предотвращения рецидива ТМА у посттрансплантационных пациентов с АФС [56]. Устойчивая ремиссия ТМА была зарегистрирована у пациентов с КАФС, получавших экулизумаб после неэффективного плазмафереза [26, 29]. Однако четкие рекомендации относительно длительности терапии экулизумабом на сегодня отсутствуют.
Специфический ингибитор рецептора C5a в настоящее время тестируется в качестве потенциальной мишени для лечения воспалительных заболеваний с участием комплемента. Рецептор C5a экспрессируется не только гемопоэтическими, но и различными неиммунными клетками, такими как почечные клетки и эндотелиальные клетки сосудов [57]. В ходе испытаний ингибитор рецептора C5a (CCX168) продемонстрировал высокую эффективность в контроле активности и течения ANCA-ассоциированного васкулита с поражением почек. Кроме того, отмечалось, что при использовании этого агента удавалось обходиться без высоких доз глюкокортикоидов [57]. В ожидании подтверждения этих результатов текущие исследования указывают, что ингибитор рецептора C5a является перспективным средством лечения АФС-нефропатии. Кроме того, как показали недавние исследования, ингибиторы деплеции В-клеток и комплемента могут служить адъювантами в терапии АФС у пациентов, резистентных к антикоагулянтной терапии [58]. Необходимы дальнейшие клинические исследования ритуксимаба, белимумаба, экулизумаба и других ингибиторов комплемента. Исследования некритериальных проявлений у аФЛ-положительных пациентов с АФС подтвердили профиль безопасности ритуксимаба. Однако сообщается, что результатом терапии ритуксимабом является лишь частичный ответ или стабилизация поражений почек [59].
Новые прямые оральные антикоагулянты (дабигатран, ривароксабан и апиксабан), используемые при лечении тромботических событий у пациентов с АФС, выявили противоречивые результаты, поэтому последние рекомендации по лечению АФС демонстрируют сдержанное отношение к ним и ограничения в применении. Эффективность и безопасность ривароксабана при лечении АФС в настоящее время оценивается в клинических испытаниях [60].
Новые формы лечения АФС-нефропатии находятся в стадии разработки. Комплекс-мишень рапамицина в клетках млекопитающих (mTORC) был идентифицирован как потенциальный медиатор хронической васкулярной АФС-нефропатии [30]. В исследовании пациентов с АФС-нефропатией, перенесших трансплантацию, лечение с сиролимусом и без него сравнивалось с точки зрения клинического исхода и почечной гистопатологии. В первой группе не было рецидивов сосудистых поражений, а при биопсии отмечалось снижение сосудистой пролиферации. Аналогичным образом лечение сиролимусом ассоциировалось с резким снижением пролиферации сосудистых клеток, ингибированием развития хронических поражений (таких как фиброзная гиперплазия интимы) и более длительным сохранением функции почек [30]. Путь (mTORC) играет важную роль в сосудистых поражениях, связанных с АФС, и, возможно, представляет ценную потенциальную терапевтическую мишень. Необходимы проспективные исследования для выяснения того, является ли активация mTORC одновременно целью лечения и биомаркером активности АФС-нефропатии.
На последнем конгрессе Европейской противоревматической лиги (EULAR) в Мадриде были представлены последние обновленные рекомендации по менеджменту пациентов с АФС [61]. Во время беременности лечение аспирином в низких дозах (75–100 мг/сут) следует рассматривать у женщин с профилем aPL высокого риска, но без истории тромбоза или осложнений беременности. У беременных женщин с ≥ 3 повторными выкидышами в анамнезе до 10-й недели беременности или с потерей плода в анамнезе на 10-й неделе беременности или позже EULAR рекомендует комбинированную терапию низкими дозами аспирина и гепарина в профилактических целях. Женщинам с акушерским АФС, получавшим гепарин, следует продолжать прием гепарина в профилактической дозе в течение 6 недель после родов, чтобы снизить риск тромбоза. А женщины с критериями акушерского АФС, которые имели рецидивирующие осложнения беременности, несмотря на рекомендованное лечение, могут рассмотреть возможность увеличения дозы гепарина до терапевтической или добавления гидроксихлорохина или преднизолона в низких дозах в первом триместре. В особых случаях врачи могут рассмотреть возможность применения внутривенного иммуноглобулина.
Рекомендации по первичной тромбопрофилактике у aФЛ-АТ-позитивных субъектов [61]. Профилактическое лечение низкими дозами аспирина (75–
100 мг/день) рекомендуется для бессимптомных лиц с профилем aФЛ-АТ высокого риска (с традиционными факторами риска или без них) и пациентов с СКВ и отсутствием тромбозов или осложнений беременности. Низкие дозы аспирина могут быть рекомендованы для лечения небеременных женщин с акушерским АФС в анамнезе только после адекватной оценки риска/пользы.
Рекомендации по вторичной тромбопрофилактике при АФС. После начальной терапии гепарином EULAR рекомендует лечить пациентов с АФС и первым венозным тромбозом антагонистами витамина К с целевым МНО от 2,0 до 3,0. При невозможности достижения целевого МНО, несмотря на хорошее соблюдение режима приема антагонистов витамина К или при наличии противопоказаний к их приему, рекомендуется рассмотреть возможность применения пероральных антикоагулянтов. Пациенты с тройной положительной реакцией на aФЛ-АТ (наличие волчаночного антикоагулянта, антикардиолипиновых антител и анти-b2-гликопротеиновых антител I) не должны лечиться ривароксабаном из-за высокого риска повторных тромбоэмболических осложнений. У пациентов с неспровоцированным первым венозным тромбозом следует рассмотреть возможность длительной антикоагулянтной терапии; пациенты, которые демонстрируют профили высокого риска aФЛ-АТ в повторных измерениях или демонстрируют факторы риска рецидива, могут также рассмотреть возможность более длительной антикоагуляции.
Преимущественное применение антагонистов витамина К рекомендуется по сравнению с низкими дозами аспирина только у пациентов с АФС и первым артериальным тромбозом; исходя из риска повторного тромбоза или сильного кровотечения, рекомендуется целевое значение МНО от 2 до 3 или от 3 до 4. В качестве альтернативы можно рассмотреть лечение антагонистами витамина К с целевым МНО от 2 до 3 плюс аспирин в низких дозах. У пациентов с артериальными тромботическими событиями и тройной положительной реакцией на aФЛ-АТ рекомендуются как ривароксабан, так и прямые пероральные антикоагулянты. У пациентов с АФС и рецидивирующим тромбозом необходимо изучить приверженность пациента к приему антагонистов витамина К, а также информировать пациентов о соблюдении режима лечения и проводить частые тесты МНО. Если было достигнуто целевое значение МНО от 2 до 3, возможно добавление низких доз аспирина в схему лечения, увеличение целевого значения МНО до 3–4 или переход на НМГ.
Всем пациентам с АФС-нефропатией рекомендуется проводить строгий регулярный контроль за уровнем артериального давления и протеинурией.
Выводы
Поражение почек у больных АФС до настоящего времени остается недооцененным. Возможно, это обусловлено тем, что у больных первичным АФС клинические проявления нефропатии отступают на второй план по сравнению с тяжелым поражением ЦНС, сердца и легких, тромботическими эпизодами, тогда как при СКВ любые симптомы поражения почек рассматриваются как манифестация ВН. Однако АФС-нефропатия является самостоятельным заболеванием, которое не ассоциируется с люпус-нефритом и другими видами нефропатий. Гломерулярная ТМА является характерным гистопатологическим признаком АФС, тесно коррелирующим с наличием аФЛ-АТ. Кроме того, АФС-нефропатия чаще всего развивается у пациентов с артериальными тромбозами в анамнезе. Эти релевантные признаки помогают дифференцировать АФС-нефропатию от других причин поражения почек и имеют важные терапевтические последствия. Следовательно, исследование аФЛ-АТ следует проводить регулярно у пациентов со стенозом почечной артерии в анамнезе, персистирующей или нарастающей протеинурией, вторичной гипертензией и нарушениями функции почек без видимой на то причины. Необходимо проведение длительных перспективных исследований для оценки эффективности антикоагулянтов или вазопротективных агентов на почечный прогноз и определение влияния АФС-нефропатии на прогрессирование поражения почек у этой категории пациентов.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
1. Miyakis S., Lockshin M.D., Atsumi T. et al. International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome (APS). J. Thromb. Haemost. 2006. Vol. 4. P. 295-306.
2. Turrent-Carriles А., Herrera-Félix J.B., Mary-Amigo С. Renal Involvement in Antiphospholipid Syndrome. Front. Immunol. 2018. Vol. 9. P. 1008.
3. Merashli M., Noureldine M.H., Uthman I., Khamashta M. Antiphospholipid syndrome: an update. Eur. J. Clin. Investig. 2015. Vol. 45, № 6. Р. 653-662.
4. Sinico R.A., Cavazzana I., Nuzzo M. et al. Renal involvement in primary antiphospholipid syndrome: retrospective analysis of 160 patients. Clin. J. Am. Soc. Nephrol. 2010. Vol. 5, № 7. P. 1211-7.
5. Parodis I., Arnaud L., Gerhardsson J. et al. Antiphospholipid Antibodies in Lupus Nephritis. PLoS One. 2016. Vol. 11, № 6. P. 0158076.
6. Silvariño R., Sant F., Espinosa G. et al. Nephropathy associated with antiphospholipid antibodies in patients with systemic lupus erythematosus. Lupus. 2011. Vol. 20, № 7. P. 721-729.
7. Zheng H., Chen Y., Ao W. et al. Antiphospholipid antibody profiles in lupus nephritis with glomerular microthrombosis: a prospective study of 124 cases. Arthritis Res. Ther. 2009. Vol. 11, № 3.
P. 93.
8. Tektonidou M.G., Sotsiou F., Moutsopoulos H.M. Antiphospholipid syndrome (APS) nephropathy in catastrophic, primary, and systemic lupus erythematosus-related APS. J. Rheumatol. 2008. Vol. 35, № 10. P. 1983-1988.
9. Gao R., Yu W., Wen Y., Li H. Beta2-glycoprotein I expression in lupus nephritis patients with antiphospholipid-associated nephropathy. J. Rheumatol. 2016. Vol. 43, № 11. P. 2026-2032.
10. Romanidou G., Konstantinidis T.G., Koutsogiannis O. et al. Study of Antiphospholipid Antibodies in Patients with Arterial Hypertension. Med. Sci. (Basel). 2018. Vol. 6, № 4. P. 102.
11. Smyth A., Oliveira G.H., Lahr B.D. et al. A systematic review and meta-analysis of pregnancy outcomes in patients with systemic lupus erythematosus and lupus nephritis. Clin. J. Am. Soc. Nephrol. 2010. Vol. 5. P. 2060-2068.
12. Gigante A., Ludovica M., Rosario G. et al. Antiphospholipid Antibodies and Renal Involvement. Am. J. Nephrol. 2009. Vol. 30. P. 405-412.
13. Nasri H. Antiphospholipid syndrome-associated ephropathy: Current concepts. J. Renal. Inj. Prev. 2013. Vol. 2, № 1. P. 1-2.
14. Barbour T.D., Crosthwaite A., Chow K. et al. Antiphospholipid syndrome in renal transplantation. Nephrology (Carlton). 2014. Vol. 19, № 4. P. 177-85.
15. Choi J.Y., Jung J.H., Shin S. et al. Living donor renal transplantation in patients with antiphospholipid syndrome. Medicine (Baltimore). 2016. Vol. 95, № 46. P. 5419.
16. Morales J.M., Serrano M., Martinez-Flores J.A. et al. The presence of pretransplant antiphospholipid antibodies IgA anti-beta-2-
glycoprotein I as a predictor of graft thrombosis after renal transplantation. Transplantation. 2017. Vol. 101. P. 597-607.
17. Meroni P.L., Chighizola C.B., Rovelli F., Gerosa M. Antiphospholipid syndrome in 2014: more clinical manifestations, novel pathogenic players and emerging biomarkers. Arthritis Res. Ther. 2014. Vol. 16, № 2. P. 209.
18. Arachchillage D.R., Efthymiou M., Mackie I.J. et al. Antiprotein C antibodies are associated with resistance to endogenous protein C activation and a severe thrombotic phenotype in antiphospholipid syndrome. J. Thromb. Haemost. 2014. Vol. 12, № 11. P. 1801-1809.
19. Brandt K.J., Kruithof E.K., de Moerloose P. Receptors involved in cell activation by antiphospholipid antibodies. Thromb. Res. 2013. Vol. 132. P. 408-413.
20. Willis R., Pierangeli S.S. Pathophysiology of the antiphospholipid antibody syndrome. Auto Immun. Highlights. 2011. Vol. 2, № 2. P. 35-52.
21. Макаренко Е.В. Антифосфолипидный синдром. Проблемы здоровья и экологии. 2017. T. 4, № 54. С. 4-11.
22. Yang Y.H., Chien D., Wu M. et al. Novel autoantibodies against the activated coagulation factor IX (FIXa) in the antiphospholipid syndrome that interpose the FIXa regulation by antithrombin. J. Immunol. 2009. Vol. 182, № 3. P. 1674-1680.
23. Negrini S., Pappalardo F., Murdaca G. et al. The antiphospholipid syndrome: from pathophysiology to treatment. Clin. Exp. Med. 2017. Vol. 17, № 3. Р. 257-267.
24. Vlachoyiannopoulos P.G., Routsias J.G. A novel mechanism of thrombosis in antiphospholipid antibody syndrome. J. Autoimmun. 2010. Vol. 35, № 3. P. 248-55.
25. Seshan S.V., Franzke C.W., Redecha P. et al. Role of tissue factor in a mouse model of thrombotic microangiopathy induced by antiphospholipid antibodies. Blood. 2009. Vol. 114. P. 1675-1683.
26. Lonze B.E., Singer A.L., Montgomery R.A. Eculizumab and renal transplantation in a patient with CAPS. N. Engl. J. Med. 2010. Vol. 362, № 18. P. 1744-1745.
27. Shapira I., Andrade D., Allen S.L., Salmon J.E. Brief report: induction of sustained remission in recurrent catastrophic antiphospholipid syndrome via inhibition of terminal complement with eculizumab. Arthritis Rheum. 2012. Vol. 64, № 8. P. 2719-23.
28. Hadaya K., Ferrari-Lacraz S., Fumeaux D. et al. Eculizumab in acute recurrence of thrombotic microangiopathy after renal transplantation. Am. J. Transplant. 2011. Vol. 11, № 11. P. 2523-7.
29. Canaud G., Kamar N., Anglicheau D. et al. Eculizumab improves posttransplant thrombotic microangiopathy due to antiphospholipid syndrome recurrence but fails to prevent chronic vascular changes. Am. J. Transplant. 2013. Vol. 13, № 8. P. 2179-85.
30. Canaud G., Bienaime F., Tabarin F. et al. Inhibition of the mTORC pathway in the antiphospholipid syndrome. N. Engl. J. Med. 2014. Vol. 371, № 4. Р. 303-12.
31. Al-Homood I.A. Thrombosis in Systemic Lupus Erythematosus: A Review Article. ISRN Rheumatology. 2012. Vol. 428, № 269. P. 6.
32. Boltin D., Boguslavski V., Sagi L. et al. Antiphospholipid syndrome presenting as unilateral renal artery occlusion: case report and literature review. Rheumatol. Int. 2009. Vol. 29, № 7. P. 831-5.
33. Tektonidou M.G. Antiphospholipid Syndrome Nephropathy: From Pathogenesis to Treatment. Front. Immunol. 2018. Vol. 9. P. 1181.
34. Peleg H., Bursztyn M., Hiller N., Hershcovici T. Renal artery stenosis with significant proteinuria may be reversed after nephrectomy or revascularization in patients with the antiphospholipid antibody syndrome: a case series and review of the literature. Rheumatol. Int. 2012. Vol. 32, № 1. P. 85-90.
35. Vellanki V.S., Parvathina S., Gondi S. et al. Post-partum bilateral renal cortical necrosis in antiphospholipid syndrome and systemic lupus erythematosus. Saudi J. Kidney Dis. Transpl. 2013. Vol. 24. P. 549-552.
36. Cervera R., Rodriguez-Pinto I., Espinosa G. on behalf of the Task Force on Catastrophic Antiphospholipid Syndrome. Catastrophic antiphospholipid syndrome: task force report summary. Lupus. 2014. Vol. 23, № 12. P. 1283-5.
37. Rodriguez-Pinto I., Espinosa G., Cervera R. Catastrophic APS in the context of other thrombotic microangiopathies. Curr. Rheumatol. Rep. 2015. Vol. 17, № 1. P. 482.
38. Gerhardsson J., Sundelin B., Zickert A. et al. Histological antiphospholipid-associated nephropathy versus lupus nephritis in patients with systemic lupus erythematosus: an observational cross-sectional study with longitudinal follow-up. Arthritis Res. Ther. 2015. Vol. 17, № 1. P. 109.
39. Majdan М. Kidney involvement in antiphospholipid syndrome — current diagnostic and management problems. Reumatologia. 2017. Vol. 55, № 5. P. 213-214.
40. Bommer M., Wölfle-Guter M., Bohl S., Kuchenbauer F. The Differential Diagnosis and Treatment of Thrombotic Microangiopathies. Dtsch. Arztebl. Int. 2018. Vol. 115, № 19. P. 327-334.
41. Sciascia S., Baldovino S., Schreiber K. et al. Antiphospholipid syndrome and the Kidney. Semin. Nephrol. 2015. Vol. 35, № 5. P. 478-486.
42. Cervera R., Tektonidou M.G., Espinosa G. et al. Task Force on Catastrophic Antiphospholipid Syndrome (APS) and Non-criteria APS Manifestations (I): catastrophic APS, APS nephropathy and heart valve lesions. Lupus. 2011. Vol. 20, № 2. P. 165-73.
43. De Azevedo F.V., Maia D.G., de Carvalho J.F. et al. Renal involvement in antiphospholipid syndrome. Rheumatol. Int. 2018. Vol. 38. P. 1777.
44. Pons-Estel G.J., Andreoli L., Scanzi F. et al. The antiphospholipid syndrome in patients with systemic lupus erythematosus. J. Autoimmun. 2017. Vol. 76. P. 10-20.
45. Ünlu O., Zuily S., Erkan D. The clinical significance of antiphospholipid antibodies in systemic lupus erythematosus. Eur. J. Rheumatol. 2016. Vol. 3. P. 75-84.
46. Erkan D., Espinosa G., Cervera R. Catastrophic antiphospholipid syndrome: updated diagnostic algorithms. Autoimmun. Rev. 2010. Vol. 10, № 2. P. 74-9.
47. Bienaime F., Legendre C., Terzi F., Canaud G. Antiphospholipid syndrome and kidney disease. Kidney International. 2017. Vol. 91. P. 34-44.
48. American College of Obstetricians and Gynecologists, Task force on hypertension in pregnancy. Hypertension in pregnancy. Report of the American College of Obstetricians and Gynecologists “Task Force on hypertension in pregnancy”. Obstet. Gynecol. 2013. Vol. 122, № 5. P. 1122-31.
49. De Groot P.G., Urbanus R.T. The significance of autoantibodies against β2-glycoprotein. Blood. 2012. Vol. 120. P. 266-274.
50. Miranda J.M., Jara L.J., Calleja C. et al. Clinical significance of antiphospholipid syndrome nephropathy (APSN) in patients with systemic lupus erythematosus (SLE). Reumatol. Clin. 2009. Vol. 5, № 5. P. 209-213.
51. Puente D., Pombo G., Forastiero R. Current management of antiphospholipid syndrome-related thrombosis. Expert Rev. Cardiovasc. Ther. 2009. Vol. 7, № 12. P. 1551-8.
52. Del Papa N., Vaso N. Management of Antiphospholipid Syndrome. Ther. Adv. Musculoskelet. Dis. 2010. Vol. 2, № 4. P. 221-227.
53. Cervera R., Rodríguez-Pintó I., Colafrancesco S. et al. 14th International Congress on Antiphospholipid Antibodies Task Force Report on Catastrophic Antiphospholipid Syndrome. Autoimmun. Rev. 2014. Vol. 13. P. 699-707.
54. Rodriguez-Pintó I., Espinosa G., Cervera R. Catastrophic antiphospholipid syndrome: The current managementapproach. Best Pract. Res. Clin. Rheumatol. 2016. Vol. 30, № 2. Р. 239-249.
55. Erkan D., Aguiar C.L., Andrade D. et al. 14th International Congress on Antiphospholipid Antibodies: task force report on antiphospholipid syndrome treatment trends. Autoimmun. Rev. 2014. Vol. 13, № 6. Р. 685-696.
56. Hadaya K., Ferrari-Lacraz S., Fumeaux D. et al. Eculizumab in acute recurrence of thrombotic microangiopathy after renal transplantation. Am. J. Transplant. 2011. Vol. 11, № 11.
P. 2523-7.
57. Jayne D.R., Bruchfeld N.A., Harper L. et al. Randomized trial of c5a receptor inhibitor avacopan in ANCA-associated vasculitis. J. Am. Soc. Nephrol. 2017. Vol. 28, № 9. P. 2756-2767.
58. Pons I., Espinosa G., Cervera R. Efficacy and safety of rituximab in the treatment of primary antiphospholipid syndrome: analysis of 24 cases from the bibliography review. Med. Clin. (Barc.). 2015. Vol. 144, № 3. P. 97-104.
59. Erkan D., Vega J., Ramon G. et al. A pilot open-label phase II trial of rituximab for non-criteria manifestations of antiphospholipid syndrome. Arthritis Rheum. 2013. Vol. 65, № 2. P. 464-71.
60. Win K., Rodgers G.M. New oral anticoagulants may not be effective to prevent venous thromboembolism in patients with antiphospholipid syndrome. Am. J. Hematol. 2014. Vol. 89, № 10. P. 1017.
61. Tektonidou M.G., Andreoli L., Limper M. et al. EULAR recommendations for the management of antiphospholipid syndrome in adults. Ann. Rheum. Dis. Published Online First. 15 May 2019.

/53-1.jpg)
/54-1.jpg)
/56-1.jpg)