Вступ
Був проведений огляд літератури з діагностики та лікування нейроендокринних пухлин (НЕП) шлунка та висвітлено сучасні підходи й останні дані щодо використання нових методів діагностики та лікування. Опрацьовано дані значної кількості проспективних і неконтрольованих досліджень, клінічних рекомендацій European Neuroendocrine Tumor Society (ENETS), інструкцій National Comprehensive Cancer Network (NCCN), з використанням пошукового ресурсу PubMed.
Нейроендокринні пухлини шлунка
Нейроендокринні пухлини виникають з нейроендокринних клітин організму. НЕП можуть бути розташовані по всьому тілу: від солідних ендокринних органів до ендокринних клітин в інших органах, таких як легені. Рідкісна локалізація НЕП — шлунок, частка якої становить 7–8 % [1, 2]. Однак частота виникнення нейроендокринних пухлин шлунка зростає, що, можливо, пов’язано з удосконаленням методів діагностики або широким застосуванням інгібіторів протонної помпи [2, 3].
Розуміння поведінки і патофізіології проблеми розвивалося й еволюціонувало з 1970-х років, коли було помічено, що у пацієнтів із синдромом Золлінгера — Еллісона (СЗЕ) спостерігалась проліферація ентерохромафіноподібних (ЕХП) клітин [4]. У наш час є загальноприйнятним той факт, що НЕП шлунка розвиваються з гістамінсекретуючих ЕХП-клітин шлунка, але деякі пухлини цього ряду виникають з серотонінсекретуючих ЕХП-клітин або клітин, що секретують грелін. До початку 1990-х років було зібрано достатньо даних щодо НЕП шлунка для класифікації осередків ураження на три різних типи (табл. 1) [4, 6].
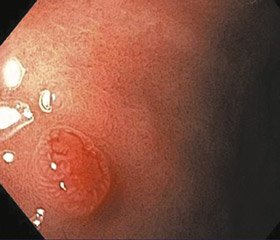
Нейроендокринні пухлини шлунка I типу
НЕП I типу є найбільш поширеними з трьох типів та становлять приблизно 70–80 % випадків. Встановлено чіткий зв’язок даного типу з автоімунним атрофічним гастритом, який викликає ахлоргідрію і дефіцит внутрішнього фактора [4, 7]. У результаті хронічної –ахлоргідрії виникає гіперплазія G-клітин, що спричиняє підвищену секрецію гастрину, з подальшою гіпергастринемією [7]. Довготривале застосування інгібіторів протонної помпи також викликає розвиток шлункових НЕП [3, 8]. Пухлини I типу частіше зустрічаються у жінок і, як правило, є невеликими та множинними. Зазвичай обмежені слизовою або підслизовою оболонкою і характеризуються більш доброякісним перебігом (рис. 1) [8].
Нейроендокринні пухлини шлунка II типу
НЕП II типу також пов’язані з гіпергастринемією, на фоні гастриноми і СЗЕ. Спорадичний СЗЕ рідко викликає шлункові нейроендокринні пухлини II типу, але частота їх виникнення зростає при множинній ендокринній неоплазії I типу (МЕН I) [7, 9]. Даний тип зустрічається рідше, у 5–8 % випадків [1, 7, 9]. Хоча пухлини і дуже схожі на ураження I типу, вони характеризуються більш агресивним перебігом, з підвищеним метастатичним потенціалом [8]. Частота виникнення однакова у чоловіків і жінок (рис. 2) [8, 9].
Нейроендокринні пухлини шлунка III типу
Оскільки НЕП III типу не зустрічаються ні з яким супутнім захворюванням або в умовах гіпергастринемії, вони вважаються спорадичними. Їх частка становить від 15 до 20 % нейроендокринних пухлин шлунка. Даний тип має найбільш злоякісний потенціал. Частіше зустрічаються в чоловіків, зазвичай це великі, поодинокі новоутворення розміром від 2 до 5 см [10].
Нейроендокринна карцинома
Був ідентифікований і четвертий тип — нейроендокринна карцинома, хоча спочатку його не було в системі класифікації, запропонованій Rindi та його колегами [6]. Ці пухлини є низькодиференційованими з дуже злоякісним перебігом, як правило, швидко прогресують та характеризуються появою дуже поширених метастазів [11].
У цілому нейроендокринна карцинома поводиться як аденокарцинома шлунка, але має ендокринний фенотип. Пацієнти з такими пухлинами рідко є кандидатами на радикальне оперативне лікування, але можуть потребувати хірургічного лікування місцевих симптомів (кровотечі, перфорації або обструкції).
Патофізіологія
НЕП шлунка виникають з проліферуючих ЕХП-клітин, які локалізуються в слизовій оболонці тіла шлунка, що секретує кислоту. На ЕХП-клітини діє гастрин, який викликає вивільнення гістаміну [10]. Гістамін, в свою чергу, стимулює парієтальні клітини до секреції кислоти, а також чинить трофічну дію на ЕХП-клітини на фоні гіпергастринемії, яка викликає гіпертрофію і гіперплазію ЕХП-клітин. Шлункові нейроендокринні пухлини виникають на фоні гіперплазії ЕХП-клітин через розвиток гіперплазії, дисплазії та неоплазії [1, 7, 9–11]. Крім того, в пацієнтів із хронічним атрофічним гастритом порушене пригнічення G-клітин, що продукують гастрин, через негативний зворотний зв’язок рецепторів соматостатину, що додатково сприяє розвитку гіпергастринемії та її трофічному впливу на ЕХП-клітини (рис. 3) [1].
/39-1.jpg)
Шлункові НЕП не розвиваються у пацієнтів з гіпергастринемією, пов’язаною з іншими причинами (наприклад, ваготомія), крім хронічного атрофічного гастриту і СЗЕ. Пацієнти зі спорадичним СЗЕ, не пов’язаним з МЕН І, також мають набагато меншу ймовірність розвитку шлункових НЕП, що змушує припускати, що є додатковий фактор впливу, такий як бактеріальна інфекція, генетична мутація або локальний фактор росту [1]. НЕП шлунка III типу виникають спорадично, без будь-яких відомих ознак провокуючого стану. Гіперплазія ЕХП-клітин, як при пухлинах I і II типу, відсутня [11].
Генетичний вплив
Ген МЕН І вивчений найбільш широко через його роль в СЗЕ. Автосомно-домінантна мутація у хромосомі 11q13 пов’язана з розвитком шлункових НЕП у всіх пацієнтів з пухлинами II типу, в яких спостерігається втрата гетерозиготності, у 17–73 % пацієнтів з пухлинами I типу та у 25–50 % пацієнтів з пухлинами III типу [1, 7]. Мутація гена р53 пов’язана з НЕП шлунка III типу. Можливу роль у розвитку пухлин на клітинному рівні відіграють й інші фактори, такі як білок BCL-2, що інгібує апоптоз, білки позаклітинного матриксу — матриксна металопротеїназа-7 і -9, та Reg-фактор росту [7].
Клінічні прояви нейроендокринних пухлин шлунка
На відміну від НЕП інших локалізацій, які можуть викликати карциноїдний синдром, шлункові нейроендокринні пухлини є, як правило, нефункціонуючими (гормонально неактивними). Іноді супроводжуються певною симптоматикою, спричиняють виразкування, викликаючи кровотечу та/або анемію. Хронічний атрофічний гастрит, пов’язаний з НЕП I типу, може викликати дефіцит вітаміну B12 і заліза. Також можливі прояви диспепсії внаслідок повільного спорожнення шлункового вмісту.
Нейроендокринні пухлини II типу виникають на фоні гіпергастринемії з гастриноми, що також спричиняє підвищену секрецію кислоти, з високим рН, що спостерігається при 24-годинному дослідженні рівня рН або при аспірації шлункового вмісту. Тому пацієнти можуть мати класичні симптоми виразкової хвороби, а при ендоскопічному дослідженні часто виявляють пептичні виразки. Самі по собі НЕП шлунка рідко є причиною цих симптомів [12].
Спорадична природа НЕП шлунка III типу означає, що немає ніяких асоційованих станів, які можуть викликати симптоми, і даний тип, як правило, виявляється, коли стає симптомним через біль, кровотечу або втрату ваги. Рідко пов’язаний з атиповою формою карциноїдного синдрому, при якому побічними ефектами вивільнення високих рівнів гістаміну з ЕХП-клітин є свербіж, шкірні пухирі і бронхоспазм [12].
Діагностичні процедури та методи
Золотим стандартом діагностики НЕП шлунка залишається езофагогастродуоденоскопія (ЕГДС). Окрім безпосереднього спостереження за новоутвореннями слід визначати їх кількість та розмір, виконувати біопсію нормальних ділянок слизової оболонки по великій та малій кривизнах, щоб отримати нормальну тканину для порівняння щільності ЕХП-клітин [10, 12]. Після підтвердження діагнозу можна провести ендо–скопічне ультразвукове дослідження (ЕУЗД) для визначення глибини інвазії та необхідної стратегії лікування. Комп’ютерну (КТ) або магнітно-резонансну томографію (МРТ) доцільно використовувати при підозрі метастазування або ураження лімфатичних вузлів. Крім того, у визначенні місця розташування і поширеності пухлини можуть допомогти мічені радіоактивним ізотопом аналоги соматостатину [10].
Як діагностичну процедуру також слід використовувати біомаркери сироватки: рівні хроматограніну А (CgA), гістаміну, серотоніну та гастрину в плазмі крові. При пухлинах I і II типів спостерігається підвищення рівня гастрину, а при пухлинах III типу цей показник залишається в межах норми. CgA — це глікопротеїн, що експресується в секреторних гранулах ЕХП-клітин і вивільняється при їх стимуляції. При функціональних і нефункціональних НЕП часто спостерігаються підвищені рівні циркулюючого CgA; необхідно враховувати, що підвищені рівні цього білка можуть спостерігатись й при інших захворюваннях, таких як ниркова недостатність, серцева недостатність, а також при використанні інгібіторів протонної помпи [13]. При пухлинах, що характеризуються підвищеним рівнем CgA, цей біо–маркер корисний як показник відповіді на лікування та контролю за рецидивом [14]. Дослідження, виконане Borch та його колегами [15], показало підвищення концентрації CgA в плазмі пацієнтів з карциноїдними пухлинами порівняно з пацієнтами без таких ново–утворень, при цьому середня концентрація CgA в плазмі становила 5,7 нмоль/л (3,5–40).
Гістологічний тип і класифікація нейроендокринних пухлин шлунка
Гістологічне дослідження нейроендокринних пухлин шлунка є складним, а лікування рекомендується проводити у великих високоспеціалізованих медичних центрах. Для пухлин I і II типів характерне ураження ЕХП-клітин з неоплазією. Ці пухлини часто аргірофільні й аргентафінні, і в усіх випадках спостерігається наявність CgA [10]. Для порівняння, пухлини шлунка III типу мають більш стійку гістологічну картину і зазвичай аргірофільні, але не аргентафінні. Крім імуно–реактивності до CgA вони також імунореактивні до ней–ронспецифічної енолази, синаптофізину та s-100 [10].
Класифікація заснована на класифікаційній системі нейроендокринних новоутворень Всесвітньої організації охорони здоров’я 2010 р. Швидкість проліферації визначається кількістю мітозів на 10 мікроскопічних полів і відсотком пухлинних клітин, мічених антитілом до Ki-67, що називають індексом Ki-67. Пухлини 1-го ступеня мають кількість мітозу менше за 2 та індекс Ki-67 менше за 3 %, тоді як пухлини 2-го ступеня мають кількість мітозу від 2 до 20 та індекс Ki-67 3–20 %. Будь-яка кількість мітозу, що перевищує 20, або індекс Ki-67, що перевищує 20 %, характерні для пухлин 3-го ступеня [16]. Ця система класифікації забезпечує загальноприйнятий підхід для патологічного визначення пухлин. Національна мережа багатопрофільних онкологічних установ рекомендує визначати НЕП шлунка відповідно до сьомого видання American Cancer Society, опублікованого в 2010 р.
Діагностика та лікування нейроендокринних пухлин шлунка
Нейроендокринні пухлини шлунка I типу
При діагностиці НЕП I типу найчастіше виявляються у дні шлунка. Вони зазвичай поліпоподібні, множинні, розміром 5–8 мм. Можуть бути неправильної форми, еритематозними, з впадинами або центральною виразкою [11]. Рівень pH шлункового вмісту, визначеного під час ендоскопії, становить більше 4, що пов’язано з хронічним атрофічним гастритом і недостатністю кислотної секреції парієтальних клітин.
Досі ведуться суперечки стосовно кращого методу лікування пухлин I типу розміром менше 1 см (рис. 4). Одні вважають за краще ендоскопічну поліпектомію, в той час як інші стверджують, що успішний результат лікування вимагає активного ендоскопічного спостереження. Незалежно від видалення пухлини слід щорічно проводити ендоскопічне спостереження. Якщо розміри більше 1 см, необхідно виконати ЕУЗД для оцінки глибини інвазії. Якщо ураження локалізовано на слизовій або підслизовій оболонці, необхідно виконувати ендоскопічну резекцію слизової оболонки або підслизову дисекцію з резекцією [10]. Хірургічна резекція рекомендується для пацієнтів із 6 ділянками уражень, з яких 3–4 ділянки більше 1 см, або якщо одна ділянка ураження більше 2 см. Якщо розмір пухлини більше 2 см, для оцінки інвазії та ураження лімфатичних вузлів рекомендується КТ або МРТ [12]. Консервативне лікування НЕП шлунка I типу включає щомісячні внутрішньом’язові ін’єкції аналога соматостатину тривалої дії, що характеризується мінімальними побічними ефектами. Це лікування зазвичай призначають пацієнтам, яким хірургічне лікування протипоказане.
/41-1.jpg)
Залишається значна кількість лікарів, які виступають за шлункову антрумектомію при пухлинах шлунка I типу з мультифокальними ураженнями, інвазивними ураженнями або при рецидивах, оскільки такий об’єм забезпечує видалення G-клітин, тим самим усуваючи джерело гіпергастринемії [17]. Є докази того, що більше 90 % НЕП шлунка регресують після усунення гіпергастринемії [11]. Однак при деяких пухлинах є незалежність від секреції гастрину, і вони продовжують прогресувати навіть при нормалізації його рівня. У 2016 р. Jenny і співавт. [18] опублікували інформацію стосовно групи пацієнтів з НЕП шлунка I типу, які прой–шли процедуру лапароскопічної антрумектомії і мали більш низький ризик рецидивів порівняно з пацієнтами, які пройшли поліпектомію або знаходились під наглядом. Інші дослідники стверджують, що такі пацієнти незалежно від їх стану повинні бути під наглядом протягом усього життя. Chen та співавт. [19] опублікували інформацію з досвіду школи медицини «Маунт-Синай» (Mount Sinai) стосовно лікування НЕП шлунка I типу в 2014 р. У 5,5 % пацієнтів з НЕП шлунка I типу пізніше розвинулася аденокарцинома шлунка, що було підтверджено результатами ендоскопічного моніторингу. Ці дані відповідають рекомендаціям Національної мережі багатопрофільних онкологічних установ щодо ЕГДС спостереження кожні 6–12 місяців після первинної резекції, з подальшим щорічним моніторингом [19, 20].
Нейроендокринні пухлини шлунка II типу
Діагностика і лікування НЕП шлунка II типу відрізняється від тактики при пухлинах I типу через більш злоякісний та інвазивний потенціал цих уражень. При ендоскопічному дослідженні спостерігаються множинні дрібні поліпоподібні пухлини, а також ознаки виразкової хвороби. Ураження, як правило, розміщені у дні шлунка, але також можуть бути і в антральному відділі. Рівень pH шлункового вмісту дуже кислий, становить менше 2. У більшості пацієнтів підвищуються рівні гастрину в сироватці, зазвичай більше 1000 пг/мл [12]. Крім ендоскопічного дослідження та визначення рівня гастрину в сироватці крові слід проводити генетичне тестування для виявлення МЕН І, встановлення локалізації асоційованих гастрином, а також здійснювати скринінг інших асоційованих пухлин паращитоподібної залози та гіпофіза. Пухлини II типу необхідно видаляти; ендоскопічна резекція показана при ураженнях без інвазії за межі підслизової оболонки. Радикальна резекція рекомендується для інвазивних уражень, а також, при можливості, резекції гастриноми. При неможливості видалення гастриноми гіперсекрецію шлункової кислоти слід контролювати за допомогою високих доз інгібіторів протонної помпи або сироваткових антагоністів серотоніну. Після резекції необхідно проводити щорічне спостереження.
Нейроендокринні пухлини шлунка III типу
Нейроендокринні пухлини шлунка III типу зазвичай більше 2 см і поодинокі, а оточуюча слизова оболонка шлунка в нормі. Типовою є інвазія за межі підслизової оболонки, а метастази спостерігаються у 50–100 % пацієнтів на момент діагностики захворювання [7, 12]. Потрібно визначити ступінь ураження за допомогою КТ і/або МРТ. За наявності метастатичного процесу спочатку проводять системну терапію першої лінії. Якщо НЕП операбельна, проводять хірургічну резекцію з лімфаденектомією.
Лікування метастазування
Лікування при метастазах у печінку здійснюють шляхом хірургічного видалення, системної терапії та методів місцево-регіонарного контролю. За наявності карциноїдного синдрому як антипроліферативні або антисекреторні препарати використовують аналоги соматостатину (АСС) [12, 16]. Крім того, АСС можна застосовувати при інших типах НЕП шлунка, оскільки вони пригнічують секрецію гастрину і зменшують проліферацію ЕХП-клітин. Лікування добре переноситься, спостерігається регресія або зменшення розміру пухлин. Однак після припинення терапії можливий розвиток рецидивів. При застосуванні АСС поки не відмічалося покращення результатів лікування [12]. Частота відповіді на лікування у разі застосування хіміотерапії на пізніх стадіях захворювання може становити 20–40 %. Зазвичай використовуються такі хіміопрепарати, як стрептозоцин, 5-фторурацил, циклофосфамід, етопозид і доксорубіцин [10, 21].
Новим препаратом є нетазепід — пероральний селективний антагоніст рецептора гастрину/холецистокініну-2. У нерандомізованому дослідженні з застосуванням цього засобу спостерігались зменшення числа і розміру НЕП шлунка I типу, а також нормалізація рівня CgA, але не гастрину [16]. Щоб повністю зрозуміти потенційну терапевтичну користь цього препарату при шлункових НЕП, необхідні подальші дослідження.
У міру кращого розуміння біохімічних механізмів, що лежать в основі розвитку НЕП шлунка та інших органів, можуть бути розроблені додаткові терапевтичні цілі. Наприклад, Somnay та співавт. [22] нещодавно продемонстрували, що хризин, протираковий флавоноїд, викликає апоптоз і зупинку клітинного циклу в клітинній лінії нейроендокринних пухлин кишечника. Це відкриття має важливий терапевтичний потенціал.
Клінічні результати щодо нейроендокринних пухлин шлунка
Результати лікування НЕП шлунка корелюють із типом пухлини, а також з її ступенем: пухлини I типу, як правило, мають сприятливий прогноз, а пухлини III типу — більш несприятливий прогноз. Пухлини I типу, як правило, є пухлинами 1-го ступеня і І стадії, з низьким індексом Ki-67, рідко проникають в м’язовий шар та рідко метастазують при розмірі менше за 1 см. Існує відмінний довгостроковий прогноз з нормальною тривалістю життя, навіть у рідкісних випадках, за наявності метастазів [12, 23–27].
НЕП шлунка II типу зазвичай високо диференційовані, 1-го або 2-го ступеня, але у 5–35 % випадків спостерігається ураження регіональних лімфатичних вузлів. В цілому прогноз залишається сприятливим, з рівнем смертності менше 10 % [11, 12, 28]. Більшість пухлин III типу також 2-го ступеня, але пухлини 3-го ступеня зустрічаються частіше, ніж при новоутвореннях інших типів. Поширена інвазія за межі підслизової оболонки, метастатичний процес зустрічається у 50–100 % пацієнтів [12]. Рівень виживаності в цій групі є найменшим, а рівень смертності становить 25–30 % [28].
Postlewait та співавт. [29] опублікували результати 15-річного спостереження за пацієнтами в лікарні Еморі. Трирічна безрецидивна виживаність становила 33 % при пухлинах I типу порівняно з 86 % при пухлинах III типу, що є очікуваним через патофізіологію пухлин I типу. Трирічна виживаність, що залежить безпосередньо від захворювання, становила 100 % для пухлин I типу і 75 % для пухлин III типу. Аналогічно, дослідження Rappel та співавт. [23] показало, що у пацієнтів з нейроендокринними пухлинами I типу очікувана тривалість життя була високою, тоді як у пацієнтів з НЕП шлунка III типу виживаність з поправкою на вік становила 79 %.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Nikou G.C., Angelopoulos T.P. Current concepts on gastric carcinoid tumors // Gastroenterol. Res. Pract. — 2012. — 2012. — 287825.
2. Modlin I.M., Lye K.D., Kidd M. A 5-decade analysis of 13,715 carcinoid tumors // Cancer. — 2003. — 97(4). — Р. 934-59.
3. Nandy N., Hanson J.A., Strickland R.G. et al. Solitary gastric carcinoid tumor associated with long-term use of omeprazole: a case report and review of the literature // Dig. Dis. Sci. — 2016. — 61. — Р. 708-12.
4. Bordi C. Neuroendocrine pathology of the stomach: the Parma contribution // Endocr. Pathol. — 2014. — 25. — Р. 171-80.
5. Latta E., Rotondo F., Leiter L.A. et al. Ghrelin and serotonin producing gastric carcinoid // J. Gastrointest. Cancer. — 2012. — 43. — Р. 319-23.
6. Rindi G., Petrone G., Inzani F. 25 Years of neuroendocrine neoplasms of the gastrointestinal tract // Endocr. Pathol. — 2014. — 25. — Р. 59-64.
7. Burkitt M.D., Pritchard D.M. Review article: pathogenesis and management of gastric carcinoid tumours // Aliment. Pharmacol. Ther. — 2006. — 24. — Р. 1305-20.
8. Kidd M., Gustafsson B., Modlin I.M. Gastric carcinoids (neuroendocrine neoplasms) // Gastroenterol. Clin. North Am. — 2013. — 42. — Р. 381-97.
9. Mulkeen A., Cha C. Gastric carcinoid // Curr. Opin. Oncol. — 2005. — 17(1). — Р. 1-6.
10. Modlin I.M., Kidd M., Lye K.D. Biology and management of gastric carcinoid tumours: a review // Eur. J. Surg. — 2002. — 168. — Р. 669-83.
11. Fendrich V., Bartsch D.K. Surgical treatment of gastrointestinal neuroendocrine tumors // Langenbecks Arch. Surg. — 2011. — 396. — Р. 299-311.
12. Basuroy R., Srirajaskanthan R., Prachalias A. et al. Review article: the investigation and management of gastric neuroendocrine tumors // Aliment. Pharmacol. Ther. — 2014. — 39. — Р. 1071-84.
13. Verbeek W.H., Korse C.M., Tesselaar M.E.T. Secreting gastro-enteropancreatic neuroendocrine tumours and biomarkers // Eur. J. Endocrinol. — 2016. — 174. — R1-7.
14. Zhang L., Ozao J., Warner R. et al. Review of the pathogenesis, diagnosis, and management of type I gastric carcinoid tumor // World J. Surg. — 2011. — 35. — Р. 1879-86.
15. Borch K., Stridsberg M., Burman P. еt al. Basal chromogranin A and gastrin concentrations in circulation correlate to endocrine cell proliferation in type-A gastritis // Scand. J. Gastroenterol. — 1997. — 32(3). — Р. 198-202.
16. Massironi S., Zilli A., Conte D. Somatostatin analogs for gastric carcinoids: for many, but not all // World J. Gastroenterol. — 2015. — 21(22). — Р. 6785-93.
17. Hirschowitz B.I. Clinical aspects of ECL-cell abnormalities // Yale J. Biol. Med. — 1998. — 71(3–4). — Р. 303-10.
18. Jenny H.E., Ogando P.A., Fujitani K. et al. Laparoscopic antrectomy: a safe and definitive treatment in managing type 1 gastric carcinoids // Am. J. Surg. — 2016. — 211. — Р. 778-82.
19. Chen W.C., Warner R.R.P., Ward S.C. et al. Management and disease outcome of type I gastric neuroendocrine tumors: the Mount Sinai experience // Dig. Dis. Sci. — 2015. — 60. — Р. 996-1003.
20. [Guideline] National Comprehensive Cancer Network. Available at: https://www. nccn.org/professionals/physician_gls/pdf/neuroendocrine.pdf. Accessed July 17, 2016.
21. Gilligan C.J., Lawton G.P., Tang L.H. et al. Gastric carcinoid tumors: the biology and therapy of an enigmatic and controversial lesion // Am. J. Gastroenterol. — 1995. — 90(3). — Р. 338-52.
22. Somnay Y.R., Dull B.Z., Eide J. et al. Chrysin suppress estheachaete-scute complex like 1 and alters the neuroendocrine phenotype of carcinoids // Cancer Gene Ther. — 2015. — 22(10). — Р. 496-505.
23. Rappel S., Altendorf-Hofmann A., Stolte M. Prognosis of gastric carcinoid tumors // Digestion. — 1995. — 56(6). — Р. 455-62.
24. Hosokawa O., Kaizaki Y., Hatoori M. et al. Long-term follow up of patients with multiple gastric carcinoids associated with type A gastritis // Gastric Cancer. — 2005. — 8(1). — Р. 42-6.
25. Kim B.S., Park Y.S., Yook J.H. et al. Differing clinical courses and prognoses in patients with gastric neuroendocrine tumors based on the 2010 WHO classification scheme // Medicine. — 2015. — 94(44). — Р. e1748.
26. La Rosa S., Inzani F., Vanoli A. et al. Histologic characterization and improved prognostic evaluation of 209 gastric neuroendocrine neoplasms // Hum. Pathol. — 2011. — 42. — Р. 1373-84.
27. Thomas D., Tsolakis A.V., Grozinsky-Glasberg S. et al. Long term follow up of a large series of patients with type 1 gastric carcinoid tumors: data from a multicenter study // Eur. J. Endocrinol. — 2013. — 168. — Р. 185-93.
28. Ruszniewski P., Delle Fave G., Cadiot G. et al. Well differentiated gastric tumors/carcinomas // Neuroendocrinology. — 2006. — 84. — Р. 158-64.
29. Postlewait L.M., Baptiste G.G., Ethun C.G. et al. A 15-year experience with gastric neuroendocrine tumors: does type make a difference? // J. Surg. Oncol. — 2016. — 114(5). — Р. 576-80.

/38-2.jpg)
/38-1.jpg)
/39-1.jpg)
/41-1.jpg)