Вступ
Гемітиреоїдектомія — одна з найчастіших операцій у практиці ендокринного хірурга. У рекомендаціях Американської тиреоїдної асоціації за 2015 рік розширені показання для проведення гемітирео–їдектомії порівняно з тотальною тиреоїдектомією. Одразу після набрання чинності цими рекоменда–ціями відзначається значне збільшення числа гемітиреоїдектомій порівняно з тотальною тиреоїдектомією в клініках Північної Америки.
Переваги гемітиреоїдектомії порівняно з тиреоїдектомією
Доброякісний вузловий зоб і солітарний вузол — найбільш поширені патологічні зміни щитоподібної залози (ЩЗ), особливо в йододефіцитних регіонах [1], до яких належить уся територія України. Основні причини зміни оперативної тактики при утвореннях ЩЗ пов’язані з меншою ймовірністю як післяопераційних ускладнень, так і обов’язкової замісної терапії при тиреоїдектомії порівняно з гемітиреоїдектомією.
У випадку ураження однієї частки й підтвердження доброякісності процесу гемітиреоїдектомія є операцією вибору при цьому виді патології. Кількість виконаних гемітиреоїдектомій у світі збільшується за рахунок розширення показань для даного оперативного втручання порівняно з тиреоїдектомією. У першу чергу це пов’язано з тяжчим перебігом післяопераційного періоду й частішим виникненням ускладнень при тотальній тиреоїдектомії. Ризик розвитку таких ускладнень, як гіпокальціємія, гіпотиреоз, пошкодження ларингеального зворотного нерва, набагато нижча при гемітиреоїдектомії, ніж при тотальній тиреоїдектомії [2].
Найбільш поширене ускладнення гемітиреоїд–ектомії — післяопераційний гіпотиреоз, згідно з дослідженням, він спостерігається в 10,9–48,8 % випадків [3]. Тотальна тиреоїдектомія вимагає замісної гормональної терапії в усіх випадках, що призводить до погіршення якості життя пацієнтів і значних фінансових втрат. Рутинна післяопераційна замісна гормональна терапія після проведеної гемітиреоїдектомії для лікування можливого гіпотиреозу й запобігання новому вузлоутворенню більше не використовується через множинні ускладнення й сумнівну ефективність [4, 5]. Тривала терапія тироксином збільшує ризик розвитку аритмій, фібриляції передсердь, неврологічних розладів, остеопорозу/остеопенії, особливо у хворих похилого віку, жінок постменопаузного віку [4–6]. Необхідно звертати увагу на те, що при гемітиреоїдектомії, на відміну від тотальної тиреоїдектомії, є ризик вузлоутворення, особливо при субнормальних показниках тиреотропного гормону (ТТГ) у пацієнтів, у яких не проводиться замісна терапія [7]. Це підвищує складність ведення пацієнтів з вікарною часткою у зв’язку із застосуванням препаратів левотироксину для пригнічення рівня ТТГ як чинника зменшення ризику розвитку вузлоутворення в залишковій частці.
Післяопераційний гіпотиреоз
На основі міжнародних досліджень проведено оцінку ризику розвитку післяопераційного гіпотиреозу (як субклінічного, так і маніфестного), визначено час виникнення гіпотиреозу після гемітиреоїдектомії й частоту рецидивів вузлоутворення в залишковій частці ЩЗ. Для аналізу післяопераційного гіпотиреозу були відібрані 13 досліджень з електронної бази PubMed [4, 6–17], з них у 8 [4, 6–8, 10, 11, 13, 15] було наведено кількісне співвідношення в структурі гіпотиреозу, який розділили на два підтипи: субклінічний гіпотиреоз (СГ) і маніфестний гіпотиреоз (МГ) (табл. 1). Дослідження проводилися з 2000 по 2016 рік, включали 3595 пацієнтів з гемітиреоїдектомією й середнім часом спостереження за пацієнтом від 1,5 до 56,4 місяця. У всіх дослідженнях рівень передопераційного ТТГ був у межах норми, перед операцією пацієнти не отримували замісної терапії, усім було понад 17 років. Середній вік пацієнтів у групах становив від 42,3 ± 11,8 року до 50 ± 1 років (від 17 до 86 років). Референтні значення ТТГ у цитованих дослідженнях перебували в діапазоні від 0,23 до 6,0 мМО/мл, тоді як зазвичай межа в багатьох дослідженнях — до 4,0 мМО/мл (табл. 1). Також у дослідженнях вказується на різницю у визначенні субклінічного й маніфестного гіпотиреозу. Субклінічний гіпотиреоз характеризувався підвищенням рівня ТТГ без наявної клініки гіпотиреозу в усіх дослідженнях, маніфестний гіпотиреоз у частині досліджень характеризувався зниженням рівня тироксину (Т4) та трийодтироніну (Т3) на тлі субнормального ТТГ (до 10 мМО/мл) [4, 7, 8, 11]; в інших — як прояв клініки на тлі ТТГ до 10 мМО/мл з нормальними показниками вільного Т3, вільного Т4 [6, 10, 13, 15]. Більшість досліджень [4, 8–11, 15–18] включали пацієнтів із наявністю антитиреоїдних антитіл.
/345-1.jpg)
Згідно з результатами досліджень (табл. 1), післяопераційний гіпотиреоз розвинувся в 10,9–55,8 % пацієнтів, що відповідає результатам двох попередніх великих метааналізів [3, 19], у яких ризик розвитку післяопераційного гіпотиреозу становив від 7 до 43 % [19] і від 10,9 до 48,8 % [3] із середнім ризиком розвитку 22 % [19].
У групі пацієнтів із гіпотиреозом у структурі патології відзначалася більша частка саме субклінічного гіпотиреозу — від 50 до 98,8 %, причому чим більша вибірка, тим більшим був відсоток субклінічного гіпотиреозу. Маніфестний гіпотиреоз розвивався в 1,2–50 % від загальної кількості пацієнтів із гіпотиреозом. Від загального числа обстежених пацієнти із СГ і маніфестним гіпотиреозом становили 8–54 % і 1–12,6 % відповідно. Середня частка пацієнтів із післяопераційним гіпотиреозом становить 28,4 %, із СГ — 20,6–25,8 %, із маніфестним гіпотиреозом — 6,9–7,5 %. У багатьох дослідженнях [6, 8–17] відзначалася частка пацієнтів із гіпотиреозом, що виник у перший рік спостереження, вона становила від 76,3 до 100 %. У цілому можна сказати, що у 89,1 % пацієнтів із гіпотиреозом він розвинувся протягом року. На жаль, у жодному досліджені не було показано співвідношення часу розвитку маніфестного й субклінічного гіпотиреозу. Також деякі автори [8, 13] відзначали частку випадків спонтанного видужання, що становила від 33 до 67,1 %, без використання замісної терапії. У низці досліджень не виявлено взаємозв’язку ризику розвитку гіпотиреозу з віком [4, 6–9, 11–13, 16], чотири роботи підкреслили даний зв’язок [10, 14, 15, 17]. Відзначався прямий зв’язок між розвитком гіпотиреозу й наявністю автоантитіл до ЩЗ. Ризик розвитку післяопераційного гіпотиреозу був більшим у тих пацієнтів, у яких був вищий рівень ТТГ до операції.
/346-1.jpg)
Рецидив вузлоутворення в залишковій частці щитоподібної залози
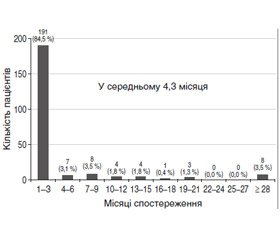
Щодо розвитку рецидиву вузлів у залишковій частці ЩЗ нами проведено огляд п’яти відповідних досліджень [7, 20–23]. Частка пацієнтів із післяопераційним рецидивом становила від 12 до 30,5 % залежно від середнього часу спостереження за пацієнтом — від 25,2 місяця до 5,8 року. Деякі автори [20, 21] підкреслили підвищений ризик розвитку рецидиву в пацієнтів, які не отримували замісної терапії, і пацієнтів із підвищеним титром антитиреоїдних антитіл. У дослідженнях відзначено, що післяопераційне спостереження тривалістю до року є недостатнім для моніторингу можливого рецидиву вузлоутворення при невеликій вибірці пацієнтів [24].
Основним ускладненням у віддаленому періоді після проведення гемітиреоїдектомії з приводу доброякісного еутиреоїдного захворювання однієї частки ЩЗ є гіпотиреоз, що спостерігається в 10,9–48,8 % випадків. Частота розвитку післяопераційного гіпотиреозу й перехід із транзиторної в перманентну форму залежить насамперед від передопераційних значень ТТГ і рівнів антитіл до ЩЗ [25]. Післяопераційна замісна терапія препаратами тирео–їдних гормонів повинна призначатися не рутинно, а лише при переході СГ у маніфестний гіпотиреоз (ТТГ понад 10 мМО/мл). Крім того, рівні ТТГ до 10 мМО/мл є фактором стимуляції резидуальної тиреоїдної тканини для підвищення продукції гормонів і, як наслідок, зниження частоти перманентного гіпотиреозу. Значення рутинного призначення післяопераційної замісної терапії цій категорії хворих із метою профілактики вузлоутворення в здоровій частці є досить сумнівним. Більшість авторів у строки післяопераційного спостереження до 10 років не знаходять вірогідного зв’язку рецидивування вузлового зоба й замісної терапії препаратами тиреоїдних гормонів [25].
/347-1.jpg)
Особливості ведення пацієнтів похилого віку із субклінічним і маніфестним гіпотиреозом
Клінічний й субклінічний гіпотиреоз є одними з найбільш поширених станів у практиці лікаря-ендокринолога після цукрового діабету 2-го типу. За різними даними [1–3], частка клінічного гіпотирео–зу серед населення сягає 2 %. Однак субклінічний (латентний) гіпотиреоз — більш поширений, він діагностується в 5–10 разів частіше від клінічного. Його виявляють у 7–10 % жінок і 2–3 % чоловіків. Кожен рік до 5 % випадків субклінічного гіпоти–реозу переходить у клінічний. Згідно з даними досліджень [4, 5], частота вперше діагностованого клінічного гіпотиреозу серед жінок становила 4,1 на 1000 населення на рік, а серед чоловіків — 0,6 на 1000 на рік. Якщо провести епідеміологічний аналіз поширеності гіпотиреозу серед хворих похилого віку, то у віковій групі населення понад 60 років гіпотиреоз виявляється в 6–12 %.
У хворих похилого віку найчастіше діагностують первинний гіпотиреоз, який пов’язують з такими основними факторами:
— тиреоїдектомією чи субтотальною резекцією ЩЗ;
— застосуванням тиреостатичної терапії в анамнезі;
— лікуванням тиреотоксикозу радіоактивним йодом;
— променевою терапією ділянки шиї при захворюваннях, що не пов’язані з ЩЗ;
— застосуванням медикаментозних засобів (аміо–дарон, йодид калію тощо);
— атрофічною формою автоімунного тиреоїдиту (АІТ);
— станом йодного дефіциту;
— палінням (активне чи пасивне паління, особливо за наявності підвищеного титру антитіл, викликає більш швидкий розвиток гіпотиреозу за рахунок вмісту в тютюновому диму тіоціанідів, що мають зобогений ефект);
— факторами, що складно піддаються класифікації (наприклад, гіпотиреоз може бути діагностований в осіб із гіпонатріємією нез’ясованого генезу, підвищеним вмістом креатинфосфокінази, лактатдегідрогенази, макроцитозом чи анемією тощо).
В осіб похилого віку перебіг гіпотиреозу відзначається такими проявами:
— повільний розвиток симптоматики, що є непомітним як для самого хворого, так і для оточуючих;
— різноманітність симптоматики із залученням у процес практично всіх органів і систем організму [6, 8, 9];
— пролонгація часу діагностичного пошуку через багатогранність проявів гіпотиреозу і, як наслідок, більш пізній початок медикаментозної корекції, а також розвиток ускладнень.
За різними даними [8], у перший рік від початку розвитку патології правильний діагноз був встановлений у 34 % пацієнтів, а в 9 % хворих до початку адекватної терапії минало понад 10 років. У зв’язку з цим при клінічній верифікації гіпотиреозу, особливо у хворих похилого віку, найбільш інформативним методом є лабораторне дослідження. Маркером зниженої секреторної функції ЩЗ є підвищення рівня ТТГ, як правило, навіть при мінімальному зниженні вільного Т4 відзначається багаторазове збільшення ТТГ. При вторинному гіпотиреозі знижуються рівні як ТТГ, так і вільного Т4, у багатьох випадках для диференціальної діагностики між первинним і вторинним гіпотиреозом проводиться тест із тиреоліберином.
При клінічному обстеженні хворих важливе значення має ультразвукове дослідження ЩЗ. Для діагностики гіпотиреозу й вибору лікувальної тактики важливими ознаками є такі:
— аплазія чи гіпоплазія ЩЗ;
— ехографічні ознаки АІТ;
— дифузні чи вузлові зміни ЩЗ
— стан після оперативного втручання на ЩЗ.
Численні дослідження довели, що оптимальним методом лікування гіпотиреозу є застосування левотироксину в індивідуально підібраних адекватних дозах.
Тактика ведення таких пацієнтів ускладнюється значною кількістю й тяжкістю супутньої патології, необхідністю медикаментозної корекції цих станів, а також загальним психосоматичним статусом хворого. При призначенні лікування слід враховувати підвищення з віком чутливості до впливу тиреоїдних гормонів, більш частий і швидкий прояв ознак передозування препаратів тиреоїдних гормонів, що супроводжується, зокрема, порушеннями з боку діяльності серцево-судинної системи.
Отже, хворі старшої вікової групи потребують менших доз, ніж молоді, приблизно на 20–40 %, що в середньому становить 0,9 мкг/кг маси тіла. Однак в осіб з ожирінням розрахунок необхідної терапевтичної дози необхідно проводити на 1 кг ідеальної маси. Початкова доза левотироксину у хворих похилого віку не повинна перевищувати 25 мкг на добу, це обумовлено мінімізацією ризику розвитку серцево-судинних ускладнень. У той же час повна доза замісної гормональної терапії може становити всього 50 мкг/добу. Як правило, початкова доза призначається на 4–6 тижнів (у деяких випадках тривалість збільшують до 2–4 місяців), у подальшому відбувається динамічне дослідження рівня ТТГ. Якщо рівень ТТГ не досягає нормальних значень, доза препарату збільшується. Контроль значення ТТГ проводиться кожні 3 місяці після початку терапії, а після досягнення еутиреозу — не рідше ніж кожні 6 місяців.
Певні труднощі мають пацієнти з поєднанням гіпотиреозу й стенокардії. Так, при замісній терапії левотироксином серед пацієнтів зі стенокардією напруження в анамнезі в 17 % хворих відзначалося погіршення перебігу кардіальної патології, у 38 % — зникнення клінічних проявів (кардіалгії), у 45 % — не спостерігалося змін в організмі.
Отже, при лікуванні пацієнтів з поєднанням стенокардії (незалежно від класу й типу) і гіпотиреозу доцільно дотримуватися такого алгоритму [12–16]:
— розпочинати терапію необхідно з мінімальних доз тиреоїдних препаратів, а титрування дози має бути повільним й поступовим, з постійним контролем як тиреоїдного гормонального статусу, так і кардіальних показників (оцінюється динаміка рівнів артеріального тиску й частоти серцевих скорочень, даних електрокардіографії та ін.) [17];
— сумісність з іншими препаратами, що особливо важливо для пацієнтів геріатричної практики;
— при розвитку інфаркту міокарда необхідна відміна препарату, у подальшому доза тиреоїдних засобів повинна бути меншою, а контроль гормонального статусу — більш частим;
— оптимальними для лікування є препарати левотироксину, це обумовлено достатньо тривалим періодом напівжиття, що дозволяє підтримувати стабільну концентрацію тиреоїдних гормонів протягом усієї доби при одноразовому прийомі [18].
Отже, в осіб похилого віку оптимальним є визначення рівнів ТТГ і вільного Т4 щонайменше 1 раз на 3 місяці. У разі необхідності призначення й корекцію замісної терапії препаратами левотироксину слід проводити поступово.
Особливості лабораторного етапу діагностики й моніторингу ефективності лікування гіпотиреозу
Для адекватного моніторингу тиреоїдного статусу хворих, які перебувають під спостереженням не лише ендокринологів, а й сімейних лікарів у зв’язку з реформуванням системи охорони здоров’я, при аналізі лабораторних даних слід враховувати патофізіологічні, переданалітичні, інтерферуючі фактори впливу на результат.
Тиреотропний гормон — глюкопротеїд, що продукується передньою часткою гіпофіза та є основним регулятором функції ЩЗ, контролюється тиреотропін-рилізинг-гормоном гіпоталамуса й умістом тиреоїдних гормонів. ТТГ впливає на велику кількість метаболічних процесів у ЩЗ (активує АТФазний цикл), що призводить до збільшення синтезу Т3 і Т4. Основна клінічна мета визначення ТТГ — оцінка функціонального стану ЩЗ. У пацієнтів із нормальною гіпофізарною функцією ТТГ визначається для виключення гіпо- й гіпертиреозу, моніторингу замісної терапії первинного гіпотиреозу чи пригнічення функції ЩЗ при лікуванні тиреотоксикозу, ТТГ-контролю тироксин-супресії при вузловому зобі, раку ЩЗ, а також при введенні тиреотропін-рилізинг-гормону. Референтні межі для дорослих: 0,4–4,0 мМО/мл. Преаналітичний етап: виключити жирну їжу, алкоголь, паління й фізичні навантаження. Інтерференція: підвищення рівня ТТГ можуть провокувати аміодарон, бенсеразид, галоперидол, літій, анальгін, метоклопрамід, морфін, фенотіазини; зниження рівня ТТГ можуть провокувати бромкриптин, карбамазепін, кортикостероїди, допамін, гепарин (внутрішньовенне введення), леводопа, фентоламін, соматостатин, трийодтиронін, йодиди, наявність автоантитіл до рецептора ТТГ.
Вільна фракція Т3 забезпечує весь спектр метаболічної активності. Вільний Т3 є продуктом метаболічного перетворення Т4 поза ЩЗ. Процес дейодування Т4 з утворенням Т3 відбувається більш інтенсивно в передній частці гіпофіза, ніж у периферичних тканинах. Тому визначення рівня вільного Т3 у сироватці має більше значення в оцінці стану регуляції секреції ТТГ за принципом зворотного зв’язку. Преаналітичний етап: за 3 дні до дослідження виключити прийом йодовмісних препаратів, за добу до дослідження виключити жирну їжу, фізичне навантаження й стреси. Інтерференція: підвищення рівня вільного Т3 може провокувати декстротироксин; зниження рівня вільного Т4 можуть провокувати фенітоїн, пропранолол, вальпроєва кислота, гепарин. Знижує чи підвищує їх вміст залежно від дози аміодарон.
Із концентрацією вільного тироксину, не пов’язаного з білками крові, корелює рівень активності ЩЗ. Вільний Т4 становить 0,03–0,05 % загального Т4. Незалежність рівня вільного Т4 від вмісту тироксинзв’язуючого глобуліну дозволяє застосовувати його як надійний діагностичний параметр при всіх станах, що супроводжуються змінами концентрації тироксинзв’язуючого глобуліну. Преаналітичний етап: виключити жирну їжу, алкоголь, паління й фізичні навантаження. Інтерференція: підвищення рівня вільного Т4 можуть провокувати аміодарон, пропранолол, фуросемід, амфетаміни, гепарин, даназол, йопаноєва кислота; зниження рівня можуть провокувати фенобарбітал, глюкокортикоїди, допамін, сульфаніламіди, антиконвульсанти, метадон, рифампіцин.
Якщо пацієнт приймає біотин, застосування будь-якої біотин-залежної методики імуноаналізу ТТГ, вільного Т4, вільного Т3 може дати хибні результати.
Висновки
1. У випадках вузлоутворення в одній частці щитоподібної залози й підтвердження доброякісності процесу гемітиреоїдектомія за рахунок меншої тяжкості перебігу післяопераційного періоду, меншої ймовірності як післяопераційних ускладнень, так і необхідності замісної терапії є операцією вибору порівняно з тиреоїдектомією.
2. Після гемітиреоїдектомії не використовується рутинна післяопераційна замісна гормональна терапія, левотироксин призначається лише при переході субклінічного гіпотиреозу в маніфестний (ТТГ понад 10 мМО/мл).
3. При гемітиреоїдектомії, на відміну від тотальної тиреоїдектомії, є ризик розвитку рецидиву вузлоутворення в пацієнтів, які не отримували замісну терапію, і в пацієнтів із підвищеним титром антитиреоїдних антитіл.
4. Клінічний й субклінічний гіпотиреоз у віковій групі пацієнтів, старших за 60 років, виявляється в 6–12 %. Тактика ведення таких пацієнтів ускладнюється значною кількістю й тяжкістю супутньої патології, необхідністю медикаментозної корекції цих станів, а також загальним психосоматичним статусом хворого. Початкова доза левотироксину у хворих похилого віку не повинна перевищувати 25 мкг на добу, призначається на 4–6 тижнів (можливо до 2–4 місяців), надалі щонайменше 1 раз на 3 місяці необхідно визначати рівень ТТГ і вільного Т4 і Т3 і проводити поступову корекцію замісної терапії препаратами левотироксину.
5. Для адекватного моніторингу тиреоїдного статусу хворих при інтерпретації отриманих результатів ТТГ, вільного Т4 і Т3 слід враховувати інтерферуючі фактори, що впливають на результати досліджень (супутні стани в пацієнта, прийом препаратів, дотримання пацієнтом умов преаналітичного етапу), у тому числі можливість отримання хибних результатів, якщо пацієнт приймає препарати біотину, а лабораторне дослідження проводилося з використанням біотинзалежної методики імуноаналізу.
На відміну від інших лабораторій, у МЛ «Діла» методики визначення ТТГ, вільного тироксину, вільного трийодтироніну є біотин-незалежними. МЛ «Діла» — достовiрна діагностика й моніторинг лікування порушень функції щитоподібної залози.
Конфлікт інтересів. Автори заявляють, що у них немає конфлікту інтересів при підготовці даної статті.
Фінансування: цей огляд літератури не має джерела фінансування.
Особистий внесок авторів у підготовку статті: Кваченюк Д.А. — збір та обробка матеріалів; Кваченюк А.М. — концепція й мета дослідження.

/345-1.jpg)
/346-1.jpg)
/347-1.jpg)