Международный эндокринологический журнал Том 15, №4, 2019
Вернуться к номеру
Дослідження макро- й мікроелементного статусу в пацієнтів з автоімунним тиреоїдитом серед мешканців постраждалих після Чорнобильської аварії районів Київської області
Авторы: Лузанчук І.А. (1), Кравченко В.І. (1), Андрусишина І.М. (2), Голінько О.М.(3)
1 - ДУ «Інститут ендокринології та обміну речовин імені В.П. Комісаренка НАМН України», м. Київ, Україна
2 - ДУ «Інститут медицини праці НАМН України», м. Київ, Україна
3 - Науковий центр превентивної токсикології, харчової та хімічної безпеки імені Л.І. Медведя МОЗ України, м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
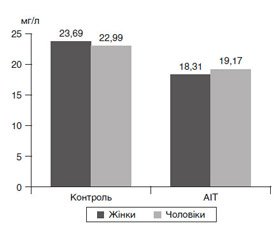
Актуальність. Автоімунний тиреоїдит (АІТ) — комплексне полігенне органоспецифічне захворювання. Рівень захворюваності на АІТ має тенденцію до зростання в усьому світі. Спостерігається тенденція до зростання захворюваності в молодших вікових групах. Циркулюючі антитіла до тиреоїдної пероксидази (ТПО) знаходять у 10–15 % практично здорових ociб, які перебувають у стані еутиреозу. Мета: встановити макро- й мікроелементний статус у пацієнтів з АІТ серед мешканців постраждалих після Чорнобильської аварії районів Київської області. Матеріали та методи. Обстежено 61 мешканця постраждалих після Чорнобильської аварії районів Київської області: з них 45 — без тиреоїдної патології (контрольна група) і 16 — з АІТ (дослідна група). Усі обстежені з дозою опромінення щитоподібної залози (ЩЗ) < 0,3 Гр — ≥ 1 Гр входять до когортних досліджень українсько-білорусько-американського проекту. Дослідження мікроелементів і макроелементів здійснювали методом атомно-емісійної спектрометрії з індуктивно-зв’язаною плазмою («Джерело-2003») на приладі Optima 2100 DV фірми PerkinElmer (США). Результати. При дослідженні показників тиреоїдного статусу група пацієнтів з АІТ відрізнялась від контролю збільшеним тиреоїдним об’ємом, підвищеним рівнем антитіл до ТПО і тиреотропного гормону. Медіана екскреції йоду із сечею в досліджуваних групах вірогідно не відрізнялася, її показник у контрольній групі становив 65,0 мкг/л, у дослідній групі — 80,6 мкг/л, що вказувало на наявність йодного дефіциту слабкого ступеня. В обстежених пацієнтів з АІТ встановлено знижений (p < 0,01) рівень магнію в сироватці крові (медіанне значення 18,59 мг/л) порівняно з відповідним показником у контрольній групі. Виконана оцінка шансів зв’язку наявного діагнозу АІТ зі зниженим понад медіанне значення рівнем магнію (20,6 мг/л) у загальній групі обстежених: співвідношення шансів (СШ) становить 6,63 (95% довірчий інтервал (ДІ) [1,73; 24,8]; р < 0,01). Висновки. Наявний діагноз АІТ вірогідно значимий у пацієнтів, які мали показник дозового опромінення ЩЗ понад медіанне значення (0,12 Гр), у загальній групі обстежених у Київській області: СШ = 4,1 (95% ДІ [1,2; 13,9]; р < 0,05). Найвищий показник СШ був при поєднаному зниженому вмісті магнію й підвищеному дозовому опроміненні ЩЗ: СШ = 25 (95% ДІ [3,16; 179,0]; р = 0,002).
Актуальность. Аутоиммунный тиреоидит (АИТ) — комплексное полигенное органоспецифическое заболевание. Уровень заболеваемости АИТ имеет тенденцию к росту во всем мире. Наблюдается тенденция к росту заболеваемости в младших возрастных группах. Циркулирующие антитела к тиреоидной пероксидазе (ТПО) находят у 10–15 % практически здоровых лиц, которые находятся в состоянии эутиреоза. Цель: установить макро- и микроэлементный статус у пациентов с АИТ среди жителей пострадавших после Чернобыльской аварии районов Киевской области. Материалы и методы. Обследован 61 житель пострадавших после Чернобыльской аварии районов Киевской области: из них 45 — без тиреоидной патологии (контрольная группа) и 16 — с АИТ (опытная группа). Все обследованные с дозой облучения щитовидной железы (ЩЖ) < 0,3 Гр — ≥ 1 Гр являются участниками когортных исследований украинско-белорусско-американского проекта. Исследование микроэлементов и макроэлементов проводили методом атомно-эмиссионной спектрометрии с индуктивно-связанной плазмой («Джерело-2003») на приборе Optima 2100 DV фирмы Perkin Elmer (США). Результаты. При исследовании показателей тиреоидного статуса группа пациентов с АИТ отличалась от контроля увеличенным тиреоидным объемом, повышенным уровнем антител к ТПО и увеличенным уровнем тиреотропного гормона. Медиана экскреции йода с мочой в исследованных группах достоверно не отличалась, ее показатель в контрольной группе составлял 65,0 мкг/л, в опытной группе — 80,6 мкг/л, что указывало на наличие йодного дефицита слабой степени тяжести. У обследованных пациентов с АИТ установлено более низкое (p < 0,01) содержание магния в сыворотке крови (медианное значение 18,59 мг/л) по сравнению с соответствующим показателем контрольной группы. Проведена оценка шансов связи установленного диагноза АИТ со сниженным менее медианного значения уровнем магния (20,6 мг/л) в общей группе обследованных: отношение шансов (ОШ) составляет 6,63 (95% доверительный интервал (ДИ) [1,73; 24,8]; р < 0,01). Выводы. Имеющейся диагноз АИТ достоверно значимый у пациентов, у которых показатель дозового облучения ЩЖ выше медианного значения (0,12 Гр), в общей группе обследованных в Киевской области: ОШ = 4,1 (95% ДИ [1,2; 13,9]; р < 0,05). Наибольший показатель ОШ был при сочетании сниженного содержания магния и высоких значений дозового облучения ЩЖ: ОШ = 25 (95% ДИ [3,16; 179,0]; р = 0,002).
Background. Autoimmune thyroiditis (AIT) is a combined, polygenic, organ-specific disease. The incidence rate of AIT has a tendency to increase throughout the world. There is an upward trend in morbidity in younger age groups. Circulating thyroid peroxidase antibodies are found in 10–15 % of apparently healthy euthyroid persons. The purpose of the study was to establish the macro- and microelement status in patients with AIT among residents of districts of Kyiv region affected by the Chornobyl accident. Materials and methods. Sixty-one residents from the areas in Kyiv region affected by the Chornobyl accident were examined: 45 persons without thyroid pathology were included in the control group and 16 with AIT — in the experimental group. All patients with a thyroid dose of < 0.3 Gy — ≥ 1 Gy are participants of the cohort studies of Ukrainian-Belarusian-American project. The study of micro- and macroelements was performed by atomic emission spectroscopy with inductively coupled plasma (Dzherelo-2003) on Optima 2100 DV device (PerkinElmer, USA). Results. When studying thyroid status, the group of patients with AIT differed from the controls in terms of increased thyroid volume, high levels of thyroid peroxidase antibodies and thyroid-stimulating hormone. Urinary iodine excretion median in the studied groups was not significantly different: in the control group, it was 65.0 μg/l, in the experimental group — 80.6 μg/l, indicating the presence of mild iodine deficiency. The examined patients with AIT had reduced (p < 0.01) magnesium level in the blood serum (the median value was 18.59 mg/l) compared to the control group. The assessment of the chances of correlation between AIT diagnosis and magnesium level below the median one (20.6 mg/l) in the total group of subjects was: odds ratio (OR) = 6.63 (95% confidence interval (CI) [1.73; 24.8]; p < 0.01). Conclusions. The existing diagnosis of AIT is reliably significant in patients with thyroid dose above median value (0.12 Gy)) in the total group of patients surveyed in the Kyiv region: OR = 4.1 (95% CI [1.2; 13.9]; p < 0.05). The odds ratio was highest with a combination of reduced magnesium content and increased thyroid radiation dose: OR = 25 (95% CI [3.16; 179.0]; p = 0.002).
йодний дефіцит; щитоподібна залоза; автоімунний тиреоїдит; екскреція йоду із сечею; макро- й мікроелементи; відносний ризик виникнення захворювання
йодный дефицит; щитовидная железа; аутоиммунный тиреоидит; экскреция йода с мочой; макро- и микроэлементы; относительный риск возникновения заболевания
iodine deficiency; thyroid gland; autoimmune thyroiditis; iodine urine excretion; macro- and microelements; relative risk of disease
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- Kravchenko VI, Postol SV. Dynamics of the morbidity of thyroid pathology in Ukraine. Mìžnarodnij endokrinologìčnij žurnal. 2011;(35):26-31. (in Ukrainian).
- Tronko MD, Kovalenko AYe, Tarashchenko YuM, Ostafiychuk MV. Thyroid nodules in the population of Ukraine, protocol of diagnosis and treatment after the Chernobyl accident (literature review and own data). Mìžnarodnij endokrinologìčnij žurnal. 2018;14(7):677-683. doi: 10.22141/2224-0721.14.7.2018.148775. (in Ukrainian).
- Vlasenko MV. Autoimmune thyroiditis in adolescents. In: Karachentsev IuI, Kazakova AV, Kravchun NA, Il’ina IM, editors. 100 izbrannykh lektsii po endokrinologii [100 selected lectures on endocrinology]. Kharkiv; 2009. 372-378 pp. (in Russian).
- McLeod DS. Autoimmune thyroid disease: a novel risk factor for atherosclerosis? Endocrine. 2013 Aug;44(1):8-10. doi: 10.1007/s12020-013-9952-8.
- Taddei S, Caraccio N, Virdis A, et al. Lowgrade systemic inflammation causes endothelial dysfunction in patients with Hashimoto’s thyroiditis. J Clin Endocrinol Metab. 2006 Dec;91(12):5076-82. doi: 10.1210/jc.2006-1075.
- Zimmermann MB, Aeberli I, Andersson M, et al. Thyroglobulin is a sensitive measure of both deficient and excess iodine intakes in children and indicates no adverse effects on thyroid function in the UIC range of 100-299 μg/L: a UNICEF/ICCIDD study group report. J Clin Endocrinol Metab. 2013 Mar;98(3):1271-80. doi: 10.1210/jc.2012-3952.
- Weetman AP, McGregor AM. Autoimmune thyroid disease: further developments in our understanding. Endocr Rev. 1994 Dec;15(6):788-830. doi: 10.1210/edrv-15-6-788.
- Kaminskyi OV, Pankiv VI, Pankiv IV, Afanasyev DE. Vitamin D content in population of radiologically contaminated areas in Chernivtsi oblast (pilot project). Problems of radiation medicine and radiobiology. 2018;(23):442-451. doi: 10.33145/2304-8336-2018-23-442-451. (in Ukrainian).
- Pearce EN, Caldwell KL. Urinary iodine, thyroid function, and thyroglobulin as biomarkers of iodine status. Am J Clin Nutr. 2016 Sep;104 Suppl 3:898S-901S. doi: 10.3945/ajcn.115.110395.
- Brenner AV, Nronko MD, Hatch M, et al. I-131 dose response for incident thyroid cancers in Ukraine related to the Chornobyl accident. Environ Health Perspect. 2011 Jul;119(7):933-9. doi: 10.1289/ehp.1002674.
- Tronko MD, Brenner AV, Olijnyk VA, et al. Autoimmune thyroiditis and exposure to iodine 131 in the Ukrainian cohort study of thyroid cancer and other thyroid diseases after the Chornobyl accident: results from the first screening cycle (1998-2000). J Clin Endocrinol Metab. 2006 Nov;91(11):4344-51. doi: 10.1210/jc.2006-0498.
- Dunn JT, Grutchfield HE, Gutekunst R, et al. Methods for measuring iodine in urine. Amsterdam, Netherlands: International Council for Control of Iodine Deficiency Disorders; 1993. 71 p.
- World Health Organization (WHO). Assessment of iodine deficiency disorders and monitoring their elimination: a guide for programme managers. 3rd ed. Geneva: WHO-press; 2007. 97 p.
- Brunn J, Block U, Ruf G, Bos I, Kunze WP, Scriba PC. Volumetric analysis of thyroid lobes by real-time ultrasound (author’s transl). Dtsch Med Wochenschr. 1981 Oct 9;106(41):1338-40. doi: 10.1055/s-2008-1070506. (in German).
- Tsyb AF, Parshin VS, Nestaiko GV, et al. Ul’trazvukovaia diagnostika zabolevanii shchitovidnoi zhelezy [Ultrasound diagnosis of thyroid diseases]. Moscow: Meditsina; 1997. 332 p. (in Russian).
- Koch W, Karim MR, Marzec Z, Miyataka H, Himeno S, Asakawa Y. Dietary intake of metals young adult population of Eastern Poland: Result from a market basket study. J Trace Elem Med Biol. 2016 May;35:36-42. doi: 10.1016/j.jtemb.2016.01.007.
- Gietka-Czernel M, Dębska M, Kretowicz P, et al. Iodine status of pregnant women from central Poland ten years after introduction of iodine prophylaxis programme. Endokrynol Pol. 2010 Nov-Dec;61(6):646-51.
- Giray B, Arnaud J, Sayek I, Favier A, Hincal F. Trace element status in multinodular goiter. J Trace Elem Med Biol. 2010 Apr;24(2):106-10. doi: 10.1016/j.jtemb.2009.11.003.
- Szeliga A, Czyżyk A, Niedzielski P, et al. Assesment of serum selenium concentration in patients with autoimmune thyroiditis in Poznan district. Pol Merkur Lekarski. 2018 Oct 29;45(268):150-153.
- Wang K, Wei H, Zhang W, et al. Severly low serum magnesium is associated with increased risks of positive antithyroglobulin antibody and thyroidism: a cross-sectional study. Sci Rep. 2018 Jul 2;8(1):9904. doi: 10.1038/s41598-018-28362-5.
- Baltaci AK, Mogulkoc R, Baltaci SB. Review: the role of zinc in the endocrine system. Pak J Pharm Sci. 2019 Jan;32(1):231-239.

/292-1.jpg)
/292-2.jpg)
/293-1.jpg)
/293-2.jpg)
/294-1.jpg)
/294-2.jpg)