Журнал «Здоровье ребенка» Том 14, №4, 2019
Вернуться к номеру
Прогностическая модель для определения вероятности развития врожденной пневмонии у доношенных новорожденных
Авторы: Горячко А.Н., Сукало А.В.
Белорусский государственный медицинский университет, г. Минск, Республика Беларусь
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
За даними Всесвітньої організації охорони здоров’я, пневмонія є однією з основних причин смерті дітей віком до п’яти років. Мета дослідження: розробка прогностичної моделі для визначення факторів, асоційованих з розвитком уродженої пневмонії у доношених новонароджених. Проведено комплексне обстеження 116 доношених новонароджених, які знаходилися в педіатричному відділенні для новонароджених дітей та пологовому фізіологічному відділенні державного закладу «Республіканський науково-практичний центр «Мати і дитя» у період з 2017 по 2019 р. У досліджувану групу ввійшло 53 доношених новонароджених із уродженою пневмонією, народжених у терміні гестації 39,50 ± 0,69 тижня, з масою тіла 3337,50 ± 354,42 г і довжиною тіла 52,20 ± 2,13 см. Контрольну групу становили 63 здорових доношених новонароджених, народжених у терміні гестації 39,30 ± 0,63 тижня, з масою тіла 3417,30 ± 253,82 г і довжиною тіла 52,50 ± 1,57 см. В результаті проведеного обстеження встановлено найбільш значущі фактори, асоційовані з розвитком уродженої пневмонії у доношених новонароджених: з акушерсько-гінекологічного та соматичного анамнезу життя матері — мимовільний викидень; з ускладнень вагітності — хронічна внутрішньоматкова гіпоксія плода; за результатами дослідження плаценти — наявність запальних змін у плаценті; за результатами клінічних проявів у перші 72 години життя — наявність дихальної недостатності. На підставі отриманих даних розроблена модель з чутливістю, рівною 92,5 %, специфічністю — 92,1 % і площею під ROC-кривою AUC = 0,940 ± 0,054, р < 0,001 (95% довірчий інтервал 0,90–0,99). За допомогою прогностичної моделі розраховані порогові значення: для мимовільного викидня — 0,810; хронічної внутрішньоматкової гіпоксії плода — 0,289; запальних змін в плаценті — 0,565; наявності дихальної недостатності — 0,928, що при граничних значеннях ≥ 0,56 ROC-кривої дозволяє виділити групу високого ризику щодо розвитку вродженої пневмонії серед доношених новонароджених.
По данным Всемирной организации здравоохранения, пневмония является одной из основных причин смерти детей в возрасте до пяти лет. Цель исследования: разработка прогностической модели для определения факторов, ассоциированных с развитием врожденной пневмонии у доношенных новорожденных. Проведено комплексное обследование 116 доношенных новорожденных, находившихся в педиатрическом отделении для новорожденных детей и родильном физиологическом отделении Государственного учреждения «Республиканский научно-практический центр «Мать и дитя» в период с 2017 по 2019 г. В исследуемую группу вошло 53 доношенных новорожденных с врожденной пневмонией, родившихся в сроке гестации 39,50 ± 0,69 недели, с массой тела 3337,50 ± 354,42 г и длиной тела 52,20 ± 2,13 см. Контрольную группу составили 63 здоровых доношенных новорожденных, родившихся в сроке гестации 39,30 ± 0,63 недели, с массой тела 3417,30 ± 253,82 г и длиной тела 52,50 ± 1,57 см. В результате проведенного обследования установлены наиболее значимые факторы, ассоциированные с развитием врожденной пневмонии у доношенных новорожденных: из акушерско-гинекологического и соматического анамнеза жизни матери — самопроизвольный выкидыш; из осложнений беременности — хроническая внутриматочная гипоксия плода; по результатам исследования плаценты — наличие воспалительных изменений в плаценте; по результатам клинических проявлений в первые 72 часа жизни — наличие дыхательной недостаточности. На основании полученных данных разработана модель с чувствительностью, равной 92,5 %, специфичностью — 92,1 % и площадью под ROC-кривой AUC = 0,940 ± 0,054, р < 0,001 (95% доверительный интервал 0,90–0,99). С помощью прогностической модели рассчитаны пороговые значения: для самопроизвольного выкидыша — 0,810; хронической внутриматочной гипоксии плода — 0,289; воспалительных изменений в плаценте — 0,565; наличия дыхательной недостаточности — 0,928, что при пороговых значениях ≥ 0,56 ROC-кривой позволяет выделить группу высокого риска по развитию врожденной пневмонии среди доношенных новорожденных.
According to the data of the World Health Organization, pneumonia is one of the leading causes of death in children under five years of age. Objective: to develop a prognostic model to determine the factors associated with the development of congenital pneumonia in full-term newborns. A comprehensive survey of 116 full-term newborns who were in the pediatric Department for newborn children and the Maternity Physiological Department of the State Institution “Republican Scientific and Practical Center “Mother and Child” in the period from 2017 to 2019 was conducted. The study group consisted of 53 healthy full-term newborns with congenital pneumonia, born at the gestational age of 39.50 ± 0.69 weeks, body weight 3337.50 ± 354.42 g and a body length of 52.20 ± 2.13 cm. The control group consisted of 63 healthy full-term babies born at gestational age of 39.30 ± 0.63 weeks, body weight 3417.30 ± 253.82 g and a body length of 52.50 ± 1.57 cm. The survey revealed the most significant factors associated with the development of congenital pneumonia in full-term newborns: from the obstetric-gynecological and somatic history of the mother’s life — spontaneous miscarriage; from the complications of pregnancy — chronic intrauterine fetal hypoxia; the placenta study determined the presence of inflammatory changes in the placenta; clinical manifestations within the first 72 hours of life included respiratory failure. Based on the data obtained, a model with sensitivity equal to 92.5 %, specificity 92.1 % and an area under ROC-curve (AUC) 0.94 ± 0.054, p < 0.001 (95% CI 0.90–0.99). Using a prognostic model, threshold values were calculated: for spontaneous miscarriage — 0.810; chronic intrauterine fetal hypoxia — 0.289; inflammatory changes in the placenta — 0.565; the presence of respiratory failure — 0.928, which at threshold values ≥ 0.56 ROC-curve allows identify a high risk group for the development of congenital pneumonia among full-term newborns.
модель; фактори ризику; доношені новонароджені; вроджена пневмонія
модель; факторы риска; доношенные новорожденные; врожденная пневмония
model; risk factors; full-term newborns; congenital pneumonia
Введение
По данным Всемирной организации здравоохранения, в мире в возрасте до пяти лет за 2017 год умерло 5 400 000 детей. Таким образом, каждый день их умирало 14 800. Более 45 % детей умерло на первом месяце жизни. Основными причинами смерти этих детей являлись пневмония, асфиксия при рождении и осложнения, связанные с преждевременными родами [1].
По данным статистики, в Российской Федерации за 2015 г. врожденная пневмония диагностирована у 0,98 % недоношенных новорожденных с массой тела при рождении 1000 г и более, и у 20,77 % новорожденных от 500 до 999 г. Летальность от врожденной пневмонии у доношенных новорожденных составила 1,66 %. Среди недоношенных детей, родившихся с массой тела 1000 г и более, она регистрировалась на уровне 2,3 %; среди детей, родившихся с экстремально низкой массой тела, — на уровне 11,8 % [2].
В Республике Беларусь за период с 2007 по 2016 г. заболеваемость пневмонией у детей до 17 лет составила 11,65 ‰ с пиком в возрасте до 5 лет (от 16,3 до 22,9 ‰). Смертность от пневмонии в возрасте до 17 лет составляла от 0,17 до 0,72 на 100 000 детей. Большая часть летальных исходов (89,3 %) приходилась на возраст до трех лет [3].
Цель работы: разработать прогностическую модель для определения вероятности развития врожденной пневмонии у доношенных новорожденных.
Материалы и методы
Проведено комплексное обследование 116 доношенных новорожденных, находившихся в педиатрическом отделении для новорожденных детей и родильном физиологическом отделении ГУ «РНПЦ «Мать и дитя» в период с 2017 по 2019 г.
Тип исследования — «случай — контроль». Все новорожденные были разделены на две группы.
В исследуемую группу вошло 53 доношенных новорожденных с врожденной пневмонией, родившихся в сроке гестации 39,50 ± 0,69 (39,3–39,7) недели, с массой тела 3337,50 ± 354,42 (3239,9–3435,2) г, длиной тела 52,20 ± 2,13 (51,6–52,8) см, окружностью головы 34,60 ± 1,08 (34,3–34,9) см, окружностью груди 33,70 ± 1,19 (33,4–34,0) см.
Дети поступили на лечение и выхаживание в педиатрическое отделение из 6 родильных домов и отделений анестезиологии и реанимации города Минска, 4 областных и районных учреждений здравоохранения Республики Беларусь.
Критерии постановки диагноза «врожденная пневмония»: клинические и лабораторные данные, наличие инфильтративных теней на рентгенограмме легких в первые 72 часа жизни. Критерии исключения: наличие хромосомной патологии и генетических заболеваний, антенатально выявленные пороки развития, рождение в результате применения вспомогательных репродуктивных технологий.
Контрольную группу составили 63 здоровых доношенных новорожденных, родившихся в сроке гестации 39,30 ± 0,63 (39,1–39,4) недели, с массой тела 3417,30 ± 253,82 (3353,4–3481,2) г, длиной тела 52,50 ± 1,57 (52,1–52,9) см, окружностью головы 34,70 ± 1,08 (34,5–35,1) см, окружностью груди 33,70 ± 1,04 (33,5–34,0) см.
Среди обследованных новорожденных было 65 (56,0 %) мальчиков и 51 (44,0 %) девочка, в исследуемой группе: мальчиков — 31 (58,5 %) и девочек — 22 (41,5 %), в группе контроля: 34 (54,0 %) и 29 (46,0 %) соответственно.
При сравнении антропометрических показателей новорожденных обеих групп достоверных различий не выявлено.
Во всех случаях после родов проводилось макроскопическое исследование плаценты. В дальнейшем плацента направлялась в Городское клиническое патологоанатомическое бюро г. Минска для гистологического исследования.
Проведен анализ анамнестических данных матерей обследованных детей: возраст, количество и исходы предыдущих беременностей, наличие гинекологических заболеваний и экстрагенитальной патологии, особенности течения беременности и родов. Из 53 рожениц исследуемой группы первые роды были у 26 (49,1 %) женщин, вторые — у 18 (34,0 %), третьи и более — у 9 (17,0 %). В контрольной группе: первые роды — у 29 (46,0 %), вторые — у 29 (46,0 %), третьи и более — у 5 (7,9 %) женщин. Статистически значимых различий между группами не выявлено.
Средний возраст 53 матерей новорожденных исследуемой группы составил 31,2 (27,0–34,0) года и по сравнению с возрастом 63 матерей контрольной группы (31,0 (27,0–35,0)) не имел достоверных различий.
Статистическая обработка данных выполнялась с помощью пакета программ Statistica 10 и Microsoft Excel. Нормальность распределения количественных признаков оценивалась тестами Колмогорова — Смирнова и Лиллиефорса. При нормальном распределении величин рассчитывалось среднее и его среднеквадратичное отклонение (М ± SD) с указанием доверительного интервала (95% доверительный интервал (ДИ)), критерий Стьюдента (t), при отличном от нормального — медиана (Ме) и интерквартильный размах (25–75 %), критерий Манна — Уитни (U). Различия считали статистически достоверными при р < 0,05.
Для определения статистически значимых различий качественных величин использовался метод хи-квадрата (c2) или точный критерий Фишера (F). При статистически значимых показателях проводился расчет отношения шансов (ОШ) и доверительного интервала (95% ДИ).
Прогностическая ценность факторов, ассоци–ированных с развитием врожденной пневмонии у доношенных новорожденных, оценивалась с помощью бинарной логистической регрессии, анализа ROC-кривой, отрицательного удвоенного логарифма функции правдоподобия (–2LL) и меры определенности (R2). Использование данных для построения модели основывалось на гипотезе, объеме выборки и отсутствии между факторами статистически значимых корреляционных связей.
Работа выполнена в рамках проекта Белорусского республиканского фонда фундаментальных исследований № М17-002 (сроки выполнения 18.04.2017 — 31.03.2019).
Карты обследования новорожденных детей и информированное согласие для выполнения исследований утверждены на заседании комиссии по медицинской этике Государственного учреждения «Республиканский научно-практический центр «Мать и дитя», протокол № 18 от 18.07.2017.
На всех обследованных новорожденных получены информированные согласия от законных представителей (мать или отец).
Результаты и обсуждение
С учетом данных акушерско-гинекологического и соматического анамнеза матерей проведена оценка по следующим факторам: самопроизвольный выкидыш, неразвивающаяся беременность, вакуумный аборт, медикаментозный аборт, хронический тонзиллит, гипотиреоз, хронический гастрит, миопия, герпес, пиелонефрит. При оценке анамнеза матерей новорожденных исследуемой группы выявлено, что доля женщин с самопроизвольным выкидышем (ОШ 11,02 (8,00–15,18)), неразвивающейся беременностью (ОШ 7,91 (5,46–11,47)) и пиелонефритом (ОШ 5,85 (4,14–8,27)) была больше в сопоставлении с данными женщин контрольной группы.
Среди осложнений беременности отмечались: хроническая фетоплацентарная недостаточность, хроническая внутриматочная гипоксия плода, изменение объема околоплодных вод (мало- или многоводие), синдром задержки развития плода, пиелонефрит беременной, эрозия шейки матки, гестоз, острые респираторные инфекции, кольпит, истмико-цервикальная недостаточность, анемия, угроза прерывания беременности. Выявлено, что у матерей новорожденных исследуемой группы по сравнению с матерями контрольной группы значительно чаще наблюдалась хроническая внутриматочная гипоксия плода (ОШ 11,02 (8,00–15,18)) и хроническая фетоплацентарная недостаточность (ОШ 11,02 (8,00–15,18)), что соответствует данным литературы [4–7] (табл. 1).
В исследуемой группе 38 (71,7 %) новорожденных, а в группе контроля 53 (84,1 %) родились путем естественного родоразрешения, показатель не имел значимых различий.
У 26,4 % матерей новорожденных исследуемой группы по сравнению с 3,2 % контрольной группы выявлены воспалительные изменения в плаценте (ОШ 10,95 (8,05–14,88)). Характер воспалительных изменений в 13 (24,5 %) случаях был серозным и в 1 (1,9 %) — гнойно-некротическим, что согласуется с данными авторов [8–11] (табл. 2).
При рождении состояние 51 (96,2 %) новорожденного исследуемой группы и 63 (100 %) младенцев контрольной группы оценено в 8–10 баллов по шкале Апгар. Однако из них в течение первых 24 часов жизни у 39 (73,6 %) младенцев исследуемой группы развилась дыхательная недостаточность (ДН) (ДН 1-й ст. — 32, ДН 2-й ст. — 4, ДН 3-й ст. — 3 детей), что значительно чаще по сравнению с 2 (3,2 %) новорожденными контрольной группы (F = 0,54, р < 0,001, ОШ 87,757 (54,34–141,58)). При рождении у 3 (5,7 %) новорожденных исследуемой группы отмечалась умеренная асфиксия при рождении с быстрым нарастанием тяжелой дыхательной недостаточности, требующей проведения искусственной вентиляции легких (ИВЛ) с первых часов жизни. Длительность пребывания на ИВЛ у этих детей в среднем составила 4,30 ± 0,06 суток [2, 13, 14].
Новорожденным обеих групп в первые сутки жизни проведено исследование общего анализа крови (табл. 3).
У новорожденных исследуемой группы по сравнению с данными литературы [15, 16] и анализом крови в группе контроля отмечались достоверно более низкие значения следующих показателей: RBC (р < 0,001), HGB (р = 0,004), HCT (р < 0,001), MCV (р < 0,001), MCH (р < 0,001) и PLT (р < 0,001), что расценивается как результат повышенного разрушения эритроцитов и тромбоцитов при воздействии экзо- и эндотоксинов. В связи с наличием воспалительного процесса у новорожденных с пневмонией наблюдались высокие значения лейкоцитов (р = 0,029).
Проведен анализ совместного влияния групп факторов, ассоциированных с врожденной пневмонией у доношенных новорожденных, с использованием метода бинарной логистической регрессии. При выборе модели учитывался объем выборки, отсутствие между факторами статистически значимых корреляционных связей и возможность включения факторов в зависимости от числа наблюдений (табл. 4).
Для представления работоспособности разработанной прогностической модели в табл. 5 приведены параметры с указанием отрицательного удвоенного логарифма функции правдоподобия и меры определенности.
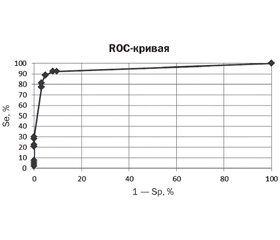
ROC-кривая, являясь графической характеристикой качества бинарного классификатора, указывает зависимость доли верных положительных результатов от доли ложных положительных результатов при варьировании оптимального порога. На данной кривой оптимальный порог ≥ 0,56. Следовательно, пороговые значения (≥ 0,56) показывают высокую вероятность наличия врожденной пневмонии у доношенных новорожденных. Для данной модели определены чувствительность и специфичность. Чувствительность, отражающая долю положительных результатов, которые правильно идентифицированы как больные, была равна 92,5 %. Специфичность, отражающая долю отрицательных результатов, которые правильно идентифицированы как здоровые, — 92,1 %, с площадью под ROC-кривой AUC = 0,940 ± 0,054, р < 0,001 (95% ДИ 0,90–0,99) (табл. 6, рис. 1).
При расчете прогностической модели получены пороговые данные для наиболее значимых факторов, ассоциированных с развитием врожденной пневмонии у доношенных новорожденных: из анамнеза жизни — самопроизвольный выкидыш с ОШ 11,02 (8,00–15,18) и пороговым значением 0,810; из осложнений беременности — хроническая внутриматочная гипоксия плода с ОШ 11,02 (8,00–15,18) и пороговым значением 0,289; по результатам исследования плаценты — наличие воспалительных изменений в плаценте с ОШ 10,95 (8,05–14,88) и пороговым значением 0,565; по результатам клинико-лабораторных данных в первые 72 часа жизни — наличие дыхательной недостаточности с ОШ 87,757 (54,34–141,58) и пороговым значением 0,928.
Выводы
1. В результате проведенного обследования установлены наиболее значимые факторы, ассоциированные с развитием врожденной пневмонии у доношенных новорожденных: из акушерско-гинекологического и соматического анамнеза жизни матери — самопроизвольный выкидыш; из осложнений беременности — хроническая внутриматочная гипоксия плода; по результатам исследования плаценты — наличие воспалительных изменений в плаценте; по результатам клинических проявлений в первые 72 часа жизни — наличие дыхательной недостаточности.
2. С помощью прогностической модели рассчитаны пороговые значения: для самопроизвольного выкидыша — 0,810; хронической внутриматочной гипоксии плода — 0,289; воспалительных изменений в плаценте — 0,565; наличие дыхательной недостаточности — 0,928, что при пороговых значениях ≥ 0,56 ROC-кривой позволяет выделить группу высокого риска по развитию врожденной пневмонии среди доношенных новорожденных.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Информация о вкладе авторов: Горячко А.Н. — сбор, обработка и анализ полученных материалов; Сукало А.В. — концепция и дизайн исследования.
1. Дети: сокращение смертности. Информационный бюллетень ВОЗ. 19 сентября 2018 [Электронный ресурс]. Режим доступа: https://www.who.int/ru/news-room/fact-sheets/detail/children-reducing-mortality. Дата доступа: 24.12.2018.
2. Антонов А.Г., Байбарина Е.Н., Балашов Е.Н. и др. Врожденная пневмония (клинические рекомендации). Неонатология. Новости, мнения, обучение. 2017. № 4(18). С. 133-148.
3. Бобровничий В.И. Пневмонии у детей: эпидемиологические аспекты. Медицинский журнал. 2018. № 2. С. 29-30.
4. Bhutta Z.A. Interventions to address deaths from childhood pneumonia and diarrhoea equitably: what works and at what cost? The Lancet. 2013. № 9875. P. 1417-1429.
5. Косьянчук А.В. Инфекционный фактор у женщин с неразвивающейся беременностью и хроническим эндометритом. Мат-лы X Съезда акушеров-гинекологов и неонатологов Республики Беларусь. Минск, 9–10 нояб. 2017 г. Минск, 2017. С. 791-795; Репродуктивное здоровье. Восточная Европа. 2017. № 5.
6. Gill C.J. Bottlenecks, barriers, and solutions: results from multicountry consultations focused on reduction of childhood pneumonia and diarrhoea deaths. The Lancet. 2013. № 9876. P. 1487-1498.
7. Можейко Л.Ф. Невынашивание беременности: Учебно-методическое пособие. М-во здравоохранения Респ. Беларусь, Бел. гос. мед. ун-т. Минск: БГМУ, 2013. 28 с.
8. McGuire W. Infection in the preterm infant. BMJ. 2004. V. 2. P. 329-341.
9. Малевич Ю.К., Шостак В.А. Фетоплацентарная недостаточность. Минск: Беларусь, 2007. 158 с.
10. Мудров В.А. Возможности модификации способов определения объема околоплодных вод. Журнал акушерства и женских болезней. 2016. Т. 65, № 34. С. 12-17.
11. Савельева Г.М., Федорова М.В., Клименко П.А. и др. Плацентарная недостаточность. М.: Медицина, 1991. 272 с.
12. Тютюнник В.Л. Хроническая плацентарная недостаточность при бактериальной и вирусной инфекции (патогенез, диагностика, профилактика, лечение): Автореф. дис. … докт. мед. наук. М., 2002. 46 с.
13. Володин Н.Н. Детские болезни. Т. 1. Неонатология. М.: Династия, 2011. 512 с.
14. Шабалов Н.П. Неонатология: в 2 т. Т. 1. 3-е изд., доп. и испр. М.: МЕДпресс-информ, 2004. 607 с.
15. Сукало А.В., Бовбель И.Э.; Национальная академия наук Беларуси. Справочник по поликлинической педиатрии. Минск: Бел. навука, 2015. 313 с.
16. Рооз Р., Генцель-Боровичени О., Прокитте Г. Практические рекомендации. Пер. с нем.; ред. пер.: Р. Вауэр, Г.А. Шишко. М.: Медицинская литература, 2011. 592 с.

/95-1.jpg)
/96-1.jpg)
/97-1.jpg)
/97-2.jpg)