Журнал «Боль. Суставы. Позвоночник» Том 9, №2, 2019
Вернуться к номеру
Гигантоклеточный артериит: эпидемиология, диагностика, прогноз
Авторы: Нетяженко В.З. (1), Пузанова О.Г. (2)
1 - Национальный медицинский университет имени А.А. Богомольца, г. Киев, Украина
2 - Киевский медицинский университет, г. Киев, Украина
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
Гігантоклітинний артеріїт (ГКА) — найпоширеніший системний васкуліт, що уражує великі судини в осіб старше 50 років. Захворювання на нього пов’язане з підвищеним ризиком розвитку низки інших запальних хвороб і судинних ускладнень. Розв’язанню основних асоційованих з ГКА проблем присвячено численні зарубіжні наукові дослідження та настанови. Метою публікації є аналітичний огляд, систематичне узагальнення та обговорення доказів, що стосуються різних аспектів епідеміології ГКА, сучасних підходів і методів його діагностики, а також чинників ризику несприятливого прогнозу.
Гигантоклеточный артериит (ГКА) — наиболее распространенный системный васкулит, поражающий крупные сосуды у лиц старше 50 лет. Заболевание сопряжено с повышенным риском развития ряда других воспалительных болезней и сосудистых осложнений. Решению основных связанных с ГКА проблем посвящено множество зарубежных научных исследований и рекомендаций. Целью публикации является аналитический обзор, систематическое обобщение и обсуждение доказательств, касающихся разных аспектов эпидемиологии ГКА, современных подходов и методов его диагностики, а также факторов риска неблагоприятного прогноза.
Giant cell arteritis (GCA) is the most common systemic vasculitis affecting large vessels in subjects over 50 years old. This disease is associated with an increased risk of other inflammatory diseases and vascular conditions. Many studies and guidelines focus on solving GCA-associated problems. The aim of this paper is to perform an analytical review, systematic generalization and discussion of evidence on various epidemiological GCA aspects, modern approaches and methods of its diagnosis as well as risk factors of unfavorable prognosis.
giant cell arteritis; large vessel vasculitis; epidemiology; diagnosis; prognosis
гигантоклеточный артериит; васкулит крупных сосудов; эпидемиология; диагностика; прогноз
giant cell arteritis; large vessel vasculitis; epidemiology; diagnosis; prognosis
Среди первичных системных васкулитов (СВ), сопряженных с развитием сосудистых осложнений, наиболее распространенными являются васкулиты крупных сосудов — гигантоклеточный артериит (ГКА) и артериит Такаясу (АТ), характеризующиеся гранулематозным поражением аорты и/или ее основных ветвей. Их дистрактором признан возраст дебюта: первые симптомы ГКА возникают после 50 лет, а гораздо более редкого АТ — у более молодых людей. Согласно определению, утвержденному на международной конференции в Chapel Hill, США (2012), ГКА преимущественно поражает ветви сонных и позвоночных артерий [1], однако многие эксперты подчеркивают частое вовлечение височных артерий и сочетание с ревматической полимиалгией (РПМ) [2].
Итак, ГКА — артериит, часто гранулематозный, обычно поражающий аорту и/или ее основные ветви, преимущественно сонные и позвоночные, у лиц старше 50 лет [1]. Актуальность изучения диагностических и прогностических аспектов ГКА связана с его недооцененной распространенностью и вкладом в формирование структуры смертности, развитие слепоты, атеросклероза и других возрастзависимых воспалительных заболеваний [3–8]. При растущем количестве клинических исследований, разработке национальных и международных рекомендаций — британских обществ ревматологов и специалистов здравоохранения в ревматологии (BSR/BHPR, 2010) [9], французской группы по изучению CВ крупных сосудов (GEFA, 2015) [10], Европейской противоревматической лиги (EULAR, 2018) [2] — диагностика ГКА остается «крайне сложной клинической задачей» (Бекетова Т.В. и соавт., 2016) [11], особенно с учетом вероятности поражения любых артерий среднего калибра, в т.ч. интракраниальных, коронарных и сосудов нижних конечностей [12–18].
R. Watanabe и соавт. (2018) изучили особенности функционального профиля макрофагов сосудистой стенки при ГКА и коронарной болезни сердца (КБС) [19]. Ранее M. Sigl и соавт. (2014) именно с ГКА связали развитие ишемических симптомов у части пациентов с заболеванием периферических артерий (ЗПА), определив этот васкулит фактором риска (ФР) худших результатов инвазивного лечения (шунтирования, ангиопластики) и назвав установление диагноза ГКА «вызовом для всех врачей, занимающихся пациентами с ЗПА» [7]. По мнению D. Laviriere и соавт. (2014), столь же важно выявление ГКА во всех случаях острого нарушения мозгового кровообращения (ОНМК) [20].
Большой массив эпидемиологических доказательств по ГКА накоплен при изучении репрезентативной выборки европеоидов США — населения округа Олмстед (штат Миннесота), бóльшая часть которого имеет североевропейские корни [15, 21–23]. При этом ряд приоритетов в изучении ГКА принадлежит клинике Мейо в Миннесоте, в т.ч. гистологическое подтверждение и подробное описание клинической картины заболевания: в 1932 г. B. Horton и соавт. наблюдали «новую» (длящуюся 4–6 нед.) головную боль у 55-летней женщины и 68-летнего мужчины, сочетающуюся с повышенной чувствительностью кожи черепа, особенно выраженной по ходу височных артерий, с лихорадкой, слабостью, анорексией, похудением, анемией, небольшим лейкоцитозом. Именно в клинике Мейо у больных височным артериитом впервые описали потерю зрения (1937) и применили глюкокортикоиды (ГК) (1949), указав, что еще Авиценна в 940–1010 гг. отмечал возникновение зрительных расстройств при подобной болезни, а ее клинические проявления впервые описал J. Hutchinson в 1890 г. В конце 1980-х E.B. Machado и соавт. установили высокие показатели заболеваемости ГКА в Миннесоте (17 на 100 тыс. населения) [22], по итогам обсервационного исследования 1950–1985 гг. описали основные симптомы этого васкулита и указали на связь с развитием атеросклероза [24].
Известно, что жители США имеют высокий риск развития в течение жизни воспалительных ревматических заболеваний — как женщины (каждая 12-я), так и мужчины (каждый 20-й). В особенности это касается ревматоидного артрита и РПМ (соответственно 3,6 и 2,4 % у женщин, по 1,7 % у мужчин). Относительно ГКА с вовлечением височных артерий данный риск составляет 1,0 % у женщин и 0,5 % у мужчин [25].
Ранее называемый височным артериитом, ГКА (или ГКА Хортона) является самым частым СВ у лиц старше 50 лет [4, 17, 18, 26] и вообще у взрослых [13, 16]. Основные эпидемиологические показатели ГКА очень вариабельны: высоки на Западе, особенно в Северной Европе, Скандинавии, Великобритании среди европеоидов, низки в Азии и Африке [6, 27, 28]. Частично различия можно объяснить несовершенством номенклатуры, методологии диагностики, учета фактических данных. В Международной классификации болезней 10-го пересмотра код этого васкулита (в сочетании с РПМ) — М31.5. Согласно статистическим данным, в США, Дании, Норвегии, Финляндии, Швеции распространенность ГКА составляет 10–35 на 100 тыс. населения этого возраста. Женщины болеют ГКА чаще мужчин в 1,5–6 раз [8, 18, 22, 24]. Ряд данных о распространенности ГКА является результатом перекрестных клинических исследований визуализирующих диагностических тестов [15].
Заболеваемость ГКА варьирует от 1,6 до 32,8 на 100 тыс. населения старше 50 лет [15]: в странах Северной Европы этот показатель достигает 15–33 [23, 29], в Германии — 3,5 [18, 30], в Великобритании — 10 и является наибольшим (74 на 100 тыс.) среди женщин 70–79 лет [31]. По данным E. Genda и соавт. (2018), в Тунисе ГКА чаще встречается у мужчин [27].
Чаще всего ГКА сопряжен с РПМ, которая проявляется проксимальной болью и скованностью (в мышцах, суставах плечевого и/или тазового пояса), ограничивающей активные движения в этих суставах и «разительно быстро» отвечающей на ГК. Сегодня определены и другие болезни и симптомы, риск развития которых повышен при ГКА или связан с высокой кумулятивной дозой применяемых при нем ГК (табл. 1) [31].
Чрезвычайно важные ГКА-ассоциированные зрительные нарушения субъективно проявляются головной болью, диплопией или односторонней внезапной преходящей слепотой (amaurosis fugax). Причина их возникновения — васкулит a.ophthalmicae и ее мелких ветвей [1]. Ишемическую зрительную нейропатию (ИЗН, т.е. ишемию n.оpticus) выявляют с помощью специального офтальмологического исследования. При этом могут быть обнаружены снижение остроты зрения, дефекты полей зрения, относительный афферентный зрачковый дефект, окклюзии артерий сетчатки [9].
Эпидемиологические параметры ИЗН изучены в Rochester Epidemiology Study — крупном обсервационном исследовании когорты жителей Олмстеда с диагнозом ГКА, установленным в 1950–2009 гг. В итоге доказано, что это осложнение развивается у 6,9 % больных ГКА и в 85 % случаев приводит к необратимой слепоте. Частота артериальных окклюзий такова: a.centralis retinae — 1,6 %, a.cilioretinalis — 0,4 %. Заболеваемость ГКА-ассоциированной ИЗН составляет 1,3 на 100 тыс. населения старше 50 лет, и в 20 % случаев необратимая потеря зрения наступает без предшествующих системных признаков васкулита [21]. Говоря о предикторах развития ИЗН при ГКА, отметим, что в британских рекомендациях (BSR/BHPR, 2010) к ним отнесены перемежающаяся боль в челюсти, диплопия и аномалии височной артерии [9].
Возрастзависимый характер ГКА — основной, но не общепризнанный его дистрактор от АТ — особенно значим в контексте развития кардио- и цереброваскулярных осложнений (мозговых инсультов, инфаркта миокарда, сосудистых аневризм), критической ишемии нижних конечностей, а также диагностических трудностей. В частности, в возрасте старше 60 лет с ГКА связано 17–24 % случаев лихорадки неясного генеза и/или значительно повышенной скорости оседания эритроцитов (СОЭ) [32], подразумевающих необходимость исключения инфекционных, онкологических, ревматических заболеваний. Однако развитие ГКА возможно и на фоне низких острофазовых показателей [9, 15].
Что касается вклада в формирование глобального бремени болезней, то повышенный риск смерти в течение 5 лет после установления диагноза ГКА был доказан в 2009 г. по итогам анализа данных Utah Population Database [5]. Опубликованные в 2015 г. результаты исследования когорты национального ре–естра пациентов с ГКА, верифицированные с помощью биопсии височной артерии (БВА), продемонстрировали «незначительное» повышение уровня и ранней смертности (в течение первых 2 лет болезни), и поздней (после 10 лет): относительный риск (ОР) составил соответственно 1,17 и 1,22. При этом подтвердилась связь повышенного риска смерти в первые два года заболевания ГКА с сердечно-сосудистыми осложнениями, в т.ч. аневризмой аорты [3]. В 2017 г. эти данные и результаты еще одного исследования определены как гетерогенные в документах наивысшего уровня доказательности — кокрановском обзоре и метаанализе C.L. Hill и соавт. Итоги метаанализа 17 исследований, отобранных в основных компьютерных базах данных доказательной медицины (Cochrane Library, Medline, EMBASE), не подтвердили влияние ГКА на уровень смертности [33].
Анализ доказательств, касающихся эпидемиологии крупнососудистых осложнений ГКА, также демонстрирует их неоднородность. Приоритет описания таких осложнений принадлежит J.M. Evans и соавт. (1995) [34]. Их профиль и предикторы возникновения, повышенные риски раннего развития расслоения аорты и смерти от него охарактеризовали D.M. Nuenninghoff и соавт. (2003) [23, 29]. По итогам проспективного исследования когорты жителей штата Олмстед с диагнозом ГКА, установленным в 1950–1999 гг., аневризмы и стенозы крупных артерий имели 27 % больных васкулитом, причем почти каждый 5-й (18 %) — аневризму и/или расслоение аорты, каждый 8-й (13 %) — стенозы. Вероятность выявления аневризм оказалась повышенной при наличии гиперлипидемии и КБС, а стенозов — при наличии краниальных симптомов (головной боли, перемежающейся боли в челюсти, чувствительности черепа) и повышенной СОЭ. Частота встречаемости аневризмы грудной аорты составила 11 %, ее расслоения — 5 %. Было показано, что заболеваемость аневризмой аорты при ГКА достигает 18,7 ‰, причем аневризма грудной аорты возникает у 8,2 ‰ пациентов в год, брюшной аорты — у 10,1 ‰, расслоение грудной аорты — у 5,4 ‰, брюшной — у 0,6 ‰ [23].
В целом риск развития аневризмы аорты и ее расслоения при наличии ГКА повышен по сравнению с общей популяцией в 2,0–17,3 раза [23, 34–36].
Стенозирующие поражения сосудов шеи D.M. Nuenninghoff и соавт. (2003) выявили в 9 % случаев ГКА, подключичных, подмышечных и плечевых артерий — в 6 %, подвздошных и бедренных — в 0,6 % [23]. Ранее J.M. Evans и соавт. (1995) диагностировали стенозы артерий верхних конечностей у 18–21 % больных, стенозы церебральных сосудов — у 7 % [34].
Спустя десятилетие, в 2013 г., исследуя когорту пациентов с ГКА крупных сосудов, эксперты клиники Мейо в Миннесоте T.A. Kermani и соавт. выявили такую же распространенность стенозов и аневризм — 20–25 % [37]. E.L. Matteson и соавт. (2016) установили частоту аневризмы аорты при ГКА (9,6 %) и показали, что от момента установления диагноза васкулита до выявления этого осложнения в среднем проходит 5,8 года, в 33,3 % случаев развивается аортальная недостаточность, в 44,4 % — расслоение аорты и смерть [38]. При этом уровень смертности у больных ГКА крупных сосудов сопоставим с таковым в общей популяции США [37].
Говоря о частоте и предикторах структурных сосудистых осложнений у больных ГКА, не подвергавшихся систематическим визуализирующим обследованиям, приведем итоги кокрановского обзора и метаанализа S.L. Mackie и соавт. (2014): в этой когорте аневризму грудной аорты выявляли в 2–8 %, а расслоения и разрывы аневризм — в 1 и 6 % случаев соответственно. В трех первичных исследованиях было показано, что возможным ФР развития аневризмы грудной аорты и ее расслоения при ГКА является мужской пол. По итогам данного обзора эксперты отметили необходимость определения ОР этих осложнений на разных этапах заболевания ГКА [35].
В 2015 г. J.C. Robson и соавт. [36] опубликовали результаты анализа данных национального реестра UK General Practice Research Database — сравнительного исследования частоты встречаемости аневризмы аорты у 6999 пациентов с ГКА и 41 994 — без ГКА, сопоставимых по полу, возрасту и месту жительства. С применением модели конкурирующих рисков было доказано двукратное повышение риска развития аневризмы аорты при заболевании ГКА: коэффициент риска (КР) hazard ratio составил 1,92 (95% ДИ 1,52–2,41). На основании рассчитанных КР (с 95% ДИ) определены предикторы развития аневризмы аорты: курение в настоящий момент (3,37; 2,61–4,37) или в анамнезе (2,64; 2,03–3,43), наличие сердечно-сосудистого заболевания (1,98; 1,50–2,63), предшествующая антигипертензивная терапия (1,57; 1,23–2,01); однако при наличии сахарного диабета (СД) КР развития аневризмы аорты составил 0,32 (0,19–0,56). У больных ГКА значительными предикторами развития аневризмы аорты оказались курение в настоящий момент (3,79; 2,20–6,53) или в анамнезе (2,20; 1,22–3,98), мужской пол (2,10; 1,38–3,19), антигипертензивная терапия (1,62; 1,00–2,61); при наличии СД КР развития аневризмы аорты составил 0,19 (0,05–0,77). Таким образом, авторы подтвердили, что наличие ГКА является ФР развития аневризмы аорты (наряду с мужским полом, возрастом и курением), и рекомендовали учесть это при планировании скрининговых программ. Вывод о протективном эффекте сочетания ГКА с СД был сделан на основании расчета более низкого риска развития аневризмы аорты у таких пациентов [36].
Исследований структуры смертности пациентов с ГКА в доступных информационных ресурсах нами не найдено.
Что касается ОНМК при ГКА, то доказано преимущественное развитие ишемических инсультов в вертебробазилярном бассейне (73–100 % случаев, множественные и единичные очаги) [4, 20]. В 2014 г. D. Laviriere и соавт. установили значительное преобладание этого осложнения у мужчин и указали на головную боль как его основной предиктор [39].
По результатам анализа 28 публикаций, касающихся инсультов у больных ГКА, R.S. Alsolaimani и соавт. (2016) выделили интракраниальный вариант васкулита, отметив 100% смертность в отсутствие лечения [40].
В недавнем исследовании типа «случай — конт–роль» H. de Boysson и соавт. (2017) продемонстрировали связь развития ГКА-ассоциированных инсультов с предшествующими симптомами ишемии n.opticus и более низкой активностью воспаления. Частота ОНМК на момент установления диагноза или в течение 1-го месяца лечения васкулита составила 16,7 %, и 3/4 всех очагов возникло в вертебробазилярном бассейне. Пациенты с инсультом были старше других больных ГКА (78 и 74 года) и чаще имели симптомы ИЗН (63 и 25 %), но реже — анемию (59 и 79 %). Примечательно, что активность воспаления у них также была ниже: установлены более низкие уровни СОЭ (68 и 80 мм/ч) и С-реактивного белка (СРБ) (61 и 91 мг/л). По результатам многофакторного анализа (с учетом статуса курения, наличия артериальной гипертензии, СД и гиперхолестеринемии) наилучшими предикторами развития ОНМК при ГКА оказались снижение остроты зрения (ОР = 5,0) и отсутствие анемии [4].
Информационный анализ показал, что в 2014–2016 гг. P. Ungprasert и др. сотрудники клиники Мейо опубликовали ряд систематических обзоров и мета–анализов когортных исследований, в которых оценили вероятность развития при ГКА основных неинфекционных заболеваний (табл. 2) [41–45]. В итоге доказано значительное повышение риска развития ОНМК при ГКА [41], повышение риска развития ЗПА при ГКА [43] и риска онкологических заболеваний при ГКА/РПМ (небольшое, но статистически значимое, а в течение 6–12 мес. после установления ревматологического диагноза — значительное: ОР = 2,16, 95% ДИ 1,85–2,53) [44]. Гетерогенность результатов первичных исследований не позволила подтвердить влияние васкулита на риск развития КБС [42]. Итогом еще одного метаанализа стала гипотеза о протективном эффекте заболевания ГКА в отношении развития СД [45].
Эпидемиологические доказательства связи ГКА с СД и опухолями неоднородны. Так, по данным L. Li и соавт. (2017), британские пациенты с ГКА по сравнению с пациентами без васкулита имеют повышенные риски развития всех сосудистых осложнений (аневризмы аорты, венозных тромбоэмболий, ЗПА, ОНМК, инфаркта миокарда), а также СД 2-го типа и депрессии, но не рака [46].
Таким образом, с позиций доказательного подхода актуальность ранней диагностики ГКА определяют следующие повышенные риски: риск смерти в связи с развитием аневризмы аорты, риск развития ИЗН и ишемического ОНМК. При этом именно слепоту считают самым тяжелым осложнением ГКА [16]. Однако в международных рекомендациях 2016–2018 гг. по ведению пациентов с болезнями периферических артерий, ишемическим инсультом и др. целенаправленное выявление ГКА не обсуждается.
Переходя к проблемам диагностики и прогнозирования исходов ГКА и другого васкулита крупных сосудов (large vessel vasculitis, LVV) — АТ, отметим, что результаты проведенного нами анализа научных публикаций последних лет демонстрируют устойчивый интерес к следующим аспектам:
— пересмотр и систематизация клинических проявлений и подгрупп LVV, определение их патогенетических основ и прогностического значения;
— описание генетической гетерогенности и цитокинового профиля LVV (в отсутствие специфических иммунологических маркеров этих болезней);
— определение диагностического потенциала (аналитических параметров) визуализирующих тестов — ультразвукового исследования (УЗИ, в частности цветовой допплерографии), магнитно-резонансной томографии (МРТ), компьютерной томографии (КТ), позитронной эмиссионной томографии (ПЭТ), прежде всего в отношении диагностики активности васкулита и оценки долгосрочного прогноза, а также по сравнению с БВА как эталонным диагностическим тестом, в различных комбинациях, на разных этапах развития ГКА и на фоне ГК-терапии;
— пересмотр классификационных критериев LVV;
— изучение континуума «АТ — ГКА — атеросклероз и его осложнения».
С 1990 г. основой диагностики ГКА являются классификационные критерии Американской коллегии ревматологов (ACR) (табл. 3). Эти пять критериев были определены в результате сравнения 214 больных ГКА с 593 пациентами с другими васкулитами. Выявление любых 3 критериев позволяло установить диагноз ГКА (чувствительность 93,5 %, специфичность 91,2 %) [47], прежде всего для создания гомогенных исследуемых когорт [15]. На основе этих критериев было также разработано классификационное дерево ГКА: после исключения критерия «повышенная СОЭ» и добавления «чувствительности черепа» и «перемежающейся боли в челюсти, языке или при глотании» этот инструмент диагностики состоит из шести критериев и имеет чувствительность 95,3 %, специфичность 90,7 % [47].
Низкую позитивную прогностическую ценность классификационных критериев ACR отметили уже в 1998 г. [20]. Еще ранее указывали на гетерогенность проявлений ГКА, необходимость выделения его клинических субтипов (крупных сосудов, экстракраниальный, с аортоартериитом и др.), и именно такие случаи реже удовлетворяли этим критериям [48–50]. По данным F. Muratore и соавт. (2015), критериям ACR соответствуют 95 % больных краниальным ГКА и лишь 39 % лиц с крупнососудистым вариантом болезни [50]. Что касается применения критериев ACR в исследовательских целях, эксперты клиники Мейо считают их малопригодными (что согласуется с пересмотром ACR) [15], а французские эксперты ограничивают сферу их использования (GEFA, 2015) [10]. D. Lariviere и соавт. (2016) предложили концепцию диагностики ГКА, отражающую реальную практику и основанную на таких трех китах, как клиническое суждение, результаты БВА и критерии ACR [39].
Что касается клинического суждения о вероятном диагнозе ГКА, то речь идет об общей оценке заболевания экспертами-клиницистами и быстром, рази–тельном, драматическом улучшении клинических симптомов и снижении уровня СРБ при применении ГК [39]. Изучение публикаций позволяет прийти к выводу, что общая оценка болезни врачом подразумевает знание клинических особенностей и неоднородности ГКА [16, 49]. В частности, в 2002 г. S.M. Levine и –соавт. отнесли к классическим симптомам ГКА головную боль, перемежающуюся боль в челюсти, РПМ и расстройства зрения, указав на большую (40 %) частоту встречаемости широкого спектра иных симптомов, в т.ч. обусловленных поражением крупных сосудов [16]. Тогда же G.W. Smetana и соавт. предложили различать два варианта ГКА: 1) классический, или краниальный, с вовлечением ветвей наружной сонной артерии, с преобладанием воспалительного типа (> 90 % случаев) и возможностью ишемического типа (4 %); 2) генерализованный, или «такаясу-подобный» (табл. 4) [51]. С тех пор категория «ГКА крупных сосудов» утвердилась в литературе, но предложенная классификация васкулита не стала общепризнанной. К примеру, M. Koster и соавт. (2018) отмечают широту клинического спектра ГКА (изолированный краниальный, изолированный крупнососудистый, сочетанный) и указывают на поражение крупных сосудов в большинстве случаев болезни (80–83 %), ссылаясь на результаты гистологических и визуализирующих тестов и подчеркивая, что крупнососудистый ГКА является прежде всего аортитом или артериитом первичных ветвей аорты, подтвержденным визуализирующими методами [15].
Говоря о краниальных симптомах ГКА, отметим, что их выявление у лиц старше 50 лет является главным основанием для клинического подозрения этого диагноза. Так, эксперты BSR/BHPR (2010) призывают врачей обращать внимание на внезапно развившуюся головную боль (особенно одностороннюю в височной области), чувствительность черепа, перемежающуюся боль в челюсти и языке, зрительные нарушения (включая диплопию), а также конституциональные симптомы, РПМ, перемежающуюся хромоту [9]. В рекомендациях EULAR (2018) краниальными симптомами ГКА названы головная боль, зрительные симптомы, перемежающаяся боль в челюсти, отек и/или чувствительность височных артерий [3].
Анализ публикаций, посвященных клиническим особенностям ГКА в разных этнических группах, не позволяет исключить влияние на результат систематических ошибок отбора. К примеру, именно краниальные симптомы преобладают в современном описании ГКА у африканцев: головную боль имеют 91,7 % пациентов, аномалии височных артерий — 85,4 %, тяжелые проявления ишемии — 80,2 %; частота встречаемости конституциональных симптомов составляет 75 %, РПМ — 56,3 %, признаки поражения крупных сосудов не описаны [27]. В то же время при выявлении крупнососудистого субтипа ГКА у европеоидов в клинической картине доминируют проявления ишемии верхних конечностей, а симптомы краниальной ишемии и РПМ либо отсутствуют, либо встречаются не реже, чем при классическом ГКА [49, 50].
Как видно из табл. 4, соотношение встречаемости краниального и экстракраниального (крупнососудистого) субтипов ГКА точно не определено. Результаты проведенного нами анализа литературы позволяют связать это с гетерогенностью изученных когорт и первичных исследований, в т.ч. с применением разных визуализирующих методов диагностики аномалий сосудов, комбинаций и сроков их выполнения, сравнением с результатами БВА-теста и т.д.
Важный аспект диагностики ГКА — определение дистракторов его основных вариантов. Частота встречаемости при них некоторых симптомов представлена в табл. 5.
По данным F. Muratore и соавт. (2015), при крупнососудистом ГКА значительно чаще, чем при классическом, имеются различия артериального давления (АД) и пульса на правой и левой верхней конечности [50]. И хотя ранее дистрактором субтипов ГКА считали краниальные симптомы [49], частота встречаемости болезненности височной области и преходящих нарушений зрения при ГКА крупных сосудов оказалась не меньшей, чем при классической болезни Хортона, не выявлено и различий уровня СОЭ. По сравнению с краниальным ГКА крупных сосудов характеризовался более ранним дебютом (68,2 и 75,4 года), более частым сочетанием с РПМ (26 и 15 %), бóльшей частотой рецидивов и бóльшей кумулятивной дозой ГК, но меньшей частотой потери зрения [50]. В 2018 г., ссылаясь на ряд исследований [10, 49, 50], M. Koster и соавт. предположили, что «крупнососудистый ГКА чаще, чем краниальный, развивается у женщин, начинается в более молодом возрасте и характеризуется более длительным периодом времени до установления диагноза, а также более низким уровнем маркеров воспаления» [15].
Распределение пораженных крупнососудистым ГКА артерий изучено F. Muratore и соавт. (2015) с помощью рентгенологических методов: чаще всего (в 93 % случаев) наблюдали аномалии левой подключичной артерии. Частота вовлечения прочих сосудов такова: правая подключичная артерия — 72 %, левая подмышечная — 66 %, правая подмышечная — 54 %, брюшная аорта — 48 %, нисходящая аорта — 44 %, плечеголовной ствол — 43 %, левая общая сонная артерия — 42 %, дуга аорты — 41 % [50].
Наиболее частое вовлечение подключичных артерий было подтверждено и с помощью УЗИ — у больных ГКА без краниальных симптомов, обычно у женщин более молодого возраста. В половине этих случаев (52 %) результаты БВА-теста оказались отрицательными [49, 55].
Представления о роли БВА в диагностике ГКА за последние годы изменились. В 2002 г., говоря о раннем выявлении васкулита, S.M. Levine и соавт. отмечали, что визуализирующие методы (цветовая допплерография, КТ- и МРТ-ангиография, ПЭТ) не заменяют БВА как золотой стандарт верификации этого диагноза [16]. В дальнейшем, с учетом частоты ложноотрицательных результатов БВА [56], внимание к альтернативным диагностическим тестам возросло, что нашло отражение в рекомендациях EULAR 2018 г. [2]. Однако в ряде стран, к примеру в Великобритании (BSR/BHPR, 2010) и Франции (GEFA, 2015), проведение БВА предусмотрено во всех случаях подозрения на ГКА [9, 10].
Специфические гистологические находки в био–птатах височных артерий, взятых у лиц с классическим ГКА, представлены в табл. 3. Как известно, фибриноидный некроз при этом васкулите отсутствует, характерным является гранулематозное воспаление с наличием гигантских клеток на границе интима-медиа либо (чаще) панартериит с наличием мононуклеарных и лимфоцитарных инфильтратов. При обнаружении таких изменений БВА-тест считают позитивным, но и у пациентов с клиническими признаками височного ангиита он позитивен лишь в 85 % случаев. При ГКА крупных сосудов чувствительность БВА-теста не превышает 60 % [50, 55, 57, 58].
На сегодня при ГКА установлен ряд важных клинико-гистологических ассоциаций. A. Cavazza и соавт. (2014), исследовав 888 биоптатов, взятых у больных ГКА, подтвердили большую частоту ложноотрицательных результатов БВА-теста: лишь 39,9 % образцов были положительными. По результатам изучения биоптатов был описан гистологический спектр темпорального ангиита при ГКА и выделены 4 категории заболевания: 1) васкулит мелких сосудов (SVV, 9 % биоптатов); 2) васкулит vasae vasorum (VVV, 6,5 %); 3) воспаление, ограниченное адвентицией (ILA, 7 %); 4) трансмуральное воспаление (TMI, 77,5 %). В случае TMI инфильтраты обнаруживаются между медией и адвентицией, состоят из Т-лимфоцитов и макрофагов (иногда — плазмоцитов), в 75 % случаев содержат гигантские клетки, в 15–20 % — ламинарные некрозы и кальцификаты. По сравнению с SVV и VVV категория «трансмуральное воспаление» сопряжена с более выраженными краниальными симптомами, острофазовыми показателями и клиническими признаками системного воспаления, бóльшей частотой выявления симптома halo по данным допплерографии височных артерий и меньшей частотой применения ГК к моменту проведения биопсии. При бóльшем сходстве с TMI-ГКА у пациентов категории ILA реже встречается головная боль, аномалии височных артерий и ультразвуковой симптом halo [57].
Согласно рекомендациям BSR/BHPR (2010) и GEFA (2015), БВА для диагностики ГКА должна быть выполнена опытным хирургом, достаточно односторонней биопсии, размер участка артерии для исследования многочисленных серий срезов должен быть не менее 1 см [9, 10].
Практически важным является вопрос влияния ГК-терапии на результаты БВА и других диагностических тестов. По данным клиники Мейо (E.L. Matteson, 2017), исчезновение гигантских клеток происходит в течение 1-й недели ГК-терапии, однако другие гистологические признаки артериита сохраняются несколько недель, месяцев и даже лет. Кроме того, у пациентов, получающих ГК, описаны такие атипичные результаты БВА, как скудное воспаление, леченый артериит и др. [38]. Британские эксперты отмечают возможность выявления гистологических признаков ГКА в течение 2–6 недель ГК-терапии [9].
Рецидивы. Симптомы ГКА, требующие лечения, у большинства пациентов возникают повторно — в течение первых 2 лет заболевания при лечении поддерживающими дозами ГК (преднизолон < 10 мг/сут).
При этом у 47–51 % больных в клинической картине преобладает РПМ, у 31–42 % — краниальные симптомы, но почти у каждого 5-го (18 %) на первый план выходят конституциональные признаки. Так характеризуют рецидивы ГКА в когортах пациентов испанских и итальянских медицинских центров M.A. Alba (2014) и G. Restuccia (2016–2017) с соавт. Основными ФР развития рецидивов ГКА ими определены необходимая кумулятивная доза ГК и длительность периода перехода на поддерживающую дозу [59–61].
G. Restuccia и соавт. установили наибольшую вероятность рецидивов ГКА при наличии в дебюте лихорадки > 38 °С и сильной воспалительной инфильтрации стенок сосудов по данным БВА; анемия также отнесена к ФР [60]. M.A. Alba и соавт. отмечают бóльшую частоту рецидивов ГКА при наличии остеопороза, чем без него (65 и 32 %) [59].
По данным L. Martinez-Lado и соавт. (2011), в испанской когорте больных ГКА частота рецидивов на 1-м году болезни составляет 40,8 %, причем самыми частыми симптомами являются головная боль (52 %) и РПМ (30 %), а наилучшим предиктором рецидивов — анемия в дебюте [62].
В чилийском медицинском центре наблюдали рецидивы ГКА на 1-м году болезни у 50 % пациентов, в течение 2 лет — у 68 %, в течение 5 лет — у 79 %. По данным С. Labarca и соавт. (2016), ФР развития рецидивов ГКА являются женский пол, наличие артериальной гипертензии и СД [63].
Определены и ФР благоприятного прогноза: по данным G. Restuccia и соавт. (2017), достижение длительной ремиссии (т.е. полной клинической ремиссии без повышения лабораторных маркеров воспаления в течение года) и снижение риска рецидивов ГКА более вероятно при отсутствии в дебюте болезни РПМ и анемии [61].
Таким образом, прогностически важными представляются характеристики дебюта ГКА и профиль коморбидности. Актуальным аспектом прогнозирования исходов ГКА (риска смерти, развития осложнений, рецидивов, вероятности длительной ремиссии) является оценка влияния иммуносупрессивной и таргетной биологической терапии. Перспективным выглядит изучение эффектов и использование тоцилизумаба, устекинумаба и абатацепта [15].
Отметим, что именно крупнососудистый субтип ГКА вызывал и вызывает и терминологические, и диагностические трудности. В отсутствие явных/доминирующих краниальных симптомов круг дифференциальной диагностики ГКА включает такие болезни: 1) ревматические: первичные СВ (болезнь Такаясу, болезнь Бехчета, узелковый полиартериит, АНЦА-ассоциированные) и вторичные васкулиты (при спондилоартритах, ревматоидном артрите, системной красной волчанке), IgG4-заболевание, ретроперитонеальный фиброз, идиопатический аортит; 2) инфекционные: инфекционный эндокардит, сифилис, герпетические инфекции (Herper zoster, вирус Эпштейна — Барр, цитомегаловирус); 3) гематологические: амилоидоз, множественная миелома, болезнь Эрдгейма — Честера; 4) атеросклероз [15].
Признание крупнососудистого субтипа ГКА и его распространенности индуцировало выдвижение гипотезы о преемственности болезни Такаясу и болезни Хортона, т.е. единого васкулита крупных сосудов. Однако по итогам изучения генетических, иммунологических и клинических аспектов АТ и ГКА эта гипотеза не подтвердилась [50, 54, 55, 64–66].
В частности, K. Maksimovicz-McKinnon и соавт. (2009) предположили роль систематических ошибок при отборе клинических данных и применении визуализирующих тестов у больных указанными васкулитами. Они провели ретроспективный анализ данных 144 пациентов с ГКА и АТ, среди которых преобладали женщины (82 и 91 % соответственно) европеоидной расы (95 и 88 %). В итоге при ГКА подтвердилась бóльшая частота встречаемости классических краниальных симптомов и значительно более редкое применение методов визуализации крупных сосудов (62 и 100 %), но и при этом поражение хотя бы одного артериального сегмента выявляли в 3/4 случаев [54].
Гипотезу единого васкулита опровергли и результаты детального фенотипирования 45 больных ГКА и АТ, проведенного S. Futura и соавт. (2015). При ГКА чаще встречались головная боль и протяженные стенозирующие изменения подключичных и сонных артерий, отмечались более высокие уровни СОЭ и СРБ и меньшая частота рецидивов (60 и 22 %). Дискриминатором васкулитов было предложено считать тип поражений подключичных и сонных артерий [67].
В том же году несколько иные данные получили T.A. Kermani и соавт., а именно: преобладание аневризматических изменений грудной аорты при ГКА (100 и 19 % при АТ) и стенозирующих — при АТ (81 и 0 % при ГКА). В опровержение гипотезы единого васкулита было отмечено присущее АТ более частое поражение грудной и брюшной аорты, плечеголовного ствола, сонных, мезентериальных, левой почечной артерий и различие показателей АД на верхних конечностях [64].
Итоги изучения клинико-лабораторных особенностей и результатов применения визуализирующих методов диагностики аномалий сосудов при ГКА и АТ обобщены в табл. 6. Отметим, что АТ встречается очень редко (заболеваемость 0,5–3 на 1 млн населения), и при преобладающем его развитии в Азии распределение вовлеченных сосудов неоднородно даже в регионе: у пациентов из Японии и Кореи чаще поражена дуга аорты, из Индии и Таиланда (а также Европы и Туниса) — брюшная аорта [27, 28].
Как видно из табл. 6, применение визуализирующих методов позволило установить большую частоту встречаемости аортита при ГКА — до 65 % [54]. Признавая аортит характерным проявлением ГКА, эксперты отмечают различную частоту его выявления с помощью разных тестов: до 40 % — по данным гистологических исследований (клинические симптомы аортита имеются при этом в 2 раза реже), 20–65 % — по данным КТ (при проведении исследования в течение 4 нед. от даты предположения диагноза ГКА выявляют утолщение стенки аорты разной протяженности; позже выявляют такие структурные изменения аорты и ее ветвей, как эктазия, дилатация, аневризма, стеноз, окклюзия), 83 % — по данным ПЭТ [48, 68–72]. Эти результаты, полученные в 1995–2014 гг., подтвердили целесообразность применения визуализирующих методов для диагностики ГКА крупных сосудов [73–75].
Признаки воспаления аорты или ее основных ветвей, диагностируемые с помощью различных визуализирующих методов, приведены в табл. 7: при использовании КТ- или МРТ-ангиографии таковыми являются циркулярное утолщение стенки сосуда, контрастное усиление, стеноз/окклюзия и/или дилатация/аневризма (последний признак выявляет и –обычная ангиография); с помощью ПЭТ с применением –18F-фтордезоксиглюкозы (ФДГ-ПЭТ) выявляют гомогенный гиперметаболизм стенки; с помощью цветовой допплерографии — гипоэхогенное утолщение стенки (halo-симптом) [15].
Опыт клиники Мейо, описанный в 2013–2016 гг. T.A. Kermani, E.L. Matteson и др. [37, 38], подтвердил необходимость проведения КТ- или МРТ-ангиографии для выявления поражения грудной аорты и ее ветвей у пациентов с сильным клиническим подозрением на ГКА и отрицательными результатами БВА-теста, поскольку применение этих визуализирующих методов позволяет выявить признаки васкулита в 1/3 таких случаев. Авторами предложен алгоритм мониторинга аневризмы аорты при ГКА. Исходный скрининг предполагает выполнение рентгенографии органов грудной клетки и УЗИ органов брюшной полости; эхокардио–графию следует проводить каждые 1–3 года; КТ- или МРТ-ангиография названы методами выбора при экстракраниальном ГКА. Если результат скрининга положителен (т.е. выявлена дилатация или аневризма аорты), придерживаются имеющихся рекомендаций по ведению пациентов с аневризмой аорты, выполняя контрольные обследования каждые 6–12 мес. При отрицательном результате скрининга визуализирующие тесты повторяют каждые 5 лет [27, 28].
Отметим, что КТ- или МРТ-скрининги осложнений ГКА-аортита также рекомендованы и французской группой GEFA (2015) — с интервалами от 2 до 5 лет и только при отсутствии противопоказаний к возможному оперативному вмешательству на аорте [10] и EULAR (2018) — наряду с УЗИ и индивидуальным подходом к выбору скрининговых тестов и определению межскрининговых интервалов [2].
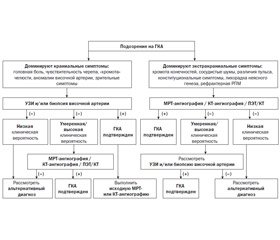
Новый предложенный в клинике Мейо диагностический алгоритм оценивания пациентов с подозрением на ГКА представлен на рис. 1 [15].
Актуальность изучения диагностического потенциала ПЭТ при ГКА определяется существенным вкладом этого васкулита в структуру причин лихорадки неясного генеза у пожилых и частой ассоциацией ГКА/РПМ с опухолями [32, 39]. В последние годы для выявления аортоартериита при ГКА все чаще используют метод ПЭТ/КТ, т.е. ФДГ-ПЭТ в сочетании с низкодозовой КТ без контрастного усиления — с целью получения анатомических корреляций и коррекции данных ПЭТ [26, 76]. Необходимость применения ПЭТ/КТ у пожилых пациентов с неспецифическими жалобами и значительно повышенной СОЭ отмечают K.D. Lensen и соавт. (2013): «В частности, это позволяет выявить васкулит крупных сосудов. При негативном результате ПЭТ/КТ можно считать безопасной тактику выжидания и наблюдения» [32].
Практикуемый в клинике Мейо подход к применению ПЭТ/КТ согласуется с мнением S. Prieto-Gonzalez и соавт. (2014) отдавать предпочтение ПЭТ/КТ перед КТ- и МРТ-ангиографией лишь в определенных случаях: при подозрении на наличие злокачественной опухоли и неясном диагнозе. У пациентов с предполагаемым диагнозом «ГКА крупных сосудов» тест ПЭТ/КТ имеет следующие первичные аналитические параметры: чувствительность 80 %, специфичность 79 % [27, 28, 71].
Чувствительность и специфичность ПЭТ для диагностики поражения сосудов при ГКА, по данным M.D. Stellingwerff и соавт. (2015), составляют 89,5 и 97,7 % соответственно [26]. Доказательная база точности ПЭТ-теста представлена в табл. 8. Изучение указанных в ней вторичных доказательств [76–78] позволило установить, что их основу составили контролируемые исследования, найденные в трех компьютерных базах данных доказательной медицины (Medline, EMBASE, Cochrane Library) и содержащие в качестве референт–ного теста не БВА, а классификационные критерии ACR.
В частности, F.L. Besson и соавт. (2011) выполнили систематический обзор 14 и метаанализ 6 первичных исследований точности ПЭТ как диагностического теста при ГКА с РПМ и без таковой. Результатом обзора явилось установление маркера васкулита (бóльшее поглощение ФДГ сосудами, чем печенью) и характерного для ГКА паттерна поглощения ФДГ аортой (гладкого линейного или протяженного сегментированного). Итоги метаанализа (101 пациент с ГКА) подтвердили эффективность применения ПЭТ для диагностики ГКА: отношение правдоподобия положительного результата теста составило 6,73 (3,55–12,77), отношение правдоподобия отрицательного результата — 0,25 (0,13–0,46), точность — 0,84 (0,76–0,90). Таким образом, в структуре позитивных результатов ПЭТ у лиц с подозрением на ГКА доля истинных составляет 84 %, ложных — 16 % [77].
Большой диагностический потенциал ПЭТ при подозрении на васкулит крупных сосудов подтвержден M. Soussan и соавт. (2015) — по результатам систематического обзора (21 исследование, 413 пациентов с ГКА и АТ) и двух метаанализов (ГКА: 4 исследования, 57 пациентов; АТ: 7 исследований, 191 пациент). Доказана даже бóльшая точность ПЭТ для выявления аортоартериита при ГКА, чем при АТ. Считая достаточным критерий «сосудистое поглощение ФДГ ≥ печеночного», эксперты отметили необходимость усиления доказательной базы, определения пороговых значений ПЭТ-теста и их клинической значимости [78]. Такие же выводы в отношении ПЭТ или ПЭТ/КТ сделаны Y.H. Lee и соавт. (2016) по итогам метаанализа 8 исследований (170 пациентов с ГКА и АТ) [76].
Заслуживают внимания результаты двух моноцентровых исследований, завершенных недавно в Германии и Франции.
M.D. Stellingwerff и соавт. (2015) в когорте 18 пациентов с ГКА изучили аналитические параметры ПЭТ/КТ. Итоги:
1) подтверждена наибольшая диагностическая точность теста при выявлении преобладания сосудистого поглощения ФДГ над печеночным (чувствительность 83 %, специфичность 91 %) и бóльшая чувствительность ПЭТ/КТ (92 %) в отсутствие ГК-терапии;
2) при сравнении 4 полуколичественных показателей standardized uptake value (SUV) — максимального стандартизированного поглощения ФДГ (SUVmax aorta, SUVmax aorta-to-liver ratio, SUVmax aorta-to-superior-caval-vein ratio, SUVmax aorta-to-inferior-caval-vein ratio) наилучшие параметры (специфичность 92 %, чувствительность 69 %, а в отсутствие ГК-терапии — 90 %) имеет показатель SUVmax aorta-to-liver ratio;
3) наибольшее количество сосудистых сегментов с диффузным паттерном поглощения ФДГ выявлено у больных, не получавших ГК;
4) информативность уровня СРБ в отношении результата теста ПЭТ/КТ при ГКА оказалась низкой [26].
Во втором исследовании D. Laviriere и соавт. (2016) определены аналитические параметры ПЭТ и КТ-ангиографии как тестов для выявления пораженных ГКА сосудов — первичные (чувствительность, специфичность) и вторичные (позитивная и негативная прогностическая ценность — ППЦ и НПЦ). В нем приняли участие 24 пациента с подозрением на ГКА; на основании клинического суждения, БВА и критериев ACR диагноз был установлен у 15 (62,5 %). В случае отрицательного БВА-теста клинический диагноз ГКА «сохраняли, если в течение 6 мес. не было установлено иное». В итоге частота ложноотрицательных результатов тестов при ГКА оказалась следующей: БВА — 60,0 %, ПЭТ — 30,0 %, КТ — 26,7 %. Результаты исследования приведены в табл. 9. Они подтвердили ценность и ПЭТ, и КТ для диагностики ГКА. С учетом бóльшей ППЦ был сделан вывод о возможности «позиционирования ПЭТ лучшим неинвазивным методом… и оценки стратегии «без биопсии» у пациентов с клиническим подозрением на ГКА и сильным поглощением ФДГ крупными сосудами» [39].
Отмечая небольшую мощность и моноцентровый характер данного исследования, следует обратить внимание на ряд выявленных в нем важных аспектов применения ПЭТ при ГКА:
— даже недлительная (1–5 дней) ГК-терапия снижает чувствительность ПЭТ (т.к. при угнетении воспаления уменьшается поглощение ФДГ) и повышает вероятность ложноотрицательных результатов теста;
— содержание СРБ является информативным показателем в отношении результатов ПЭТ (выявлена тенденция к корреляции уровня СРБ и поглощения ФДГ (SUVmax) всеми артериальными сегментами), что согласуется с одними ранее полученными данными [71] и отличается от других [26];
— главным вызовом для специфичности ПЭТ у пожилых пациентов является дифференциальная диагностика истинного аортита и атеромы аорты (отличительный признак: в зоне атеромы поглощение ФДГ выглядит более фокусным);
— выдвинута гипотеза о пользе применения ПЭТ для диагностики рецидивов ГКА, его рефрактерности к ГК-терапии и прогнозирования риска развития дилатации аорты [39].
Информативность УЗИ сосудов при ГКА изучали многие авторы [7, 14, 20, 23, 52, 55, 65, 73–75, 79, 80]. По данным W. Schmidt и соавт. (2008), ультразвуковые признаки поражения височных артерий (halo-симптом, стеноз, окклюзия) имеют 84 % больных ГКА: 95 % пациентов без признаков вовлечения проксимальных артерий верхних конечностей и 58 % пациентов с признаками васкулита крупных сосудов [55]. Систематический обзор S.L. Mackie и соавт. (2014) показал, что частота вовлечения сонных артерий, установленная с помощью цветовой допплерографии, составляет 29–54 % [35].
Сопоставляя имеющиеся рекомендации в части «диагностические тесты 1-й линии» при подозрении на ГКА, отметим различия: по мнению французских экспертов (GEFA, 2015), УЗИ височных артерий не заменяет БВА [10], в британских разработках (BSR/BHPR, 2010) ультразвуковые тесты не упомянуты [9], а по мнению EULAR (2018), УЗИ височных артерий является визуализирующим тестом 1-й линии при подозрении на преимущественно краниальный ГКА (речь идет об изолированном УЗИ этих сосудов или в сочетании с УЗИ подмышечных артерий) [2]. Альтернативой УЗИ височных артерий EULAR называет МРТ, в то время как GEFA не рекомендует этот метод. И GEFA, и EULAR отмечают невысокую ценность УЗИ для диагностики аортита [2, 10].
Одновременное или последовательное УЗИ нескольких сосудов — один из способов повышения точности диагностики ГКА (а именно выявления пораженных артерий, их распределения, описания типа аномалий). В 2014 г. в результате изучения серии случаев БВА-позитивного ГКА A.P. Diamantopulos и соавт. установили аналитические параметры комбинированной цветовой допплерографии височной, подмышечной и общей сонной артерий (чувствительность 100 %, специфичность 91 %) и пришли к выводу о возможности использования данного теста вместо БВА в обычной клинической практике [80]. Тогда же W. Schmidt и соавт. обосновали целесо–образность УЗИ-мониторинга при ГКА с применением цветовой допплерографии сосудов верхних и нижних конечностей, считая двустороннее снижение эхо-сигнала (halo-симптом) высокоспецифичным признаком васкулита. Они отметили необходимость: 1) раннего проведения УЗИ после начала ГК-терапии (поскольку редукция воспаления снижает чувствительность теста); 2) учета маскирующего влияния ГКА артерий верхних конечностей на результаты измерения АД на руках для диагностики артериальной гипертензии [65].
В завершение отметим, что проблема доказательной диагностики ГКА на сегодня решена на уровне разработки международных клинических рекомендаций. В табл. 10 приведены соответствующие 5 из 9 положений рекомендаций BSR/BHPR (2010) [9].
Из 15 положений французских рекомендаций по ведению больных ГКА (GEFA, 2015) вопросам терминологии, номенклатуры, классификации и диагностики посвящены 8 (табл. 11), и уровень согласия 80 % достигнут для всех положений [10]. В табл. 12 приведены все 12 положений рекомендаций EULAR (2018) по визуализации васкулита крупных сосудов в клинической практике [2]; ГКА не касаются лишь положений 7, 8, посвященных АТ.
Как видно из табл. 12, важнейшим аспектом ведения пациентов с предполагаемым СВ крупных сосудов признано раннее применение доступного и качественно выполненного визуализирующего диагностического теста (при подозрении на ГКА — биопсии или УЗИ височных артерий, возможно, в сочетании с УЗИ подмышечных артерий; при подозрении на АТ — МРТ-ангиография), что не должно отсрочить начало лечения. EULAR не рекомендованы: 1) обычная ангиография как метод диагностики СВ крупных сосудов; 2) специальные ангиографические методы (КТ и ПЭТ) для оценки воспаления краниальных артерий; 3) рутинное применение визуализирующих тестов в отсутствие подозрения на рецидив васкулита.
Информационный анализ прогнозирования рецидивов ГКА показал перспективность определения сывороточной концентрации такого биомаркера, как остеопонтин (sOPN), — гликопротеина, участвующего в процессах дифференциации Тh1- и Th2-лимфоцитов, тканевого воспаления и ремоделирования. На сегодня именно sOPN признают маркером активности ГКА и предиктором развития обострений этого заболевания [81].
Остаются предметом научных исследований и дискуссий патогенетические механизмы сосудистых осложнений ГКА, прежде всего раннего развития дилатации аорты. Кроме персистенции субклинического воспаления сосудистой стенки, важную роль при этом отводят раннему повреждению эластических волокон и мышечного слоя вследствие воспаления, недостаточной репарации, ремоделированию, сосудистому старению и/или гемодинамическим факторам [82].
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.

/91-1.jpg)
/93-1.jpg)
/94-1.jpg)
/95-1.jpg)
/98-1.jpg)
/99-1.jpg)
/100-1.jpg)
/101-1.jpg)
/102-1.jpg)
/102-2.jpg)
/103-1.jpg)