На сьогодні відомі близько 100 видів вірусів родини герпесвірусів (ГВ, Herpesviridae), що мають особливі механізми взаємодії з імунною системою господаря. Родина ГВ відповідно до класифікації Міжнародного комітету з таксономії вірусів (International Committee on Taxonomy of Viruses) розділяється на 4 підродини: α-герпесвіруси (аlpha-herpesvirinae), β-герпесвіруси (beta-herpesvirinae), γ-герпесвіруси (gamma-herpesvirinae) та підродину некласифікованих вірусів. Патогенні для людини ГВ можуть бути причиною широкого спектра захворювань. Залежно від механізму зараження розрізняють набуту й уроджену форму герпесвірусної інфекції (ГВІ). Набута ГВІ може бути первинною і вторинною (рецидивуюча), локалізованою і генералізованою. На сьогодні відомі 8 патогенних для людини типів ГВ: два типи вірусу простого герпесу (HSV-1, HSV-2), вірус вітряної віспи та оперізувального герпесу (VZV, або HHV-3), вірус Епштейна — Барр (ЕBV, або HHV-4), цитомегаловірус (CMV, або HHV-5), HHV-6, HHV-7, HHV-8 [1].
Герпесвіруси людини типів 1 та 2 (Human Herpesvirus 1, 2, HHV-1, HHV-2), що також називають вірусами простого герпесу (ВПГ, Herpes simplex virus 1, 2, HSV-1, HSV-2), належать до α-герпесвірусів. Віруси асоціюються з такими захворюваннями, як інфекція новонароджених (генералізований герпес, енцефаліти, герпес шкіри і слизових), енцефаліт, гінгівостоматит, герпетиформна екзема Капоші, первинний герпес шкіри, очей, герпетичний панарицій, кератит.
Герпесвірус людини типу 3 (Human Herpesvirus 3, HHV-3), відомий як вірус вітряної віспи (Varicella zoster virus, VZV), також являє собою α-герпесвірус. Найчастіше вірус асоціюється з такими захворюваннями, як вітряна віспа, оперізувальний лишай, ураження нервової системи (енцефаліт).
Герпесвірус людини типу 4 (Human Herpesvirus 4, HHV-4), або вірус Епштейна — Барр (Epstein — Barr virus, EBV), належить до групи γ-герпесвірусів. ЕBV може викликати інфекційний мононуклеоз, лімфому Беркітта, назофарингеальну карциному, хронічну активну ЕBV-інфекцію, лейоміосаркому, лімфоїдну інтерстиціальну пневмонію, волосисту лейкоплакію, неходжкінську лімфому, вроджену ЕBV-інфекцію.
Герпесвірус людини типу 5 (Human Herpesvirus 5, HHV-5), або цитомегаловірус людини (Human cytomegalovirus, CMV), відноситься до групи β-герпесвірусів. У випадку вродженої інфекції та в імуноскомпрометованих пацієнтів CMV може спричиняти тяжкі захворювання, такі як гепатит, гепатоспленомегалія, мікроцефалія, гіпотрофія, недоношеність, гепатит, тромбоцитопенічна пурпура, енцефаліт, хоріоретиніт, пневмонія, нефрит. В імунокомпетентних дітей більш старшого віку набута CMV-інфекція в 99 % випадків перебігає в субклінічній формі. Серед клінічно виражених форм частими проявами CMV-інфекції в дітей віком понад один рік є мононуклеозоподібний синдром та прояви гострого респіраторного захворювання у вигляді фарингіту, ларингіту, бронхіту.
Герпесвірус людини типу 6 (Human Herpesvirus 6, HHV-6) також належить до групи β-герпесвірусів. HHV-6 об’єднує два споріднених віруси герпесу — HHV-6A і HHV-6B. HHV-6B заражує майже 100 % людей, як правило, у віці до трьох років і часто призводить до лихоманки, діареї, іноді з висипом, відомої як дитяча розеола (раптова екзантема, «шоста хвороба»). Інколи гостра інфекція може супроводжуватися фебрильними судомами. В імуноскомпрометованих пацієнтів HHV-6 може провокувати ураження нервової системи (енцефаліт) або кісткового мозку. Про поширеність та захворюваність на HHV-6A на даний час існує дуже обмежена інформація.
Герпесвірус людини типу 7 (Human Herpesvirus 7, HHV-7) належить до β-герпесвірусів. Первинне інфікування HHV-7 зазвичай відбувається в дитинстві й може викликати такі клінічні прояви, як дитяча розеола та фебрильні судоми. Латентна HHV-7-інфекція може реактивуватися в імуноскомпрометованих осіб [2]. Є повідомлення про асоціацію HHV-7-інфекції з енцефалітами [3].
Герпесвірус людини типу 8 (Human Herpesvirus 8, HHV-8), відомий також як пов’язаний із саркомою Капоші вірус герпесу, являє собою γ-герпесвірус. Вірус викликає захворювання переважно в імуноскомпрометованих пацієнтів і пов’язаний із злоякісними пухлинами, включаючи саркому Капоші, первинну випітну лімфому і хворобу Кастлемана [4].
Серед герпесвірусних інфекцій провідне клінічне значення мають інфекції, спричинені вірусами простого герпесу HSV-1 та HSV-2. За сучасними оцінками, у всьому світі 3,7 мільярда людей віком до 50 років (67 %) інфіковані HSV-1 та 417 мільйонів людей (11 %) — HSV-2 [5, 6]. Частота неонатального герпесу — 10 випадків на 100 000 новонароджених, що включає близько 4000 випадків HSV-1- та 10 000 випадків HSV-2-інфекції [7]. Інфікування HSV-1 зазвичай відбувається при контакті з інфікованою слиною та частіше спостерігається в дитячому віці, а передача HSV-2 звичайно відбувається під час сексуальних контактів і рідше — під час пологів при інтранатальному зараженні.
Після проникнення до організму через слизові оболонки або пошкоджену шкіру та первинної реплікації віруси простого герпесу спричиняють віремію. Гістологічні зміни під час активної HSV-інфекції шкіри та слизових оболонок включають балонну дегенерацію кератиноцитів та утворення багатоядерних гігантських клітин. Такі морфологічні знахідки непатогномонічні і можуть спостерігатися при інших інфекційних ураженнях. Згодом відбувається поширення вірусів по нервових шляхах до чутливих нейронів (для HSV-1 найчастіше — трійчастий ганглій, HSV-2 — ганглії спінальних нервів S2–S5), де вони залишаються впродовж усього життя господаря у прихованій формі (латенція). За певних сприятливих умов в подальшому може відбуватися реактивація герпетичної інфекції [8]. Характер перебігу герпесвірусних інфекцій, частота і тяжкість рецидивів значною мірою визначаються станом імунної системи. Формування адекватної імунної відповіді на антигени герпесвірусів залежить від генетично детермінованих особливостей реагування дитини, ступеня фізіологічної зрілості її загального й місцевого імунітету й імунної відповіді в цілому, вираженості транзиторного імунодефіциту на тлі рекурентних респіраторних захворювань, дитячих інфекцій, вакцинацій, які передували гострій формі захворювання.
Реактивація ВПГ звичайно асоціюється з дією зовнішніх чинників, таких як фізична травма, сонячний опік, місцеве переохолодження, запальні процеси тощо. Майже у 70 % інфікованих HSV-1 реактивація інфекції відбувається субклінічно [9]. Серед клінічно виражених форм частіше зустрічається герпес губ (Herpes labialis), герпетичний панарицій (Herpetic whitlow), герпес гладіаторів (Herpes gladiatorum), герпетична екзема [1, 10].
Герпес губ є найпоширенішим проявом рецидивуючої інфекції HSV-1. Захворювання характеризується розвитком еритематозних папул, які швидко розвиваються в дрібні, тонкостінні, інтраепідермальні везикули та згодом перетворюються на пустульозні та виразкові елементи. Частота рецидивів частіше становить 1–2 епізоди на рік, проте в окремих осіб можуть спостерігатись і щомісячні рецидиви.
Герпетичний панарицій може виникати після інокуляції вірусу безпосередньо в пошкоджену ділянку шкіри при потраплянні на неї біологічних рідин, що містять ВПГ. Герпетичний панарицій розвивається як первинна інфекція через 2–20 днів після інфікування. При цьому в ураженій ділянці з’являється відчуття печіння та болю. Після цього проявляється набряк та почервоніння. У місці ураження утворюються пухирі з прозорим або каламутним умістом. Це може бути лише один пухир, а може виникнути група. Як правило, вони невеликі й дуже болючі на дотик. Протягом наступних декількох тижнів пухирі розриваються та загоюються. Захворювання може супроводжуватися лихоманкою та регіонарною лімфаденопатією. Після первинної інфекції захворювання може рецидивувати. При цьому повторне ураження, як правило, знову з’являється в тій же ділянці, що й первинна інфекція. Рецидиви зазвичай тривають трохи більше тижня. Під час рецидиву інфекції кількість пухирів, як правило, менша і вони менш болючі, ніж при первинній інфекції.
Герпес гладіаторів являє собою ураження вірусом ВПГ обличчя, рук, шиї і верхньої частина тулуба. Механізм зараження та місцеві прояви схожі з герпетичним панарицієм. Захворювання, як правило, спостерігається в борців та інших учасників контактних видів спорту.
Герпетична екзема є вторинною інфекцією ВПГ, це особлива форма інфекції, яка розвивається на тлі атопічного дерматиту або інших запальних захворювань шкіри. Герпетична екзема зазвичай з’являється на обличчі та шиї, проте може уражати й інші ділянки тіла. Захворювання звичайно розвивається протягом двох тижнів після першого контакту з вірусом простого герпесу. Місцеві прояви включають множинні дрібні везикульозні елементи червоного чи темного фіолетового кольору. Висипка частіше супроводжується відчуттям свербежу і/або болю. При розриві з пухирців може вивільнятися гноєподібне виділення. Загальні симптоми можуть включати високу лихоманку, лімфаденопатію та загальне нездужання. Захворювання асоціюється з високим ризиком інвазивної вторинної інфекції та смертності.
Ураження вірусом HSV-1 очей призводить до очної форми інфекції й може зустрічатись як у дитячому віці, так і в дорослих. Первинна очна форма інфекції звичайно представлена кератокон’юнктивітом, одностороннім або двостороннім. Ураження очей може супроводжуватися сльозотечою, набряком повік, світлобоязню, набряком кон’юнктиви й преаурикулярною лімфаденопатією. Досить часто захворювання рецидивує. Зазвичай у цих випадках процес односторонній. При розвитку кератиту або розгалуженої дендритної виразки рогівки захворювання може призводити до сліпоти.
Характерною для ВПГ формою ураження центральної нервової системи є енцефаліт. Це тяжка і, як правило, смертельна інфекція, якщо відсутнє належне лікування. Летальність пацієнтів із герпетичним енцефалітом без відповідного лікування становить понад 70 %. Вірус частіше уражає скроневу частку мозку, клінічна картина характеризується змінами поведінки, психічними розладами та вогнищевими неврологічними симптомами. Серед інших неспецифічних проявів — лихоманка й загальне нездужання.
Класична клінічна картина першого епізоду симптомів первинної генітальної інфекції ВПГ характеризується двосторонніми групами червоних папул, везикул або виразок на зовнішніх статевих органах, в періанальній ділянці або на сідницях. Захворювання, як правило, починається через 4–7 днів після інфікування. Механізм передачі звичайно контактний, статевий. Класична клінічна картина розвивається лише у 10–25 % випадків первинних інфекцій. Окрім болю та свербежу в ділянці геніталій можуть також спостерігатись дизуричні розлади. Характерною є також поява загальних симптомів, таких як лихоманка, головний біль, міалгії та нездужання. Первинні інфекції часто супроводжуються цервіцитом і незначною паховою і стегновою лімфаденопатією. Нові підсипання та еволюція елементів висипки продовжуються протягом 2–3 тижнів. На слизових оболонках ураження від початку може бути виразковим, без попереднього утворення везикул. Атипові форми HSV-2-інфекції можуть включати невеликі ерозії і тріщини, а також дизурію або уретрит без характерного везикульозного ураження. Більшість людей відмічають один або більше симптоматичний рецидив протягом року після першого епізоду інфекції HSV-2. Якщо генітальна інфекція пов’язана з HSV-1, симптоматичні епізоди розвиваються значно рідше. Рецидиви захворювання звичайно супроводжуються менш серйозною клінічною симптоматикою, ніж первинна інфекція. Рецидивам часто передують продромальні симптоми: поколювання, парестезії та біль. Місцеві ураження характеризуються меншою інтенсивністю проявів, ніж перший епізод, часто можуть бути односторонніми і не супроводжуватись загальними симптомами. Під час рецидивів біль менш виражений, а виразки загоюються через 5–10 днів, навіть без застосування противірусної терапії. Пацієнти з ослабленим імунітетом, у тому числі з ВІЛ, зазвичай мають більш часті рецидиви з більш тяжкими симптомами. Часті рецидиви створюють у пацієнтів суттєвий психічний та фізичний дискомфорт.
Рідкісною формою захворювання, асоційованою з хронічною HSV-2-інфекцією, є доброякісний рецидивуючий менінгіт Молларе. Він характеризується повторними епізодами асептичного менінгіту зі спонтанним одужанням. Періоди загострення супроводжуються сильним головним болем, лихоманкою, позитивними менінгеальними симптомами, моноцитарним, нейтрофільним чи лімфоцитарним плеоцитозом у лікворі. Близько половини хворих має транзиторні неврологічні порушення у вигляді судом, порушення свідомості, диплопії, галюцинацій, паралічів черепно-мозкових нервів. Безсимптомні періоди ремісії тривають від декількох тижнів до декількох місяців (років). Зазвичай клінічно захворювання проявляється протягом 3–5 років, але в поодиноких випадках цей період може тривати понад 21 рік. У переважної більшості хворих реєструється від 3 до 10 періодів загострень.
Діагностика захворювання базується на виявленні типових клінічних проявів та може уточнюватися за допомогою додаткових специфічних досліджень, що включають ізоляцію HSV у культурі клітин та виявлення ДНК HSV методом полімеразної ланцюгової реакції. Матеріалом для дослідження може служити рідина з везикул, мазок із шийки матки, виділення з піхви, кров, спинномозкова рідина. Крім того, ідентифікація збудника може проводитися за допомогою серологічного дослідження, що базується на виявленні специфічних антитіл проти HSV, що з’являються у крові протягом декількох тижнів після інфікування.
Специфічна терапія герпетичної інфекції базується на призначенні противірусних засобів. Галогеновані нуклеозидні аналоги, такі як йододеоксіуридин і трифлуридин, були першими антивірусними препаратами, розробленими для лікування ВПГ. Механізм дії цих антивірусних препаратів полягає у включенні їх трифосфорильованих форм і блокуванні формування ланцюга вірусної ДНК із наступним інгібуванням реплікації вірусу. Ці препарати мають неселективну дію і порушують також синтез клітинної ДНК, що позначається на їх високій токсичності, особливо при системному застосуванні. Серйозним проривом у терапії ВПГ-інфекції було створення нуклеозидних аналогів, що мають селективний механізм дії. Першим таким препаратом був ацикловір. Пізніше розроблений пенцикловір з аналогічним механізмом дії. Надалі були створені препарати валацикловір і фамцикловір [11]. Ці препарати в процесі метаболізму в організмі людини перетворюються на ацикловір і пенцикловір відповідно, проте, на відміну від своїх активних метаболітів, мають кращу біодоступність при ентеральному прийомі. Так, наприклад, біодоступність валацикловіру коливається приблизно в межах 42–64 %, а ацикловіру — лише на рівні 10–20 % [12]. Ще один засіб — відарабін є аналогом аденозинового нуклеозиду, що також впливає на інгібування синтезу вірусної ДНК. До недоліків даного засобу відноситься низька розчинність, що вимагає великих об’ємів інфузії, та дуже швидкий метаболізм з утворенням гіпоксантину арабінозиду, який має низьку противірусну активність. Фосфоноформат, або фоскарнет, є структурним аналогом пірофосфату і використовувався при ацикловір-резистентних інфекціях. Він зв’язується з вірусною ДНК-полімеразою на ділянці пірофосфату, інгібуючи неконкурентне зв’язування нуклеозидів. Препарат має низьку біодоступність і погану переносимість при ентеральному введенні, тому його слід вводити внутрішньовенно. Іншим протигерпетичним засобом є цидофовір. Він являє собою фосфонатний аналог цитидину й був першим аналогом нуклеотидів, дозволеним для клінічного застосування. Для його активації клітинна кіназа послідовно приєднує дві додаткові фосфатні групи, перетворюючи цидофовір у його активну дифосфатну форму. Основною проблемою цього препарату є нефротоксичність, що вимагає обережності при його застосуванні [11].
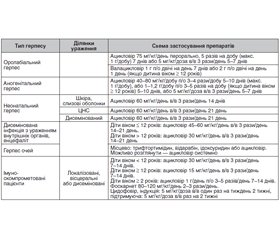
Вибір лікарського засобу, доза та шлях введення залежать як від характеристик препарату, так і від тяжкості клінічних проявів та преморбідного стану пацієнта. У табл. 1 наведені схеми лікування різних форм активної герпетичної інфекції в дітей.
/18.jpg)
З огляду на схильність герпетичних інфекцій до рецидивуючого перебігу в клінічній практиці часто постає питання профілактики та зменшення частоти рецидивів [14]. Серед неспецифічних заходів для цього рекомендується, за можливості, зменшити вплив провокуючих факторів, що сприяють розвитку рецидиву (захист від сонячних променів, санація вогнищ інфекції тощо). З іншого боку, можливе й застосування специфічної терапії для профілактики загострень інфекції. Це відбувається за двома основними напрямками: лікування гострого періоду та застосування супресивних доз противірусних засобів протягом тривалого часу [15]. Проте на даний час рекомендації щодо курсів супресивної терапії протигерпетичними препаратами розроблені переважно для пацієнтів дорослого віку. Серед педіатричних існує, зокрема, рекомендація щодо рецидивів інфекції при неонатальному герпесі. У таких випадках можна застосовувати ацикловір 80 мг/кг/день п/о 4 рази/день впродовж 7 днів при першому рецидиві, а потім продовжити прийом 300 мг/м2/доза п/о тричі на день впродовж 6 місяців [13].
Тривалий прийом нуклеозидних аналогів із протирецидивною метою загрожує розвитком резистентності вірусів до цієї групи терапевтичних засобів [16]. Тому постійно ведуться пошуки застосування альтернативних схем профілактичного лікування герпетичної інфекції.
На даний час вважається, що перебування герпесвірусів в організмі людини в стані латенції забезпечується балансом між вірусною активністю та напруженістю сил імунного контролю. Відомо, що пригнічення імунітету, особливо у випадках супресії імунної функції Т-клітин, асоціюється з підвищенням ризику реактивації герпетичної інфекції. Зокрема, це простежується в осіб, які страждають від вродженого або набутого імунодефіциту, у випадках лікування імунодепресантами, під час впливу фізичного або психологічного стресу, зниження функцій організму, пов’язаних зі старінням [17]. Тому особливий інтерес прикутий до препаратів, які поєднують противірусну та імуномодулюючу активність [14]. До таких засобів, зокрема, відноситься препарат інозину пранобекс. Препарат є синтетичним похідним пурину з імуномодулюючими і противірусними властивостями. На фармацевтичному ринку України на даний час інозину пранобекс представлений препаратом Новірин виробництва Київського вітамінного заводу. Препарат випускається у вигляді таблеток, які містять 500 мг інозину пранобексу, та у вигляді сиропу, в 1 мл якого міститься 50 мг інозину пранобексу.
Інозину пранобекс нормалізує клітинний імунітет, стимулюючи диференціювання Т-лімфоцитів у Т-цитотоксичні клітини і Т-хелпери і збільшуючи утворення лімфокінів. Інозину пранобекс також посилює функцію NK-клітин (природні кілери) та гуморальну імунну відповідь, стимулюючи диференціювання В-лімфоцитів у плазматичні клітини й підвищуючи продукцію антитіл [18]. У дослідженнях in vitro препарат посилював секрецію фактора некрозу пухлини альфа та гамма-інтерферону, а також мав дозозалежний вплив на пригнічення продукції інтерлейкіну-10 [18]. За даними клінічних досліджень, інозину пранобекс показав свою ефективність для лікування й профілактики різних гострих і хронічних вірусних інфекцій, зокрема при герпетичній інфекції. Препарат значно полегшує перебіг герпетичного процесу, а також відновлює імунологічні порушення, спричинені захворюванням. Крім того, інозину пранобекс здатний потенціювати противірусну дію інших противірусних препаратів. Його застосування дозволяє полегшити перебіг захворювання й запобігти виникненню вторинних бактеріальних ускладнень [19]. Інозину пранобекс у дітей звичайно призначається в дозі 50 мг/кг (тобто 1 мл сиропу Новірин на 1 кілограм ваги пацієнта) за 3–4 прийоми протягом 10–14 днів, до зникнення симптомів захворювання.
За результатами великого багатоцентрового рандомізованого дослідження, інозину пранобекс показав однакову з ацикловіром ефективність у лікуванні загострень орального та генітального герпесу. Крім того, на тлі прийому інозину пранобексу порівняно з оральним ацикловіром вірогідно зменшувалася частота рецидивів захворювання [20]. В іншому дослідженні у 76 дорослих пацієнтів із генітальним герпесом лікування інозину пранобексом супроводжувалося зменшенням тривалості рецидиву в групі хворих. Уже на 4–5-й день лікування у хворих зникали основні симптоми захворювання (у групі контролю — 7–9 днів). Протирецидивні курси інозину пранобексу сприяли зменшенню не тільки тривалості рецидивів, а й частоти. В імунологічному статусі пацієнтів, які отримували інозину пранобекс, дослідники спостерігали кращу динаміку відновлення кількості зрілих Т-лімфоцитів, CD4+-клітин, відсотка фагоцитуючих клітин та їх поглинальної здатності [19].
Висновки
Хронічний рецидивуючий перебіг герпетичної інфекції являє собою поширену та складну медичну проблему, що потребує удосконалення терапевтичної тактики. Застосування інозину пранобексу в комплексній терапії хворих із рецидивуючим герпесом дозволяє покращити клінічний перебіг захворювання під час загострення та запобігає рецидивам.
Конфлікт інтересів. Не заявлений.
Список литературы
1. Oliver S., James S.H. Herpes Viruses. Ref. Modul. Biomed. Sci. January 2016. doi: 10.1016/B978-0-12-801238-3.98786-5.
2. Cohen J.I. Human Herpesvirus Types 6 and 7 (Exanthem Subitum). Mand Douglas, Bennett’s Princ. Pract. Infect Dis. January 2015. Р. 1772-1776.e1. doi: 10.1016/B978-1-4557-4801-3.00142-9.
3. Parra M., Alcala A., Amoros C. et al. Encephalitis associated with human herpesvirus-7 infection in an immunocompetent adult. Virol J. 2017. 14(1). 97. doi: 10.1186/s12985-017-0764-y.
4. Hupp J.R., Ferneini E.M., Barakat L.A., Malinis M. Nonbacterial Microbiology of the Head, Neck, and Orofacial Region. Head, Neck, Orofac Infect. January 2016. Р. 38-59. doi: 10.1016/B978-0-323-28945-0.00003-X.
5. Looker K.J., Magaret A.S., May M.T. et al. Global and Regional Estimates of Prevalent and Incident Herpes Simplex Virus Type 1 Infections in 2012. PLoS One. 2015. 10(10). doi: 10.1371/JOURNAL.PONE.0140765.
6. Looker K.J., Magaret A.S., Turner K.M.E., Vickerman P., Gottlieb S.L., Newman L.M. Global estimates of prevalent and incident herpes simplex virus type 2 infections in 2012. PLoS One. 2015. 10(1). Р. e114989. doi:10.1371/journal.pone.0114989.
7. Looker K.J., Magaret A.S., May M.T. et al. First estimates of the global and regional incidence of neonatal herpes infection. Lancet Glob Heal. 2017. 5(3). Р. e300-e309. doi: 10.1016/S2214-109X(16)30362-X.
8. Beketova G., Savichuk N. Human viromе and its role in the formation of diseases. Herpes infection in children: current approaches to therapy. Педиатрия. Восточная Европа. 2016. № 4(1). С. 47-62.
9. Miller C.S., Danaher R.J. Asymptomatic shedding of herpes simplex virus (HSV) in the oral cavity. Oral Surgery, Oral Med. Oral Pathol. Oral Radiol. Endodontology. 2008. 105(1). Р. 43-50. doi: 10.1016/j.tripleo.2007.06.011.
10. Saleh D., Sharma S. Herpes Simplex Type 1. Stat. Pearls Publishing; 2019. http://www.ncbi.nlm.nih.gov/pubmed/ 29489260. Accessed April 23, 2019.
11. Rechenchoski D.Z., Faccin-Galhardi L.C., Linhares R.E.C., Nozawa C. Herpesvirus: an underestimated virus. Folia Microbiol. (Praha). 2017. 62(2). 151-156. doi: 10.1007/s12223-016-0482-7.
12. Taketomo C.K., Hodding J.H., Kraus D.M. Pediatric and Neonatal Dosage Handbook. 21st ed. Hudson, OH: Lexi-Comp, 2014.
13. James S., Whitley R. Treatment of Herpes Simplex Virus Infections in Pediatric Patients: Current Status and Future Needs. Clin. Pharmacol. Ther. 2010. 88(5). Р. 720. doi: 10.1038/CLPT.2010.192.
14. Крамарєв С.О., Савичук Н.О., Палатна Л.О. Сучасні підходи до протирецидивної терапії герпесу шкіри та слизової оболонки порожнини рота. Педіатрія, акушерство та гінекологія. 2000. № 3. С. 23-26.
15. Chi C.-C., Wang S.-H., Delamere F.M., Wojnarowska F., Peters M.C., Kanjirath P.P. Interventions for prevention of herpes simplex labialis (cold sores on the lips). Cochrane database Syst. Rev. 2015. 2015(8). CD010095. doi: 10.1002/14651858.CD010095.pub2.
16. FDA. Recurrent Herpes Labialis: Developing Drugs for Treatment and Prevention Guidance for Industry. 2016 (July).
17. Koyuncu O.O., MacGibeny M.A., Enquist L.W. Latent versus productive infection: the alpha herpesvirus switch. Future Virol. 2018. 13(6). Р. 431-443. doi: 10.2217/fvl-2018-0023.
18. Lasek W., Janyst M., Wolny R., Zapała Ł., Bocian K., Drela N. Immunomodulatory effects of inosine pranobex on cytokine production by human lymphocytes. Acta Pharm. 2015. 65(2). Р. 171-180. doi: 10.1515/acph-2015-0015.
19. Осипова Л.С., Сольський С.Я., Сольська Т.В. Генітальний герпес — погляд на проблему. Здоров`я киян. 2008. № 6. С. 1-3.
20. You Y., Wang L., Li Y. et al. Multicenter randomized study of inosine pranobex versus acyclovir in the treatment of recurrent herpes labialis and recurrent herpes genitalis in Chinese patients. J. Dermatol. 2015. 42(6). Р. 596-601. doi: 10.1111/1346-8138.12845.

/18.jpg)