Архив офтальмологии Украины Том 7, №2, 2019
Вернуться к номеру
Експериментальне обгрунтування застосування малих доз атропіну сульфату в стабілізації морфологічних структур склери та решітчастої пластинки
Авторы: Бездітко П.А., Гуліда А.О.
Харківський національний медичний університет МОЗ України, м. Харків, Україна
Рубрики: Офтальмология
Разделы: Клинические исследования
Версия для печати
Актуальність. Атропін застосовується для стабілізації міопії. Мета — вивчення морфологічних структур ока після застосування атропіну сульфату 0,5% у кролів. Матеріали та методи. Основній групі застосовували інстиляції атропіну 0,5% 1 раз на день. Групі контролю — ні. Після енуклеації провели морфологічне дослідження очей. Результати. Вірогідне збільшення товщини склери, решітчастої пластинки, світіння колагену I і III типів. Морфофункціонально сітківка без змін. Висновки. Атропін сульфат низьких концентрацій зміцнює решітчасту пластинку та склеру.
Актуальность. Атропин применяется для стабилизации миопии. Цель — изучение морфологических структур глаза после применения атропина сульфата 0,5% у кроликов. Материалы и методы. Основной группе применяли инстилляции атропина 0,5% 1 раз в день. Группе контроля — нет. После энуклеации провели морфологическое исследование глаз. Результаты. Достоверное увеличение толщины склеры, решетчатой пластинки, свечение коллагена I и III типов. Морфофункционально сетчатка без изменений. Выводы. Атропин сульфат низких концентраций укрепляет решетчатую пластинку и склеру.
Background. The prevalence of ophthalmopathology significantly affects the health of the population, causes a decrease in the capacity for work and significantly deteriorates the quality of life. Using atropine sulfate in low doses can stabilize myopia progression and myopic changes in the posterior pole of the eye. The purpose was to study the morphological structures of the eye after the application of low doses of atropine sulfate in experimental animals. Materials and methods. The study involved 19 Chinchilla rabbits (38 eyes). They were 5 months old and weighed 2.5 kg. Animals were observed for 6 months, after which they were withdrawn from the experiment. During the study, the atropine sulfate instillations were applied at a concentration of 0.5% once a day. The control group included 11 rabbits (22 eyes) of the same weight and age. Materials for morphological study were enucleated eyeballs of animals from all groups fixed in 10% formalin solution for 72 hours. In each group, 5–8 randomly selected fields of view were studied. Results. The data of morphological examination showed that in the region of the posterior pole of the eyeball in the study group animals compared to the control group, there was a thickening of the fibrous tunic of eyeball, the thickness of the sclera significantly increased, as well as the thickness of the lamina cribrosa and the wall of it pores, and a significant increase in the intensity of type I and III collagen glow. The morphofunctional state of the retina does not change. Conclusions. Using 0.5% solution of atropine sulfate helps to strength the fibrous membrane of the eye wall, sclera and lamina cribrosa and its pores, with no changes in the morphofunctional state of the receptor apparatus of the eye.
морфологічне дослідження; міопія; решітчаста пластинка; атропіну сульфат
морфологическое исследование; миопия; решетчатая пластинка; атропина сульфат
morphological examination; myopia; lamina cribrosa; atropine sulfate
Вступ
Поширеність офтальмологічної патології значно впливає на показники здоров’я населення, є причиною зниження працездатності і значно погіршує якість життя [1]. При цьому переважна більшість випадків аметропії припадає на міопію, що виникає у все більш ранньому віці. Розуміння патофізіологічних змін структур ока при міопії дає можливість комплексного лікування та профілактики міопії серед населення. Тому вивчення причин, методів лікування міопії і її ускладнень стає більш актуальним [2]. Найбільш призводить до інвалідизації прогресуюча міопія за рахунок ростягнення склери. Існує ймовірність, що решітчаста пластинка також підлягає змінам. Вона відіграє важливу роль у формуванні та функціонуванні очного апарата. Через решітчасту пластинку проходять нервові волокна та судини, які живлять зоровий нерв.
Раніше були проведені дослідження щодо структури, функціонування та змін решітчастої пластинки у хворих на глаукому [12]. Співвідношення гліального і сполучнотканинного компонентів решітчастої пластинки в різних індивідумів визначає напрямок й інтенсивність розвитку екскавації диска зорового нерва при хронічній глаукомі. З віком відзначається ряд структурних і біохімічних змін решітчастої пластинки, що, на думку авторів, сприяє розвитку ураження зорового нерва при глаукомі. На жаль, такі дослідження з приводу міопії є поодинокими в світовій офтальмології [13].
У світовій науковій літературі з’явилися роботи із застосування малих доз атропіну сульфату з метою стабілізації змін склери під час прогресування міопії. Але робіт з експериментальним обґрунтуванням стабілізаційної дії малих доз атропіну сульфату мало, а щодо решітчастої пластинки — зовсім немає.
Мета роботи: вивчити морфологічні структури ока після застосування малих доз атропіну сульфату на експериментальних тваринах.
Матеріали та методи
Під час експерименту було вивчено 19 тварин (38 очей). До експерименту були залучені кролі породи шиншила віком 5 місяців, вагою 2,5 кг. Тварини спостерігались упродовж 6 місяців, після чого були виведені з експерименту. Під час експерименту тваринам були застосовані інстиляції атропіну в концентрації 0,5% 1 раз на добу. Група контролю представлена 11 зіставними за масою та віком кролями (22 ока).
Експеримент було проведено в стандартних умовах на базі Харківського національного медичного університету. Всі експериментальні дослідження проведені з дотриманням принципів біоетики, викладених у Гельсінській декларації та Законі України «Про захист тварин від жорстокого поводження» (№ 1759-VI від 15.12.2009 р.), та з урахуванням рекомендацій В.Д. Мішалова і співавторів (2007) щодо проведення наукових морфологічних досліджень [3]. Утримання тварин здійснювалося згідно з міжнародними нормами (GLP).
Матеріалом для морфологічного дослідження послужили енуклейовані очні яблука тварин зі всіх груп, фіксовані в 10% розчині формаліну протягом 72 годин. Після фіксації проведено січіння передньозаднього сегмента очного яблука, що проходив через зіницю і зоровий нерв. Матеріал піддавали спиртовій проводці і заливці парафіном, виготовляли зрізи товщиною 5–6 мкм. Зрізи, що проходили через центральну частину оптичного диска, фарбували гематоксиліном й еозином для загальної оцінки стану досліджуваних тканин.
Гістологічні та гістохімічні методики виконувалися за прописами, викладеними в інструкціях із гістологічної техніки та гістохімії [4, 5].
У кожному препараті вивчалося 5–8 випадково обраних полів зору.
Цифрові дані морфометричного і цитофотометричного досліджень обробляли методами математичної статистики з використанням варіаційного аналізу. Дані були подані середнім арифметичним та стандартним відхиленням (M ± SD). Відмінність між двома незалежними малими вибірками визначали за допомогою U-критерію Манна — Уїтні. При визначенні ступеня вірогідності допускали точність р < 0,05, що, як відомо, відповідає р > 95,0 % [2]. Вивчення препаратів, забарвлених гістологічними і гістохімічними методами, а також морфометричне і цитофотометричне дослідження проводилися на мікроскопі Olympus BX-41 з використанням програм Olympus DP-Soft (Version 3: 1) і Microsoft Excel [6].
Результати
При мікроскопічному дослідженні в ділянці заднього полюса ока у зорового диска вивчалися такі структури, як склера, хоріоідея і сітківка.
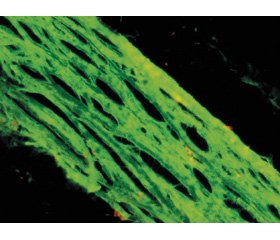
В 50 % випадків основної групи основна речовина була вогнищево набрякла. Товщина склери в ділянці заднього полюса становила 191,64 ± 10,09 мкм і вірогідно перевищувала відповідний показник у групі контролю (р < 0,05). Біля краю зорового диска склера ділиться на зовнішній більш товстий шар, який входить у тверду мозкову оболонку. Внутрішній тонкий шар формує решітчасту пластинку, через пори якої нервові волокна сітківки вступають у зоровий нерв (рис. 1). Товщина решітчастої пластинки в середньому становила 43,30 ± 6,45 мкм, товщина стінок вікон (пір) решітчастої пластинки — 8,88 ± 1,23 мкм, що вірогідно вище відповідних показників контрольної групи — 36,77 ± 4,35 мкм та 5,57 ± 1,33 мкм відповідно (р < 0,05).
При імуногістохімічному дослідженні розподілу колагенів у склері і решітчастій пластині колаген I типу визначався у вигляді безперервного лінійного світіння з локусами посилення інтенсивності, значення якої в середньому по групі становило 1,015 ± 0,012 ум.од.св. і вірогідно перевищує відповідний показник у групі контролю — 0,9360 ± 0,0178 ум.од.св. (р < 0,05) (рис. 2). На відміну від контрольної групи в досліджуваних спостереженнях відзначався більш поширений характер розташування колагену III типу — вогнища світіння численні, місцями зливалися між собою, і світіння набувало переривчастого лінійного характеру (рис. 3, 4). Інтенсивність світіння в середньому по групі становила 1,005 ± 0,011 ум.од.св. і вірогідно перевищувала відповідний показник у групі контро–лю — 0,850 ± 0,053 ум.од.св. відповідно (р < 0,05).
Під час дослідження в першій групі пухкої волокнистої сполучної тканини надсудинні пластинки хоріоідеї визначалися як тонкі помірно фуксинофільні колагенові волокна, еластичні волокна, фібробласти і меланоцити з включеннями меланіну. Артерії і вени судинної пластинки були з добре помітним просвітом, помірно повнокровні, оточені дещо набряклою пухкою волокнистою сполучною тканиною (рис. 1). Капіляри хоріокапілярної пластинки з розширеним просвітом, повнокровні, в частині капілярів відзначалося набухання ендотеліоцитів, між капілярами зустрічалися функціонально активні фібробласти з округлим помірно базофільним ядром. Мембрана Бруха виглядала дещо потовщеною. На краю диска зорового нерва судинна оболонка переривалася.
Однорядний призматичний епітелій пігментного шару сітківки був розташований на тонкій базальній мембрані, що межує з мембраною Бруха. Епітеліоцити були гексагональної форми, містили гранули меланіну. Товщина шару становила 5,06 ± 0,49 мкм і вірогідно не відрізнялася від такої в групі конт–ролю — 5,28 ± 0,71 км (р > 0,05). В шарі паличок і колбочок подовженої форми відростки світлочутливих фоторецепторів щільно прилягали один до одного, їх вільні кінці дещо вдалися в пігментний шар. Товщина шару становила 19,18 ± 2,87 мкм і вірогідно не відрізнялася від відповідного показника в групі конт–ролю — 20,80 ± 0,82 мкм (р > 0,05). Тонка зовнішня прикордонна мембрана була помірно еозино–фільна. У зовнішньому ядерному шарі ядровмісні частини рецепторів тісно прилягали один до одного, розташовуючись у 4–5 рядів. Ядра були округлої форми, базофільні. Товщина шару становила 21,40 ± 0,79 мкм і вірогідно не змінювалася порівняно з показником групи контролю — 21,02 ± 1,36 мкм. Зовнішній і внутрішній сітчастий шари визначалися у вигляді мілкопетльованої слабоеозинофільної мережі. Товщина шарів становила відповідно 8,22 ± 1,15 мкм і 12,97 ± 0,94 мкм, вірогідно не відрізнялася від значень аналогічних показників у групі контролю — 8,57 ± 0,82 мкм та 10,40 ± 0,72 мкм відповідно (р > 0,05). У внутрішньому ядерному шарі визначали 2–3 ряди ядровмісних частин біполярних і горизонтальних нейронів, мюлерових клітин сітківки. Деякі тіла нейронів були з ознаками перинуклеарного набряку. Товщина шару становила 10,70 ± 1,40 мкм і вірогідно не відрізнялася від показника контрольної групи — 13,03 ± 0,98 мкм (р > 0,05). У гангліонарному шарі розташовувалися великі гангліозні клітини, ядра їх округлі, добре сприймали основні барвники, цитоплазма помірно еозинофільна. Гліальні клітини були нечисленні, судини тонкостінні, помірного кровонаповнення. Товщина шару становила 19,21 ± 1,52 мкм, вірогідно не змінювалася порівняно з групою контролю — 19,06 ± 2,63 мкм (р > 0,05). В середньому по групі товщина I–VIII шарів сітківки становила 96,51 ± 6,50 мкм, вірогідно не відрізняючись від відповідного показника в групі контролю — 98,11 ± 1,55 мкм (р > 0,05). Шар нервових волокон був сформований аксонами гангліоцитів, між якими зустрічалися окремі клітини астроглії і кровоносні судини (рис. 5). Товщина шару наростала в напрямку до диска зорового нерва, у края якого нервові волокна повертали під прямим кутом і через пори решітчастої пластинки входили до складу зорового нерва. Замикав десятий шар, представлений тонкою внутрішньою прикордонною мембраною.
Обговорення
Отримані при морфологічному дослідженні дані свідчать про те, що в ділянці заднього полюса ока в тварин досліджуваної групи порівняно з контрольною групою спостерігається потовщення фіброзної оболонки за рахунок як потовщення пучків колагенових волокон, так і накопичення основної речовини, що, ймовірно, обумовлено активацією фібробластів під дією атропіну. Паралельно спостерігається потовщення решітчастої пластинки і стінки її пір.
При імуногістохімічному розподілі в склері і решітчастій пластинці колагенів відзначалося наростання інтенсивності світіння зрілого колагену I типу, що пов’язано з посиленням дозрівання молодого колагену III типу, інтенсивність світіння якого посилювалася, а характер розташування мав більш поширений характер порівняно з групою контролю.
Отримані дані підтверджуються морфометрично — порівняно з групою контролю вірогідно збільшувалася товщина склери, показники товщини решітчастої пластинки і стінки її пір, вірогідно наростають значення інтенсивності світіння колагену I і III типів. Морфофункціональний стан сітківки не змінювався, що підтверджується результатами мікроскопічного дослідження і даними морфометричних показників, значення яких вірогідно не відрізнялися від таких у групі порівняння. У судинному шарі відзначалися дисциркуляторні зміни у вигляді помірної гіперемії судин і слабовираженого набряку пухкої волокнистої тканини, зв’язані з впливом атропіну сульфату на судини [14].
Таким чином, використання 0,5% розчину атропіну сульфату сприяє зміцненню фіброзної оболонки і решітчастої пластинки стінки ока, при цьому морфофункціональний стан сітківки не змінюється.
Висновки
1. В ділянці заднього полюса ока в експериментальних тварин після застосування малих доз атропіну сульфату виявлено потовщення фіброзної оболонки за рахунок як потовщення пучків колагенових волокон, так і накопичення основної речовини.
2. В експериментальних тварин групи дослідження спостерігається потовщення структури решітчастої пластинки її стінки та пір за рахунок потовщення волокон колагену.
3. При імуногістохімічному розподілі в склері і решітчастій пластинці колагенів відзначалося наростання інтенсивності світіння зрілого колагену I і III типів в основній групі після застосування атропіну сульфату 0,5%.
4. У досліджуваних тварин після інстиляцій атропіну сульфату 0,5% у судинному шарі відзначалися різко виражені дисциркуляторні зміни у вигляді помірної гіперемії судин і слабо вираженого набряку пухкої волокнистої тканини.
5. Під час експерименту після застосування малих доз атропіну сульфату морфофункціональний стан сітківки не змінювався.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
1. Евсеева А.А. Методы изучения качества жизни у офтальмологических больных / А.А. Евсеева, С.Л. Кузнецов // Практическая медицина. Офтальмология. — 2012 — Т. 2. — С. 14-19.
2. Тарутта Е.П. Возможности профилактики прогрессирующей и осложненной миопии в свете современных знаний о ее патогенезе / Е.П. Тарутта // Вестник офтальмологии. — 2006. — Т. 122, № 1. — С. 43-46.
3. Мішалов В.Д. Про правові, законодавчі та етичні норми і вимоги при виконанні наукових досліджень / В.Д. Мішалов, Ю.Б. Чайковський, І.В. Твердохліб // Морфологія. — 2007. — Т. 1, № 2. — С. 108-115.
4. Ліллі Р. Патогістологічна техніка і практична гістохімія / Ліллі Р. — М.: Світ, 1960. — 648 с .
5. Пірс Е. Гістохімія (теоретична і прикладна ) / Пірс Е. — М.: Иностранная литература, 1962. — 962 с.
6. Атраментова Л.А. Статистичні методи в біології / Л.А. Атраментова, О.М. Утевская. — Горлівка, 2008. — 247 с.
7. Курышева Н.И. Роль методов визуализации диска зрительного нерва и слоя нервных волокон сетчатки в ранней диагностике глаукомы / Н.И. Курышева // Глаукома. — 2007. — № 1. — С. 16-21.
8. Сергієнко В.І., Бондарева І.Б. Математична статистика в клінічних дослідженнях. — М.: Геотар Медицина, 2000. — 59 с.
9. Albona J., Purslowb P.P., Karwatowskic W.S.S., Eastyd D.L. Age related compliance of the lamina cribrosa in human eyes // Br. J. Ophthalmol. — 2000. — Vol. 84. — P. 318-323.
10. Эйди У.Р. Организация мозговых структур с точки зрения передачи и хранения информации / У.Р. Эйди // Современные проблемы электрофизиологии центральной нервной системы. — М., 1967. — С. 324-338.
11. Lee E.J., Kim T.W., Weinreb R.N., Park K.H., Kim S.H., Kim D.M. Visualization of the lamina cribrosa using enhanced depth imaging spectral-domain optical coherence tomography // Am. J. Ophthalmol. — 2011. — 152. — Р. 87-95.e1.
12. Roberts M.D., Grau V., Grimm J. et al. Remodeling of the connective tissue microarchitecture of the lamina cribrosa in early experimental glaucoma // Invest. Ophthalmol. Vis. Sci. — 2009. — 50. — Р. 681-690.
13. Kotecha А., Izadi S., Jeffery G. Age related changes in the thickness of the human lamina cribrosa // Br. J. Ophthalmol. — 2006 Dec. — 90(12). — Р. 1531-1534.
14. Кузнецов С.Г. Синтетические атропиноподобные вещества / С.Г. Кузнецов, С.Н. Голиков. — Л.: Медгиз, 1962. — 224 с.: ил. — Б. ц.

/13-1.jpg)
/14-1.jpg)
/14-2.jpg)