Международный эндокринологический журнал Том 15, №2, 2019
Вернуться к номеру
Рівень інсуліну та лептину у хворих на цукровий діабет 1-го та 2-го типу з діабетасоційованим остеоартритом
Авторы: Орленко В.Л. (1), Тронько М.Д. (1), Єлізарова О.Т. (2)
1 - ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМНУ», м. Київ, Україна
2 - ДУ «Інститут громадського здоров’я ім. О.М. Марзєєва НАМН України», м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Актуальність. Ураження суглобів у хворих на цукровий діабет належить до поширених ускладнень і пов’язане з виникненням дeгeнepативно-дистpофічних змін у навколосуглобових структурах. Метою нашої роботи було вивчити рівень гормонів інсуліну і лептину в пацієнтів із діабетичним остеоартритом і дослідити їх можливий вплив на розвиток цього ускладнення. Матеріали та методи. Обстежені 77 пацієнтів, які були розподілені на групи за типом цукрового діабету, наявністю та ступенем тяжкості діабетичної артропатії. Вміст інсуліну і лептину в сироватці крові визначали імуноферментним методом. Результати. Серед обстежених пацієнтів діабетична артропатія діагностована більше ніж у 70 % осіб. У пацієнтів із діабетичною артропатією вірогідно підвищені рівні інсуліну (при цукровому діабеті 1-го типу — на 38,5 %, при цукровому діабеті 2-го типу — на 55,6 %) і лептину (при цукровому діабеті 1-го типу — на 43,8 %, при цукровому діабеті 2-го типу — на 53,7 %). Спостерігається прямий кореляційний зв’язок між ступенем тяжкості ураження суглобів і рівнем інсуліну і лептину. Ступінь тяжкості артопатії в пацієнтів із цукровим діабетом 2-го типу прямо корелює з показниками інсулінорезистентності. Висновки. Шанси на виявлення артропатії при цукровому діабеті 1-го типу при підвищенні рівня інсуліну збільшуються в 3,8 раза, при підвищенні лептину — в 1,3 раза, у хворих на цукровий діабет 2-го типу — у 2,6 і у 1,2 раза відповідно. Для даної вибірки встановлено, что розвиток артропатії не залежить від типу цукрового діабету. У жінок із цукровим діабетом 2-го типу шанси розвитку артропатії вищі в 6,4 раза, ніж у чоловіків. Таким чином, підвищення рівня інсуліну і лептину може бути маркерами наявності і прогресування артропатії у хворих на цукровий діабет.
Актуальность. Поражение суставов у больных сахарным диабетом является распространенным осложнением и связано с возникновением дeгeнepативнодистpофичних изменений в околосуставных структурах. Целью нашей работы было изучить уровень гормонов инсулина и лептина у пациентов с диабетическим остеоартритом и исследовать их возможное влияние на развитие этого осложнения. Материалы и методы. Обследованы 77 пациентов, которые были разделены на группы по типу сахарного диабета, наличию и степени тяжести диабетической артропатии. Содержание инсулина и лептина в сыворотке крови определяли иммуноферментным методом. Результаты. Среди обследованных пациентов диабетическая артропатия диагностирована более чем у 70 % лиц. У пациентов с диабетической артропатией достоверно повышены уровни инсулина (при сахарном диабете 1го типа — на 38,5 %, при сахарном диабете 2го типа — на 55,6 %) и лептина (при сахарном диабете 1го типа — на 43,8 %, при сахарном диабете 2го типа — на 53,7 %). Наблюдается прямая корреляционная связь между степенью тяжести поражения суставов и уровнем инсулина и лептина. Степень тяжести артопатии у пациентов с сахарным диабетом 2го типа прямо коррелирует с показателями инсулинорезистентности. Выводы. Шансы на обнаружение артропатии при сахарном диабете 1го типа при повышении уровня инсулина увеличиваются в 3,8 раза, при повышении лептина — в 1,3 раза, у больных сахарным диабетом 2го типа — в 2,6 и в 1,2 раза соответственно. Для данной выборки установлено, что развитие артропатии не зависит от типа сахарного диабета. У женщин с сахарным диабетом 2го типа шансы развития артропатии выше в 6,4 раза, чем у мужчин. Таким образом, повышение уровня инсулина и лептина может быть маркерами наличия и прогрессирования артропатии у больных сахарным диабетом.
Background. Joint damage in patients with diabetes mellitus is a common complication and is associated with degenerative dystrophic changes in the periarticular structures. The purpose of our work was to study insulin and leptin hormone levels in patients with diabetic osteoarthritis and to investigate their possible influence on the development of this complication. Materials and methods. Seventyseven patients were examined, they were divided into groups by the type of diabetes mellitus, the presence and severity of diabetic arthropathy. The content of insulin and leptin in the blood serum was determined by enzymelinked immunosorbent assay. Results. Diabetic arthropathy was diagnosed in more than 70 % of patients. In persons with diabetic arthropathy, insulin levels were significantly elevated (for type 1 diabetes mellitus — by 38.5 %, for type 2 diabetes mellitus — by 55.6 %), as well as leptin content (for type 1 diabetes mellitus — by 43.8 %, for type 2 diabetes mellitus — by 53.7 %). There is a direct correlation between the severity of joint damage and the levels of insulin and leptin. The severity of arthropathy in patients with type 2 diabetes mellitus directly correlates with insulin resistance. Conclusions. Risk of developing arthropathy in type 1 diabetes mellitus with elevated insulin levels is increased by 3.8 times, with elevated leptin content — by 1.3 times, in patients with type 2 diabetes mellitus — by 2.6 and 1.2 times, respectively. For this sample, it was found that the development of arthropathy does not depend on the type of diabetes mellitus. In women with type 2 diabetes, the risk of developing arthropathy is 6.4time higher than in men. Thus, an increased insulin and leptin levels can be markers of the presence and progression of arthropathy in patients with diabetes mellitus.
цукровий діабет; діабетична артропатія; суглоби; хондроцити; інсулін; лептин
сахарный диабет; диабетическая артропатия; суставы; хондроциты; инсулин; лептин
diabetes mellitus; diabetic arthropathy; joints; chondrocytes; insulin; leptin
Вступ
Цукровий діабет (ЦД) сьогодні залишається однією з найважливіших медико–соціальних проблем у зв’язку з прогресуючим ростом захворюваності й інвалідизації хворих працездатного віку. Одним із тяжких, але маловивчених ускладнень ЦД є ураження кістково–суглобової системи. Діабетичні артропатії — це запальні або дегенеративно–дистрофічні зміни структурних елементів суглобів на тлі основного захворювання, що спочатку призводять до обмеження рухливості, а згодом — до розвитку контрактур. За даними різних авторів [1, 2], ураження суглобів у хворих на ЦД виявляють досить часто, але відомі лише фрагментарні дослідження з питань розвитку, клініки та діагностики діабетичних артропатій. Особливо багато питань стосується патогенезу цього ускладнення, адже розвиток діабетичних артропатій є складним і багатогранним процесом [3]. Лише дослідження останнього часу переконливо показали вплив інсуліну та інших гормонів (лептину, остеокальцину, адипонектину, остеопротегерину та ін.) на тлі підвищення прозапальних цитокінів на порушення структури та функції суглобів у хворих на ЦД. Останнім часом термін «діабетасоційований остеоартрит» все частіше можна зустріти в науковій літературі. І серед гормонів, що впливають на структури суглоба у хворих на ЦД, виділяють інсулін та лептин.
Сучасні дослідження доводять, що лептин є плейотропним гормоном, що бере участь у таких фізіологічних процесах, як репродуктивна функція, ангіогенез, у контролі ліпідного гомеостазу, секреції інсуліну в метаболізмі кістки [4]. Крім того, дані останніх років свідчать про виражений вплив лептину на хондроцити, що під його дією здатні виробляти прозапальні медіатори, пов’язані із запаленням, що може призводити до втрати структури хрящової тканини. Крім того, встановлено, що експресія лептину збільшується в остеоартритичних хондроцитах, а також у суглобах після екзогенного введення лептину [5].
Також продемонстровано, що рівні лептину були істотно підвищеними в значно ураженому хрящі при остеоартрозі (ОА) порівняно з мінімально зміненим хрящем. Лептин негативно впливав на проліферацію хондроцитів, викликав продукцію ІЛ–1β і експресію металопротеїнази–9 і –13 білків. Експресія мРНК лептину в значно ураженому хрящі корелювала з індексом маси тіла (ІМТ), і рівень лептину був істотно вищим у синовіальній рідині, ніж у сироватці крові. Як вважають автори, отримані дані підтверджують, що лептин залучений у патогенез ОА і впливає безпосередньо на метаболізм хряща як прозапальний цитокін із подальшим катаболічним впливом на хрящ [6]. Популяційне перехресно–групове (секційне) дослідження, проведене V.B. Kraus та співавт. (2007), показало, що СРБ корелює з ІМТ й асоційований із рентгенологічними стадіями ОА колінних і кульшових суглобів [7]. Установлено, що остеобласти та хондроцити здатні синтезувати і секретувати лептин та його рецептори [8].
Було доведено, що прямий вплив лептину на хондроцити реалізовується синергічно разом із інтерфероном–γ та інтерлейкіном–1β шляхом сприяння синтезу оксиду азоту [9], який індукує широкий спектр прозапальних цитокінів, є прозапальним медіатором у хрящах суглобів та сприяє активації металопротеїназ та апоптозу хондроцитів [10]. Вказується, що здатність підвищувати продукцію прозапальних цитокінів лептином реалізовується через активізацію NF–kВ [11]. Ці дані підтверджують думку, що лептин відіграє роль прозапального цитокіну з прямим впливом на імунозапальні реакції, і свідчать, що він може бути єднальною ланкою між ожирінням і запаленням, що пов’язане зі змінами хрящового гомеостазу. При надмірній продукції лептину сповільнюється синтез продуктів хрящового матриксу і розвивається деструкція хряща [12].
У клінічних дослідженнях показано, що вміст лептину залежав від терміну захворювання та ступеня ураження. Високі рівні лептину виявлено в хрящі й остеофітах осіб з OA, а лише поодинокі хондроцити продукували лептин у хрящах здорових осіб. Автори пояснюють цей феномен або різним рівнем експресії лептинових рецепторів залежно від стадії розвитку захворювання та ураження зразків хрящів, або кращим доступом до хондроцитів лептину через щілини або ураження екстрацелюлярного матриксу [13]. З іншого боку, хондроцити самі по собі можуть діяти через паракринний або автокринний шляхи, індукуючи синтез лептину [14].
Установлено, що лептин може бути залучений у регулювання анаболічної активності хондроцитів при OA, особливо на ранніх стадіях хвороби, що характеризується посиленням синтетичної діяльності хондроцитів [15]. Стимулюючий ефект лептину на синтез позаклітинного матриксу (колагену і протеогліканів) свідчить про безпосередній вплив лептину на формування хряща та підтверджує роль лептину в рості та розвитку скелета [16], або впливаючи через нейрональну сітку, або виділяючи невизначений остеогенний фактор, або безпосередньо стимулюючи проліферацію остеобластів, синтез колагену, мінералізацію кісток та ендохондральну осифікацію [17]. Роль лептину в патогенезі ОА підтримується гіперекспресією лептину в хрящі та його кореляцією зі ступенем руйнування хряща, синтез лептину остеофітами також пояснює високий рівень лептину в суглобах при ОА. Таким чином, лептин може мати подвійний вплив на суглоб: регулювати проліферацію хондроцитів і їх анаболічні функції і сприяти формуванню остеофітів при OA [18].
Метою нашого дослідження було вивчити рівень лептину та інсуліну (ІРІ) у хворих на ЦД 1–го та 2–го типу з артропатіями та встановити їх можливий вплив на розвиток патології суглобів у цієї категорії хворих.
Матеріали та методи
У дослідженні брали участь 77 пацієнтів (28 чоловіків та 49 жінок). Хворі були розподілені на дві групи залежно від типу ЦД. Так, з ЦД 1–го типу було 40 осіб (17 чоловіків та 23 жінки), з ЦД 2–го типу — 37 хворих (11 чоловіків та 26 жінок). Таким чином, у групі пацієнтів із ЦД 1–го типу виявлено рівномірний розподіл за статтю (t = 1,36; p > 0,1), а у групі пацієнтів із ЦД 2–го типу переважають жінки (t = 3,8; p < 0,001). Середнє значення віку пацієнтів та їх ІМТ очікувано значимо нижчі, ніж у групі пацієнтів із ЦД 2–го типу (p < 0,001). У даній вибірці середній ІМТ вищий у групі пацієнтів із ЦД 2–го типу, ніж у групі пацієнтів із ЦД 1–го типу, на 24,2 % (t = 10,5; p = 0,001). За тривалістю ЦД групи статистично не відрізнялись (p > 0,07). Відмінностей за вивченими показниками за статтю не виявлено (p > 0,2). Артропатія була діагностована в 59 (76,6 %) хворих, патологія суглобів не виявлена у 18 (23,4 % пацієнтів). Вміст глюкози в крові визначали глюкозооксидазним методом. Ступінь компенсації вуглеводного обміну обстежених пацієнтів оцінювали за рівнем глікованого гемоглобіну (HbA1c), який визначали калориметричним методом із тіобарбітуровою кислотою. Компенсацію ЦД реєстрували при рівні HbA1c до 7 %. У комплекс досліджень також входили традиційні клінічні тести (біохімічний аналіз крові, загальний аналіз крові, сечі, визначення добової протеїнурії, калію, кальцію загального й іонізованого, глікемічний профіль). Функція нирок оцінювалась за швидкістю клубочкової фільтрації (ШКФ) за формулою CKD–EPI. Наявність і ступінь вираженості діабетичної артропатії оцінювали за методикою A. Rosenbloom [19].
Вміст інсуліну та лептину в сироватці крові визначали імуноферментним методом (ELISA) із використанням наборів реагентів фірми Diaclone (Франція) та планшетного імуноферментного аналізатора Stat Fax 3200 (США). Наявність інсулінорезистентності встановлювали за рівнем ІРІ понад 20 мкОд/мл. Для оцінки чутливості до інсуліну розраховували індекс інсулінорезистентності НОМА–ІR (Homeostatic Model Assessment — оцінка гомеоста–тичної моделі) = [інсулін крові натще (мкОд/мл) × глюкоза крові натще (ммоль/л)] : 22,5, що діагностували при рівні НОМА 3 і більше.
Статистична обробка отриманих даних проводилася за допомогою методів варіаційної статистики стандартного пакета для статистичних підрахунків Statistica 5.0 Microsoft Office Exсel 2003. У роботі наведені статистичні показники середніх величин (що позначаються як M), а також середнє квадратичне відхилення (SD), стандартна помилка середньої величини (m). Для порівняння середніх абсолютних величин у різних досліджуваних групах застосовувався t–критерій Стьюдента. Різниця в отриманих результатах вважалась статистично вірогідною при величині показника р ≤ 0,05. Для аналізу даних також були використані кореляційний, дисперсійний однофакторний, множинний регресійний аналіз, а також дискримінантна статистика.
Результати
У групі пацієнтів із ЦД 1–го типу артропатія виявлена в 75,0 ± 6,8 % хворих, у групі пацієнтів із ЦД 2–го типу — у 73,4 ± 7,3 % (t = 0,35; p > 0,1). У табл. 1 наведений розподіл пацієнтів за типом ЦД, статтю та наявністю артропатії. При проведенні дисперсійного аналізу (використовувався класичний t-–test для непов’язаних вибірок) встановлено, що в жінок із ЦД 2–го типу шанси розвитку артропатії вищі в 6,4 раза, ніж у чоловіків (OR = 6,39; ДI = 1,18–34,62, p = 0,032). При ЦД 1–го типу шанси на розвиток артропатії в чоловіків та жінок виявилися рівними (OR = 1,5; ДI = 0,36–6,32, p = 0,581).
При порівнянні середніх значень клініко–лабораторних показників у групах пацієнтів із ЦД 1–го та 2–го типу виявилось, що в групі пацієнтів із ЦД 2–го типу рівень глюкози натще та рівень кальцію в крові вірогідно нижчі, ніж у групі пацієнтів із ЦД 1–го типу (табл. 2). Рівень інсуліну вищий у групі пацієнтів із ЦД 2–го типу. За іншими лабораторними показниками статистичних відмінностей не виявлено.
Проведення двофакторного дисперсійного аналізу з факторами «ЦД» та «стать» показало статистичні відмінності лише за показником «лептин» (табл. 3).
Проведення детального t–тесту за методом Уелша дозволило виявити, що ці відмінності є дійсними тільки для групи пацієнтів із ЦД 2–го типу. У жінок із ЦД 2–го типу середній рівень лептину вірогідно вищий, ніж у чоловіків (t = 2,4; р = 0,02), із відповідними рівнями 22,3 ± 6,4 та 40,7 ± 4,1 нг/мл (рис. 1).
За допомогою логіт–регресійного аналізу окремо для пацієнтів із ЦД 1–го та 2–го типу була встановлена залежність ризику розвитку артропатії від рівня інсуліну (рис. 2, 3). У табл. 4 наведені коефіцієнти створених моделей та відношення шансів розвитку артропатії. При розрахунку моделей був використаний квазіньютонівський метод аналізу.
Для групи пацієнтів із ЦД 1–го типу шанси розвитку артропатії підвищуються при підвищенні рівня інсуліну (ВШ 3,80; ДІ 1,38–10,45). Модель вірогідна (χ2 = 19,7; p < 0,001). Чутливість моделі становить 80,0 %, специфічність — 86,4 %. Тобто чим більша доза введеного екзогенного інсуліну, тим вищі шанси розвитку артропатії.
Отримана модель для групи пацієнтів із ЦД 2–го типу також свідчить про ризик розвитку артропатії при більш високих рівнях інсуліну (рис. 3) у 2,6 раза (ВШ 2,62; ДІ 1,05–6,53). Модель вірогідна (χ2 = 18,4; p < 0,001). Чутливість моделі становить 87,5 %, специфічність — 88,9 %. Це свідчить, що у хворих на ЦД 2–го типу зміни в суглобах виникають за умов компенсаторного підвищення інсуліну на тлі розвитку інсулінорезистентності.
Більш детальний аналіз виявленого взаємозв’язку проводили за допомогою дисперсійного аналізу та t–-тесту.
Установлені вірогідні (F = 2,9; p = 0,04) відмінності середнього рівня інсуліну залежно від стадії артропатії та типу цукрового діабету (рис. 4).
Для групи пацієнтів із ЦД 1–го типу вірогідні відмінності виявлені тільки для груп «відсутня артропатія»/«наявна артропатія» (t = 5,1; p < 0,001) із відповідними рівнями 5,5 ± 0,7 та 8,9 ± 0,3 мкОд/мл. За наявності артропатії відмінностей між значеннями рівня інсуліну при різних стадіях артропатії не визначено (F = 0,14; p = 0,87).
У групі пацієнтів із ЦД 2–го типу визначено зростання рівня інсуліну з підвищенням стадії артропатії (F = 9,9; p < 0,001). У пацієнтів із наявністю та відсутністю артропатії та ЦД 2–го типу середні значення показника «інсулін» становлять відповідно 14,3 ± 1,4 та 6,4 ± 0,3 (t = 5,4; p < 0,001). Більш детальний аналіз показав, що статистично вірогідних відмінностей середнього рівня інсуліну за відсутності першої стадії та її наявності артропатії не визначено (t = 0,05; p = 0,96). При другій стадії артропатії середній рівень інсуліну вищий у 1,7 раза, ніж при першій (t = 2,9; p = 0,015), а при третій — в 1,6 раза вищий, ніж при другій (t = 2,5; p = 0,022).
У 70,0 % (ЦД 1–го типу) та 72,4 % (ЦД 2–го типу) хворих з артропатією виявлено наявність інсулінорезистентності. Виявлено прямий кореляційний зв’язок інсулінорезистентності та наявності артропатії як при ЦД 1–го типу (r = 0,46; p < 0,001), так і при ЦД 2–го типу (r = 0,68; p < 0,001) (кореляція Спірмена).
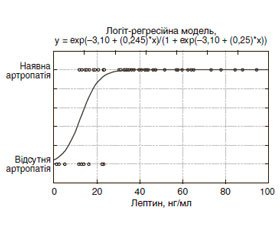
Розрахунок за допомогою логіт–регресійного аналізу (рис. 4) виявив підвищення ризику розвитку артропатії при підвищенні рівня лептину в пацієнтів із ЦД 1–го типу (ВШ = 1,27; ДІ 1,03–1,57). Модель вірогідна (χ2 = 16,6; p < 0,001), її чутливість становить 71,4 %, а специфічність — 100,0 %. У табл. 6 наведені характеристики отриманих моделей.
Обговорення
При аналізі середніх показників лептину спостерігаємо розподіл середніх значень даного гормона аналогічно розподілу інсуліну. Для пацієнтів із групи з ЦД 1–го типу виявлені відмінності тільки за наявності/відсутності артропатії (t = 2,4; p = 0,02), а середні значення лептину при різних стадіях артропатії у хворих на ЦД 1–го типу статистично не відрізняються (F = 0,25; p = 0,78).
У пацієнтів із ЦД 2–го типу спостерігається зростання середнього значення лептину із збільшенням стадії артропатії з вірогідними відмінностями між показниками пацієнтів із першою та другою стадією (t = 2,6; p = 0,03), із першою та третьою стадією (t = 3,1; p = 0,007). Вірогідних відмінностей показників у пацієнтів із відсутністю артропатії та першою стадією (t = 0,35; p = 0,73), а також із другою та третьою стадією (t = 0,62; p = 0,54) не визначено.
Для групи пацієнтів із ЦД 2–го типу також визначено вірогідний ризик розвитку артропатії при підвищенні рівня лептину (ВШ 1,17; ДІ 1,02–1,35) (рис. 6). Модель вірогідна (χ2 = 15,1; p < 0,001), специфічність її становить 61,5 %, чутливість — 94,6 %.
Вивчення відмінностей середніх значень лептину залежно від факторів «тип ЦД», «стать» та «стадія артропатії» за допомогою дисперсійного аналізу дало можливість визначити вірогідні відмінності за факторами «стать» (F = 3,3; p = 0,02) та «стадія артропатії» (F = 6,7; p = 0,01) окремо. Вірогідного підтвердження впливу усіх трьох факторів не визначено (F = 1,4; p = 0,25).
Установлено прямий кореляційний зв’язок між рівнями показників «лептин» та «інсулін» у групі пацієнтів із ЦД 2–го типу (r = 0,50; p = 0,002). У групі пацієнтів без артропатії коефіцієнт кореляції становить 0,70 (p = 0,050), а в групі з артропатією — 0,41 (p = 0,029).
Розрахунок за допомогою логіт–регресійного аналізу виявив підвищення ризику розвитку артропатії при підвищенні рівня лептину в пацієнтів із ЦД 1–го типу (ВШ 1,27; ДІ 1,03–1,57). Модель вірогідна (χ2 = 16,6; p < 0,001), її чутливість становить 71,4 %, а специфічність — 100,0 %. У табл. 6 наведені характеристики отриманих моделей.
Висновки
1. Серед обстежених пацієнтів артропатія діаг–ностована в 75,0 ± 6,8 % хворих на ЦД 1–го типу та в 73,4 ± 7,3 % хворих на ЦД 2–го типу (t = 0,35; p > 0,1). Для даної вибірки встановлено, що розвиток артропатії не залежить від типу цукрового діабету (p > 0,1).
2. При ЦД 1–го типу шанси на розвиток артропатії в чоловіків та жінок виявилися рівними. У жінок із ЦД 2–го типу шанси розвитку артропатії вищі в 6,4 раза, ніж у чоловіків (ВШ 6.39; ДI 1,18–34,62, р < 0,05).
3. Шанси виявлення артропатії підвищуються при підвищенні рівня інсуліну в 3,8 раза при ЦД 1–го типу та у 2,6 раза при ЦД 2–го типу (р < 0,001). За наявності артропатії в групі пацієнтів із ЦД 1–го типу рівень інсуліну вищий на 38,5 %, ніж за її відсутності (p < 0,001). Відповідний показник у групі пацієнтів із ЦД 2–го типу становить 55,6 % (p < 0,001). Виявлено прямий кореляційний зв’язок інсулінорезистентності та наявності артропатії при ЦД 2–го типу (r = 0,50; p < 0,01).
4. Шанси виявлення артропатії підвищуються при підвищенні рівня лептину в 1,3 раза при ЦД 1–го типу та в 1,2 раза при ЦД 2–го типу (р < 0,001). У пацієнтів із ЦД 1–го типу рівень лептину за наявності артропатії вищий на 43,8 %, ніж за її відсутності (t = 2,4; p < 0,05). Відповідний показник у групі пацієнтів із ЦД 2–го типу становить 53,7 % (p < 0,05).
5. У жінок із ЦД 2–го типу середній рівень лептину вірогідно вищий в 1,8 раза, ніж у чоловіків (t = 2,4; р < 0,05).
6. Установлено прямий кореляційний зв’язок між рівнями показників «лептин» та «інсулін» у групі пацієнтів із ЦД 2–го типу й артропатією (r = 0,41; p < 0,01). Установлено, що при ЦД обох типів разом із підвищенням стадії артропатії спостерігається перевищення рівня показників «інсулін» та «лептин» (p < 0,01).
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.

/82-1.jpg)
/83-1.jpg)
/83-2.jpg)
/83-3.jpg)
/84-1.jpg)
/86-1.jpg)
/85-1.jpg)