Журнал «Здоровье ребенка» Том 14, Додаток 1, 2019 Дитяча гастроентерологія та нутриціологія
Вернуться к номеру
Особливості ведення дітей із персистуючою діареєю й надмірним ростом Candida albicans
Авторы: Няньковський С.Л.(1), Няньковська О.С.(1), Пакулова-Троцька Ю.В.(1), Вівчарівська Г.З.(2), Шайдич В.Д.(2), Горайська О.М.(2), Заставна Л.В.(2), Томків З.В.(1)
(1) — Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
(2) — Комунальне некомерційне підприємство «Міська дитяча клінічна лікарня м. Львова», м. Львів, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Мета роботи: оцінити ефективність застосування препарату Мутафлор у дітей віком від 1 до 4 років із діагнозом функціональних гастроінтестинальних розладів у вигляді персистуючої діареї на фоні доведеного надмірного росту Candida albicans. Матеріали та методи. У дослідженні брали участь 32 дитини віком від 1 до 4 років з діагнозом функціональних гастроінтестинальних розладів у вигляді персистуючої діареї з доведеним надмірним ростом Candida albicans. Тривалість призначення пробіотичного препарату Мутафлор в дозі 1 мл суспензії один раз на добу становила 15 днів. Закінчили спостереження 30 дітей, дві дитини були виключені з аналізу результатів через порушення протоколу призначеної терапії. Результати. У всіх дітей перед початком роботи був визначений надмірний ріст Candida albicans. Після 15 днів лікування Candida albicans у випорожненнях реєструвалась у 12 дітей (40 %), із них в 11 дітей (36,7 %) вона була визначена в кількості 104 КУО, а в однієї дитини (3,3 %) — 103 КУО, що свідчить про достатню ефективність застосування штаму Escherichia coli Nissle 1917 при кандидозі кишечника. Висновки. Застосування препарату Мутафлор (пробіотичний штам Escherichia coli Nissle 1917) у дітей із персистуючою діареєю на фоні надмірного росту Candida albicans сприяє зменшенню діареї, кольок, здуття живота, блювання, епізодів крику/неспокою й поганого сну, сприяє нормалізації біоценозу кишечника.
Цель работы: оценить эффективность применения препарата Мутафлор у детей в возрасте от 1 до 4 лет с диагнозом функциональных гастроинтестинальных расстройств в виде персистирующей диареи на фоне доказанного чрезмерного роста Candida albicans. Материалы и методы. В исследовании принимали участие 32 ребенка в возрасте от 1 до 4 лет с диагнозом функциональных гастроинтестинальных расстройств в виде персистирующей диареи с доказанным чрезмерным ростом Candida albicans. Длительность назначения пробиотического препарата Мутафлор в дозе 1 мл суспензии один раз в сутки составляла 15 дней. Закончили наблюдение 30 детей, два ребенка были исключены из анализа результатов из-за нарушения протокола назначенной терапии. Результаты. У всех детей перед началом работы был определен чрезмерный рост Candida albicans. После 15 дней лечения Candida albicans в испражнениях регистрировалась у 12 детей (40 %), из них у 11 детей (36,7 %) — в количестве 104 КОЕ, а у одного ребенка (3,3 %) — 103 КОЕ, что свидетельствует о достаточной эффективности применения штамма Escherichia coli Nissle 1917 при кандидозе кишечника. Выводы. Применение препарата Мутафлор (пробиотический штамм Escherichia coli Nissle 1917) у детей с персистирующей диареей на фоне чрезмерного роста Candida albicans способствует уменьшению диареи, колик, вздутия живота, рвоты, эпизодов крика/беспокойства и плохого сна, способствует нормализации биоценоза кишечника.
Background: to evaluate the effectiveness of Mutaflor in children from 1 to 4 years of age with a diagnosis of functional gastrointestinal disorders in the form of persistent diarrhea against the background of proven overgrowth of Candida albicans. Materials and methods. The study involved 32 children aged 1 to 4 years with a diagnosis of functional gastrointestinal disorders in the form of persistent diarrhea with proven overgrowth of Candida albicans. Duration of administration of the probiotic agent Mutaflor at a dose of 1 ml of suspension once a day was 15 days. Thirty children completed the follow-up, two patients were excluded from the analysis of results due to non-adherence to treatment protocol. Results. All children had an overgrowth of Candida albicans at baseline. After 15 days of treatment, Candida albicans was detected in the stools of 12 children (40 %), in 11 of them (36.7 %), it was detected in the amount of 104 CFUs, and in one patients (3.3 %) — 103 CFUs indicating that the strain Escherichia coli Nissle 1917 was quite effective for intestinal candidiasis. Conclusions. The use of Mutaflor (Escherichia coli Nissle 1917 probiotic strain) in children with persistent diarrhea against the background of Candida albicans overgrowth contributes to the reduction of diarrhea, colic, abdominal distension, vomiting, episodes of crying/anxiety and poor sleep in children, normalizes intestinal biocenosis.
діти; функціональні розлади травної системи; діарея; Candida albicans
дети; функциональные расстройства пищеварительной системы; диарея; Candida albicans
children; functional gastrointestinal disorders; diarrhea; Candida albicans
Вступ
Оптимальний стан функціонування кишечника в дітей має надзвичайно важливе значення. Як нам відомо, кишечник впливає на загальний стан здоров’я, забезпечує перетравлення й засвоєння поживних речовин і рідин, що потрібно для нормального функціонування й розвитку дитячого організму. Однією з дуже важливих функцій кишечника є імунна функція. Здоровий кишечник, з яким контактує більше ніж половина імунних клітин, забезпечує захист організму від збудників інфекційних захворювань, сприяє індукції толерантності, що має істотне значення для профілактики розвитку алергії. За сучасними даними, кишечник містить 500 мільйонів нейронів (це більше, ніж у спинному мозку), у ньому ідентифіковано близько 40 нейротрансмітерів, він продукує 50 % допаміну, 95 % серотоніну, а метаболіти кишечника змінюють активність клітин гематоенцефалічного бар’єра. Мікробіота, яка домінує в кишечнику, індукує цитокіни в імунних клітинах, що впливає на гомеостаз людини й навіть на фізіологію мозку. На сьогодні вважають, що для оптимального функціонування організму й підтримки гомеостазу дуже важливим є системний зв’язок «кишечник — мозок», а процеси, які відбуваються в кишечнику, безпосередньо впливають на роботу центральної нервової системи [1, 2].
Окрім травлення й абсорбції кишечник виконує також і ряд інших важливих функцій. Одна з них — це бар’єрна функція. Так, бар’єр шлунково-кишкового тракту є більше ніж просто механічним бар’єром, він забезпечує зв’язок між мікробіотою кишечника й мозком, має опосередкований вплив на імунологічну, ендокринну й кишкову нервову системи, і саме ця взаємодія забезпечує зв’язок кишечника й мозку [3]. Тому нервову систему кишок іноді називають другим мозком [4]. На взаємодію «кишечник — мозок» опосередковано впливають різноманітні фактори, наприклад епітеліальні хемосенсори в просвіті кишечника, які приймають і передають сигнали про бактеріальні метаболіти, присутні в просвіті кишечника [5]. У зв’язку з тим, що кишечник дитини виконує настільки важливі й різноманітні функції, будь-які порушення його діяльності, такі як діарея, запор, кольки, порушення балансу мікробіоти кишок, можуть мати різноманітні негативні наслідки для організму дитини. Збільшується кількість даних, які свідчать про те, що оптимальний склад і функціонування мікробіоти кишечника є особливо важливим аспектом здоров’я кишечника за рахунок його ролі в засвоєнні поживних речовин, захисті від патогенних мікроорганізмів, розвитку імунної системи, забезпеченні гомеостазу, психологічного здоров’я й загального доброго самопочуття [6].
Зацікавлення впливом пробіотиків на організм людини стрімко зростає з року в рік, про що свідчить неухильне збільшення кількості досліджень згідно з даними пошуку в PubMed. Розвиток антибіотикорезистентності мікроорганізмів, формування нових патогенних штамів стимулюють пошук альтернативних ефективних методів підтримання гомеостазу мікробіоти в організмі людини. Одним із найбільш досліджуваних мікроорганізмів є непатогенний штам Escherichia coli Nissle 1917, що використовується в Європі як ліцензований пробіотичний препарат для лікування хронічних запальних, інфекційних і функціональних захворювань кишечника протягом майже 100 років [7].
Століття тому вчений Альфред Ніссле виділив цей штам із фекалій солдата, який під час першої світової війни не захворів на ентероколіт, перебуваючи на фронті в складі великої групи людей з кишковими інфекціями, які були у незадовільних побутових умовах, і цей штам кишкової палички було названо на честь цього вченого. Вчений дослідив, що цей штам має здатність пригнічувати ріст ентеропатогенів і їм можна ефективно лікувати діарею в різних пацієнтів [8–10]. Із того часу штам Escherichia сoli Nissle 1917 широко застосовується в клінічній практиці лікування діарей, при цьому спостерігається значний клінічний ефект як у дітей, так і в дорослих [11]. Дослідження, проведені на значній кількості пацієнтів згідно з принципами GCP, підтверджують ці дані [12–14]. Вивченню штаму Escherichia сoli Nissle 1917 присвячено 228 робіт у РubMed [15]. У ряді досліджень була проведена оцінка безпеки, переносимості й ефективності цього штаму, в тому числі в новонароджених і недоношених дітей [16–19].
Були проведені різнопланові дослідження механізмів дії й ефективності штаму Escherichia сoli Nissle 1917. 49 публікацій описували результати, отримані in vitro, 51 публікація містила результати досліджень, виконаних на тваринах (миші або щури), понад 30 досліджень були виконані на людях. Дані, отримані в дослідженнях на тваринах, є дуже цінними, але слід розуміти, що результати, отримані in vitro або на тваринах, не завжди можна екстраполювати на людей, оскільки вони в основному інформують нас про те, як кишечник тварин реагує на введення певного штаму E.coli. Натомість у людей додатково слід враховувати особливості дієти, спосіб життя, загальний стан мікробіоти тощо. Результати одного цікавого тривалого дослідження, виконаного на значній групі людей (1074 пацієнти із функціональними кишковими розладами), були опубліковані у 1989 р. У публікації повідомлялось про добру толерантність штаму (більш ніж 90 %), малу кількість незначних побічних ефектів (2,8 %). Тільки 16 пацієнтів (1,5 %) припинили прийом препарату через наявні побічні реакції, а 84 % пацієнтів вказали на суб’єктивне покращення стану [20, 21].
Вивчення мікробної конкуренції було важливим інструментом виявлення нових антимікробних препаратів із часів Олександра Флемінга, який використовував платформу Waksman для ідентифікації стрептоміцину й неоміцину. Ці експерименти надали важливу інформацію про те, як мікробна конкуренція, мікробний антагонізм сприяють формуванню здорової мікробної флори людини [22]. Мікрофлора людини складається з бактерій, грибів і вірусів. Вважається, що між ними існують складні зв’язки й взаємодії, які забезпечують відносну стабільність гомеостазу [23]. Порушення рівноваги мікробіоти (дисбіоз), включно з надмірним ростом Candida albicans, пов’язане з численними негативними наслідками для здоров’я людини. Надмірний ріст Candida albicans може спостерігатись після тривалої антибіотикотерапії, при імунодефіцитах тощо [24–26]. Місцеві й системні грибкові інфекції, викликані Candida albicans, можуть викликати досить тяжкі захворювання, навіть призводити до смерті. Однак тяжкі інфекції, викликані Candida albicans, є відносно рідкісними й зустрічаються переважно в осіб з порушеним імунним захистом. Проте майже 80 % населення асимптоматично колонізовано Candida albicans, що становить певну загрозу. Вважається, що людська мікробіота й імунна система працюють узгоджено, обмежуючі ріст Candida albicans через конкуренцію й модифікацію середовища росту. У 2018 році опубліковано результати масштабного дослідження, яке виявило, що кишкова паличка Escherichia coli (штам MG1655) знищує Candida albicans (штам SC5314) in vitro. Було встановлено, що Escherichia coli продукує розчинний фактор, який вбиває Candida albicans, дія якого, у свою чергу, є залежною від концентрації магнію [27].
Протягом ХХ століття було проведено багато досліджень щодо взаємодії мікробіоти кишок [28]. Стало зрозумілим, що взаємодія різноманітних штамів мікробіому може бути дуже складною — від симбіозу до антагонізму [29, 30]. Значна робота також була виконана для вивчення характеру відносин між коменсальними бактеріями й грибковими патогенами. Автори таких робіт висловлюють сподівання, що ці дослідження сприятимуть появі нових протигрибкових терапевтичних засобів у майбутньому.
Ще одним важливим напрямком вивчення мікробної взаємодії є дослідження бактеріальних біоплівок, які є ефективною перешкодою для патогенної флори й альтернативою застосуванню антибіотиків, наприклад, при тривалому використанні катетерів різної локалізації, інтубаційних трубок тощо, що пов’язано з високим ризиком бактеріальних ускладнень. У дослідженні, результати якого було опубліковано у 2017 році, вивчалась профілактична ефективність біоплівок, утворених пробіотичним штамом Escherichia coli Nissle 1917 [31]. Авторами було доведено, що даний штам утворює стійкі біоплівки на силіконовій основі, що дозволило суттєво знизити заселення патогенним штамом Enterococcus faecalis протягом 11 днів. Це важливо, оскільки захист у вигляді біоплівки є живим і здатен самовідновлюватись, тоді як сучасні антимікробні покриття піддаються поступовому нівелюванню згенерованою біомасою швидко зростаючих патогенів в умовах насиченого поживного середовища. Слід зазначити, що штам Escherichia coli Nissle 1917 є комерційно доступним й випробуваний у багатьох клінічних дослідженнях. Також в цьому дослідженні було показано, що даний пробіотичний штам є значно ефективнішим, ніж інші генетично модифіковані штами Escherichia coli. У медицині штам Escherichia coli Nissle 1917 ефективно використовується вже понад 100 років під торговою назвою Мутафлор як засіб при розладах кишечника, у тому числі при лікуванні виразкового коліту [32], хвороби Крона [33] та інших захворювань кишечника через його потенційну здатність конкурувати з ентеропатогенами в кишечнику людини [34].
З огляду медичної наукової літератури можна зробити висновок, що штам Escherichia coli Nissle 1917 є одним з найбільш вивчених пробіотиків із доведеною ефективністю використання, який чинить антагоністичну дію щодо Candida albicans, здатний до тривалої колонізації кишечника й запобігає розвитку інших патогенних мікроорганізмів.
На ринку пробіотичний штам Escherichia coli Nissle 1917 представлений препаратом Мутафлор у вигляді оральної суспензії (1 мл суспензії містить живу бактеріальну культуру в дозі 108 КУО) і капсул, що містять 2,5–25 ´ 109 живих бактеріальних клітин.
Мета роботи: враховуючи антагоністичні властивості пробіотичного штаму Escherichia coli Nissle 1917 щодо Candida albicans, оцінити ефективність застосування препарату Мутафлор у дітей віком від 1 до 4 років із діагнозом функціональних гастроінтестинальних розладів у вигляді персистуючої діареї на фоні доведеного надмірного росту Candida albicans.
Матеріали та методи
Під нашим спостереженням перебували 32 дитини віком від 1 до 4 років з діагнозом функціональних гастроінтестинальних розладів у вигляді персистуючої діареї з доведеним надмірним ростом Candida albicans. Тривалість призначення пробіотичного препарату Мутафлор у дозі 1 мл суспензії один раз на добу становила 15 днів. Закінчили спостереження 30 дітей, дві дитини були виключені з аналізу результатів через порушення протоколу призначеної терапії.
Критерії включення: доношені діти (37–42 тижні) з вагою при народженні понад 2500 г, віком від 1 до 4 років із функціональними гастроінтестинальними розладами у вигляді персистуючої діареї з доведеним надмірним ростом Candida albicans.
Критерії виключення: наявність будь-якої вродженої та іншої органічної патології, тяжких супутніх захворювань, гострої кишкової інфекції, прийом інших пробіотичних препаратів, непереносимість препарату або його компонентів, недотримання протоколу спостереження.
Ефективність застосування препарату Мутафлор оцінювалась із застосуванням анкетно-опитувальних і клінічних методів обстеження. Оцінка скарг, об’єктивного стану дитини проводилась на початку, при взятті дитини під спостереження й через 7 і 15 днів. Лабораторні методи дослідження, такі як копрограма, забір калу на мікробну флору й ультразвукове дослідження внутрішніх органів, проводились на початку спостереження й через 15 днів прийому препарату. Діти перебували на базі денного стаціонару дитячого гастроентерологічного відділення Комунальної міської дитячої клінічної лікарні м. Львова. Симптоми й скарги оцінювали згідно з показниками ступеня вираженості: 0 — симптому немає; 1 — незначний ступінь; 2 — значний ступінь вираженості.
Результати та обговорення
На початку спостереження, перед застосуванням Мутафлору, у картах спостереження 30 дітей із функціональними розладами шлунково-кишкового тракту був відмічений діарейний синдром без температури, здуття живота — у 29 дітей (96,7 %), кишкові кольки — у 25 дітей (83,3 %), порушення сну — у 21 дитини (70 %), блювання — у 9 дітей (30 %), періодичний немотивований крик/плач — у 9 дітей (30 %), виражений періодичний неспокій — у 17 дітей (56,7 %) (табл. 1).
Якщо на початку спостереження загальний стан був незадовільним в усіх дітей, то через 7 днів він розцінювався як відносно незадовільний у 18 дітей (60 %), через 15 днів усі діти почували себе добре. У всіх дітей перед початком дослідження був визначений надмірний ріст Candida albicans. При цьому у 2 дітей (6,7 %) вона була висіяна в кількості 104 КУО, у 12 дітей (40 %) — 105 КУО, в 11 дітей (36,7 %) — 106 КУО, у 4 дітей (13,3 %) — 107 КУО, в одної дитини (3,3 %) — 108 КУО. Після 15 днів лікування Candida albicans у випорожненнях реєструвалась у 12 дітей (40 %), з яких у 11 дітей (36,7 %) вона була визначена у кількості 104 КУО, а в однієї дитини (3,3 %) — 103 КУО, що свідчить про достатню ефективність застосування штаму Escherichia coli Nissle 1917 при кандидозі кишечника й вкладається в межі норми (рис. 1).
При першому бактеріологічному дослідженні Staphylococcus aureus був висіяний з випорожнень у 4 дітей (13,3 %), з них у 3 дітей (10 %) — у кількості 103 КУО і в одної дитини (3,3 %) — у кількості 104 КУО. Klebsiella pneumoniae була знайдена у 1 дитини (3,3 %) в кількості 103 КУО. Після 15 днів призначення пробіотичного штаму Escherichia coli Nissle 1917 ці умовно-патогенні збудники у випорожненнях дітей не визначалися, що опосередковано свідчить про антагоністичну ефективність даного штаму щодо цих бактерій.
У той же час після 15 днів призначення Мутафлору у випорожненнях дітей, які перебували під нашим спостереженням, збільшився рівень біфідо- і лактофлори. На початку нашого спостереження ми відмічали істотно нижчу кількість біфідобактерій у випорожненнях: у 2 дітей (6,7 %) — 102 КУО, в 1 дитини (3,3 %) — 103 КУО, у 3 дітей (10 %) — 104 КУО, у 6 дітей (20 %) — 105 КУО, у 12 дітей (40 %) — 106 КУО, у 4 дітей (13,3 %) — 107 КУО, у 2 дітей (6,7 %) — 108 КУО. Лактобактерії у випорожненнях дітей на початку дослідження були визначені в такій кількості: у 2 дітей (6,7 %) — 103 КУО, у 2 дітей (6,7 %) — 104 КУО, у 11 дітей (36,7 %) — 105 КУО, у 7 дітей (23,3 %) — 106 КУО, у 3 дітей (10 %) — 108 КУО. Після проведеного лікування, через 15 днів, реєструвались значно вищі показники як біфідо-, так і лактобактерій. Так, рівень біфідобактерій у випорожненнях був таким: в 1 дитини (3,3 %) — 104 КУО, у 2 дітей (6,7 %) — 106 КУО, у 9 дітей (30 %) — 107 КУО, у 15 дітей (50 %) — 108 КУО, у 3 дітей (10 %) — 109 КУО. Рівень лактобактерій становив в 1 дитини (3,3 %) 105 КУО, у 3 дітей (10 %) — 106 КУО, у 8 дітей (26,7 %) — 107 КУО, у 14 дітей (46,7 %) — 108 КУО, у 4 дітей (13,3 %) — 109 КУО.
Дані анкетного опитування засвідчили, що застосування препарату Мутафлор сприяло покращенню характеристик випорожнень. Так, через 7 днів тільки в 30 % дітей зберігались скарги на рідкі випорожнення, а через 15 днів батьки тільки однієї дитини (3,3 %) відмічали рідкі випорожнення (рис. 2). При цьому в цієї дитини ступінь вираженості даного симптому змінився від значного до незначного.
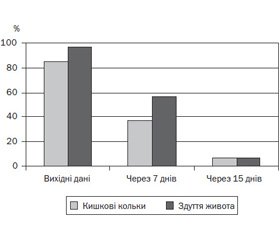
Аналогічна позитивна динаміка спостерігалась щодо частоти кишкових кольок і здуття живота. Так, на початку спостереження кишкові кольки відмічались у 83,3 % дітей, через 7 днів — у 36,7 % дітей, через 15 днів — лише в 6,7 % дітей. Подібна ситуація була й щодо скарг на здуття живота. На початку спостереження цей симптом спостерігався в 96,7 % дітей, через 7 днів після призначення Мутафлору — у 56,7 % дітей, через 15 днів — лише в 6,7 % дітей (рис. 3).
Подібна ситуація спостерігалась і з блюванням, хоча частота даної скарги на початку спостереження була значно меншою. На початку спостереження блювання відмічалось у 30 % дітей, через 7 днів — у 3,3 % дітей, і через 15 днів блювання не було в жодного пацієнта (рис. 2).
Отже, на кінець періоду спостереження, через 15 днів прийому пробіотичного препарату Мутафлор, було підтверджено ефективне вирішення проблеми діарейного синдрому у вигляді нормалізації випорожнень у 96,7 % дітей, зменшення кольок — з 83,3 до 6,7 % дітей, здуття живота — з 96,7 до 6,7 % дітей і редукції супутніх симптомів (блювання, крику й поганого сну) у всіх дітей групи спостереження. У поодиноких дітей, у яких залишалися симптоми гастроінтестинальних розладів, було відзначене істотне зменшення інтенсивності їх проявів.
У нашому спостереженні не було зазначено несприятливих ефектів чи непереносимості застосування пробіотичного штаму Escherichia coli Nissle 1917.
Висновки
Затяжні діареї в дітей віком 1–4 роки можуть супроводжуватися дисбіотичними змінами мікробіоти кишок у вигляді надмірного росту Candida albicans.
На фоні застосування пробіотичного препарату Мутафлор (пробіотичний штам Escherichia coli Nissle 1917) у дітей із персистуючою діареєю на фоні надмірного росту Candida albicans протягом 15 днів в дозі 1 мл суспензії (містить живу бактеріальну культуру в дозі 108 КУО) було доведене ефективне полегшення проявів діарейного синдрому: нормалізувалися випорожнення в 96,7 % дітей і припинилися кольки в 92 % дітей, минуло здуття живота в 93 % дітей, відбувалась ефективна редукція супутніх симптомів, таких як блювання, крик і поганий сон.
Після прийому Мутафлору лабораторного росту Candida albicans в 60 % дітей не виявлялося взагалі, в інших дітей кількість була в межах допустимої норми.
У той же час після 15 днів застосування Escherichia coli Nissle 1917 у випорожненнях дітей відмічалося суттєве збільшення рівня біфідо- і лактофлори, що свідчить про вагомий вплив препарату на нормалізацію власної мікрофлори кишечника.
Отже, доцільним є проведення подальших глибоких досліджень впливу Escherichia coli Nissle 1917 на Candida albicans при діарейному синдромі в дітей.
Конфлікт інтересів. Не заявлений.
1. Bischoff S. Gut health: a new objective in medicine? // BMC Med. — 2011. — 9. — 24.
2. Sharon G., Sampson T.R., Mazmanian S.K. The Central Nervous System and the Gut Microbiome // Cell. — 2016. — 167(4). — 915-932. — http://dx.doi.org/10.1016/j.cell.2016.10.027.
3. Keunen K., van Elburg R.M., van Bel F., Banders M.J.N.L. Impact of nutrition on brain development and its neuroprotective implications following preterm birth // Pediatr. Res. — 2015. — 77. — 148-155.
4. Mayer E.A. Gut feelings: the emerging biology of gut-brain communication // Nat. Rev. Neurosci. — 2011. — 12. — 453-66.
5. Lyte M. Microbial endocrinology in the microbiome-gutbrain axis: How bacterial production and utilization of neurochemicals influence behaviour // PLoS Pathog. — 2013. — 9. — e1003726.
6. Lloyd-Price J., Abu-Ali G., Huttenhower C. The healthy human microbiome // Genome Medicine. — 2016. — 8. — 51. DOI 10.1186/s13073-016-0307.
7. Henker J., Laass M.W., Blokhin B.M., Maydannik V.G., Bolbot Y.K., Elze М., Wolff С., Schreiner А., Schulze J. Пробіотик Escherichia coli штамм Nissle 1917 порівняно з плацебо при лікуванні діареї тривалістю понад 4 днів у дітей грудного і молодшого віку // Современная педиатрия. — 2013. — 3(51). — 25-31.
8. Nissle A. Weiteres uber Grundlagen und Praxis der Mutaflorbehandiung // Dtsch Med. Wochenschr. — 1925. — 44. — 1809-1813.
9. Nissle A. Über die Grundlagen einer neuen ursächlichen Bekämpfung der pathologischen Darmflora // Deutsche Medizinische Wochenschrift. — 1916. — 42. — 1181-1184.
10. Nissle A. Die antagonistische Behandlung chronischer Darmstörungen mit Colibakterien // Med. Klin. — 1918. — 2. — 29-33.
11. Krammer H.J., Kamper H., von Bunau R. et al. Probiotic drug therapy with Escherichia coli strain Nissle 1917 (EcN): results of a prospective study of the records of 3807 patients // Z. Gastroenterol. — 2006. — 44. — 651-656.
12. Rohrenbach J., Matthess A., Maier R. et al. Escherichia coli Stamm Nissle 1917 (EcN) bei Kindern: Ergebnisse einer prospektiven Datenerhebung mit 668 Patienten // Kinder Jugendarzt. — 2007. — 3. — 164-167.
13. Henker J., Blokhin B.M., Bolbot Y.K. et al. The probiotic E.coli Nissle 1917 stops acute diarrhoea in infants and toddlers // Eur. J. Pediatr. — 2007. — 166. — 311-318.
14. Tromm A., Niewerth U., Khoury M. et al. The probiotic Escherichia coli strain Nissle 1917 (EcN) for the treatment of collagenous colitis: first results of an open_label trial // Z. Gastroenterol. — 2004. — 42. — 365-369.
15. Lodinová-Zádniková R., Sonnenborn U. Effect of preventive administration of a nonpathogenic Escherichia coli strain on the colonization of the intestine with microbial pathogens in newborn infants // Biol. Neonate. — 1997. — 71. — 224-232.
16. Gronbach К., Eberle U., Müller М., Ölschläger T.A., Dobrindt U., Leithäuser F., Niess J.H., Döring G., Reimann J., Autenrieth I.B., Frick J.-S. Safety of Probiotic Escherichia coli Strain Nissle 1917 Depends on Intestinal Microbiota and Adaptive Immunity of the Host // Infect. Immun. — 2010 Jul. — 78(7). — 3036-3046.
17. Lodinova-Zadnikova R., Tlaskalova-Hogenova H., Sonnenborn U. Local and serum antibody response in fullterm and premature infants after artificial colonization of the intestine with E.coli strain Nissle 1917 (Mutaflor®) // Pediatr. Allergy Immunol. — 1992. — 3. —
43-48.
18. Lodinova-Zadnikova R., Sonnenborn U. Effect of preventive administration of a nonpathogenic Escherichia coli strain on the colonization of the intestine with microbial pathogens in newborn infants // Biol. Neonate. — 1997. — 71. — 224-232.
19. Cukrowska B., Lodinova-Zadnikova R., Enders C. et al. Specific proliferative and antibody response of premature infants to intestinal colonization with nonpathogenic probiotic E.coli strain Nissle 1917 // Scand. J. Immunol. — 2002. — 55. — 204-209.
20. Schütz E. Behandlung von Darmerkrankungen mit Mutaflor // Fortschr. Med. — 1989. — 107. — 599-602.
21. Kruis W., Chrubasik S., Boehm S., Stange C., Schulze J. A double-blind placebo-controlled trial to study therapeutic effects of probiotic Escherichia coli Nissle 1917 in subgroups of patients with irritable bowel syndrome // Int. J. Colorectal. Dis. — 2012. — 27. — 467-474.
22. Shirtliff M.E., Peters B.M., Jabra-Rizk M.A. Cross-kingdom interactions: Candida albicans and bacteria // FEMS Microbiol. Lett. — 2009. — 299(1). — 1-8. doi: 10.1111/j.1574-6968.2009.01668.
23. Consortium THMP. Structure, function and diversity of the healthy human microbiome // Nature. — 2012. — 486(7402). — 207-214. doi: 10.1038/nature11234.
24. Collins S.M. A role for the gut microbiota in IBS // Nat. Rev. Gastroenterol. Hepatol. — 2014. — 11(8). — 497-505. doi: 10.1038/nrgastro.2014.40.
25. Kraft-Bodi E., Jørgensen M.R., Keller M.K., Kragelund C., Twetman S. Effect of Probiotic Bacteria on Oral Candida in Frail Elderly // J. Dent. Res. — 2014. — 94 (9 Suppl.). — 181-186S. doi: 10.1177/0022034515595950.
26. Cabral D.J., Wurster J.I., Flokas M.E., Alevizakos M., Zabat M., Korry B.J., Rowan A.D., Sano W.H., Andreatos N., Ducharme R.B., Chan P.A., Mylonakis E., Fuchs B.B., Belenky P. The salivary microbiome is consistent between subjects and resistant to impacts of short-term hospitalization // Sci. Rep. — 2017. — 7(1). — 11040. doi: 10.1038/s41598-017-11427-2.
27. Cabral D.J., Penumutchu S., Norris С., Morones-Ramirez J.R., Belenky Р. Мicrobial competition between Escherichia coli and Candida albicans reveals a soluble fungicidal factor // Microbial Cell. — 2018. — 5(5).
28. Sonnenborn U. Escherichia coli strain Nissle 1917 — from bench to bedside and back: history of a special Escherichia coli strain with probiotic properties // FEMS Microbiol. Lett. — 2016. — 363(19). — fnw212. doi: 10.1093/femsle/fnw212.
29. Coyte K.Z., Schluter J., Foster K.R. The ecology of themicrobiome: Networks, competition, and stability // Science. — 2015. — 350(6261). — 663-666. doi: 10.1126/science.aad2602.
30. Vazquez-Rodriguez A., Vasto-Anzaldo X.G., Barboza Perez D., Vázquez-Garza E., Chapoy-Villanueva H., García-Rivas G., Garza-Cervantes J.A., Gómez-Lugo J.J., Gomez-Loredo A.E., Garza Gonzalez M.T., Zarate X., Morones-Ramirez J.R. Microbial Competition of Rhodotorula ucilaginosa UANL-001L and E. coli increase biosynthesis of Non-Toxic Exopolysaccharide with Applications as a Wide-Spectrum Antimicrobial // Sci Rep. — 2018. — 8(1). — 798. doi: 10.1038/s41598-017-17908-8.
31. Е.соlі 1917 Probiotic E.coli Nissle 1917 biofilms on silicone substrates for bacterial interference against pathogen colonization / Quan Chen, Zhiling Zhu, Jun Wang et al. // Acta Biomaterialia. — 2017. — 50. — 353-360.
32. Rembacken B.J., Snelling A.M., Hawkey P.M., Chalmers D.M., Axon A.T.R. Non-pathogenic Escherichia coli versus mesalazine for the treatment of ulcerative colitis: a randomised trial // Lancet. — 1999. — 354. — 635-639.
33. Malchow H.A. A new approach in therapy to maintain remission of colonic Crohn’s disease? // J. Clin. Gastroenterol. — 1997. — 25. — 653-658.
34. Hancock V., Dahl M., Klemm P. Probiotic Escherichia coli strain Nissle 1917 outcompetes intestinal pathogens during biofilm formation // J. Med. Microbiol. — 2010. — 59. — 392-399.

/61-1.jpg)
/62-1.jpg)