Журнал «Практическая онкология» Том 2, №1, 2019
Вернуться к номеру
Овариальная супрессия в терапии рака молочной железы
Авторы: Зотов А.С.
Национальный медицинский университет им. А.А. Богомольца, г. Киев, Украина
Рубрики: Онкология
Разделы: Справочник специалиста
Версия для печати
В огляді висвітлені сучасні дані щодо місця оваріальної супресії/абляції в ендокринотерапії раку молочної залози. Наведено відомості про показання та методики оваріальної супресії, надана характеристика сучасних лікарських засобів, що застосовуються з цією метою, — агоністів рилізинг-факторів гіпоталамусу, вказані їх переваги та можливі побічні дії. Огляд містить описання еволюції поглядів на показання до оваріальної супресії, ґрунтуючись на даних найбільш авторитетних і вірогідних клінічних випробувань. Вказані останні дані провідних міжнародних настанов щодо галузі застосування оваріальної супресії/абляції в паліативному, ад’ювантному та неоад’ювантному режимах.
В обзоре освещены современные данные о месте овариальной супрессии/абляции в эндокринотерапии рака молочной железы. Приведены сведения о показаниях и методиках овариальной супрессии, дана характеристика современных лекарственных средств, применяющихся с этой целью, — агонистов рилизинг-гормонов гипоталамуса, указаны их преимущества и возможные побочные эффекты. Обзор содержит описание эволюции взглядов на показания к овариальной супрессии на основании данных наиболее авторитетных и достоверных клинических исследований. Указаны последние данные ведущих международных руководств относительно области применения овариальной супрессии/абляции в паллиативном, адъювантном и неоадъювантном режимах.
The review summarizes current data about the role of ovarian suppression/ablation in endocrine therapy for breast cancer. Information of the indications and methods of ovarian suppression is given; the characteristics of modern drugs used for this purpose — gonadotropin-releasing hormone agonist — are presented, including their advantages and possible side effects. The review contains a description of the evolution of views on the indications for ovarian suppression based on the data from the most authoritative and reliable clinical trials. The latest data from leading international guidelines on the scope of ovarian suppression/ablation in the palliative, adjuvant and neoadjuvant modes are discussed.
рак молочної залози; ендокринотерапія; оваріальна супресія; огляд
рак молочной железы; эндокринотерапия; овариальная супрессия; обзор
breast cancer; endocrine therapy; ovarian suppression; review
Первое упоминание об эндокринотерапии (ЭТ) рака молочной железы (РМЖ) относится к 1896 г., когда в журнале «The Lancet» появилась статья «К лечению иноперабельных случаев карциномы молочной железы: предложения нового лечебного метода с иллюстративными случаями». В ней хирург Эдинбургского опухолевого госпиталя Джордж Томас Битсон описывал историю 33-летней женщины, обратившейся после удаления раковой опухоли молочной железы с рецидивом заболевания и диссеминацией по коже грудной клетки. Рецидивная опухоль была запущенной, и хирургическое вмешательство представлялось невозможным. Однако автор 15 июня 1895 г. прооперировал пациентку, удалив ей фаллопиевы трубы и яичники (операцию он назвал «оофорэктомия»). Через 8 месяцев все исследования показали, что проявления опухоли исчезли. В последующих публикациях сообщалось, что пациентка прожила 4 года после вмешательства. У двух других пациенток, прооперированных подобным образом, наблюдалось улучшение.
Таким образом, овариоэктомия стала первым практически примененным методом ЭТ. Методы выключения функции яичников менялись со временем; сейчас для хирургической или лучевой кастрации применяется термин «овариальная абляция» (ОА), а понятие «овариальная супрессия» (ОС) соответствует фармакологической кастрации.
В пременопаузе яичники являются преимущественным источником эстрогенов, и вполне естественно, что они стали первой мишенью для аблятивной терапии. Она оказалась весьма эффективным средством — ответ на лечение демонстрировали около 30 % всех пациенток с метастатическим РМЖ и около 80 % женщин с рецепторпозитивными (ER+) опухолями.
Хотя овариоэктомия позволяла достичь достоверного и постоянного снижения эстрогенемии почти у всех женщин в пременопаузе, ее выполнение требовало госпитализации и имело потенциальный операционный/анестезиологический риск осложнений и летальности. В ранних публикациях авторы сообщали о 5% послеоперационной летальности, которая с развитием медицинской практики и техники существенно снижалась. Распространение лапароскопической оварио–эктомии существенно снизило риск вмешательства. Несмотря на очевидные преимущества овариоэктомии (отсутствие реакции «вспышки», наиболее оптимальное соотношение «стоимость — эффективность»), ее необратимый характер и потеря фертильности заставляют молодых пациенток выбирать альтернативные методы обратимого подавления функции яичников [22].
Эффективная супрессия яичников стала возможна благодаря появлению синтетических аналогов гипоталамических рилизинг-гормонов (аГнРГ), у которых, в отличие от нативных декапептидов, заменены амино–кислоты в 6-м и 10-м положениях, что позволило снизить скорость ферментативного расщепления и повысить сродство к соответствующим рецепторам гипофиза.
В фармакодинамике аГнРГ отмечается двухфазное действие. В первую фазу, длящуюся 5–7 дней, наблюдается стимуляция гипофиза с транзиторным 5–10-кратным повышением уровней ФСГ, ЛГ и эстрогенов — реакция «вспышки» (flare). Симптомами этой реакции являются некоторое увеличение размеров опухоли, боль и покраснение кожи в месте ее локализации, субфебрилитет, боли в костях и гиперкальциемия (при метастазах в кости), повышение титра опухолевых маркеров. Во вторую фазу наступает десенситизация гипофиза к действию рилизинг-факторов (связанная с уменьшением числа рецепторов к ГнРГ) и блокада синтеза гонадотропных гормонов. Через 2–3 недели после введения аГнРГ развивается гипоэстрогенемия, сопровождающаяся аменореей, что и составляет сущность клинического эффекта. Эффект обратим, через 8–9 недель после окончания терапии депо-препаратами функционирование гипоталамо-гипофизарно-яичниковой оси восстанавливается.
Агонисты ГнРГ выпускаются в виде спрея для интраназального введения (бусерелин), депо-суспензий (бусерелина ацетат, трипторелин), депо-имплантатов (гозерелин, лейпрорелин). Интраназальные формы обладают низкой биодоступностью (1–3 % введенной дозы), требуют введения не менее 2 раз в сутки и в онкологии практически не используются. При парентеральном введении биодоступность составляет около 90 %.
Наибольшую популярность приобрели депонированные формы — суспензия и капсулы. Активное действующее вещество в них заключено в биодеградирующую микросферу, обеспечивающую постепенное его поступ–ление в организм. Постепенность процесса выделения действующего вещества обеспечивает необходимую продолжительность действия препарата. Преимуществом депонированной формы для внутримышечного или подкожного введения является абсолютно одинаковая интенсивность деградации микросфер в мышцах у всех людей, что позволяет говорить о стабильности концентрации действующего вещества в сыворотке крови.
Сертифицированные для лечения рака молочной железы депонированные формы обеспечивают действие препарата в течение 28 дней и 3 месяцев после введения.
Побочными эффектами приема агонистов ГнРГ являются патологические проявления менопаузы, связанные с фармакологическим действием препарата и в редких случаях приводившие к его отмене.
Частые осложнения: «приливы», снижение либидо, сухость слизистой оболочки влагалища, снижение настроения, депрессия, артралгия, снижение минеральной плотности костной ткани, реакция в месте введения препарата[1].
Применяют аналоги ГнРГ также при эндомет–риозе, фибромиоме матки: они вызывают истончение эндометрия, уменьшение симптоматики и размеров объемных образований [8]. Кроме того, аналоги ГнРГ применяют в программах экстракорпорального оплодотворения.
Овариальная абляция/супрессия в лечении распространенного/метастатического РМЖ
Исследованиями, проведенными в 1980–90-х гг. и обобщенными в метаанализе (около 200 пациенток, получавших овариальную супрессию), было установлено, что медиана выживаемости составила 26,5 мес., частота ответа на лечение — 36 % (44 % у ER+ пациенток) при средней продолжительности ответа на лечение 44 недели, что оказалось сопоставимо с историческим контролем — пациентками, подвергшимися овариоэктомии [20].
Сравнимые результаты в отношении уровня ответа на лечение, частоты прогрессирования и смертности получены при метаанализе исследований, посвященных сравнению эффектов тамоксифена и агонистов ГнРГ [4].
Комбинация овариальной супрессии и тамоксифена была эффективнее в лечении метастатического РМЖ в пременопаузе, чем монотерапия, и рекомендовалась как 1-я линия терапии [13, 18].
Согласно одному из наиболее авторитетных руководств — IV Международному консенсусному руководству по распространенному раку молочной железы Европейской школы онкологии и Европейского общества медицинской онкологии, пациенткам в пременопаузе с метастатическим рецепторположительным РМЖ следует назначать овариальную абляцию/супрессию в комбинации с другими средствами эндокринной терапии. При достижении искусственной менопаузы дальнейшая тактика ведения будет соответствовать таковой у женщин в постменопаузе [1].
Особо оговаривается, что в лечении распространенного РМЖ предпочтение отдается применению эндокринной терапии, даже если есть висцеральные метастазы. Химиотерапию рекомендуется сохранить в качестве резерва для случаев быстро прогрессирующего заболевания (т.е. при наличии висцерального криза — состояния, которое сопровождается серьезным нарушением функции внутреннего органа(-ов), а не просто при существовании висцеральных метастазов) или доказанной эндокринной резистентности [14].
Аналогичных подходов придерживаются и американские эксперты в рекомендациях Американского общества клинической онкологии (ASCO) и NCCN [9, 15].
Овариальная абляция/супрессия в режиме адъювантной терапии
Исследования по изучению эффективности ОА/ОС начались около 30 лет назад, задачи, методы и результаты их освещены во множестве публикаций, в т.ч. и наших [23–25].
Успешное применение ОА/ОС в лечении распространенного/метастатического РМЖ стало основанием для применения фармакологической кастрации в адъювантном лечении раннего РМЖ.
Авторитетная группа Early Breast Cancer Trialists’ Collaborative Group (EBCTCG) провела анализ 12 клинических исследований, в которых участвовало 3500 пациенток. Он показал существенное улучшение 15-летней выживаемости (52 против 46 %; p = 0,001) у женщин моложе 50 лет, получавших овариальную абляцию, по сравнению с теми, кто ей не подвергался. Интересно, что это единственный результат EBCTCG, который оказался недолговечным [5].
В клиническом практическом руководстве ESMO по диагностике, лечению и наблюдению первичного РМЖ, изданном в 2011 г., было определено, что применение аналогов ГнРГ вызывает супрессию яичников, достаточную для терапевтического эффекта, такого же, как и после овариоэктомии. Авторы руководства указывали, что «аналоги ГнРГ следует назначать не менее чем на 2 года, хотя оптимальная длительность лечения не установлена. Комбинация ГрРГ и ингибиторов ароматазы у пациенток в пременопаузе не показана вне рамок клинических исследований, наилучшие варианты использования ГнРГ (вместе или последовательно с химиотерапией) неизвестны». Похожие воззрения разделяли в клинических рекомендациях и эксперты ASCO [9].
Однако в 2011 г. в официальном органе ASCO — Journal of Clinical Oncology — появилась публикация, после которой отношение к овариальной абляции изменилось [2].
Фактической основой публикации стал отчет группы канадских онкологов в рамках исследовательской инициативы нескольких онкологических организаций (Program in Evidence-based Care, Cancer Care Ontario, Breast Cancer Disease Site Group). Три группы экспертов провели масштабное изучение опубликованных данных для оценки результатов использования аГнРГ в лечении РМЖ. Были проанализированы около полусотни авторитетных публикаций, отобранных из более семисот реферированных в базах данных MEDLINE (с 1966 до 2009 г.), EMBASE (1980–2009), библиотеки Кокрановского сообщества (до 2009 г.), материалы ряда американских и канадских профессиональных онкологических организаций [6].
Исследование должно было ответить на 2 вопроса:
1. Каким образом ОА (ОС) в качестве системной терапии в адъювантном режиме может улучшать клинически значимые исходы (безрецидивный период, общую выживаемость, качество жизни, токсичность) в сравнении и/или в дополнение к другим видам системной терапии, особенно химиотерапии и тамоксифену?
Для ответа были изучены всевозможные комбинации этих видов лечения: ОА в сравнении с –отсутствием адъювантного лечения; ОА + ХТ против только ХТ и пр. — в целом 9 различных вариантов адъювантной терапии, результаты проведения которых были опуб–ликованы.
Выводы: рутинное добавление ОА к системной полихимиотерапии, тамоксифену или их сочетанию не рекомендуется.
ОА самостоятельно не рекомендуется как альтернатива любой другой форме системной терапии, кроме специфических случаев, когда пациентки, которым такая системная терапия показана, не могут ее получать по каким-либо причинам (например, из-за непереносимости или желания получать альтернативные варианты системной терапии).
В исследованиях показано, что ОА в адъювантном режиме по эффективности сопоставима с программами CMF и FE50C. Выраженность описанных выше побочных эффектов от ОА/ОС нередко переносится пациентками хуже, чем относительно нетоксичная программа CMF. С другой стороны, у женщин, желающих сохранить репродуктивную функцию, применение овариальной супрессии может быть предпочтительней (обратимость супрессивного эффекта и отсутствие токсического воздействия на пул яйцеклеток в сравнении с ХТ).
2. Какой способ абляции или супресии овариальной функции является лучшим: хирургическая овариоэктомия, облучение яичников или фармакологическая супрессия?
Результаты метаанализа свидетельствуют, что метод ОА не влияет на сроки появления рецидива и смерт–ность. Таким образом, при выборе метода ОА/ОС следует учитывать иные факторы, включая пожелания пациентки и стоимость лечения.
Американский колледж акушеров и гинекологов, оценивая показания к сальпингоовариоэктомии, указывает на ее целесообразность у больных РМЖ с высоким риском рака яичников. В первую очередь это пациентки с мутациями генов BRCA1 и BRCA2, имеющие 20–50% риск развития рака яичников и 40–60% — билатерального РМЖ [7].
International Breast Cancer Study Group (IBCSG) в 2003 году инициировали три многоцентровых рандомизированных исследования по оценке эффективности овариальной супрессии, химиотерапии и ингибиторов ароматазы в адъювантном режиме в пременопаузе на ранних стадиях. Одно из них — PERCHE (Premenopausal Endocrine Responsive Chemotherapy Trial) было остановлено из-за низкого рекрутирования пациенток.
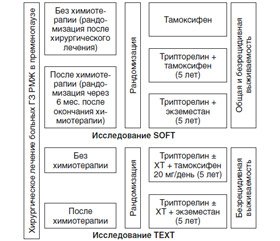
Исследования SOFT (Suppresion of Ovarian Function Trial), TEXT (Tamoxifen and Exemestan Trial) — это рандомизированные клинические испытания III фазы; в период с 11.2003 по 04.2011 года в них было включено соответственно 2672 и 3066 женщин в пременопаузе с ранним ГР + РМЖ; суммарно 4690 пациенток были рандомизированы. Для подавления функции яичников использовали ежемесячные инъекции трипторелина в течение 5 лет (наиболее распространенный выбор), хирургическую или лучевую абляцию. В обоих исследованиях около 55 % включенных пациенток получали адъювантную ХТ, которая назначалась и проводилась до рандомизации в соответствии с общепринятыми клинико-морфологическими факторами риска.
Дизайн исследований представлен на рис. 1.
Первичный анализ данных исследований SOFT/TEXT не выявил дополнительных преимуществ овариальной супрессии в общей когорте пациенток. Дополнительные преимущества овариальной супрессии (более выраженные при сочетании ее с ингибитором ароматазы, чем с тамоксифеном) имела группа пациенток с высоким риском рецидива, которым была показана адъювантная химиотерапия: моложе 35 лет, а также сохранившие пременопаузальный статус после химиотерапии.
В 2017 г. на конференции в Сан-Антонио были сообщены последние результаты исследования SOFT. Безрецидивная 8-летняя выживаемость в группе пациенток до 35 лет, получавших тамоксифен, составила 78,9 %, тамоксифен + ОС — 83,2 %, экземестан + ОС — 85,9 % [10, 16].
В 2018 г. на ежегодном съезде ASCO, состоявшемся в Чикаго, были опубликованы данные объединенного анализа 4096 пациенток, участвовавших в исследованиях SOFT/TEXT. Обнаружено, что степень различий между изученными режимами ЭТ в значительной степени зависела от исходного риска рецидива. При разделении на группы в зависимости от исходного риска отдаленного рецидива учитывали возраст (с интервалом 5 лет), число пораженных регионарных лимфатических узлов (0, 1–3, ≥ 4), размер первичной опухоли (≤ 2 см, > 2 см), экспрессию рецепторов эстрогенов, получала ли пациентка адъювантную химиотерапию. У больных с высоким риском применение экземестана на фоне овариальной супрессии по сравнению с тамоксифеном + ОС или тамоксифеном в монотерапии увеличивало 8-летнюю выживаемость без отдаленных рецидивов на 10–15 %. У пациенток промежуточного риска, большинство из которых получали адъювант–ную химиотерапию, различия составили 4–5 %. У пациенток с низким риском рецидива потенциальный эффект добавления ОС по сравнению с монотерапией может быть минимальным, так как даже в группе монотерапии тамоксифеном 8-летняя выживаемость без отдаленных рецидивов превысила 97 % [19].
Полученные данные о сочетании ОС + ИА не соответствуют выводам австрийского исследования ABCSG-12, в котором не обнаружена дополнительная польза от добавления ОС к тамоксифену в адъювант–ном режиме, а также установлен больший риск смерти от РМЖ при сочетании ОС + ингибитор ароматазы, чем ОС + тамоксифен). Среди возможных причин таких противоречий в результатах исследований ABCSG и SOFT/TEXT называются использование разных ингибиторов ароматазы и разных агонистов LHRH, разная длительность эндокринной терапии, различия в когортах пациенток, размерах выборок и статистической мощности исследований, возможное влияние химиотерапии.
В опубликованных на ASCO-2018 результатах рандомизированного клинического исследования 3-й фазы ASTRRA оценена роль добавления ОС к адъювантной ГТ тамоксифеном у молодых женщин с ГР + РМЖ, которые после адъювантной ХТ остаются в пременопаузе или восстановили менструальную функцию. В отличие от предыдущих исследований SOFT и TEXT, в программу ASTRRA включались только пациентки после адъювантной ХТ (то есть высокого риска рецидива); 1293 пациентки были рандомизированы, 1282 получали лечение по протоколу. Тамоксифен (Т) назначался на 5 лет, в экспериментальной группе добавляли ОС в течение первых двух лет терапии (это более короткая продолжительность ОС по сравнению с исследованиями SOFT и TEXT, где ОС проводилась в течение 5 лет лечения). При медиане наблюдения 63 мес. 5-летняя БРВ составила 91,1 % в группе T + ОС и 87,5 % в группе одного тамоксифена (ОР = 0,686, 95% ДИ 0,483–0,972, р = 0,029); 5-летняя ОВ составила 99,4 % в группе T + ОС и 97,8 % в группе Т (ОР = 0,310, 95% ДИ 0,102–0,941, р = 0,029). Исследователи пришли к выводу, что добавление к тамоксифену ОС достоверно увеличивает 5-летнюю БРВ и ОВ [21].
Использование аГнРГ предотвращает развитие индуцированной химиотерапией овариальной недостаточности (данные исследований POEMS и TEXT).
Резюмируя приведенные выше данные, следует заключить, что область применения ОА/ОС в качестве средства адъювантной терапии больных гормоночувствительным РМЖ в пременопаузе ограничивается следующими клиническими ситуациями:
1. Пациентке показана адъювантная ПХТ, но по ряду причин она не может быть проведена (индивидуальная непереносимость отдельных препаратов, нежелание пациентки).
2. Желание пациентки сохранить репродуктивную функцию и избежать токсического воздействия химиотерапии на яичники вне зависимости от рецепторного статуса опухоли (т.е. включая и гормононегативные варианты; вне протоколов донации и криоконсервации яйцеклеток) [1].
3. Пациентки высокого риска развития рака яичников, прежде всего носители мутаций BRCA1 и BRCA2 онкогенов, как кандидатки на хирургическую овариоэктомию [7].
4. Пациентки с высоким риском рецидива опухоли: моложе 35 лет, а также сохранившие пременопаузальный статус после химиотерапии, имеющие прочие факторы риска.
К таким факторам панель экспертов Сент-Галленского консенсуса 2015 г. большинством голосов добавила также поражение 4 и более лимфатических узлов, низкую степень дифференцировки опухоли (G3), повышенный риск рецидива по данным мультигенного анализа [12]. Эта позиция была подтверждена и на Сент-Галленском консенсусе 2017 г. Необходимо отметить, что она поддерживается не всеми онкологами, например 14 немецких специалистов по РМЖ — членов AGO (Arbeitsgemeinschaft Gynäkologische Onkologie) (из них трое — участники Сент-Галленской панели) указывают на отсутствие доказательной базы для такого рода рекомендаций [12].
Во всех остальных случаях проведение ОА/ОС не влияет на результаты лечения (но повышает его стоимость и привносит новые побочные эффекты, ухудшающие качество жизни) и, таким образом, не рекомендуется.
Указанные данные нашли отражение в рекомендациях ESMO по лечению первичного РМЖ, опубликованных в 2015 г. [17].
Таким образом, четкое определение показаний к овариальной абляции/супрессии позволяет оптимизировать лечение, избежать неоправданных побочных эффектов лечения и финансовых трат.
Овариальная абляция/супрессия в неоадъювантном режиме терапии
Неоадъювантная эндокринотерапия (НЭТ) не является на сегодняшний день общепринятым стандартом лечения. Только некоторые руководства рассматривают ее как опцию у пожилых пациенток с сопутствующей патологией.
Потенциальная польза от НЭТ обусловлена следующими фактами:
— люминальный РМЖ менее чувствителен к химиотерапии. По имеющимся на сегодня данным клинических исследований, неоадъювантная ЭТ имеет эффективность по крайней мере не меньшую, чем ХТ;
— эндокринная терапия имеет лучшую переносимость, меньшую токсичность и не требует госпитализации. Это обусловливает и меньшую стоимость курса лечения;
— эндокринная терапия считается методом выбора при лечении гормоночувствительного распространенного РМЖ (кроме случаев наличия висцерального криза).
В небольшом по объему исследовании STAGE, проведенном в Японии, показана эффективность в нео–адъювантном режиме у пациенток в пременопаузе гозерелина в сочетании с анастрозолом и тамоксифеном (с уровнем ответа на лечение 70,4 и 50,5 % соответственно). В настоящее время продолжаются исследования сочетания овариальной супрессии, ингибиторов ароматазы со средствами таргетной терапии и блокаторами контрольных точек [3].
Длительность НЭТ должна составлять не менее 4–6 месяцев; при проведении продолженной НЭТ — до максимального ответа или до размера опухоли, позволяющего выполнить ОСО. Неизвестна польза от пролонгации НЭТ более 12 месяцев, теоретически существует риск появления резистентности. В исследованиях уровень прогрессирования во время НЭТ был невелик (0,8–12,0 %).
Конфликт интересов. Не заявлен.
[1] У мужчин, получавших агонисты ГнРГ, наблюдалось снижение толерантности к глюкозе, проявлявшееся развитием сахарного диабета или ухудшением контроля над уровнем глюкозы в крови у пациентов с сахарным диабетом в анамнезе.

/17-1.jpg)