Архив офтальмологии Украины Том 7, №1, 2019
Вернуться к номеру
Статистичне моделювання ризику прогресування часткової атрофії зорового нерва різної етіології
Авторы: Салдан Й.Р.(1), Галінська І.В.(1), Гур’янов В.Г.(2)
(1) — Вінницький національний медичний університет імені М.І. Пирогова, м. Вінниця, Україна
(2) — Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Офтальмология
Разделы: Справочник специалиста
Версия для печати
В роботі наведено дані щодо побудови й аналізу логістичних моделей регресії тяжкості перебігу часткової атрофії зорового нерва різної етіології. Розроблено математичні моделі прогнозування низької (< 0,3) гостроти зору за показниками порогу електричної чутливості за фосфеном, коефіцієнтів MD/RNFL thickness, MD/Average GCL + IPL thickness. Також розроблено математичні моделі прогнозування тяжкої стадії за показниками коефіцієнтів MD/RNFL thickness, MD/Average GCL + IPL thickness.
В работе приведены данные по построению и анализу логистических моделей регрессии тяжести течения частичной атрофии зрительного нерва различной этиологии. Разработаны математические модели прогнозирования низкой (< 0,3) остроты зрения по показателям порога электрической чувствительности по фосфену, коэффициентов MD/RNFL thickness, MD/Average GCL + IPL thickness. Также разработаны математические модели прогнозирования тяжелой стадии по показателям коэффициентов MD/RNFL thickness, MD/Average GCL + IPL thickness.
Background. Optic nerve atrophy (ONA) is a severe multifactorial ophthalmopathy caused by common diseases (75.8 %), congenital pathology (18 %) and injuries (3–6.2 %). The disease is one of the main etiopathogenetic factors of blindness, low vision and vision disability. According to the statistics of Ukraine, the frequency of ONA as the main severe nosological form of ophthalmic pathology in primary visual disability was 8.9 %. Among the etiological factors of ONA, the diseases of the central nervous system, neuroinfections (meningitis, encephalitis, basal arachnoiditis, multiple sclerosis), ischemic heart disease, hypertension, diabetes mellitus, atherosclerosis prevail. Treatment of ONA is a complex task. The ability of the nerve tissue to regenerate is very limited, and the treatment of atrophy is reduced to increased vital activity of nerve fibers that have survived. There is no doubt that the full ONA can be attributed to incurable diseases. Therefore, all therapeutic measures relate to the so-called partial optic nerve atrophy, in which the visual functions are retained to varying degrees. The causes, nature and degree of damage to the optic nerve are diverse, making it difficult to create an optimal treatment regimen and to evaluate its efficacy. According to many authors, treatment should be combined and systematic, taking into account the etiology of the disease, the duration of the pathological process, age and general condition of the patient. The purpose of the study was to create a statistical model of the risk of progression of partial optic nerve atrophy of various etiologies. Materials and methods. Under our supervision, there were 52 patients (52 eyes) with partial ONA of various etiologies. Patients in the dynamics underwent visometry, refractometry, spheroperimetry, static Humphrey automated perimetry, tonometry, biomicroscopy, ophthalmoscopy, sonography, optical coherent tomography, phosphene threshold determination, and also calculations of ratios (mean deviation (MD)/retinal nerve fiber layer (RNFL) thickness, MD/average ganglion cell layer (GCL) + inner plexiform layer (IPL)). Methods for constructing and analyzing logistic regression models were used to identify the risk factors for ineffective treatment in patients with partial ONA of various etiologies, to evaluate the direction and degree of their influence. The observation time is 1 year. Results. Model of risk prediction does not achieve the effect by visual acuity. For the analysis of factor signs associated with the risk of not achieving the effect by visual acuity, all patients were divided into two groups: low visual acuity (initial variable Y = 1, with visual acuity < 0.3) and satisfactory visual acuity (output variable Y = 0, with visual acuity > 0.3). The analysis was conducted for 10 risk factors. To identify significant risk factors for low visual acuity, selection was performed using the step-by-step rejection-addition method. As a result, three indicators approximately equal in terms of significance were selected: threshold phosphene thresholds, μA, MD/RNFL thickness, MD/average GCL + IPL thickness. To determine the predictive qualities of each indicator and to select the optimal threshold for predicting the risk of low visual acuity, the method of constructing and analyzing the curves of the operational characteristics of the tests was used. Selection was carried out using the step-by-step method of adding attributes to determine the significant factors associated with the risk of severe partial ONA. Two indicators — MD/RNFL thickness and MD/average GCL + IPL thickness — were selected. Model for predicting the risk of severe partial ONA. To analyze the factors related to the risk of severe partial ONA, all patients were divided into two groups: severe partial ONA (initial variable Y = 1, at stages 4 and 5), and moderate partial ONA (initial variable Y = 0, at disease stages 1–3). The analysis was carried out for 9 factors: sex, age, etiology, total photoconductivity of central visual field, total photoconductivity of peripheral visual field, RNFL, μm, MD, PSD, MD/RNFL thickness, MD/average GCL + IPL thickness. Conclusions. The article presents data on the construction and analysis of logistic regression models of the severity of partial optic nerve atrophy of various etiologies. Mathematical models for predicting low (< 0.3) visual acuity with respect to phosphene threshold have been created. Also, mathematical models were developed to predict severe stage of the disease.
зоровий нерв; атрофія зорового нерва різної етіології; логістична модель регресії
зрительный нерв; атрофия зрительного нерва различной этиологии; логистическая модель регрессии
optic nerve; optic nerve atrophy of various etiologies; logistic regression model
Вступ
Атрофія зорових нервів (АЗН) — тяжка поліетіологічна офтальмопатологія, до розвитку якої призводять загальні захворювання (75,8 %), вроджена патологія (18 %) та травми (3–6,2 %). Захворювання є одним з основних етіопатогенетичних чинників сліпоти, слабобачення (недобачання) та інвалідності по зору [3–5].
На даний час поширеність АЗН не зменшується, досягаючи в середньому по Україні 103,1 випадку на 100 000 осіб [7]. В Україні серед причин сліпоти та слабозорості атрофія зорового нерва становить 23,6 %, у нозологічній структурі первинної інвалідності — 8,9 %, причому її питома вага стає більшою. В структурі офтальмопатології інвалідів дитинства атрофія зорового нерва становить 8 % [6].
Серед етіологічних чинників АЗН переважають захворювання центральної нервової системи (об’ємні процеси головного мозку, нейроінфекції), ішемічна хвороба серця (ІХС), гіпертонічна хвороба, цукровий діабет, атеросклероз [8, 9]. За даними окремих авторів, чинниками ризику АЗН стали ІХС (23,43 %), гіпертонічна хвороба (20,56 %), атеросклероз (18,6 %) [10]. Нами раніше наводилися дані стосовно поширеності, частоти та етіологічних чинників часткової атрофії зорових нервів (ЧАЗН) в Україні [1, 2].
Лікування АЗН є складним завданням. Здатність нервової тканини до регенерації дуже обмежена, і лікування атрофії зводиться до підвищення життєдіяльності нервових волокон, які ще збереглися. Не викликає сумніву той факт, що повну АЗН можна віднести до невиліковних захворювань. Тому всі лікувальні заходи відносяться до так званої часткової атрофії зорового нерва, при якій тією чи іншою мірою зберігаються зорові функції. Причини, характер і ступінь ушкодження зорового нерва різноманітні, що ускладнює створення оптимальної схеми лікування та оцінку її ефективності. На думку багатьох авторів, лікування повинно бути комплексним і систематичним, з урахуванням етіології захворювання, давності патологічного процесу, віку та загального стану хворого [11]. Встановлено залежність результатів від своєчасно розпочатого лікування. Вважають, що при сформованій АЗН з низькою гостротою зору (0,01–0,02 з корекцією) і тривалості захворювання від одного до двох років лікування малоефективне [12].
Мета дослідження: побудова статистичної моделі ризику прогресування часткової атрофії зорового нерва різної етіології.
Матеріали та методи
Під нашим спостереженням перебували 52 хворі (52 ока) з ЧАЗН різної етіології. Пацієнтам в динаміці виконували візометрію, рефрактометрію, сферопериметрію, статичну автоматичну периметрію Humphrey, тонометрію, біомікроскопію, офтальмоскопію, сонографію, оптичну когерентну томографію, визначення порогу електричної чутливості за фосфеном (ПЕЧФ), а також проводили розрахунки коефіцієнтів співвідношення (MD/RNFL thickness, MD/Average GCL + IPL).
Усім пацієнтам проведено лікування, в основі якого було досягнення наступних ефектів:
1. Мембраностабілізуюча, захисна, антирадикальна дії (за рахунок зв’язування вільних радикалів і переведення їх в стійку молекулярну форму).
2. Зниження активності лізосомальних гідролаз, що запобігає розщепленню мукополісахаридів у стінках капілярів і сполучній тканині, яка їх оточує, і таким чином нормалізує підвищену судинно-тканинну проникність і виявляє антиексудативну (протинабрякову) дію.
3. Стимуляція клітинного дихання й енергоутворення в клітинах, поліпшення процесу утилізації кисню тканинами, відновлення активності ферментів антиоксидантного захисту.
4. Розширення судин капілярного русла, поліпшення мікроциркуляції, нормалізація реологічних властивостей крові і проникності судин за рахунок збільшення резистентності капілярів.
5. Стимулююча дія на проведення імпульсу по нервових волокнах, міжнейрональних і нервово-м’язових синапсах периферичної нервової системи.
Статистичну обробку отриманих даних проводили в авторському пакеті MedStat (Лях Ю.Є., Гур’янов В.Г., 2004–2019) і статистичному пакеті EZR v. 1.35 (Saitama Medical Center, Jichi Medical University, Saitama, Японія, 2017). Нульову гіпотезу щодо рівності значень ознак відкидали, і відмінності між порівнювальними показниками вважали статистично значимими при рівні значущості р < 0,05.
Для виявлення факторів ризику неефективності лікування у хворих на ЧАЗН різної етіології, оцінки спрямованості і ступеня їх впливу були використані методи побудови й аналізу логістичних моделей регресії.
Термін спостереження — 1 рік.
Результати та обговорення
Модель прогнозування ризику недосягнення ефекту за гостротою зору. Для аналізу факторних ознак, пов’язаних з ризиком недосягнення ефекту за гостротою зору, всі пацієнти були розподілені на дві групи: низька гострота зору (вихідна змінна Y = 1, при гостроті зору < 0,3) та задовільна гострота зору (вихідна змінна Y = 0, при гостроті зору > 0,3). Аналіз проводився для 10 факторів ризику: стать, вік, ПЕЧФ (мкА), етіологічний фактор, сумарна світлочутливість центрального поля зору (ЦПЗ) (дБ), сумарна світлочутливість периферичного зору (ППЗ) (дБ), RNFL (мкм), MD, PSD, коефіцієнт MD/RNFL thickness, коефіцієнт MD/Average GCL + IPL thickness.
Для кожної факторної ознаки була побудована модель прогнозування ризику низької гостроти зору. Результати аналізу однофакторних моделей регресії наведено в табл. 1.
Як видно з табл. 1, встановлено зростання ризику (p = 0,003) низької гостроти зору із зростанням показника ПЕЧФ, відношення шансів (ВШ) = 1,05 (95% довірчий інтервал (ДІ) 1,02–1,08) на кожен 1 мкА зростання ПЕЧФ. Виявлено також зниження (p = 0,047) ризику низької гостроти зору із зростанням показника RNFL, ВШ = 0,7 (0,5–1,0) на кожен 1 мкм зростання RNFL. Ризик низької гостроти зору також знижується (p = 0,01) із зростанням показника коефіцієнта MD/RNFL thickness, ВШ = 0,82 (0,70–0,95) на кожну 10–3 зростання коефіцієнта. Ризик низької гостроти зору знижується (p = 0,004) із зростанням показника коефіцієнта MD/Average GCL + IPL thickness, ВШ = 0,91 (0,85–0,97) на кожну 10–3 зростання коефіцієнта.
Для визначення значимих факторів, пов’язаних із ризиком низької гостроти зору, було проведено відбір з використанням методу покрокового відкидання-додавання ознак. В результаті відбору виділено три, приблизно рівних за значимістю, показники: ПЕЧФ (мкА), коефіцієнт MD/RNFL thickness, коефіцієнт MD/Average GCL + IPL thickness. Для визначення прогностичних якостей кожного із показників і вибору оптимального порогу прогнозування ризику низької гостроти зору використано метод побудови та аналізу кривих операційних характеристик тестів (рис. 1–3).
Як видно на рис. 1, при аналізі зв’язку показника ПЕЧФ з ризиком низької (< 0,3) гостроти зору виявлений сильний зв’язок, площа під кривою операційних характеристик AUC = 0,98 (95% ДІ 0,88–1,00). При виборі оптимального критичного порогу > 265 мкА чутливість тесту становить 100 % (95% ДІ 82,4–100), специфічність тесту — 93,1 % (95% ДІ 77,2–99,2).
Як видно на рис. 2, при аналізі зв’язку показника коефіцієнта MD/RNFL thickness з ризиком низької (< 0,3) гостроти зору виявлений сильний зв’язок, площа під кривою операційних характеристик AUC = 0,98 (95% ДІ 0,90–1,00). При виборі оптимального критичного порогу ≤ –0,036 чутливість тесту становить 95,2 % (95% ДІ 76,2–99,9), специфічність тесту — 95,6 % (95% ДІ 82,2–99,9).
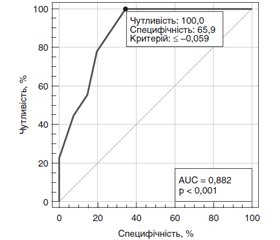
Як видно на рис. 3, при аналізі зв’язку показника коефіцієнта MD/Average GCL + IPL thickness з ризиком низької (< 0,3) гостроти зору виявлений сильний зв’язок, площа під кривою операційних характеристик AUC = 0,98 (95% ДІ 0,89–1,00). При виборі оптимального критичного порогу ≤ –0,059 чутливість тесту становить 100 % (95% ДІ 83,9–100), специфічність тесту — 93,1 % (95% ДІ 77,2–99,2 %).
Модель прогнозування ризику тяжкої стадії ЧАЗН. Для аналізу факторних ознак, пов’язаних з ризиком тяжкої стадії ЧАЗН, всі пацієнти були розподілені у дві групи: тяжка стадія ЧАЗН (вихідна змінна Y = 1, при 4-й та 5-й стадії) та середня стадія ЧАЗН (вихідна змінна Y = 0, при 1–3-й стадії захворювання). Аналіз проводився для 9 факторних ознак: стать, вік, етіологічний фактор, сумарна світлочутливість ЦПЗ (дБ), сумарна світлочутливість ППЗ (дБ), RNFL (мкм), MD, PSD, коефіцієнт MD/RNFL thickness, коефіцієнт MD/Average GCL + IPL thickness.
Для кожної факторної ознаки була побудована модель прогнозування ризику тяжкої стадії ЧАЗН. Результати аналізу однофакторних моделей регресії наведено в табл. 2.
Як видно з табл. 2, встановлено зниження ризику (p < 0,001) тяжкої стадії ЧАЗН із зростанням показника коефіцієнта MD/RNFL thickness, ВШ = 0,44 на кожну 10–3 зростання коефіцієнта. Ризик тяжкої стадії ЧАЗН також знижується (p = 0,02) із зростанням показника коефіцієнта MD/Average GCL + IPL thickness, ВШ = 0,96 (0,92–0,99) на кожну 10–3 зростання коефіцієнта.
Для визначення значимих факторів, пов’язаних із ризиком тяжкої стадії ЧАЗН, було проведено відбір з використанням методу покрокового відкидання-додавання ознак. В результаті відбору було виділено два показники: коефіцієнт MD/RNFL thickness та коефіцієнт MD/Average GCL + IPL thickness. Для визначення прогностичних якостей кожного із показників і вибору оптимального порогу прогнозування ризику тяжкої стадії ЧАЗН було використано метод побудови та аналізу кривих операційних характеристик тестів (рис. 4, 5).
Як видно на рис. 4, при аналізі зв’язку показника коефіцієнта MD/RNFL thickness з ризиком тяжкої стадії ЧАЗН (рис. 4) виявлений сильний зв’язок, площа під кривою операційних характеристик AUC = 1,000 (95% ДІ 0,93–1,00). При виборі оптимального критичного порогу ≤ –0,043 чутливість тесту становить 100 % (95% ДІ 66,4–100), специфічність тесту — 100 % (95% ДІ 91,4–100).
Як видно на рис. 5, при аналізі зв’язку показника коефіцієнта MD/Average GCL + IPL thickness з ризиком тяжкої стадії ЧАЗН виявлений сильний зв’язок, площа під кривою операційних характеристик AUC = 0,88 (95% ДІ 0,76–0,96). При виборі оптимального критичного порогу ≤ –0,059 чутливість тесту становить 100 % (95% ДІ 66,4–100), специфічність тесту — 65,9 % (95% ДІ 49,4–79,9).
Висновки
1. Розроблено математичні моделі прогнозування низької (< 0,3) гостроти зору у хворих на ЧАЗН різної етіології. За показником ПЕЧФ, при виборі критичного порогу > 265 мкА чутливість тесту становить 100 % (95% ДІ 82,4–100), специфічність тесту — 93,1 % (95% ДІ 77,2–99,2). За показником коефіцієнта MD/RNFL thickness, при виборі критичного порогу ≤ –0,036 чутливість тесту становить 95,2 % (95% ДІ 76,2–99,9), специфічність тесту — 95,6 % (95% ДІ 82,2–99,9). За показником коефіцієнта MD/Average GCL + IPL thickness, при виборі критичного порогу ≤ –0,059 чутливість тесту становить 100 % (95% ДІ 83,9–100), специфічність тесту — 93,1 % (95% ДІ 77,2–99,2).
2. Розроблено математичні моделі прогнозування тяжкої стадії ЧАЗН різної етіології. За показником коефіцієнта MD/RNFL thickness, при виборі критичного порогу ≤ –0,043 чутливість тесту становить 100 % (95% ДІ 66,4–100), специфічність тесту — 100 % (95% ДІ 91,4–100). За показником коефіцієнта MD/Average GCL + IPL thickness, при виборі критичного порогу ≤ –0,059 чутливість тесту становить 100 % (95% ДІ 66,4–100), специфічність тесту — 65,9 % (95% ДІ 49,4–79,9).
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
1. Галінська І.В. До питання етіології та частоти атрофії зорового нерва судинного генезу // Архів офтальмології України. — 2018. — Т. 6, № 2(11). — С. 6-9.
2. Галінська І.В. Розповсюдженість та етіологія часткової атрофії зорового нерва // Архів офтальмології України. — 2018. — Т. 6, № 1(10). — С. 19-23.
3. Shin Y.W. A case of optic nerve atrophy with severe disc cupping after methanol poisoning / Y.W. Shin, K.B. Uhm // Korean J. Ophthalmol. — 2011. — Vol. 25, № 2. — P. 146-150.
4. Васюта В.А. Експертна оцінка трирівневої системи профілактики атрофії зорових нервів / В.А. Васюта // Галицький лікарський вісник. — 2015. — Т. 22, № 2. — С. 144-146.
5. Tan J.Ch.H. A pilot trial of tele-ophthalmology for diagnosis of chronic blurred vision / J.Ch.H. Tan, E.W.T. Poh, S. Srinivasan, T.H. Lim // J. Telemedicine and Telecare. — 2013. — Vol. 19. — P. 65-69.
6. Correlation of structural retinal nerve fibre layer parameters and functional measures using Heidelberg Retinal Tomography and Spectralis spectral domain optical coherence tomography at different levels of glaucoma severity / J. Leaney, P.R. Healey, M. Lee, S.L. Graham // Clin. Experiment Ophthalmol. — 2012. — Vol. 40, № 8. — P. 802-812.
7. Петренко А.Ю. Стволовые клетки. Свойства и перспективы клинического применения / А.Ю. Петренко, Ю.А. Хунов, Э.Н. Иванов. — Луганск: Пресс-Экспресс, 2011. — 368 с.
8. Newman N.J. Treatment of Leber hereditary optic neuropathy / N.J. Newman // Brain. — 2011. — Vol. 134. — P. 2447-2450.
9. Hoffmann J. Volumetric assessment of optic nerve sheath and hypophysis in idiopathic intracranial hypertension / J. Hoffmann, C. Schmidt, H. Kunte [et al.] // Am. J. Neuroradiol. — 2014. — Vol. 35. — P. 513-518.
10. Васюта В.А. Управление факторами риска развития атрофии зрительных нервов на основе системного подхода и комплексных оценок / В.А. Васюта // Вестник Витебского государственного медицинского университета. — 2015. — Т. 14, № 3. — С. 78-82.
11. Бржеский В.В. Принципы лечения патологии зрительного нерва. Сукцинатсодержащие растворы — современный подход в лечении патологии зрительного нерва / В.В. Бржеский. — СПб.: Тактик-Студио, 2010. — 95 с.
12. Морозов В. И. Заболевания зрительного пути. Клиника. Диагностика. Лечение / В.И. Морозов, А.А. Яковлев. — М.: Бином, 2010. — 650 с.

/52-1.jpg)
/53-1.jpg)
/53-2.jpg)
/54-1.jpg)
/54-2.jpg)