Международный эндокринологический журнал Том 15, №1, 2019
Вернуться к номеру
Поліморфізм rs1800629 гена TNF-α при цукровому діабеті 2-го типу. Зв’язок із розвитком нефропатії
Авторы: Зябліцев С.В.(1), Чернобривцев О.П.(1), Зябліцев Д.С.(2)
1 - Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
2 - Київський медичний університет, м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Актуальність. При цукровому діабеті (ЦД) формується ендотеліальна дисфункція (ЕДФ), що визначає швидкість і тяжкість ускладнень захворювання. Серед інших чинників її розвитку сприяє наявність генетичного поліморфізму, що може відрізнятися в різних етнічних популяціях. Мета дослідження: визначити зв’язок поліморфізму rs1800629 гена TNF-α з ЦД 2-го типу в українських хворих, а також зв’язок із розвитком ускладнень і чинниками ЕДФ. Матеріали та методи. До дослідження залучено дані 152 українських хворих із ЦД 2-го типу віком від 34 до 80 років (53,9 ± 8,4 року) та 95 практично здорових осіб (контроль). За результатами клініко-лабораторних обстежень визначали наявність ретинопатії, нефропатії за рівнями мікроальбумінурії та швидкості клубочкової фільтрації (ШКФ), сенсорної полінейропатії, ангіопатії нижніх кінцівок та артеріальної гіпертензії. Поліморфізм rs1800629 визначали методом полімеразної ланцюгової реакції в реальному часі (ампліфікатор Gene Amp® PCR System 7500 Applied Biosystems, США) за допомогою тест-систем TaqMan Mutation Detection Assays Life-Technology (США). Для статистичної обробки даних використовували програму Statistica 10 (StatSoft, Inc., США). Результати. В українській когорті хворих на ЦД 2-го типу з розвитком захворювання був пов’язаний розподіл алелей (χ2 = 5,91; р = 0,015) але не генотипів (χ2 = 5,65; p = 0,059) rs1800629 гена TNF-α. Мінорна алель А збільшувала шанси розвитку ЦД 2-го типу (ВШ = 1,71; 95% ДІ 1,11–2,65). Наявність алелі А сприяла зменшенню ШКФ, що пояснювало зв’язок rs1800629 із розвитком нефропатії (χ2 = 6,38; р = 0,041) та було обумовлено розвитком ЕДФ із високими рівнями в крові TNF-α (р < 0,001), ендотеліну-1 (р = 0,026) й оксиду азоту (NO; р < 0,001). Висновки. Поліморфізм rs1800629 гена TNF-α мав зв’язок із розвитком ЦД 2-го типу у хворих з української популяції, а серед ускладнень — із розвитком нефропатії за швидкістю клубочкової фільтрації, що було пов’язане з наявністю мінорної алелі А та більш вираженою ЕДФ у таких хворих порівняно з носіями алелі G.
Актуальность. При сахарном диабете (СД) формируется эндотелиальная дисфункция (ЭДФ), которая определяет скорость и тяжесть осложнений заболевания. Среди других факторов ее развитию способствует наличие генетического полиморфизма, что может отличаться в разных этнических популяциях. Цель исследования: определить связь полиморфизма rs1800629 гена TNF-α с СД 2-го типа у украинских больных, а также связь с развитием осложнений и факторами ЭДФ. Материалы и методы. В исследование включены данные 152 больных с СД 2-го типа в возрасте от 34 до 80 лет (53,9 ± 8,4 года) и 95 практически здоровых лиц (контроль). По результатам клинико-лабораторных обследований определяли наличие ретинопатии, нефропатии по уровню микроальбуминурии и скорости клубочковой фильтрации, сенсорной полинейропатии, ангиопатии нижних конечностей и артериальной гипертензии. Полиморфизм rs1800629 определяли методом полимеразной цепной реакции в реальном времени (амплификатор Gene Amp® PCR System 7500 Applied Biosystems, США) с помощью тест-систем TaqMan Mutation Detection Assays Life-Technology (США). Для статистической обработки данных использовали программу Statistica 10 (StatSoft, Inc., США). Результаты. В украинской когорте больных СД 2-го типа с развитием заболевания было связано распределение аллелей (χ2 = 5,91; р = 0,015), но не генотипов (χ2 = 5,65; p = 0,059) rs1800629 гена TNF-α. Минорная аллель А увеличивала шансы развития СД 2-го типа (ОШ = 1,71; 95% ДИ 1,11–2,65). Наличие аллели А способствовало уменьшению клубочковой фильтрации, что объясняло связь rs1800629 с развитием нефропатии (χ2 = 6,38; р = 0,041) и было обусловлено развитием ЭДФ с высокими уровнями в крови TNF-α (р < 0,001), эндотелина-1 (р = 0,026) и оксида азота (NO; р < 0,001). Выводы. Полиморфизм rs1800629 гена TNF-α был связан с развитием СД 2-го типа у больных из украинской популяции, а среди осложнений — с развитием нефропатии по скорости клубочковой фильтрации, что было связано с наличием минорной аллели А и более выраженной ЭДФ у таких больных по сравнению с носителями аллели G.
Background. In diabetes mellitus (DM), endothelial dysfunction (EDF) is formed that determines the rate and severity of the disease complications. Among other factors, there is the presence of genetic polymorphism, which can be different in different ethnic populations. The purpose was to determine the relationship between rs1800629 polymorphism of the TNFα gene and type 2 DM in Ukrainian patients, as well as the association with the development of complications and EDF factors. Materials and methods. The study involved data from 152 Ukrainian patients with type 2 DM aged 34–80 years (53.9 ± 8.4 years) and 95 apparently healthy persons (controls). According to the results of clinical and laboratory examinations, the presence of retinopathy, nephropathy was determined by levels of microalbuminuria and glomerular filtration rate, sensory polyneuropathy, angiopathy of the lower extremities, and hypertension. The rs1800629 polymorphism was determined by real time polymerase chain reaction (Gene Amp® PCR System 7500 Applied Biosystems, USA) using the TaqMan Mutation Detection Assays Life-Technology (USA) test systems. Statistical data processing was performed by Statistica 10 (StatSoft Inc., USA). Results. The distribution of alleles (χ2 = 5.91; p = 0.015), but not genotypes (χ2 = 5.65; p = 0.059) rs1800629 of the TNFα gene was associated with the disease development in the Ukrainian cohort of patients with type 2 DM. Minor allele A increased the risk of type 2 DM (odds ratio = 1.71; 95% confidence interval 1.11–2.65). The presence of allele A led to the reduction of glomerular filtration rate that explained the association of rs1800629 with nephropathy (χ2 = 6.38; p = 0.041) and was due to the development of EDF with high levels of TNFα (p < 0.001), endothelin-1 (p = 0.026) and nitric oxide (p < 0.001). Conclusions. The rs1800629 polymorphism of the TNFα gene was associated with the type 2 DM in patients from the Ukrainian population, and among the complications — with the development of nephropathy in terms of the glomerular filtration rate, which was related to the presence of minor allele A and more severe EDF in such patients as compared to G allele carriers.
цукровий діабет 2-го типу; нефропатія; ендотеліальна дисфункція; поліморфізм rs1800629 гена TNF-α
сахарный диабет 2-го типа; нефропатия; эндотелиальная дисфункция; полиморфизм rs1800629 гена TNF-α
type 2 diabetes mellitus; nephropathy; endothelial dysfunction; rs1800629 polymorphism of TNFα gene
Вступ
Загальновідомо, що цукровий діабет (ЦД) — захворювання, що проявляється насамперед за рахунок своїх ускладнень, які визначають його тяжкість, ранню інвалідизацію і передчасну смертність населення [1, 2]. Для формування судинних ускладнень ключовим є поняття ролі судинного ендотелію, що є динамічною регулюючою системою як при фізіологічних, так і при патологічних процесах [3, 4]. Ендотеліальна дисфункція (ЕДФ) формується при запаленні судин, атеросклерозі, артеріальній гіпертензії (АГ), кардіоміопатії, ретинопатії, нейропатії [4, 5].
Останнім часом доведена важлива роль генетичних факторів, що відіграють етіологічну роль як чинники, що сприяють виникненню метаболічних захворювань, у тому числі ЦД 2-го типу [5–12]. Ще в метааналізі Z.H. Liu (2013), до якого увійшли 10 досліджень (1425 хворих на ЦД 2-го типу та 1116 — із групи контролю), у китайського населення популяції Хан було встановлено наявність зв’язку алелі А поліморфізму rs1800629 гена TNF-α (відношення шансів (ВШ) = 1,63; 95% довірчий інтервал (ДІ) 1,17–2,25) та генотипів за домінантною моделлю успадкування (G/A + AA) проти G/G (ВШ = 1,47; 95% ДІ 1,17–1,85) [5]. Такий результат метааналізу показав, що поліморфізм rs1800629 гена TNF-α був сильно пов’язаний із ризиком ЦД 2-го типу і алель А є алеллю ризику.
З іншого боку, у пакистанському дослідженні встановлено, що хворі на ЦД 2-го типу з популяції Панджабі Ражпут не мали мінорної алелі А поліморфізму rs1800629 гена TNF-α [6], хоча рівень TNF-α у них був істотно більшим, ніж у контрольній групі. З іншого боку, дослідженнями Програми 1000 Genomes Project Phase 3 (http://www.internationa lgenome.org/) показана наявність мінорної алелі А в представників Східної Азії (f = 0,059), а в численних дослідженнях показано, що у хворих на ЦД 2-го типу частота цієї алелі збільшена (до 0,11–0,20) [5, 9, 11, 13].
Дані австралійського дослідження (2494 особи з ЦД 1-го і 2-го типу) показали, що алель А поліморфізму rs1800629 гена TNF-α була пов’язана з розвитком ЦД 1-го типу (р < 0,001), але не з ЦД 2-го типу та розвитком діабетичної ретинопатії (ДР) [7]. Також і дослідження [8], що було проведено у 205 північно-східних бразильських хворих на ЦД 1-го типу, показало наявність такого зв’язку для поліморфізму rs1800629 гена TNF-α.
На відміну від результатів дослідження [7] у бразильському дослідженні [9] (745 хворих на ЦД 2-го типу, у тому числі 331 особа без ДР, 246 — із непроліферативною і 168 — із проліферативною ДР) показано що частота алелі А поліморфізму rs1800629 гена TNF-α була суттєво вищою у хворих із проліферативною ДР, ніж в інших групах хворих (р = 0,035), та мала асоціацію з її розвитком за домінантною моделлю успадкування (ВШ = 1,82; 95% ДІ 1,11–2,98). У наших попередніх дослідженнях показано, що різні ускладнення ЦД 2-го типу можуть бути пов’язані з різними поліморфними ДНК-локусами [10].
В індійських дослідженнях [11–13] показана наявність асоціації поліморфізму rs1800629 гена TNF-α з розвитком ЦД 2-го типу. Крім того, у дослідженні [11] показана наявність асоціації цього поліморфізму з діабетичною виразкою на стопі та приростом рівнів у крові IL-6, TNF-α і хемокіну SDF-1 у таких хворих. У роботі [13] визначено, що поліморфізм гена TNF-α -308G/A був потужним фактором ризику ЦД 2-го типу, особливо для хворих віком понад 45 років.
В системному огляді публікацій із 2000 по 2016 рік, виконаному G.I. Luna та співавт. (2016), звернуто увагу на суперечливість результатів визначення впливу поліморфізму rs1800629 гена TNF-α на розвиток ЦД 2-го типу в різних популяціях, що, на думку авторів, пов’язане з етнічними розходженнями та диктує необхідність таких досліджень у кожній популяції окремо [14].
Таким чином, наведені дані мали суперечливий характер і, хоча загалом вказували на наявність зв’язку промоторного поліморфізму rs1800629 (-308G/A) гена TNF-α з ЦД 2-го типу, також підкреслювали необхідність проведення таких досліджені у хворих з окремих етнічних груп.
Мета дослідження: визначити зв’язок поліморфізму rs1800629 гена TNF-α з ЦД 2-го типу в українських хворих, а також зв’язок із розвитком ускладнень і чинниками ЕДФ.
Матеріали та методи
До дослідження залучено дані 152 хворих із ЦД 2-го типу, які не мали родинних зв’язків та були етнічними українцями. Вік пацієнтів становив від 34 до 80 років, у середньому — 53,9 ± 8,4 року. Жінок було 95 (62,5 %), чоловіків — 57 (37,5 %). Згідно з клінічними рекомендаціями [1, 15, 16] за результатами клініко-лабораторних обстежень визначали наявність діабетичних ретинопатії, нефропатії — за рівнями альбумінурії та швидкості клубочкової фільтрації (ШКФ), сенсорної полінейропатії, макроангіопатії нижніх кінцівок та АГ. Відповідно до клінічної класифікації [16] перший ступінь тяжкості не був виявлений у жодного пацієнта, другий — у 120 (78,9 %) та третій — у 32 (21,1 %) хворих. До контрольної групи були залучені 95 практично здорових осіб відповідного вікового та гендерного розподілу, які не мали порушень вуглеводного обміну.
У крові визначали маркери ЕДФ: біохімічними методами — вміст оксиду азоту (NO) і дієнових кон’югат (ДК) на спектрофометрі Specord (Німеччина); імуноферментним методом — ендотеліну-1 (ЕТ-1; Biomedica Immunoassays, Австрія), ендотеліальної NO-синтази (eNOS; BCM Diagnostics, США) і фактора некрозу пухлини (TNF-α; Bender Medsystems, Австрія). Інтенсивність забарвлення продукту ферментативної реакції кількісно вимірювали на фотометрі Multiscan EX, Thermo Electron Corp. (Фінляндія).
Аналіз поліморфізму rs1800629 гена TNF-α (SNP у промоторному регіоні -308G/A; генна локалізація 6p21.33) проведено методом полімеразної ланцюгової реакції в реальному часі (контекстна послідовність GAGGCAATAGGTTTTGAGGGGCATG[A/G]GGACGGGGTTCAGCCTCCAGGGTCC) в автоматичному ампліфікаторі Gene Amp® PCR System 7500 (Applied Biosystems, США). На першому етапі дослідження виконували виділення геномної ДНК із цільної венозної крові з використанням стандартних реактивів PureLink® Genomic DNA Kit For Purification of Genomic DNA; виробник — Invitrogen (США). Аналіз поліморфізму здійснено з використанням уніфікованих тест-систем TaqMan Mutation Detection Assays Life-Technology (США).
Для статистичної обробки отриманих даних використовували програму Statistica 10 (StatSoft, Inc., США). Після проведення тестів Колмогорова — Смирнова, Андерсона — Дарлінга і χ-квадрат був установлений відмінний від нормального характер розподілу варіаційних рядів (p < 0,05), відповідно, для описової статистики кількісних даних показників ЕДФ використовували медіану (Me) та перший і третій квартилі (Q1; Q3). Незалежні вибірки порівнювали із застосуванням критеріїв Kruskal — Wallis (H) і Mann — Whitney (U). Для порівняння категоріальних змінних використовували таблиці спряженості і непараметричні критерії х-квадрат (χ2) Пірсона у модифікації Йейтса. У всіх випадках статистичного оцінювання значущість відмінностей враховували при значенні p < 0,05.
Результати
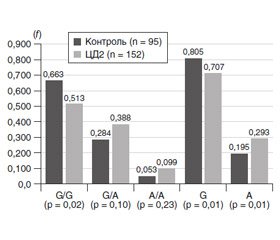
На першому етапі результати розподілу генотипів й алелей у контрольній групі, що було отримано в нашому дослідженні (рис. 1), було порівняно з результатами Програми 1000 Genomes Project Phase 3 (http://www.ensembl.org/Homo_sapiens/Variation/Population?v=rs1800629;vdb=variation).
У Програмі для визначення частот генотипів rs1800629 гена TNF-α були залучені 2504 людини. Предковий генотип G/G був визначений із частотою 0,827 (у наших дослідженнях — 0,663), гетерозигота G/A — 0,165 (у наших дослідженнях — 0,284), мінорна гомозигота Т/Т — 0,008 (у наших дослідженнях — 0,053); для європейської популяції (n = 503) частоти становили відповідно 0,744; 0,245 та 0,012. Отже, наші результати більшою мірою збігалися з результатами для європейської популяції.
При порівнянні розподілу алелей у контрольній групі (рис. 1) із даними Програми 1000 Genomes Project Phase 3 встановлено, що для всіх спостережень (n = 5008) предкова алель G була визначена з частотою 0,910 (у наших дослідженнях — 0,805), мутантна алель Т — 0,090 (у наших дослідженнях — 0,195); для європейської популяції (n = 1006) показники становили відповідно 0,866 та 0,134. Отже, результати контрольної групи і за розподілом генотипів й алелей більшою мірою відповідали даним Програми 1000 Genomes Project Phase 3 для європейської популяції. Визначення статистичної значущості відмінностей розподілів частот у європейській популяції і нашому дослідженні показало такі результати: для генотипів — χ2 = 5,38; p = 0,07 та для алелей — χ2 = 3,28; p = 0,07). Отже, дійсно суттєвих розбіжностей результатів досліджень визначено не було.
Надалі було проведено статистичне порівняння за двостороннім точним методом Фішера даних із розподілу генотипів й алелей у хворих із такими показниками в контрольній групі. Для цього спочатку було проаналізовано загальну тенденцію частот генотипів й алелей, потім — частотні різниці, які вказували на вплив генотипів й алелей на розвиток захворювання, і на завершення для виявлення відмінностей, значущих за критерієм χ2 Пірсона, розглянуто відношення шансів та 95% довірчий інтервал, тобто асоціацію з ЦД 2-го типу (генетичний ризик).
Як свідчили дані, що наведені на рис. 1, у групі хворих відзначалося значуще зменшення частоти предкового гомозиготного генотипу G/G (в 1,3 раза; p = 0,02) порівняно з контролем. Збільшення частот гетерозиготного генотипу G/A та мінорного генотипу А/А (відповідно в 1,4 та 2,0 раза) порівняно з контролем було статистично незначущим (відповідно р = 0,10 та 0,24). Також у хворих відзначалися статистично значуще зменшення частоти предкової алелі G (в 1,13 раза; р = 0,01) та збільшення частоти мінорної алелі А (в 1,45 раза; р = 0,01) порівняно з контролем.
Таким чином, було показано, що розподіл генотипу G/G й обох алелей rs1800629 значимо відрізнявся у хворих на ЦД 2-го типу від контрольної групи. З огляду на це був розрахований вплив розподілу частот генотипів (табл. 1) й алелей (табл. 2) на розвиток ЦД 2-го типу і ступінь їх асоціації з захворюванням. Тест Харді — Вайнберга для групи контролю та випадків ЦД 2-го типу відповідав випадковому характеру успадкування генотипів (відповідно χ2 = 0,84; df = 1; p = 0,360 та χ2 = 0,60; df = 1; p = 0,438).
Аналіз впливу генотипів за таблицею спряженості (3 × 3) показав відсутність зв’язку з ЦД 2-го типу (χ2 = 5,65; p = 0,059). На відміну від цього порівняння частот алелей за таблицею спряженості (2 × 2) показало наявність такого впливу (χ2 = 5,91; p = 0,015). Отже, алельний поліморфізм rs1800629 гена TNF-α мав зв’язок із розвитком ЦД 2-го типу, при цьому мінорна алель А збільшувала в 1,7 раза шанси розвитку ЦД 2-го типу (ВШ = 1,71; 95% ДІ 1,11–2,65), тоді як предкова алель G такі шанси зменшувала в 1,7 раза (ВШ = 0,58; 95% ДІ 0,38–0,90).
Таким чином, було показано, що мінорна алель А rs1800629 збільшувала шанси розвитку ЦД 2-го типу і була фактором ризику розвитку цього захворювання: шанси розвитку ЦД 2-го типу у хворих з української популяції — носіїв алелі А rs1800629 були збільшені в 1,7 раза (р = 0,015), тоді як предкову алель G можна було вважати протекторним фактором.
Надалі згідно з планом дослідження була перевірена наявність впливу генотипу rs1800629 на ступінь тяжкості стану хворих і ступінь компенсації ЦД за показниками глікемії та глікованого гемоглобіну (HbA1с), що, на наш погляд, могло би висвітлити наявність впливу генотипу на прогресування захворювання. На жаль, аналіз даних показав, що розподіл і генотипів, і алелей rs1800629 статистичного значення в жодному випадку не мав (р > 0,05). Також була показана відсутність впливу генотипів й алелей rs1800629 на вік хворих, тривалість хвороби, індекс маси тіла, величини систолічного і діастолічного артеріального тиску (р > 0,05).
Логічним у цьому плані здавався подальший пошук впливу rs1800629 на розвиток окремих судинних ускладнень ЦД 2-го типу, результати якого наведено в табл. 3.
Як показали розрахунки, генотипи статистично значуще впливали на наявність нефропатії за швидкістю клубочкової фільтрації (ШКФ) (χ2 = 6,38; р = 0,041). На цей самий показник впливав і розподіл алелей (χ2 = 6,78; р = 0,009); на інші ускладнення розподіл генотипів (як і алелей) не впливав.
Виявленню зв’язку поліморфізмів генів прозапальних цитокінів (TNF-α, IL-6 і IL-1β) із ЦД 2-го типу і діабетичною нефропатією присвячено комплексне індійське дослідження [18]. Поліморфізм rs1800629 гена TNF-α було визначено в 1326 пацієнтів, серед яких було 448 осіб із ЦД 2-го типу та діабетичною нефропатією, 414 осіб із ЦД 2-го типу без діабетичної нефропатії та 464 — із групи контролю. Найвисоку асоціацію з ЦД 2-го типу за наявності діабетичної нефропатії мав поліморфізм rs1800629 гена TNF-α: для генотипу А/А (ВШ = 2,75; 95% ДІ 1,64–4,59; р = 0,001). Дослідження зв’язку поліморфізму rs1800629 гена TNF-α з розвитком діабетичної нефропатії за рівнем мікроальбумінурії було проведено у 756 хворих на ЦД 2-го типу в роботі [19]. Установлено, що алель А значно підвищувала ризик мікроальбумінурії (ВШ = 2,1; 95% ДІ 0,8–3,7; р < 0,001). Отже, ці дані цілком збігалися з результатами, отриманими в нашому дослідженні: в українській когорті хворих на ЦД 2-го типу мінорна алель А та генотипи (G/A + A/A) були пов’язані з ЦД 2-го типу та розвитком нефропатії в таких хворих.
Надалі було проаналізовано вплив алелей rs1800629 на клініко-лабораторні показники, що –відображали функцію нирок у хворих на ЦД 2-го типу (табл. 4).
Перевірка за критерієм Mann — Whitney показала наявність впливу алелей на ШКФ (U = 8211; р = 0,045). При цьому її рівень був нижчим за наявності алелі ризику А проти предкової протективної алелі G. Це безпосередньо вказувало на патогенетичну роль мінорної алелі А в порушенні функції нирок при ЦД 2-го типу.
Розрахунок для генотипів показав відсутність їх впливу на всі досліджені показники функції нирок (р > 0,05) і в тому числі на ШКФ (р = 0,165).
Вплив поліморфізму rs1800629 на чинники ЕДФ подано в табл. 5.
Вплив генотипів поліморфізму rs1800629 серед всіх чинників ЕДФ виявився при визначенні вмісту в крові ЕТ1 (Н = 7,26; р = 0,026), NO (Н = 59,03; р = < 0,001) і TNF-α (Н = 67,42; р = < 0,001). При цьому рівні в крові всіх чинників були суттєво вищими за наявності генотипу ризику А/А проти предкового генотипу G/G, що особливо проявлялося для TNF-α, рівень якого в носіїв генотипу А/А був вищим у 1,8 раза, ніж у носіїв генотипу G/G (р = < 0,001). Аналогічні результати демонстрував і вплив алелей (за критерієм Mann — Whitney для ЕТ1: U = 7735; р = 0,008; для NO: U = 4157; р = 8,64Е-15 і для TNF-α: U = 3665; р = 2,60Е-17).
Обговорення
У дослідженні [18] показано, що у хворих на ЦД 2-го типу — носіїв мінорного генотипу А/А rs1800629 експресія гена TNF-α була збільшена більше ніж у 4 рази (n-fold = 4,43 ± 1,11), що супроводжувалося суттєвим збільшенням рівнів у крові TNF-α. Також у дослідженні [19] встановлено, що мінорний генотип А/А й алель А rs1800629 значно підвищували рівні в крові TNF-α, що було виражено більшою мірою у хворих із нефропатією. Отже, ці літературні дані разом із отриманими в даному дослідженні встановлювали загальну патогенетичну закономірність: наявність мінорної алелі А є патогенетичним фактором розвитку діабетичної нефропатії, а одним із механізмів розвитку цього стану може бути надлишкова експресія гена TNF-α, що призводить до надмірного синтезу прозапального цитокіну TNF-α. Більший вміст у таких хворих ЕТ1 і NO вказував на залучення і цих чинників ЕДФ у патогенез діабетичної нефропатії, можливо, внаслідок більшого пошкодження ендотелію у хворих — носіїв алелі А.
За сучасними уявленнями, патогенез діабетичної нефропатії — це складний багатовимірний процес, в якому поєднуються запалення, окисний стрес та генетичні чинники [20]. Ключова роль належить гломерулярній гіперфільтрації внаслідок порушення тубулогломерулярного оберненого зв’язку, що зменшує тонус аферентної артеріоли і призводить до гломерулярної гіпертензії. Очевидно, що результати даного дослідження обґрунтовують залучення до цих механізмів і виявлені патогенетичні закономірності.
Відповідно до отриманих результатів можна було дійти висновку, що поліморфізм rs1800629 гена TNF-α мав зв’язок із розвитком ЦД 2-го типу, а серед ускладнень — із розвитком нефропатії за ШКФ. Мінорна алель А сприяла зниженню ШКФ, що пояснювало встановлений факт і реалізувалося через такі чинники ЕДФ, як значне підвищення рівня в крові TNF-α, а також ЕТ1 і NO.
Висновки
1. В українській когорті хворих на ЦД 2-го типу розподіл алелей rs1800629 гена TNF-α пов’язаний із розвитком захворювання (χ2 = 5,91; р = 0,015). Мінорна алель А збільшувала в 1,7 раза (ВШ = 1,71; 95% ДІ 1,11–2,65) шанси розвитку ЦД 2-го типу.
2. Наявність алелі А сприяла зменшенню швидкості клубочкової фільтрації, що пояснювало зв’я–зок rs1800629 із розвитком нефропатії (χ2 = 6,38; р = 0,041) та було обумовлено розвитком ЕДФ із високими рівнями в крові TNF-α (р < 0,001), ЕТ1 (р = 0,026) і NO (р < 0,001).
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.

/18-1.jpg)
/19-1.jpg)
/19-2.jpg)
/20-1.jpg)