Журнал «Актуальная инфектология» Том 7, №2, 2019
Вернуться к номеру
Значение генотипов вируса гепатита В в клинической практике
Авторы: Зайцев И.А., Новак И.Н., Зайцева О.Е., Кириенко В.Т.
Национальный медицинский университет имени А.А. Богомольца, г. Киев, Украина
Рубрики: Инфекционные заболевания
Разделы: Справочник специалиста
Версия для печати
Інфекція, спричинена вірусом гепатиту В (HBV), як і раніше, залишається глобальною проблемою охорони здоров’я і характеризується високим рівнем захворюваності та смертності. У процесі реплікації вірусу накопичуються численні мутації, які протягом філогенезу призводять до появи генотипів і субгенотипів HBV. На сьогодні налічується 10 різних генотипів HBV (A-J). Вони мають різне географічне поширення з досить вираженим переважанням тих чи інших генотипів залежно від регіону. В Україні, як і в інших європейських країнах, відзначається переважання генотипів A і D. Велика кількість досліджень вказує на те, що генотип HBV впливає на природний перебіг захворювання, схильність до хронізації, ймовірність сероконверсії HBeAg і відповідь на терапію пегільованим інтерфероном альфа. У даному літературному огляді узагальнені результати наукових досліджень, присвячених вивченню впливу генотипів HBV на природний перебіг захворювання. Наводяться дані про географічне поширення генотипів HBV в Україні та світі, аргументується важливість визначення генотипів HBV з точки зору їх впливу на перебіг та наслідки HBV-інфекції.
Инфекция, вызванная вирусом гепатита В (HBV), по-прежнему остается глобальной проблемой здравоохранения и характеризуется высоким уровнем заболеваемости и смертности. В процессе репликации вируса накапливаются многочисленные мутации, которые в ходе филогенеза приводят к появлению генотипов и субгенотипов HBV. На сегодняшний день насчитывается 10 различных генотипов HBV (A-J). Они имеют различное географическое распространение с достаточно выраженным преобладанием тех или иных генотипов в зависимости от региона. В Украине, как и в других европейских странах, отмечается преобладание генотипов A и D. Большое число исследований указывает на то, что генотип HBV влияет на естественное течение заболевания, склонность к хронизации, вероятность сероконверсии HBeAg и ответ на терапию пегилированным интерфероном альфа. В данном литературном обзоре обобщены результаты научных исследований, посвященных изучению влияния генотипов HBV на естественное течение заболевания. Приводятся данные о географическом распространении генотипов HBV в Украине и мире, аргументируется значимость определения генотипов HBV с точки зрения их влияния на течение и исходы HBV-инфекции.
Hepatitis B virus (HBV) infection remains a global public health problem with significant morbidity and mortality. During virus replication, numerous mutations are accumulated, and in the process of phylogenesis it leads to the appearance of HBV genotypes and subgenotypes. HBV has been classified into 10 genotypes (A-J). They have a distinct geographical distribution. In Ukraine, as in other European countries, genotypes A and D prevail. A large number of studies showed a correlation between HBV genotype and the natural progression of the disease, the tendency to chronicity, the rate of HBeAg seroconversion and the response to pegylated interferon alpha treatment. This literature review summarizes results of the studies on the influence of HBV genotypes on the natural progression of the disease. The data on the geographical distribution of HBV genotypes in Ukraine and in the world are given, the significance of determining specific genotypes in terms of their influence on the course and outcome of HBV infection is argued.
HBV-інфекція; генотип HBV; природний перебіг HBV-інфекції; цироз печінки; гепатоцелюлярна карцинома; шляхи передачі гепатиту В; хронічний гепатит В
HBV-инфекция; генотип HBV; естественное течение HBV-инфекции; цирроз печени; гепатоцеллюлярная карцинома; пути передачи гепатита В; хронический гепатит В
HBV infection; HBV genotype; natural progression of HBV infection; liver cirrhosis; hepatocellular carcinoma; hepatitis B transmission routes; chronic hepatitis B
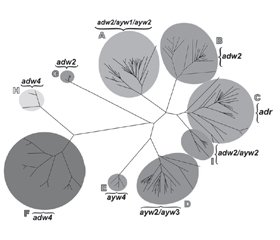
/21.jpg) Генотип А широко распространен в странах Африки к югу от Сахары, Западной Африки и Северной Европы; генотипы B и C обычно встречаются в Азии; генотип С в первую очередь встречается в Юго-Восточной Азии; генотип D доминирует в Африке, Европе, средиземноморских странах и Индии; генотип G выявляется во Франции, Германии и Соединенных Штатах; и генотип H — в Центральной и Южной Америке. Относительно недавно генотип I был выявлен во Вьетнаме и Лаосе, а генотип J — на островах Рюкю в Японии.
Генотип А широко распространен в странах Африки к югу от Сахары, Западной Африки и Северной Европы; генотипы B и C обычно встречаются в Азии; генотип С в первую очередь встречается в Юго-Восточной Азии; генотип D доминирует в Африке, Европе, средиземноморских странах и Индии; генотип G выявляется во Франции, Германии и Соединенных Штатах; и генотип H — в Центральной и Южной Америке. Относительно недавно генотип I был выявлен во Вьетнаме и Лаосе, а генотип J — на островах Рюкю в Японии. 1. Blumberg B.S., Gerstley B.J.S., Hungerford D.A. et al. A serum antigen (Australia antigen) in Down’s syndrome, leukemia, and hepatitis // Ann. Intern. Med. 1967; 66: 924-931.
2. Prince A.M. An antigen detected in the blood during the incubation period of serum hepatitis // Proc. Natl. Acad. Sci USA. 1968; 60: 814-821.
3. Dane D.S., Cameron C.H., Briggs M. Virus-like particles in serum of patients with Australia-antigen-associated hepatitis // Lancet. 1970; 1: 695-698.
4. Tiollais P., Charnay P., Vyas G.N. Biology of hepatitis B virus // Science. 1981; 213: 406-411.
5. Bruss V., Ganem D. The role of envelope proteins in hepatitis B virus assembly // Proc. Nat. Acad. Sci USA. 1991; 88: 1059-63.
6. Okamoto H., Tsuda F., Sakugawa H. et al. Typing hepatitis B virus by homology in nucleotide sequence: comparison of surface antigen subtypes // J. Gen. Virol. 1988; 69: 2575-2583.
7. Kramvis A., Kew M., Francois G. Hepatitis B virus genotypes // Vaccine. 2005; 23: 2409-2423.
8. Yu H., Yuan Q., Ge S.X. et al. Molecular and phylogenetic analyses suggest an additional hepatitis B virus genotype “I” // PloSOne. 2010; 5: e9297.
9. Norder H., Courouce A.M., Coursaget P. et al. Genetic diversity of hepatitis B virus strains derived worldwide: genotypes, subgenotypes, and HBsAg subtypes // Intervirology. 2004; 47: 289-309.
10. Kramvis A. Genotypes and genetic variability of hepatitis B virus // Intervirology. 2014; 57: 141-150.
11. Bartholomeusz A., Schaefer S. Hepatitis B virus genotypes: comparison of genotyping methods // Rev. Med. Virol. 2004; 14: 3-16.
12. Schaefer S. Hepatitis B virus taxonomy and hepatitis B virus genotypes // World J. Gastroenterol. 2007; 13: 14-21.
13. Kramvis A., Kew M.C. Relationship of genotypes of hepatitis B virus to mutations, disease progression and response to antiviral therapy // Journal of Viral Hepatitis. 2005; 12: 456-464.
14. Tong S., Revill Р. Overview of viral replication and genetic variability // J. Hepatol. 2016 April; 64(1 Suppl): S4-S16.
15. Courouce-Pauty A.-M., Plancon A. and Soulier J.-P. Distribution of HBsAg subtypes in the world // Vox. Sanguinis. 1983; 44: 197-211.
16. Kramvis A., Arakawa K., Yu M.C. et al. Relationship of serological subtype, basic core promoter and precore mutations to genotypes/subgenotypes of hepatitis B virus // Journal of Medical Virology. 2008; 80: 27-46.
17. Sunbul M. Hepatitis B virus genotypes: Global distribution and clinical importance // World J. Gastroenterol. 2014 May 14; 20(18): 5427-5434.
18. Summers J., Mason W.S. Replication of the genome of a hepatitis B — like virus by reverse transcription of an RNA intermedia–te // Cell. 1982; 29: 403-415.
19. Beck J., Nassal M. Hepatitis B virus replication // World Journal of Gastroenterology. 2007; 13: 48-64.
20. Junker-Niepmann M., Bartenschlager R., Schaller H. A short cis-acting sequence is required for hepatitis B virus pregenome encapsidation and sufficient for packaging of foreign RNA // EMBO Journal. 1990; 9: 3389-3396.
21. Kramvis A., Kew M.C. Structure and function of the encapsidation signal of hepadnaviridae // Journal of Viral Hepatitis. 1998; 5: 357-367.
22. Kato H., Orito E., Gish R.G., Bzowej N. et al. Hepatitis B e antigen in sera from individuals infected with hepatitis B virus of genotype G // Hepatology. 2002; 35: 922-929
23. Chudy M., Schmidt M., Czudai V. et al. Hepatitis B virus genotype G monoinfection and its transmission by blood components // Hepatology. 2006; 44: 99-107.
24. Tatematsu K., Tanaka Y., Kurbanov F. et al. A genetic variant of hepatitis B virus divergent from known human and ape genotypes isolated from a Japanese patient and provisionally assigned to new genotype J // Journal of Virology. 2009; 83: 10538-10547.
25. Locarnini S., Littlejohn M., Aziz M.N., Yuen L. Possible origins and evolution of the hepatitis B virus (HBV) // Seminars in Cancer Biology. 2013; 23: 561-575.
26. Wang Y., Shan X., Liang Z. et al. Deep sequencing analysis of HBV genotype shift and correlation with antiviral efficiency during adefovir dipivoxil therapy // PloS One. 2015; 10: e0131337.
27. Shi W., Carr M.J., Dunford L., Zhu C. et al. Identification of novel inter-genotypic recombinants of human hepatitis B viruses by large-scale phylogenetic analysis // Virology. 2012; 427: 51-59.
28. Araujo N.M. Hepatitis B virus intergenotypic recombinants worldwide: An overview // Infect. Genet. Evol. 2015; 36: 500-510.
29. Pourkarim M.R., Amini-Bavil-Olyaee S., Kurbanov F., Van Ranst M., Tacke F. Molecular identification of hepatitis B virus genotypes/subgenotypes: revised classification hurdles and updated resolutions // World J. Gastroenterol. 2014; 20: 7152-7168.
30. Малый В.П., Гололобова О.В., Лядова Т.И., Бойко В.В. Клинико-диагностическая характеристика генотипирования облигатно-гепатотропных вирусов. Влияние генотипов вирусов на клинические проявления и исходы болезни // Актуальная инфектология. 2013; 1 (1).
31. Kobayashi M., Arase Y., Ikeda K. et al. Clinical characteristics of patients infected with hepatitis B virus genotypes A, B, and C // J. Gastroenterol. 2002; 37: 35-9.
32. Kobayashi M., Arase Y., Ikeda K. et al. Clinical features of hepatitis B virus genotype A in Japanese patients // J. Gastroenterol. 2003; 38: 656-62.
33. Mayerat C., Mantegani A., Frei P.C. Does hepatitis B virus (HBV) genotype influence the clinical outcome of HBV infection? // J. Viral. Hepat. 1999; 6: 299-304.
34. Karin K.-L., Myhre E., Blackberg J., et al. Clinical and serologicl variation between patients infected with different hepatitis B virus genotypes // J. Clin. Microbiol. 2004; 42: 5837-5841.
35. Shi Y. Correlation between Hepatitis B Virus Genotypes and Clinical Outcomes // Jpn. J. Infect. Dis. 2012; 65: 476-482.
36. Yurchenko Т., Stepchenkova Т., Karnets I. et al. The results of a study on the prevalence of HIV, HCV and HBV genotypes in some regions of Ukraine // Retrovirology. 2012; 9(Suppl. 1): P55.
37. Velkov S., Ott J., Protzer U., Michler T. The Global Hepatitis B Virus Genotype Distribution Approximated from Available Genotyping Data. Genes (Basel). 2018 Oct; 9(10): 495.
38. Klushkina V., Kyuregyan K., Kozhanova T. et al. Impact of Universal Hepatitis B Vaccination on Prevalence, Infection-Associated Morbidity and Mortality, and Circulation of Immune Escape Variants in Russia // PLoS One. 2016; 11(6).
39. http: //www.zdrav.by/infektologiya-i-epidemiologiya/geneticheskoe-raznoobrazie-virusa-gepatita-v-v-respublike-belarus
40. Мицура В., Волченко А., Церашков Д. Распространенность и динамика заболеваемости различными формами гепатита В инфекции в Республике Беларусь // Клиническая инфектология и паразитология. — 2018. — Т. 7, № 3. — С. 370-380.
41. Nedelcu F., Toader M.A., Vasile D. Clinical and Therapeutical Importance of HBV genotyping in Romania // J. Med. Life. 2008 Apr 15; 1(2): 165-173.
42. Świderska M., Pawłowska M., Mazur W. et al. Distribution of HBV genotypes in Poland // Clin. Exp. Hepatol. 2015 May; 1(1): 1-4.
43. Deterding K., Constantinescu I., Nedelcu F.D. et al. Prevalence of HBV genotypes in Central and Eastern Europe // J. Med. Virol. 2008 Oct; 80 (10): 1707-11.
44. Kramvis A., Kew M.C. Epidemiology of hepatitis B virus in Africa, its genotypes and clinical associations of genotypes // Hepatology Research. 2007; 37: S9-S19.
45. Chang M.H. Natural history and clinicalmanagement of chronic hepatitis B virus infection in children // Hepatology International. 2008; 2: 28-36.
46. Chu C.M., Liaw Y.F. Genotype C hepatitis B virus infection is associated with a higher risk of reactivation of hepatitis B and progression to cirrhosis than genotype B: a longitudinal study of hepatitis B e antigen-positive patients with normal aminotransferase levels at baseline // Journal of Hepatology. 2005; 43: 411-417.
47. Chu C.M., Hung S.J., Lin J., Tai D.I., Liaw Y.F. Natural history of hepatitis B e antigen to antibody seroconversion in patients with normal serum aminotransferase levels // American Journal of Medicine. 2004; 116: 829-834.
48. Candotti D., Danso K., Allain J.P. Maternofetal transmission of hepatitis B virus genotype E in Ghana, west Africa // The Journal of General Virology. 2007; 88: 2686-2695.
49. Mason W., Jilbert A., Summers J. Clonal expansion of hepatocytes during chronic woodchuck hepatitis virus infection // Proc. Natl. Acad. Sci USA. 2005 Jan 25; 102 (4): 1139-1144.
50. Pournik O., Alavian S.M., Ghalichi L. et al. Lower intrafamilial transmission rate of hepatitis B in patients with hepatitis d coinfection: a data-mining approach // Hepatitis Monthly. 2013; 13: e7652.
51. Yuasa R., Takahashi K., Dien B.-V. et al. Properties of hepatitis B virus genome recovered from Vietnamese patients with fulminant hepatitis in comparison with those of acute hepatitis // J. Med. Virol. 2000; 61: 23-28.
52. Tong S., Li J., Wands J.R., Wen Y. Hepatitis B virus genetic variants: biological propertiesand clinical implications // Emerging Microbes and Infections. 2013; 2: e10.
53. Ogawa M., Hasegawa K., Naritomi T., Torii N., Hayashi N. Clinical features and viral sequences of various genotypes of hepatitis B virus compared among patients with acute hepatitis B // Hepatol. Res. 2002; 23: 167-177.
54. Suzuki Y., Kobayashi M., Ikeda K. et al. Persistence of acute infection with hepatitis B virus genotype A and treatment in Japan // J. Med. Virol. 2005; 76: 33-39 [PMID: 15779048]
55. Zhang H.W., Yin J.H., Li Y.T., Li C.Z., Ren H., Gu C.Y., Wu H.Y., Liang X.S., Zhang P., Zhao J.F., Tan X.J., Lu W., Schaefer S., Cao G.W. Risk factors for acute hepatitis B and its progression to chronic hepatitis in Shanghai, China // Gut. 2008; 57: 1713-1720.
56. Kobayashi M., Suzuki F., Arase Y., Akuta N., Suzuki Y., Hosaka T., Saitoh S., Kobayashi M., Tsubota A., Someya T., Ikeda K., Matsuda M., Sato J., Kumada H. Infection with hepatitis B virus genotype A in Tokyo, Japan during 1976 through 2001 // J. Gastroenterol. 2004; 39: 844-850.
57. Wai C.T., Fontana R.J., Polson J., Hussain M., Shakil A.O., Han S.H., Davern T.J., Lee W.M., Lok A.S. Clinical outcome and virological characteristics of hepatitis B-related acute liver failure in the United States // J. Viral. Hepat. 2005; 12: 192-198.
58. Lin C.L., Kao J.H. The clinical implications of hepatitis B virus genotype: Recent advances // J. Gastroenterol. Hepatol. 2011; 26 Suppl 1: 123-130.
59. Hsia C.C., Purcell R.H., Farshid M., Lachenbruch P.A., Yu M.Y. Quantification of hepatitis B virus genomes and infectivity in human serum samples // Transfusion. 2006; 46: 1829-1835.
60. Jegaskanda S., Ahn S.H., Skinner N., Thompson A.J., Ngyuen T., Holmes J. et al. Down-regulation of IL-18 mediated cell signalling and IFN-gamma expression by the hepatitis B virus e antigen // J. Virol. 2014; 88: 10412-10420.
61. Visvanathan K., Lang T., Ryan K. et al. Toll-IL1 receptor-mediated innate immune responses vary across HBV genotype and predict treatment response to pegylated-IFN in HBeAg-positive CHB patients // J. Viral. Hepat. 2016 Mar; 23 (3): 170-9.
62. Tran A., Kremsdorf D., Capel F., Housset C., Dauguet C., Petit M.A. et al. Emergence of and takeover by hepatitis B virus (HBV) with rearrangements in the pre-S/S and pre-C/C genes during chronic HBV infection // J. Virol. 1991; 65: 3566-3574.
63. Gopalakrishnan D., Keyter M., Shenoy K.T. et al. Hepatitis B virus subgenotype A1 predominates in liver disease patients from Kerala, India // World J. Gastroenterol. 2013; 19: 9294-9306.
64. Kramvis A., Kew M.C. Molecular characterization of subgenotype A1 (subgroup Aa) of hepatitis B virus // Hepatol. Res. 2007; 37: S27-S32.
65. Livingston S.E., Simonetti J.P., Bulkow L.R. et al. Clearance of hepatitis B e antigen in patients with chronic hepatitis B and genotypes A, B, C, D, and F // Gastroenterology. 2007; 133: 1452-1457.
66. Tanaka Y., Hasegawa I., Kato T. et al. A case-control study for differences among hepatitis B virus infections of genotypes A (subtypes Aa and Ae) and D // Hepatology. 2004; 40: 747-755.
67. Maeshiro T., Arakaki S., Watanabe T. et al. Different natural courses of chronic hepatitis B with genotypes B and C after the fourth decade of life // World. J. Gastroenterol. 13(34): 4560-4565.
68. Xibing G., Xiaojuan Y., Juanhua W., Zhong H. Relationship between HBV genotypes B, C and follicular helper T cells in patients with chronic hepatitis B and its significance // Hepat. Mon. 2013; 13: e6221.
69. Livingston S.E., Simonetti J.P., McMahon B.J. et al. Hepatitis B virus genotypes in Alaska Native people with hepatocellular carcinoma: preponderance of genotype F // J. Infect. Dis. 2007; 195: 5-11.
70. Kao J.H., Chen P.J., Lai M.Y., Chen D.S. Clinical and virological aspects of blood donors infected with hepatitis B virus genotypes B and C // Journal of Clinical Microbiology. 2002; 40: 22-25.
71. Victoria F.-S., deOliverira C.-M., Victoria M.-B. et al. Characterization of HBeAg-negative chronic hepatitis B in Western Brazilian Amazonia // Brazil. J. Infect. Dis. 2008; 12: 27-37.
72. Candotti D., Opare-Sem O., Rezvan H. et al. Molecular and serological characterization of hepatitis B virus in deferred Ghanaian blood donors with and without elevated alanine aminotransferase // Journal of Viral Hepatitis. 2006; 13: 715-724.

/20.jpg)
/22.jpg)
/23.jpg)