Введение
К типичным представителям биоактивных материалов относятся биостекло (наиболее часто используется следующий состав: 24,5 % Na2O, 24,5 % CaO, 45,0 % SiO2, 6 % P2O5 — варьируя состав, можно изменять его биоактивность и резорбируемость) и материалы на основе гидроксиапатита (ГА) — Ca10(PO4)6(OH)2 (плотная и пористая керамика) [1].
Впервые данные о связывании кости с биоактивным стеклом 45S5 были представлены в 1969 году, а экспериментальные исследования, проведенные в 1971–1972 гг., показали целесообразность использования этого биоматериала для регенерации кости в условиях заполнения крупных дефектов [2, 3]. Исследования механизмов регенерации кости в условиях использования биостекла продолжаются. Одним из актуальных направлений является использование биостекла с биологически активными веществами.
Прямая связь клеток-предшественников и остеобластов с поверхностью биостекла может быть обес–печена ионами Si и Са, выделяющимися в процессе растворения биостекла, которые, как представлено в литературе, контролируют как прикрепление клеток к поверхности биоматериала, так и клеточные циклы [4].
Известно, что плазма, обогащенная тромбоцитами, стимулирует остеогенез за счет того, что тромбоциты, разрушаясь в костном дефекте, выделяют многочисленные факторы роста, запускающие и активирующие процессы остеогенеза [5, 6].
Данные литературы свидетельствуют о том, что отдельные виды биоматериалов обладают вторичной остеоиндукцией, которую обеспечивают активные белковые макромолекулы, модифицируя поверхность биоматериала, область расположения его в кости и др. [7, 8]. Биостекло и стеклокерамика (биоситаллы) после имплантации в костный дефект не инкапсулируются, а находятся в прямом контакте с костной тканью. Основным условием для связывания стеклокерамики с костной тканью является образование апатитового слоя на их поверхности в биологической среде [9, 10]. При пластике биостеклом обмен происходит на клеточном уровне, то есть биостекло деградирует за счет макрофагов и остеокластов, а построение новой кости осуществляется остеоцитами и остеобластами [11]. Образовавшийся комплекс прочнее, чем при пластике керамическим материалом на основе ГА и трехкальциевого фосфата, и имеет хаотическую структуру [12].
Цель работы — изучение регенерации кости в условиях заполнения костных дефектов биостеклом с аутоплазмой, обогащенной тромбоцитами.
Материалы и методы
Экспериментальные исследования проведены на 18 кроликах массой 3400 ± 67 г. Под общей анестезией в проксимальном метафизе большеберцовой кости выполняли костный дефект 2 мм в диаметре. В 2 сериях деффект заполняли биостеклом или биостеклом с аутоплазмой, обогащенной тромбоцитами (PRP). PRP получали при однократном центрифугировании крови подопытного животного c цитратом. Сроки наблюдения составили 4 и 12 недель. Исследование проводили в соответствии с международными требованиями о гуманном отношении к лабораторным животным, соблюдая правила «Европейской конвенции защиты позвоночных животных, используемых в экспериментальных и других научных целях» (Страсбург, 1986), а также Закон Украины № 3447-IV от 21.02.2006 «Про захист тварин від жорстокого поводження». Протокол экспериментов на животных утвержден Комитетом по биоэтике (протокол № 5 от 2016 г.).
Для морфологических исследований выделяли фрагменты костей голени кроликов с дефектами и фиксировали их в 10% растворе нейтрального формалина, декальцинировали в растворе 4% азотной кислоты, обезвоживали в спиртах возрастающей крепости и заключали в парафин. На микротоме изготавливали серийные гистологические срезы толщиной 7–9 мкм, которые окрашивали железным гематоксилином Вейгерта и эозином, а также пикрофуксином по Ван Гизону.
Окрашенные срезы анализировали в микроскопе Olympus BX-63 с использованием морфометрической программы CellSence Dimension 1.8.1. Оценку площади тканей, сформировавшихся в дефекте, проводили между двумя фрагментами кортекса, прилежащими к дефекту:
— общую площадь имплантата с образовавшимися между частицами биостекла тканями;
— площадь костной ткани между частицами биостекла;
— площадь фиброретикулярной ткани между частицами биостекла;
— площадь, занимаемую частицами биостекла.
Выбор этой области для исследования был связан с тем, что в регенерации кости в условиях перелома именно интермедиарный регенерат обеспечивает прочностные качества кости. Полученные цифровые показатели для каждого из измеренных случаев выражены в процентах от общей измеренной площади.
Статистический анализ выполнен с использованием программных пакетов Microsoft Excel XP. Для определения различий между группами применяли t-критерий Стьюдента. Статистически значимыми считали различия при P < 0,05.
Результаты и обсуждение
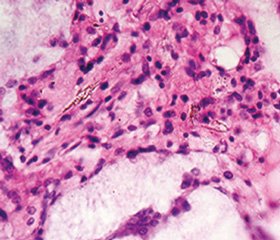
Изучение регенерации кости при использовании биостекла (контрольная серия). При микроскопическом исследовании срезов выявлено, что частицы биостекла различного размера и формы располагались в области дефекта, проходящего через кортекс большеберцовой кости, а также в области костномозгового канала (рис. 1).
В костномозговом канале биостекло было отделено от костного мозга узкими трабекулами новообразованной костной ткани и фиброретикулярной тканью остеогенного типа (рис. 2). Вокруг имплантированного биостекла по краевой поверхности располагался желтый костный мозг, на расстоянии от области имплантации сохранялись очаги красного и желтого костного мозга.
Среди имплантированных частиц биостекла различной формы и размеров располагались костные трабекулы в виде узких напластований с высокой плотностью остеоцитов (рис. 2). Короткие костные трабекулы выявлены среди фиброретикулярной ткани, что свидетельствует об остеогенной потенции этой ткани.
Непосредственно на биостекле были обнаружены единичные остеокласты, формирующие резорбтивные полости, в которые прорастали остеобласты (рис. 3). Остеобласты располагались и на поверхности биостекла, формируя остеоид.
Расположение остеокластов и остеобластов на поверхности биоматериала свидетельствует о его высокой биосовместимости с костной тканью. Прилежащая к биостеклу фиброретикулярная ткань включала клетки фибробластического дифферона различной зрелости, единичные макрофаги и остеобласты, которые были расположены непосредственно на частицах биоматериала.
В области кортекса частицы биостекла были связаны между собой новообразованной костной тканью и с материнской костью, прилежащей к области дефекта (рис. 1). На поверхности костных трабекул в узких и расширенных лакунах располагались остео–циты (рис. 4). Межтрабекулярные пространства были заполнены фиброретикулярной тканью. Костные трабекулы, формирующие межтрабекулярные пространства, в краевых отделах имели высокую плотность остеобластов, а на участках между частицами биостекла обнаружены их скопления.
Кортекс материнской кости с признаками посттравматической реактивной перестройки, связанной с расширением сосудистых костных каналов.
Для оценки соотношения тканей, сформировавшихся в области кортекса с имплантированным биостеклом, было проведено морфометрическое исследование. Результаты проведенного исследования представлены на рис. 5.
На основе данных морфометрии площади ткани в области дефекта, расположенного в кортексе, выявлено, что площадь костной ткани была на 7,3 % больше по сравнению с площадью фиброретикулярной ткани.
Введение в область дефекта порошка из биостекла и аутологичной плазмы, обогащенной тромбоцитами. При микроскопическом исследовании в большеберцовой кости четко визуализируется область дефекта с имплантированным в нее биостеклом (рис. 6).
Биостекло располагалось и в костномозговом ка-нале.
В области кортекса частицы биостекла были спаяны между собой костной и фиброретикулярной тканью с преобладанием костной ткани, которая представлена разветвленными костными трабекулами (рис. 6). Они формировались как на поверхности биоматериала, так и в толще фиброретикулярной ткани. Переплетаясь между собой, костные трабекулы образовывали узкие мостоподобные структуры, срастающиеся с кортексом материнской кости, прилежащей к области дефекта. На краевых отделах кортекса в области эндоста имело место формирование костной ткани, напластовывающейся на эндостальную поверхность и проникающей в костномозговой канал.
На поверхности костных трабекул располагались остеоциты, а по краевой поверхности — остеобласты. Большая часть поверхности костных трабекул была покрыта активными остеобластами, имеющими слабобазофильно окрашенное ядро, окруженное обильной цитоплазмой (рис. 7), что свидетельствует об активизации в таких клетках биосинтетических процессов. Обнаруживали скопления остеобластов, на основе которых формируется остеоид.
В краевых отделах частиц биостекла выявлено изменение его тинкториальных качеств, что может быть начальным признаком преобразования его поверхности за счет сорбции биологических жидкостей, в том числе входящих в их состав факторов роста, активизирующих остеогенез, а также введение плазмы, обогащенной тромбоцитами.
В области костномозгового канала, по мере удаления от кортекса, остеогенез проявлялся слабее. Лишь единичные частицы биостекла были окружены незрелой костной тканью (рис. 8).
Признаков деструкции и воспалительной реакции тканей, прилежащих к области имплантации биоматериала, не выявлено.
Красный и желтый костный мозг располагался непосредственно на частицах биостекла или контактировал без четких границ с грануляционной тканью.
Проведенное морфометрическое исследование показало, что площадь костной ткани в области травматического повреждения на 17,4 % больше, чем у фиброретикулярной ткани (рис. 9).
Выводы
Проведен сравнительный анализ между показателями фиброретикулярной и костной ткани, сформировавшейся в дефекте кости после имплантации биостекла, а также биостекла с введением аутогенной плазмы, обогащенной тромбоцитами. В серии исследований с дополнительным введением аутогенной плазмы, обогащенной тромбоцитами, выявлено повышение в дефекте костной ткани на 9 % (P < 0,001).
Таким образом, исследованный биоматериал — биостекло — характеризуется остеокондуктивностью и остеоинтеграцией. Материал биоактивен, что проявляется формированием на его поверхности активных остеобластов и костной ткани. Вокруг частиц биостекла отсутствовали воспалительные проявления и аллергическая реакция, материал был совместим с костной тканью и костным мозгом. Деструктивных нарушений костного мозга вокруг частиц биостекла не зафиксировано, однако вблизи материала в костномозговом канале повышена плотность желтого костного мозга.
На поверхности биостекла располагались остеобласты, формирующие костную ткань. Биоматериал, как и костная ткань, может частично подвергаться резорбции остеокластами, что также указывает на остеоинтегративные качества биоматериала.
Локальное введение плазмы, обогащенной тромбоцитами, способствовало повышению остеоиндуктивных свойств биостекла в области травматического повреждения.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Попков А.В. Биосовместимые имплантаты в травматологии и ортопедии (обзор литературы) // Гений ортопедии. — 2014. — 3. — С. 94-99.
2. Beckham C.A. Bone Formation at a Ceramic Implant Interface / C.A. Beckham, T.K. Greenlee, A.R. Crebo // Calcified. Tissue Research. — 1971. — Vol. 8, № 1. — Р. 165-171.
3. Hench L.L. Chronology of Bioactive Glass Development and Clinical Applications // New Journal of Glass and Cera–mics. — 2013. — 3. — С. 67-73.
4. Xynos I.D., Edgar A.J., Buttery L.D.K. Gene Expression Profiling of Human Osteoblasts Following Treatment with the Ionic Dissolu-tion Products of Bioglass® 45S5 Dissolution Journal of Biomedical. Materials Research // Journal of Biomedical. Materials Research. — 2001. — 55(2). — Р. 151-157.
5. Panda S., Doraiswam J., Malaiappan S., Varghese S.S. Additive effect of autologous platelet concentrates in treatment of intrabony defects: a systematic review and meta-analysis // J. Investig. Clin. Dent. — 2016. — 7(1). — Р. 13.
6. Meschi N., Castro A.B., Vandamme K. The impact of autologous platelet concentrates on endodontic healing: a systematic review // Platelets. — 2016. — 27(7). — Р. 613-633.
7. Берченко Г.Н., Кесян Г.А., Микелаишвили Д.С. Применение биокомпозиционного наноструктурированного препарата коллапан и обогащенной тромбоцитами аутоплазмы в инжиниринге костной ткани // Травма. — 2010. — 11(1). — Р. 7-14.
8. Barradas А.М., Yuan Н., van Blitterswijk С.А. Оsteoinductive biomaterials: current knowledge of properties, experimental models and biological mechanisms // European Cells and Materials. — 2011. — 21. — Р. 407-429.
9. Кирилова И.А., Садовой М.А., Подорожная В.Т. Сравнительная характеристика материалов для костной пластики: состав и свойства // Хирургия позвоночника. — 2012 May. — Р. 72-83.
10. Дубок В.А., Лашнева В.В., Шинкарук О.В., Дубок О.В. Сучасний ринок біоактивних керамічних матеріалів і перспективи його розвитку // Вісник Українського матеріалознавчого товариства ім. І.М. Францевича. — 2017. — С. 65-78.
11. Кравченко С.В., Запорощенко А.Ю., Савицкая И.М. Замещение биоактивного керамического материала «Синтекость» новообразованной костью в эксперименте // Клінічна хірургія. —2014. — С. 62-64.
12. Бур’янов О.А., Чорний В.С., Проценко В.В., Шаповалов В.С., Кусяк В.А. Аналіз заміщення кісткових дефектів кальцій-фосфатними біоматеріалами при захворюваннях кісткової тканини // Літопис травматопогії та ортопедії. — 2018. — 37–38(1–2). — С. 111-116.

/58-1.jpg)
/58-2.jpg)
/59-1.jpg)