Проблема діагностики і лікування ехінококозу залишається актуальною і набуває соціального характеру [1]. Всесвітня організація охорони здоров’я (ВООЗ) у 2010 році поставила завдання досягти ефективної стратегії боротьби з хворобою до 2018 року з огляду на дослідження багатьох авторів [2], які показують, що останніми роками збільшилася кількість хворих на ехінококоз не тільки в загальновизнаних ендемічних вогнищах, але також і серед жителів європейських країн [3–8]. Через зростаючу кількість людей, які емігрують до Центральної Європи з країн із високою частотою виникнення кістозного ехінококозу, дана хвороба стала важливою при диференційній діагностиці кістозних уражень.
Загальна частота ехінококозу становить від 1 до 220 випадків на 100 000 населення. Найчастіше ехінококоз трапляється в Балканських країнах, Східній Африці, Південній Америці, Австралії [9–13].
На даний час серед країн Європейського Союзу Болгарія має найвищий рівень захворюваності та поширеності кістозного ехінококозу [14]. Дитячий ехінококоз залишається серйозною проблемою для здоров’я в країні. Проведені в 1996–2013 роках дослідження встановили, що середньорічна захворюваність на кістозний ехінококоз в Болгарії становить 6,7 на 100 000 чоловік, але зі значними змінами захворюваності між різними віковими групами. Гідатидні кісти у дітей віком від 0 до 9 років найчастіше трапляються в легенях, на відміну від пацієнтів інших вікових груп. Майже 90 % постраждалих дітей підтримували контакт із собаками.
Варто зазначити, що Румунія була представлена не тільки в авангарді поширеності кістозного ехінококозу в Європі, але і серед перших країн світу щодо поширеності даної хвороби [15].
Зважаючи на відсутність патогномонічних симптомів, а також тривалий безсимптомний перебіг, ехінококоз діагностується в ряді випадків при обстеженні з приводу інших захворювань. Іноді ехінококові кісти, невизнані протягом життя, вперше діагностуються при аутопсії. Нерідко захворювання розпізнається при приєднанні до нього різних ускладнень, частота яких коливається від 15 до 52 %, що значно погіршує перебіг захворювання та результати хірургічного втручання. В дослідженнях проаналізовано матеріали 1470 пацієнтів у 10 вікових групах в Республіці Вірменія (з 2000 по 2016 рік) для з’ясування причини смертності від ехінококозу [16]. Визначено, що середньорічна смертність від ехінококозу становить 0,007 на 10 000 населення. Найвища частота смертності спостерігається у людей віком 70–79 років та у дітей. Розрив паразитарної кісти і печінкова недостатність є однією з основних причин смертності.
У спробі поліпшити ситуацію щодо діагностики ехінококозу в жовтні 2014 року запущений Європейський регістр кістозного ехінококозу (ERCE) в контексті проекту HERACLES [17]. ERCE є перспективним, спостережливим, багатоцентровим регістром пацієнтів із імовірним чи підтвердженим кістозним ехінококозом. Перша нарада ERCE відбулася в листопаді 2015 року в Італійському національному інституті охорони здоров’я (Istituto Superiore di Sanita, ISS) в Римі, в якій брали участь експерти з кістозного ехінококозу. В регістр подаються дані з європейських ендемічних країн. Перша публікація Європейським центром з профілактики та контролю захворювань відбулася у 2015 році. Система, звичайно, потребує поліпшення звітності на європейському рівні. Очікується, що колекція стандартизованих клінічних даних і зразків буде підтримувати більш раціональний, орієнтований на етапний підхід до клінічного управління та політики громадської охорони здоров’я.
Управління захворюванням споживає значні ресурси охорони здоров’я, які оцінюються приблизно в 1500–2000 доларів США для кожного нескладного випадку і приблизно вдвоє більше — для складних. У групі ризику знаходяться діти. Так, у загальній кількості випадків 22,1 % становили особи віком 0–19 років, найчастіше спостерігали пацієнтів віком 13 років (р < 0,0001), осіб чоловічої статі та сільських жителів (р = 0,01 і р < 0,0001 відповідно) та з ураженням легень (р < 0,0001). Проте дослідження, присвячені вивченню поширеності, структури та діагностики ехінококозу серед дитячого населення, проводяться недостатньо.
Ехінококоз (хвороба собачого черв’яка, хідатіаз, hyadid deisease, cystic echinococcosis) — унікальна паразитарна хвороба, ендемічна в багатьох регіонах, яка найчастіше розглядається як личинкова або міхурова стадія розвитку стрічкового гельмінта, що відноситься до виду Echinococcus granulosus, в тканинах печінки і легенів. Однак ехінококова інвазія може вражати будь-яку частину тіла і проявлятися по-різному залежно від стадії розвитку, супутніх ускладнень, а також відповідної реакції організму хворого.
Легені — провідний за частотою орган інвазії Echinococcus granulosus у дітей та другий — у дорослих. За даними різних авторів [11–16], легенева локалізація ехінококових кіст спостерігається у 10–60 % хворих дітей, печінкова — у 30–75 % випадків, локалізація в центральній нервовій системі становить 2–3 % усіх випадків, на селезінку, серце, підшлункову залозу, нирки припадає 1 %.
Найбільш часто спостерігається аліментарний шлях зараження. Яйця гельмінта з інвазованих собак потрапляють на руки дитини, продукти харчування і заносяться в рот. У шлунково-кишковому тракті людини з яєць виходять онкосфери (шестикрючні зародки), які проникають крізь слизову оболонку тонкої кишки, потрапляють у систему ворітної вени і розносяться по органах. У процесі циркуляції в крові велика частина онкосфер ехінокока осідає в печінці. Менша частина ембріонів, долаючи капілярну мережу печінки, проходить через печінкові вени, нижню порожнисту вену, праве серце і потрапляє в мале коло кровообігу, де і затримується в легенях. Крім класичного шляху поширення паразита деякі автори допускають можливість просування зародків, оминаючи печінку, через портосистемні анастомози, а також лімфатичним шляхом — через d.thoracicus у v.cava cranialis і в легені. Разом із тим існує і аерогенний шлях інвазії. Яйця паразита вдихаються з пилом, під впливом слизового секрету дихальних шляхів позбавляються оболонки і починають свій розвиток.
Онкосфери перетворюються в личинки та утворюють ехінококові кісти. Спочатку ці кісти дуже малі, але з часом можуть досягати 15–20 см в діаметрі. Є дані про існування антагонізму між ехінококовими кістами: чим більше кіст, тим менше їх розміри. Гідатидоми мають внутрішню (гермінативну) і зовнішню (кутикулярну, хітинову) оболонки. Навколо них розвивається щільна фіброзна капсула, до якої підходять бронхи, кровоносні і лімфатичні судини легені. Таким чином здійснюється обмін речовин між паразитом і організмом його носія. Фіброзна капсула і хітинова оболонка тісно примикають одна до одної, але не зростаються між собою. Тому навколо кісти є потенційний щілиноподібний простір, що має певне діагностичне значення.
Клінічна картина гідатидозного ехінококозу легень неспецифічна і залежить від розмірів і стадії розвитку паразита [18]. При невеликих, а іноді і середніх розмірах кісти клінічні ознаки можуть бути відсутні. При неускладненій формі хвороба перебігає безсимптомно, можливий біль різної інтенсивності в правому підребер’ї, у ділянці грудної клітки, кашель, відчуття тяжкості в епігастрії, правому підребер’ї, субфебрилітет, збільшення живота, пухлиноподібне утворення, що пальпується, іктеричність шкіри та склер, алергічні реакції. По мірі того, як розмір кісти збільшується, при стисненні або залученні до запального процесу сусідніх тканин з’являються клінічні симптоми: кашель, кровохаркання, біль у грудній клітці, рідше — задишка. Крім того, можуть відзначатися симптоми загальної дії паразита на організм у вигляді слабкості, субфебрильної температури, збільшення швидкості осідання еритроцитів, алергічних реакцій. Ранні прояви клінічних симптомів нерідко залежать не від величини кісти і давності її паразитування, а від локалізації ураження. Так, невелика ехінококова кіста, розташована поблизу плеври, викликає подразнення плевральних листків, рано проявляється характерними болями. При локалізації кісти у бронхіальному стовбурі клінічні симптоми проявляються кашлем і судинними розладами.
При ускладненому перебігу з’являється біль різної інтенсивності в животі, ділянці грудної клітки, кашель із мокротою, задишка, тахікардія, гіпертермія, алергічні реакції, при розриві кісти може виникати анафілактичний шок, гідроторакс зі зміщенням органів середостіння в протилежну сторону. При розриві кісти в черевну порожнину відзначаються симптоми подразнення очеревини на тлі вираженого больового синдрому. Можливе притуплення перкуторного звуку над легенями на боці ураження, при аускультації — послаблення дихання, вологі різнокаліберні хрипи.·При прориві кісти в бронхіальне дерево можуть бути ядуха, кашель із виділенням великої кількості прозорої рідини з обривками хітинової оболонки у вигляді виблискуючих плівок білого або жовтуватого кольору, іноді в рідині виявляють також невеликі бульбашки — дочірні кісти. У більшості випадків перед масивним проривом кісти стан хворих погіршується: піднімається температура, з’являється виражена слабкість, посилюється кашель, іноді остуд, можуть з’явитися ознаки кропив’янки і свербіж шкіри. Після прориву при мікроскопічному дослідженні мокротиння виявляються гаки паразита, сколекси, обривки хітинової оболонки; при прориві кісти в плевральну порожнину відзначаються симптоми внутрішньогрудної напруги, зміщення органів середостіння, тахікардія, задишка, симптоми дихальної недостатності (гідроторакс, пневмоторакс); при нагноєнні кісти відзначаються температурна реакція, симптоми інтоксикації і дихальної недостатності (піопневмоторакс). У рідкісних випадках — одночасний прорив кісти в бронх і плевральну порожнину, при цьому в плевральну порожнину надходить повітря, і рентгенологічно спостерігається картина гідропневмотораксу [19].
При ехінококозі відмічаються різні імунологічні реакції: мембранна нефропатія, анафілактичні реакції, астма, еозинофілія та/або підвищений рівень IgE [20].
Методи діагностики включають збір анамнезу, серологічні та інструментальні методи. Серед серологічних реакцій для діагностики ехінококозу в даний час застосовуються ELISA, IFT, IHA [21]. Однак при легеневому ехінококозі серологічні реакції мають низьку чутливість. У таких випадках можна використати діагностику з ехінококоспецифічною ДНК [22].
Методом скринінгу є рентгенографія грудної клітки. Характерні рентгенологічні ознаки неускладнених ехінококових кіст — одна або кілька добре окреслених тіней у легенях, зазвичай у середніх або нижніх долях. Багато дослідників звертають увагу на більш часту локалізацію гідатид у правій легені, пояснюючи це більшими її розмірами. Паразитарні кісти бувають множинними у 30 % випадків, білатеральними — у 20 % випадків, у 60 % випадків вони локалізуються в нижніх частках легень.
Високу інформативність має ультразвукове дослідження (УЗД) при ехінококозі легень у дітей [23, 24]. Ехографія дозволяє дуже чітко візуалізувати розташування, форму, контури, розміри, структуру внутрішнього вмісту кіст, стан прилеглих до кісти ділянок легені, виявити розшарування плевральних листків при реактивному плевриті. У 16,1 % випадків паразитарні кісти візуалізуються у вигляді округлих анехогенних утворень без чіткої капсули (молоді кісти). У більшості спостережень (66,2 %) визначається зріла ехінококова кіста з гіперехогенною капсулою, нерідко з подвійним контуром і гідатидним піском у порожнині. Кісти набувають концентричної будови при розшаруванні паразитарних оболонок. При дренуючих кістах із нагноєнням УЗД дозволяє виявити густу суспензію з бульбашками повітря у вигляді гіперехогенних чи лінійних структур із акустичною тінню — «хвіст до позначки». У 9,7 % хворих поряд із кістою виділяється ділянка трикутної форми ателектазованої легеневої тканини однорідної структури. У 9,7 % хворих із ехінококозом легень при УЗД виявляється реактивний плеврит.
Нещодавно експертна комісія робочої групи ВООЗ із ехінококозу запропонувала стандартизовану ультразвукову класифікацію печінкового кістозного ехінококозу. Що стосується легеневого ехінококозу, то описані тільки ультразвукові діагностичні ознаки.
Рентгенівська комп’ютерна томографія (КТ), маючи високу роздільну здатність, можливість пошарової візуалізації і виконання денситометричного аналізу, дозволяє надійно виявити навіть невеликі кісти складної локалізації (коріння легень, паракардіальні сегменти, базальні відділи легень). Первинні або вторинні гідатидні кісти за допомогою КТ можуть також визначатися в плеврі. КТ надає цінну інформацію при ускладненнях ехінококозу легень: виявляють перикістозне запалення, звапнення стінки кісти, частковий розрив стінки кісти, розшарування фіброзної і хітинової оболонок і «повітряний півмісяць» між ними. При повному розриві стінки ехінококового міхура при КТ визначаються не тільки плаваючі мембрани (water lily sign), але й дочірні кісти, перибронхіальна інфільтрація. При вторинному інфікуванні мембрани можуть руйнуватися, стінка кісти потовщується, щільність кісти підвищується. Ознака «повітряної бульбашки», вперше описана Von Sinner в 1991 році, позитивна у 83 %. Повітря проникає в гідатидну кісту внаслідок ерозії бронхіол, при прориві кісти в бронхи або внаслідок інфікування газотвірними бактеріями.
Високоінформативним методом діагностики ехінококозу легень є спіральна комп’ютерна томографія (СКТ). Вона дозволяє уточнити відношення ехінококової кісти з судинами і бронхами. Також за даними СКТ оцінюють життєздатність ехінококової кісти, наявність ускладнень, стан фіброзної капсули. Тривимірна реконструкція зображення дозволяє моделювати хід передбачуваного оперативного втручання і уникнути можливих інтраопераційних ускладнень.
Ехінококові кісти зазвичай мають гіпоінтенсивне кільце при проведенні магнітно-резонансної томографії (МРТ). Це характерна ознака гідатидної хвороби. Дочірні кісти, якщо вони є, визначаються як кістозні структури, прикріплені до гермінативної оболонки, гіпоінтенсивні, рідко гіперінтенсивні. Запавші паразитарні мембрани визначаються на МРТ-зображеннях як покручені лінійні структури всередині кіст.
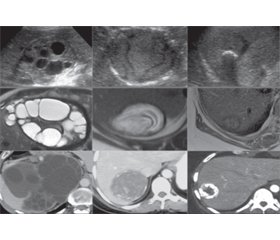
Опис специфічних ознак кістозного ехінококозу та класифікації кіст заснований на УЗД. Набір ультразвукових характеристик узгоджений як еталонний стандарт візуалізації зображень для діагностики та постановки діагнозу, в результаті чого була стандартизована класифікація ВООЗ, заснована на ультразвуковій класифікації Гарбі. На рис. 1 і 2 показані типові ультразвукові, MРТ- та КT-зображення з «найкращим прикладом» для КT/MРТ-зображень та «найгірший випадок» для КT/MРТ-зображень, в результаті чого «найкращий випадок» кістових стадій КE2, КE3a.
У табл. 1 наведені основні диференційні ознаки ехінококозу легень.
Випадок із практики
Дівчинка, 8 років. Надійшла у пульмонологічне відділення з діагнозом гострої позагоспітальної пневмонії на четвертий день хвороби зі скаргами на нежить, високу температуру тіла, нападоподібний кашель із виділенням великої кількості харкотиння та задишку, що не купірувалися лікарськими засобами. На п’яту добу з’явилися висипання за типом гострої кропив’янки, біль в грудній клітці справа. Призначення антибактеріальної терапії не призвело до покращення стану дитини.
З анамнезу відомо, що впродовж 3 років у дитини періодично був висип у вигляді кропив’янки, в загальному аналізі крові підвищений рівень еозинофілів (найвищий показник — 27 %). Лікувалася у алерголога. Дівчинці двічі призначали протигельмінтні засоби, стан покращувався, кількість еозинофілів у крові знижувалася.
Обстеження. Загальний стан середньої тяжкості. Дихання через ніс утруднене, слизові виділення. На шкірі уртикарні висипання. Підшкірно-жирова клітковина розвинена надмірно, розподілена нерівномірно, з переважанням на грудях, животі, стегнах. Набряків немає. Тонус м’язів і тургор тканин задовільний. Періорбітальні тіні. Слизова зіву рожева, волога, чиста. Пальпуються підщелепні лімфатичні вузли від 0,7–0,9 см в діаметрі, рухомі, безболісні. Дихання 25 рухів за 1 хвилину. Перкуторно над легенями легеневий звук, аускультативно — ослаблене дихання. Ділянка серця без видимих деформацій. Частота серцевих скорочень — 90 поштовхів за 1 хвилину. Тони серця ритмічні, помірно приглушені. Язик зволожений, чистий. Живіт м’який, доступний глибокій пальпації. Печінка +2,5 см нижче краю реберної дуги, край еластичний, безболісний. Селезінка не пальпується. Стул оформлений, без патологічних домішок. Сечовипускання вільне, безболісне. Діурез адекватний.
У клінічному аналізі крові: відносна лімфопенія (38 %), анемія (гемоглобін — 92 Г/л, еритроцити — 3,2 Г/л, КП — 0,87). Клінічний аналіз сечі в нормі. Біохімічне дослідження крові: креатинін крові — 54,2 (норма — 27–62 мкмоль/л), сечовина крові — 4,33 (норма — 1,8–6,4 ммоль/л); глюкоза крові — 5,3 ммоль/л. Печінкові проби: аланінамінотрансфераза — 22,7 МО/л (норма — 5–30 МО/л), аспартатамінотрансфераза — 20,6 МО/л (норма — 7–40 МО/л), загальний білірубін — 10,8 мкмоль/л (норма — 8,6–20,5 мкмоль/л), зв’язаний — 3,7 мкмоль/л (норма — до 5,1 мкмоль/л), вільний — 7,1 мкмоль/л (норма — до 15,4 мкмоль/л).
ІФА, сумарні антитіла (АТ) до гельмінтів: лямблії, токсокари, аскариди (АТ IgG негативний). Серологічне дослідження на ехінокок не проводилося.
Ультразвукове дослідження органів черевної порожнини: печінка збільшена (вертикальний косий розмір 96 мм (норма — до 85 мм)), край гострий, у правій частці печінки під діафрагмою округле аваскулярне утворення з чіткими гіперехогенними контурами, рідинним вмістом із множинними перегородками, розмірами 30 × 27 мм. Жовчний міхур: 46 × 16 мм, перегин дна і шийки, стінки не потовщені, каменів немає. Підшлункова залоза — без особливостей. Селезінка: 71 × 32 мм, не збільшена. Нирки: права — 61 × 26 мм, ліва — 63 × 35 мм, паренхіма — 13 мм, однорідна, чашко-мискова система не розширена, каменів немає. Сечовий міхур в межах норми.
На рентгенограмі органів грудної клітки — добре окреслена тінь у нижній долі легені справа. На КТ грудної клітки: в задньонижніх відділах правої плевральної порожнини визначається округле утворення діаметром 80 мм, аваскулярне, з внутрішніми пристінковими перегородками і гіперехогенними сигналами в капсулі. Утворення знаходиться в безповітряній паренхімі легені. Імовірний прорив кісти в плевральну порожнину.
Остаточний діагноз: ехінококоз, ехінококова кіста правої легені з проривом у плевру і бронх, ехінококова кіста печінки.
Крім хірургічного втручання є ще три варіанти лікування: 1) хіміотерапія з альбендазолом або мебендазолом; 2) PAIR: Punction (пункція кісти), Aspiration (аспірація вмісту кісти), Injection (введення протисколіцидної речовини), Reaspiration (реаспірація); 3) спостереження за неактивними ехінококовими стадіями (підхід «годинник і очікування») [26].
У даному випадку дитина переведена в дитяче хірургічне відділення. Призначено альбендазол 12 мг/кг/добу. На четверту добу проведено торакоскопічну цистектомію, лапароскопічне склерозування кісти печінки. Гістопатологічна експертиза підтвердила наявність ехінококової кісти з ламінованими та зародковими шарами з великою кількістю еозинофілів, багатоядерних гігантських клітин та сколексів.
Копропаразитологічні дослідження собаки, яка проживала в сім’ї, показали Taenia spp. Ці дані підтверджують збереження звички годування собак сирим субпродуктом.
Амбулаторне спостереження включало ультразвукове дослідження органів черевної порожнини протягом двох місяців та лікування альбендазолом із розрахунку 12 мг/кг/добу впродовж 28 діб. Подальше спостереження не проводилося, оскільки родина виїхала за межі країни.
Висновки
Дитячий ехінококоз викликає певні труднощі діагностики та залишається серйозною проблемою для здоров’я. Недостатня настороженість лікарів, а також прихований перебіг захворювання або прояв незначних симптомів ехінококозу протягом тривалого періоду часто призводять до медичних помилок. Рання діагностика, своєчасна госпіталізація і лікування попереджують розвиток тяжких ускладнень, які погіршують прогноз і результати хірургічного втручання. Вивчення кістозного ехінококозу у дітей та його реєстрація мають важливе епідеміологічне значення. Даний клінічний випадок — приклад пізньої діагностики кістозного ехінококозу. На підставі анамнестичних даних і розмірів ехінококових кіст можна припустити, що зараження ехінококозом мало місце три роки тому. Клінічні прояви у вигляді кропив’янки і підвищення числа еозинофілів периферичної крові могли допомогти в своєчасному розпізнанні ехінококозу, що дозволило б уникнути ускладнення, тяжкої операції і подальшої тривалої реабілітації.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Agudelo Higuita N., Brunetti E., McCloskey C. Cystic Echinococcosis // J. Clin. Microbiol. — 2016. — 54(3). — Р. 518-23. doi: 10.1128/JCM.02420-15.
2. Brunetti E., Kern P., Vuitton D.A. Writing Panel for the WHO-IWGE. Еxpert consensus for the diagnosis and treatment of cystic and alveolar echinococcosis in humans // Acta Trop. — 2010. — 114(1). — Р. 1-16. doi: 10.1016/j.actatropica.2009.11.001.
3. Cappello E., Cacopardo B., Caltabiano E. [et al.]. Epidemiology and clinical features of cystic hydatidosis in Western Sicily: a ten-year review // World J. Gastroenterol. — 2013. — 19(48). — Р. 9351-8. doi: 10.3748/wjg.v19.i48.9351.
4. Vlad D.C., Neghina A.M., Dumitrascu V. [et al.]. Cystic echinococcosis in children and adults: a seven-year comparative study in western Romania // Foodborne Pathog. Dis. — 2013. — 10(2). — Р. 189-95. doi: 10.1089/fpd.2012.1281.
5. Djuricic S.M., Grebeldinger S., Kafka D.I. [et al.]. Cystic echinococcosis in children — the seventeen-year experience of two large medical centers in Serbia // Parasitol. Int. — 2010 Jun. — 59(2). — Р. 257-61. doi: 10.1016/j.parint.2010.02.011.
6. Lopez-Bernus A., Belhassen-García M., Carpio-Perez A. [et al.]. Is cystic echinoccocosis re-emerging in western Spain? // Epidemiol. Infect. — 2015 Nov. — 143(15). — Р. 3351-7. doi: 10.1017/S0950268815000618.
7. Gołąb E., Czarkowski M.P. Echinococcosis and cysticercosis in Poland in 2012 // Przegl. Epidemiol. — 2014. — 68(2). — Р. 279-82, 379-81. PMID: 25135515.
8. Van Cauteren D., Millon L., de Valk H., Grenouillet F. Retrospective study of human cystic echinococcosis over the past decade in France, using a nationwide hospital medical information database // Parasitol. Res. — 2016 Nov. — 115(11). — Р. 4261-4265. Epub. 2016 Jul 29. PMID: 27473835.
9. Wahlers K., Menezes C.N., Wong M.L. [et al.]. Cystic echinococcosis in sub-Saharan Africa // Lancet Infect. Dis. — 2012 Nov. — 12(11). — Р. 871-80. doi: 10.1016/S1473-3099(12)70155-X.
10. Develoux M., Enache-Angoulvant A., Gounant V. [et al.]. Hepatic and pulmonary cystic echinococcosis in a patient from the Central African Republic // Travel Med. Infect. Dis. — 2011 Mar. — 9(2). — Р. 88-90. doi: 10.1016/j.tmaid.2011.02.004.
11. Alvarez Rojas C.A., Ebi D., Gauci C.G. [et al.]. Microdiversity of Echinococcus granulosus sensu stricto in Australia // Parasitology. — 2016 Jul. — 143(8). — Р. 1026-33. doi: 10.1017/S0031182016000445.
12. Larrieu E., Zanini F. Critical analysis of cystic echinococcosis control programs and praziquantel use in South America, 1974–2010 // Rev. Panam. Salud. Publica. — 2012 Jan. — 31(1). — Р. 81-7. PMID: 22427169.
13. Bingham G.M., Budke C.M., Larrieu E. [et al.]. A community-based study to examine the epidemiology of human cystic echinococcosis in Rio Negro Province, Argentina // Acta Trop. — 2014 Aug. — 136. — Р. 81-8. doi: 10.1016/j.actatropica.2014.04.005.
14. Jordanova D.P., Harizanov R.N., Kaftandjiev I.T. [et al.]. Cystic echinococcosis in Bulgaria 1996-2013, with emphasis on childhood infections // Eur. J. Clin. Microbiol. Infect. Dis. — 2015 Jul. — 34(7). — 1423-8. doi: 10.1007/s10096-015-2368-z.
15. Neghina R., Neghina A.M., Marincu I., Iacobiciu I. Cystic echinococcosis in Romania: the pediatric approach // Vector Borne Zoonotic Dis. — 2011 Aug. — 11(8). — Р. 993-9. doi: 10.1089/vbz.2010.0238.
16. Khachatryan A.S. Analysis of Lethality in Echinococcal Disease // Korean J. Parasitol. — 2017 Oct. — 55(5). — Р. 549-553. doi: 10.3347/kjp.2017.55.5.549.
17. Rossi P., Tamarozzi F., Galati F. [et al]. The first meeting of the European Register of Cystic Echinococcosis (ERCE) // Parasit. Vectors. — 2016 Apr 28. — 9. — 243. doi: 10.1186/s13071-016-1532-3.
18. Carla Mariela Lavallen, Mauricio Pons, Enrique Mercuri [et al.]. Atypical Cystic Echinococcosis in a Young Child // The Pediatric Infectious Disease Journal. — 2015. — 34(2). — 226. doi: 10.1097/INF.0000000000000525.
19. Sandal R., Jandia А., Mishra К. [et al.]. Hydatid liver disease and water lily sign, QJM // International Journal of Medicine. — Publish Ahead of Print, AUG, 2018.
20. Aslanabadi S., Zarrintan S., Abdoli-Oskouei S. [et al.]. Hydatid cyst in children: A 10-year experience from // Iran. Afr. J. Paediatr Surg. — 2013 Apr-Jun. — 10(2). — Р. 140-4. doi: 10.4103/0189-6725.115040.
21. Álvaro Díaz. Immunology of cystic echinococcosis (hydatid disease) // British Medical Bulletin. — 2017. — 124(1). — Р. 121-133. doi: 10.1093/bmb/ldx033.
22. Mourglia-Ettlin G., Miles S., Hernández A., Dematteis S. Ageing impairs parasite-specific antibody responses in cystic echinococcosis // Parasite Immunology. — 2018. — 40(1). — 123. doi: 10.1111/pim.12505.
23. Turgut A.T., Altin L., Topçu S. [et al.]. Unusual imaging characteristics of complicated hydatid disease // Eur. J. Radiol. — 2007 Jul. — 63(1). — Р. 84-93. doi: 10.1016/j.ejrad.2007.01.001.
24. Abhishek Jha, Prakhar Gupta, Shagufta Wahab [et al.]. Sonographic Diagnosis of Primary Hydatid Disease in the Breast // The Scroll Sign. Journal of Clinical Ultrasound. — 2014. — 42(8). — Р. 502-504. doi: 10.1002/jcu.22160.
25. Stojkovic M., Rosenberger K., Kauczor H.U. [et al.]. Diagnosing and staging of cystic echinococcosis: how do CT and MRI perform in comparison to ultrasound? // PLoS Negl. Trop. Dis. — 2012. — 6(10). — Р. e1880. doi: 10.1371/journal.pntd.0001880.
26. Hosch W., Junghanss T., Werner J., Düx M. Imaging Methods in the Diagnosis and Therapy of Cystic Echinococcosis // Rofo. — 2004 May. — 176(5). — Р. 679-87. doi: 10.1055/s-2004-812743. [Article in German.]

/65.jpg)
/66.jpg)