Журнал «» №6 (62), 2018
Вернуться к номеру
Легенева гіпертензія, асоційована із системними захворюваннями сполучної тканини: огляд літератури з акцентом на діагностичні аспекти
Авторы: Єгудіна Є.Д.(1), Ханюков О.О.(1), Головач І.Ю.(2), Калашникова О.С.(1)
(1) — ДЗ «Дніпропетровська державна медична академія» МОЗ України, м. Дніпро, Україна
(2) — Клінічна лікарня «Феофанія» Державного управління справами, м. Київ, Україна
Рубрики: Кардиология
Разделы: Справочник специалиста
Версия для печати
Легенева гіпертензія (ЛГ) є важливою причиною захворюваності та смертності при системних захворюваннях сполучної тканини (СЗСТ). СЗСТ можуть спричинити ЛГ через кілька механізмів: легенева артеріальна гіпертензія (ЛАГ), асоційоване інтерстиціальне захворювання легень, нервово-м’язові захворювання та/або розлади сну, що призводять до гіпоксії, асоційована тромбоемболічна ЛГ і легенева венозна гіпертензія через дисфункцію лівого шлуночка. Згідно з нещодавніми дослідженнями, ЛГ, пов’язана із захворюваннями сполучної тканини (СЗСТ-ЛАГ), має деякі відмітні клінічні аспекти від інших видів ЛГ: висока поширеність, втягнення у патологічний процес венозного русла та серця, менш сприятливий прогноз, наявність алгоритму виявлення — DETECT, відповідь на імуносупресивну терапію, значно поширені комбіновані форми. Тиск у легеневій артерії може бути виміряний за допомогою ехокардіографії, але золотий стандарт для діагностики — катетеризація правих відділів серця. ЛАГ-специфічна терапія, крім імуносупресивної, є найпоширенішим методом лікування СЗСТ-ЛАГ. У наш час існує багато суперечливих думок щодо початку та терміну призначення цих препаратів. У цьому огляді ми обговорюємо епідеміологію, патогенез, клінічну картину СЗСТ-ЛАГ, акцентуємо увагу лікарів на ранніх методах діагностування захворювання, використанні алгоритму раннього виявлення ускладнення та підходах до лікування пацієнтів.
Легочная гипертензия (ЛГ) является важной причиной заболеваемости и смертности при системных заболеваниях соединительной ткани (СЗСТ). СЗСТ могут способствовать возникновению ЛГ за счет нескольких механизмов: легочная артериальная гипертензия (ЛАГ), ассоциированное интерстициальное заболевание легких, нервно-мышечные заболевания и/или расстройства сна, приводящие к гипоксии, ассоциированная тромбоэмболическая ЛГ и легочная венозная гипертензия вследствие дисфункции левого желудочка. Согласно данным недавних исследований, ЛГ, связанная с заболеваниями соединительной ткани (СЗСТ-ЛАГ), имеет некоторые отличительные клинические аспекты от других видов ЛГ: широкая распространенность, вовлечение в патологический процесс венозного русла и сердца, менее благоприятный прогноз, наличие алгоритма обнаружения — DETECT, ответ на иммуносупрессивную терапию, частое наличие комбинированных форм. Давление в легочной артерии может быть измерено с помощью эхокардиографии, но золотой стандарт для диагностики — катетеризация правых отделов сердца. ЛАГ-специфическая терапия, кроме иммуносупрессивной терапии, является самым распространенным методом лечения СЗСТ-ЛАГ. В настоящее время существует много противоречивых мнений относительно начала и срока назначения этих препаратов. В данном обзоре мы обсуждаем эпидемиологию, патогенез, клиническую картину СЗСТ-ЛАГ, акцентируем внимание врачей на ранних методах диагностирования заболевания, использовании алгоритма раннего выявления осложнения и подходах к лечению пациентов.
Pulmonary hypertension (PH) is an important cause of morbidity and mortality in connective tissue diseases (CTD). CTD may cause PH due to several mechanisms; pulmonary arterial hypertension (PAH), associated interstitial lung disease, neuromuscular disease, and/or sleep-disordered breathing leading to hypoxia, associated thromboembolic PH, and pulmonary venous hypertension due to left ventricular dysfunction. Recent studies have clarified that pulmonary hypertension associated with connective tissue diseases (CTD-PАH) has some distinctive clinical aspects from other PH, such as high prevalence, venous and cardiac involvement, less favourable outcomes, presence of DETECT algorithm, response to immunosuppression, existence of combined forms. Pressure in pulmonary artery can be measured on echocardiography, but the gold standard for the diagnosis is right heart catheterization. PАH-specific therapy in addition to immunosuppression is the most common treatment used for CTD-PАH patients, there are currently many controversial thoughts about the beginning and duration of these drug prescribing. In this review, we discuss the epidemiologic burden, pathogenesis, clinical presentation of CTD-PАH, focus physicians’ attention on the diagnostic criteria and algorithms of early disease detection and management of these patients.
системне захворювання сполучної тканини; легенева гіпертензія; змішане захворювання сполучної тканини; системна склеродермія; системний червоний вовчак; огляд
системное заболевание соединительной ткани; легочная гипертензия; смешанное заболевание соединительной ткани; системная склеродермия; системная красная волчанка; обзор
systemic connective tissue disease; pulmonary hypertension; mixed connective tissue disease; systemic sclerosis; systemic lupus erythrematosus; review
Визначення
Легенева гіпертензія (ЛГ) являє собою підвищений середній тиск у легеневій артерії, виміряний при катетеризації правих відділів серця (КПВС), що становить 25 мм рт.ст. або більше [1]. ЛГ, що виникає внаслідок ремоделювання та звуження легеневих артерій і артеріол, — це легенева артеріальна гіпертензія (ЛАГ), класифікована як група 1; ЛГ, що виникає внаслідок порушення функції лівого відділу серця та подальшого застою у малому колі кровообігу, — група 2; ЛГ, обумовлена гіпоксія–асоційованою вазоконстрикцією легеневих судин через захворювання легень, — група 3; ЛГ, пов’язана з оклюзією легеневого судинного русла через тромбоемболію, — група 4; ЛГ, обумовлена незрозумілими багатофакторними механізмами, — група 5 [2, 3]. Серед цих п’ятьох форм ЛГ ЛАГ має особливе клінічне значення через високу смертність, а також останні досягнення специфічної терапії, включаючи антагоністи рецепторів ендотеліну (АРЕ), інгібітори фосфодіестерази типу 5 (іФДЕ5), розчинний стимулятор гуанілатциклази, аналоги простацикліну й агоністи рецепторів простацикліну.
Порівняно з низькою поширеністю у загальній популяції — приблизно 15 випадків на мільйон чоловік — ЛАГ нерідко спостерігається в осіб із системними захворюваннями сполучної тканини (СЗСТ), які є основною причиною розвитку ЛАГ і становлять близько чверті випадків у загальній популяції ЛАГ [4]. Поширеність ЛАГ і ЛГ у пацієнтів із системною склеродермією (ССД) становить приблизно 20 % [5].
ЛАГ — рефрактерна хвороба, що характеризується прогресуючим підвищенням тиску у судинах малого кола кровообігу та підвищенням легеневого судинного опору (ЛСО). Діагностичними ознаками цього стану є підвищення середнього тиску в легеневій артерії (СерТЛА) ≥ 25 мм рт.ст., ЛСО > 3 одиниць Вуда, тиску заклинювання легеневої артерії (ТЗЛА) ≤ 15 мм рт.ст. за даними катетеризації правих відділів серця і легеневої артерії. Обов’язковим критерієм діагностики є відсутність ураження лівого відділу серця, інтерстиціальних або обструктивних захворювань легень і тромбоемболії [6].
ЛАГ, пов’язана із СЗСТ (СЗСТ–ЛАГ), порівняно з ідіопатичною ЛАГ (ІЛАГ) має деякі унікальні клінічні характеристики, такі як менш сприятливий прогноз, залучення венозного русла та серця, відповідь на імуносупресію.
Поданий огляд літератури зосереджується на специфічних аспектах СЗСТ–ЛАГ, акцентує увагу лікарів на ранніх методах діагностування цього захворювання, стратифікації ризику пацієнтів із ЛГ і підходах до лікування.
Патогенез
Патогенез ЛГ включає чотири патофізіологічних механізми [7]: 1) вазоконстрикцію; 2) редукцію легеневого судинного русла; 3) зниження еластичності легеневих судин; 4) облітерацію легеневих судин (тромбоз in situ, проліферацію гладком’язових клітин). До розвитку цих подій у будь–якому генезі ЛГ призводить дисфункція ендотелію, що має перебіг із порушенням балансу вазоактивних медіаторів [8]. Внаслідок ушкодження клітин ендотелію виділяються хемотаксичні агенти, що викликають міграцію гладком’язових клітин в інтиму легеневих артеріол [8]. Також провідну роль у формуванні ЛГ відіграє тромбоз in situ, який формується через секрецію простациклінів і інгібіторів тканинного активатора плазміногену з вираженим їх вазоконстрикторним ефектом, що трансформує легеневе судинне русло зі звичайного антикоагулянтного стану у прокоагулянтний [9]. Унаслідок чого утворюється порочне коло, коли ушкодження ендотелію призводить до прогресуючого ремоделювання легеневих судин, наростання судинної обструкції й облітерації [7]. Патологічні процеси зачіпають всі шари судинної стінки та різні типи клітин — фібробласти, ендотеліальні та гладком’язові клітини [8].
Класифікація
Відповідно до сучасної класифікації, ЛГ включає в себе п’ять основних груп із загальними клінічними та патофізіологічними особливостями: група 1 — ЛАГ; група 2 — ЛГ, пов’язана з ураженням лівих відділів серця; група 3 — ЛГ, обумовлена захворюваннями легень; група 4 — хронічна тромбоемболічна легенева гіпертензія (ХТЕЛГ); група 5 — ЛГ із неясними механізмами [2, 3] (рис. 1).
Крім того, залежно від рівня ТЗЛА ЛГ підрозділяється на прекапілярну (ТЗЛА ≤ 15 мм рт.ст.) або посткапілярну (ТЗЛА > 15 мм рт.ст.) [2]. Прекапілярна ЛГ розвивається при ураженнях судинного русла легень, коли патофізіологічні процеси призводять до підвищення ЛСО. На відміну від цього посткапілярна ЛГ розвивається через пасивну передачу підвищеного ТЗЛА без обов’язкового збільшення ЛСС. У табл. 1 подані різні гемодинамічні групи ЛГ.
Яка з цих груп більш притаманна СЗСТ–ЛАГ?
У гістопатологічних дослідженнях продемонстровано ангіопатію, притаманну СЗСТ–ЛАГ, особливо щодо ЛАГ, асоційованої із системною склеродермією (ССД–ЛАГ), яка включає фіброз інтими, проліферацію клітин ендотелію та гладкої мускулатури [10]. P. Dorfmuller та співавт. [11] показали, що у 6 (75 %) з 8 пацієнтів із СЗСТ–ЛАГ, включаючи 4 осіб із ССД, 1 — із системним червоним вовчаком (СЧВ), 1 — зі змішаним захворюванням сполучної тканини (ЗЗСТ), при гістопатологічному дослідженні було виявлено не тільки обструктивну артеріопатію, але й венозне та венулярне обструктивне ураження судин легень. M.J. Overbeek та співавт. [12] виявили, що всі хворі із ССД–ЛАГ, які брали участь у дослідженні, мали реконструкцію легеневих вен і венул, тоді як такі зміни були наявні лише у 3 з 11 пацієнтів із ІЛАГ. Це є проявом легеневої венооклюзивної хвороби (ВОХЛ), яка нещодавно класифікована як ЛГ група 1’ [2]. Згідно з цим на комп’ютерній томографії легень можна виявити доволі часту рентгенографічну тріаду ВОХЛ: збільшення лімфатичних вузлів, центролобулярне затемнення та септальні лінії [13].
Крім уражень легень, для СЗСТ–ЛАГ типовим є ураження серця. У дослідженні, проведеному S.C. Mathai і співавт. [14], у сироватці крові пацієнтів із ССД–ЛАГ виявлено підвищений уміст NT–proBNP порівняно з пацієнтами з ІЛАГ, незважаючи на більш низький СерТЛА. У кількох дослідженнях із застосуванням магнітно–резонансної томографії серця спостерігалися характерні для ССД–ЛАГ зміни — порушення функції й ремоделювання правого шлуночка зі збільшенням післянавантаження та зміненою бівентрикулярною взаємодією [15, 16].
Дослідження ендоміокардіальної біопсії показало патологічну депозицію колагену в міокарді пацієнтів із ССД, які не мають ознак або симптомів захворювання лівої або правої половини серця [17]. З огляду на це у пацієнтів із СЗСТ–ЛАГ може розвиватися не тільки вторинна серцева дисфункція через підвищений артеріальний тиск у легеневій артерії, але і первинна серцева патологія через фіброз міокарда, що можна розцінювати, як комбіновану ЛГ (групи 1 та 2), що є типовим для СЗСТ–ЛАГ.
До того ж група 2 ЛГ переконливо здатна викликати реконструкцію легеневого судинного русла та подальшу диспропорційну ЛГ, що робить патогенез СЗСТ–ЛАГ більш складним. У дослідженні B.D. Fox і співавт. [18] було повідомлено про високу поширеність групи 2 ЛГ у хворих на ССД. Серед 53 пацієнтів із ССД–ЛАГ 29 були класифіковані у групу 1 ЛГ (ЛАГ) із ТЗЛА < 15 мм рт.cт., а 24 — у групу 2 ЛГ із ТЗЛА > 15 мм рт.ст. Крім того, з цих 29 пацієнтів із ССД–ЛАГ 11 мали підвищений кінцевий діастолічний тиск лівого шлуночка > 15 мм рт.ст. до чи після навантаження 500 мл рідини, що свідчить про співіснування групи 2 ЛГ із ЛАГ. Вважається, що ці відмінні венозні та серцеві ураження пов’язані з менш сприятливими наслідками у хворих на ССД–ЛАГ.
Звісний факт ураження легень, притаманний СЗСТ у вигляді інтерстиціального захворювання легень, пульмонітів, плевритів і альвеолітів, призводить до формування групи 3 ЛГ.
У пацієнтів із СЧВ–ЛАГ описано легеневий васкуліт, імунокомплексну депозицію в інтимі та медіальних шарах стінок легеневих судин, включаючи IgG, IgM, C3 і C1q [19], що підтверджують роль автоімунних процесів у патогенезі ЛГ у хворих на СЗСТ. Дуже часто у хворих на СЗСТ виникає вторинний антифосфоліпідний синдром, пов’язаний із групою 4 ЛГ (хронічна тромбоемболічна легенева гіпертензія), внаслідок виникнення артеріальних тромбозів [20]. Тобто у формуванні ЛГ при СЗСТ відіграють роль багато патогенетичних факторів, які формують ЛАГ типу 1 і 1’, ЛГ типу 2, типу 3 і 4 з розвитком як прекапілярної, так і посткапілярної ЛГ.
Клінічна картина
Немає специфічних типових клінічних симптомів, за допомогою яких можливо діагностувати ЛГ, клінічні ознаки симулюють різні захворювання серцево–судинної та дихальної систем. Першим симптомом звичайно є задишка, що часто супроводжується втомою, виснаженням і виникає в переважній більшості випадків (94 %) СЗСТ–ЛАГ [21].
Через неспецифічнсть клінічних синдромів при ЛГ існує затримка в діагностиці цього стану. При прогресуванні захворювання симптоми стають гіршими, з’являються нові, наприклад задишка при згинанні (бендопнія) та синкопе, останній симптом виникає зазвичай під час або відразу після фізичного навантаження. Часті синкопе навіть при невеликому навантаженні є прогнозонегативним фактором і чітко вказують на наявність небезпечного для життя стану, пов’язаного з високою смертністю [21].
При об’єктивному дослідженні хворих із компенсованою ЛГ, як правило, лікар не виявляє ніяких аномалій. Ранні ознаки — периферичний або центральний ціаноз спочатку під час фізичного навантаження, акцент другого тону на легеневій артерії при аускультації основи серця, систолічний шум регургітації на трикуспідальному клапані. Клінічні прояви розгорненої стадії захворювання — це ознаки хронічної серцевої недостатності (ХСН), набряки, біль у грудній клітці, серцебиття, гепатомегалія, прекардіальна пульсація, пульсація яремних вен, асцит тощо. Зниження перфузії органів через розвиток ХСН лежить в основі формування печінкової дисфункції у пацієнтів із СЗСТ–ЛАГ. У хворих на ЛГ підвищення рівня білірубіну асоційоване зі збільшенням рівня лужної фосфатази і загальної лактатдегідрогенази. Гіпербілірубінемія — доступний і достовірний маркер тяжкої правошлуночкової недостатності та несприятливого прогнозу у пацієнтів із ЛГ. Підвищення рівня γ–глутамілтранспептидази у пацієнтів із СЗСТ–ЛАГ також може бути пов’язано із супутнім первинним біліарним ураженням [22].
Анасарка, так само, як і виражена гіпотензія, зустрічається на заключних стадіях захворювання та при IV функціональному класі (ФК). При СЗСТ–ЛАГ показники систолічного тиску в правому шлуночку і легеневій артерії в більшості випадків значно нижчі, а діастолічного — вищі, ніж при ІЛАГ, що також впливає на виживаність, знижуючи останню [23]. Цей феномен, при подібних анатомічних змінах правих відділів серця, дозволяє зробити висновок, що у пацієнтів із СЗСТ–ЛАГ знижена здатність до ремоделювання правих відділів серця при збільшенні ЛСО. Це може бути наслідком запалення та фіброзу, на що вказують результати ендоміокардіальної біопсії у пацієнтів із СЗСТ [17].
Для клінічної оцінки ступеня тяжкості захворювання використовується класифікація ЛГ за функціональним класом, що є адаптованою класифікацією серцевої недостатності згідно з класифікацією Нью–Йоркської асоціації серця.
Діагностика
З огляду на порівняно високу поширеність ЛГ у пацієнтів із СЗСТ, особливо із ССД, та неспецифічність клінічної симптоматики необхідний ефективний скринінг ЛГ і ЛАГ щодо раннього виявлення цього захворювання у пацієнтів для поліпшення прогнозу. Згідно з сучасними рекомендаціями [24], пацієнти з ССД, які мають такі прояви, як склеродактилія, аномалії на капіляроскопії нігтьового ложа і специфічні для ССД автоантитіла, щороку повинні проходити скринінг щодо ЛАГ, включаючи такі тести: легеневі функціональні проби, дослідження легеневої функції з оцінкою дифузійної здатності легень для монооксиду вуглецю (DLсo), трансторакальну ехокардіографію (ТЕхоКГ), вимірювання рівня NT–proBNP, проведення катетеризації правих відділів серця при виявленні показань до цього дослідження (табл. 2). Хворі на інші СЗСТ повинні пройти скринінг так само при виникненні у лікаря підозри на наявність ЛГ з огляду на скарги, об’єктивне дослідження чи дані інструментальних методів дослідження (табл. 3, рис. 2).
/38-1.jpg)
Для скринінгу та раннього виявлення ЛГ і, зокрема, у пацієнтів із СЗСТ–ЛАГ рекомендується доказовий алгоритм DETECT [25]; окрім того він дозволяє визначити, яким саме пацієнтам потрібно проводити катетеризацію правих відділів серця для уточнення діагнозу. Цей алгоритм включає 8 показників: DLCO, наявність телеангіектазій, антицентромерних антитіл, рівень NT–proBNP, сечової кислоти крові, відхилення електричної осі на електрокардіограмі вправо, розмір правого передсердя та швидкість трикуспідальної регургітації (вимірюється при ТЕхоКГ). Калькулятор ризику ЛАГ доступний на веб–сайті:
http://detect–pah.com.
Цікавим, на наш погляд, є включення показника сироваткової концентрації сечової кислоти до алгоритму DETECT як маркера діагностики ЛГ. Ішемія легеневої тканини робить ключовий внесок у підвищення рівня сечової кислоти, рівень останньої збільшується пропорційно до тяжкості гіпоксії у пацієнтів із ЛАГ, хронічною обструктивною хворобою легень і обструктивним апное [26]. Тканинна ішемія викликає достовірне зниження рівня аденозинтрифосфату й активує деградацію пуринових нуклеотидів аж до сечової кислоти, призводячи до гіперпродукції уратів у тканинах серця, легень, печінки та скелетної мускулатури. Рівень сечової кислоти прямо корелює з ЛСО й обернено із серцевим викидом (СВ), зменшуючись при призначенні простаноїдів. Серед неінвазивних маркерів прогнозу сироватковий рівень сечової кислоти незалежно пов’язаний зі смертністю пацієнтів з ІЛАГ [26]. Крім того, у пацієнтів із ХСН концентрація сечової кислоти корелює з концентрацією інтерлейкіну–6, розчинних рецепторів фактора некрозу пухлини, розчинних молекул міжклітинної адгезії, Е–селектину, а рівні цих прозапальних маркерів істотно збільшені при СЗСТ, що також зумовлює гіперурикемію [27].
Концентрація NT–proBNP — основного маркера ХСН, широко використовуваного в кардіології, а також ІЛАГ і ЛАГ при вроджених вадах серця має тенденцію до більш високих значень, як і при СЗСТ–ЛАГ [28].
Незважаючи на відсутність доказів щодо частоти такого скринінгу, дослідження, принаймні DLCO та ТЕхоКГ, рекомендується проводити щорічно, навіть за браком ознак і симптомів ЛГ, у пацієнтів із ССД [24]. Показано, що зменшення DLCO і збільшення рівня NT–proBNP асоціюється з ЛАГ у хворих на ССД [29]. Крім того, зниження DLCO характерно для пацієнтів із ВОХЛ [13].
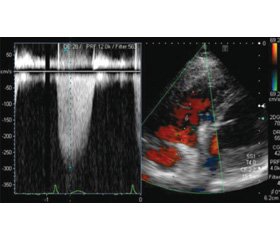
КПВС є золотим стандартом діагностики ЛГ. Якщо при КПВС СерТЛА буде 25 мм рт.ст. або більше та ТЗЛА < 15 мм рт.ст., необхідно провести вентиляційне–перфузійне (V/Q) сканування та комп’ютерну томографію (КТ) грудної клітки для виключення чи підтвердження діагнозу ЛГ груп 4, 3, 1 та 1’ (ВОХЛ) (рис. 2). Магнітно–резонансне дослідження серця, а також контрастне посилення міокарда може розглядатися для оцінки субклінічних функціональних або морфологічних аномалій, які вказують на групу 2 ЛГ, включаючи систолічну або діастолічну дисфункцію лівого або правого шлуночка. Знімки зображень подані на рис. 3.
Визначення ризику несприятливого прогнозу у пацієнтів із ЛГ
До факторів, що впливають на прогноз пацієнтів із ЛГ, відносяться ФК, наявність ознак правошлуночкової серцевої недостатності, толерантність до фізичних навантажень, дистанція в 6–хвилинному тесті ходьби (6–ХТХ), рівень пікового споживання кисню (VO2), деякі ехокардіографічні ознаки (наявність перикардіального випоту, площа правого передсердя (ПП)) і гемодинамічні параметри (тиск у ПП, СВ, змішана венозна сатурація — SvO2), а також рівні біомаркерів (сечової кислоти, натрій–уретичного пептиду — BNP, тропоніну, норадреналіну, ендотеліну–1) [2, 31, 32]. Всі вони були стратифіковані залежно від рівня ризику та подані в табл. 3.
Межова (погранична) легенева артеріальна гіпертензія
Як відомо, нормальний СерТЛА становить 14,0–20,9 мм рт.ст. Отже, СерТЛА, що дорівнює 21–24 мм рт.ст., називається пограничним (ПоТЛА),
що може являти собою ранню субклінічну стадію легеневої васкулопатії, але поки що не є показанням до терапії, специфічної для ЛАГ. У недавньому обсерваційному дослідженні G. Kovacs та спів–авт. [33] виявили, що у 32 із 141 пацієнта зі СЗСТ або без такого, які підлягали КПВС із підозрою на наявність ЛГ, спостерігався ПоТЛА. Пацієнти були старші за віком і частіше мали супутню серцеву та/або дихальну недостатність порівняно з пацієнтами із СерТЛА < 21 мм рт.ст. Це свідчить про те, що ПоТЛА асоціюється з доклінічною стадією групи 2 або 3 ЛГ, а не ЛАГ. І, навпаки, у проспективному когортному дослідженні C.J. Valerio та співавт. [34] повідомлялось про розвиток ЛАГ у 42 % (16/38) хворих на ССД із початковим ПоТЛА протягом 45–місячного спостереження, що свідчить про відносно високу поширеність попереднього пре–ЛАГ–стану, асоційованого з ПоТЛА при ССД.
Зважаючи на менш сприятливі наслідки з огляду на більш низький рівень СрТЛА, для пацієнтів із ССД–ЛАГ може знадобитися рання специфічна терапія. Проте у пацієнтів із ССД ПоТЛА може бути не лише пре–ЛАГ–станом, але й субклінічною стадією групи 1’ (ВОХЛ), 2 або 3 ЛГ, для яких призначення ЛАГ–специфічної терапії відносно протипоказане [35].
Лікування пацієнта із СЗСТ–ЛАГ
Рекомендовано уникати виникнення таких потенційно небезпечних симптомів, як виражена задишка, непритомність, біль у грудній клітці. Забороняються фізичні навантаження після їжі, при несприятливому температурному режимі. Рекомендована епідуральна анестезія як метод вибору при проведенні хирургічних втручань. Пацієнткам із ЛГ необхідно застосовувати методи контрацепції, оскільки вагітність протипоказана через можливу декомпенсацію і летальний кінець. Для профілактики респіраторних інфекцій необхідне проведення вакци–нації.
Виділяють два компоненти лікарської терапії у хворих на ЛГ — підтримуючу терапію (пероральні антикоагулянти і дезагреганти, діуретики, серцеві глікозиди, оксигенотерапія) і специфічну терапію, що включає антагоністи кальцію, простаноїди, антагоністи рецепторів ендотеліну, інгібітори фосфодіестерази типу 5.
Підтримуюча терапія. Рекомендовано призначення сечогінних препаратів у всіх випадках розвитку декомпенсації правого шлуночка у хворих на ЛГ. Оксигенотерапія рекомендується пацієнтам із ЛГ на тлі захворювання легень, при розвитку дихальної недостатності та гіпоксемії протягом не менше 15 год/добу. Важливо постійно підтримувати сатурацію кисню на рівні 90 % і вище. Призначення серцевих глікозидів рекомендовано при порушеннях шлуночкового ритму, надшлуночкових тахіаритміях у хворих на ЛГ. В інших випадках їх застосування не виправдано. Також не виправдано при СЗСТ–ЛАГ застосування антикоагулянтів, оскільки існують результати терапії цими препаратами з від’ємною кореляцією на користь виживання [36, 37]; їх призначення здійснюється тільки при наявності основних показань (тромбози) [38]. Визначено також недоцільним призначення інгібіторів ангіотензинперетворюючого ферменту, блокаторів рецепторів ангіотензину, b–адреноблокаторів, івабрадину хворим на ЛГ за відсутності специфічних показань до прийому цих препаратів [32].
Специфічна терапія. Алгоритм лікування СЗСТ–ЛАГ аналогічний до ІЛАГ, що було показано у великих рандомізованих дослідженнях. Сучасна концепція патогенетичної терапії ЛАГ подана на рис. 4.
Антагоніст ендотелінових рецепторів (АЕР) бозентан показав клінічну ефективність і добру переносимість для пацієнтів як з ІЛАГ, так і з СЗСТ–ЛАГ у подвійному сліпому плацебо–контрольованому дослідженні, яке включало 213 пацієнтів з ЛАГ, 63 з яких мали СЗСТ–ЛАГ [39]. Мацитентан — АЕР із подвійним механізмом дії, що вивчався в тривалому багатоцентровому подвійному сліпому плацебо–контрольованому дослідженні SERAPHIN для оцінки впливу терапії на прогресування захворювання та смертність хворих на ЛАГ різної етіології; цей препарат запобігає прогресуванню хвороби, поліпшує виживаність хворих на СЗСТ–ЛАГ [40].
Селективний інгібітор цГМФ–специфічної фосфодіестерази 5 силденафіл показав сприятливий терапевтичний ефект у вигляді поліпшення толерантності до фізичних навантажень, клінічної симптоматики та/або гемодинаміки в дослідженні, що включало 278 пацієнтів із ЛАГ, серед них 84 — із СЗСТ–ЛАГ [41]. Згідно з метааналізом 26 досліджень, проведеним M. Kuwana і співавт. [42], в якому порівнювався ефект іФДЕ5, АЕР та простацикліну за допомогою тесту 6–ХТХ у пацієнтів із СЗСТ–ЛАГ і ЛАГ без СЗСТ. іФДЕ5 та простациклін показали однаково добрий ефект, тоді як АЕР поступалися в ефективності. Розчинний стимулятор гуанілатциклази — ріоцигуат у подвійному сліпому рандомізованому контрольованому дослідженні серед 66 пацієнтів із ССД–ЛАГ і 39 із СЗСТ–ЛАГ переносився дуже добре, хоча ефект був менш вираженим, ніж у загальній популяції досліджених, особливо в групі ССД–ЛАГ [43].
В іншому ретроспективному дослідженні з великою кількістю пацієнтів із СЗСТ–ЛАГ, включаючи 170 із ССД–ЛАГ, 82 із СЧВ–ЛАГ і 82 із ЗЗСТ–ЛАГ, агоніст простациклінових рецепторів селексипаг добре переносився і затримував прогресування ЛАГ незалежно від підтипу СЗСТ [44]. Дослідження AMBITION [45] продемонструвало перевагу початкової комбінованої терапії АЕР амбрисентану та іФДЕ5 тадалафілу у пацієнтів із СЗСТ–ЛАГ порівняно з монотерапією цими препаратами.
Зважаючи на менш сприятливий результат лікування у пацієнтів із СЗСТ–ЛАГ порівняно з пацієнтами з ІЛАГ, такі хворі потребують більш агресивного режиму лікування. Але слід мати на увазі, що агресивна вазодилатація іноді асоціюється з негативним ефектом при лікуванні інших форм ЛГ — розвитком тяжкого набряку легень у пацієнтів із ВОХЛ і погіршенням гіпоксії у пацієнтів із ЛГ групи 3 (ЛГ внаслідок захворювання легень), імовірно, через підвищену вентиляційно–перфузійну невідповідність. ЛАГ–специфічні вазодилататори також не продемонстрували клінічної користі для ЛГ групи 2 [46].
Отже, необхідні подальші клінічні дослідження для визначення первинної комбінованої терапії при СЗСТ–ЛАГ, особливо при ССД–ЛАГ, яка часто пов’язана з ураженням венозного русла, серця та інтерстицію легень. Блокатори кальцієвих каналів не можуть бути рекомендовані як вазодилатаційна терапія для СЗСТ–ЛАГ, оскільки гостра вазореактивність під час проведення гемодинамічного тестування становить < 1 % у пацієнтів із ССД–ЛАГ [47].
Одним із найбільш відмітних аспектів СЗСТ–ЛАГ від інших ЛАГ є відповідь на імуносупресію. Лікування, що поєднує глюкокортикоїди та внутрішньовенний циклофосфамід (ЦФ), може призвести до клінічного поліпшення у пацієнтів із СЧВ–, ЗЗСТ– або первинним синдромом Шегрена–ЛАГ, але такої відповіді на лікування імуносупресантами не спостерігається у пацієнтів із ССД–ЛАГ [48, 49]. Можливою причиною для кращої відповіді на лікування імуносупресантами у пацієнтів із СЧВ– або ЗЗСТ–ЛАГ є те, що при цих захворюваннях першочергову роль у реконструкції судинної системи легень відіграють імунні та запальні механізми, а не фіброзні, як при ССД–ЛАГ. У пацієнтів із СЧВ зміни у судинах легень при ЛАГ мають також гістологічні особливості, які і при вовчаковому нефриті, особливо при проліферативному субтипі. Додавання імуносупресії до ЛАГ–специфічної вазодилатаційної терапії спричиняє подальший терапевтичний ефект у хворих на СЧВ–ЛАГ [50]. Цікаво, що резистентна до вазодилататорів хвороба може реагувати на імуносупресію [51].
З урахуванням гістопатологічної подібності між ЛАГ і проліферативним гломерулонефритом у пацієнтів із СЧВ оптимальна схема імуносупресивної терапії (ІСТ) є такою: глюкокортикоїди — 0,5–
1,0 мг/кг/день преднізолону з подальшим поступовим зниженням, внутрішньовенний ЦФ — пульс–терапія щомісяця, 500–1000 мг протягом 3–12 місяців у більшості випадків [49, 50, 52]. Сприятливий ефект мофетилу мікофенолату в поєднанні з такролімусом або циклоспорином, ритуксимабом і тоцилізумабом для лікування СЗСТ–ЛАГ був описаний у декількох клінічних випадках [49, 51]. Азатіоприн може розглядатися як підтримуюча терапія після застосування парентерального ЦФ [49].
У літературі є суперечки щодо термінів ІСТ і терапевтичних стратегій. Е. Tanaka та співавт. (2002) стверджували, що ІСТ є менш ефективною у хворих на ССЗ із задавненою ЛАГ, оскільки зміни легеневих судин вже стали необоротними [53]. Крім того, є дані, що ІСТ має найкращий ефект, якщо лікування розпочинається відразу після діагностики ЛАГ [52]. Зрештою, цю тезу можна віднести до терапії будь–якого захворювання. На відміну від цього інше дослідження стверджує, що немає різниці щодо інтервалу часу між діагнозом СЗСТ і початком ІСТ [54], що свідчить про те, що процес був все ще оборотним у момент початку лікування.
Питання, чи слід одночасно починати ІСТ і специфічну щодо ЛАГ терапію, також все ще однозначно не вирішено. J.G. Coghlan і співавт. (2017) відзначали, що пацієнти, в яких СЗСТ і ЛАГ були діагностовані одночасно, краще відповідали на первинну ІСТ, ніж на комбіновану терапію імуносупресорами та вазодилататорами, і, навпаки, у випадках діагностування ЛАГ через роки після СЗСТ комбінована терапія мала свої переваги [43].
Трансплантація легень
Хоча широке використання сучасних специфічних препаратів істотно зменшило частоту транс–плантації легень у пацієнтів із ЛАГ, останній метод лікування залишається терапією вибору для окремих пацієнтів, які не мають ефекту від призначеного лікування [55]. Як правило, діагноз ССД часто викликає настороженість у хірургів через те, що часто втягнення у патологічний процес шлунково–кишкового тракту (а саме порушення мотор–ної функції, пов’язане з рефлюксом) викликає настороженість внаслідок можливої аспірації та ушкодження алотрансплантата. Однак міжнародні рекомендації не виключають можливості трансплантації легень у пацієнтів із ССД або іншими СЗСТ за умов відсутності тяжких системних проявів.
Висновки
Отже, в останніх дослідженнях було з’ясовано, що СЗСТ–ЛАГ має декілька відмінних рис від інших варіантів ЛГ, включаючи одночасне ураження венозного русла, легень і серця, що призводить до виникнення комбінованих форм, корисність алгоритму виявлення, позитивну відповідь на ІСТ. Прогноз пацієнтів із СЗСТ–ЛАГ значно покращився останніми роками. Проте залишаються важливі питання, які необхідно вирішити, такі як виявлення та лікування випадків співіснування груп 1’, 2 та/або 3 ЛГ, оптимального режиму імуносупресивної терапії та лікування випадків По–ЛАГ. Розуміння відмітних аспектів і поточних незадоволених потреб може допомогти клініцистам забезпечити ефективне та безпечне лікування СЗСТ–ЛАГ. У наш час, незважаючи на очевидний прогрес у діагностиці та лікуванні СЗСТ–ЛАГ, існує чимало невирішених і суперечливих проблем, однак використання накопичених знань і їх практичне застосування істотно поліпшують прогноз пацієнтів із СЗСТ–ЛАГ.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів, при цьому автори не отримували від окремих осіб і організацій фінансової підтримки дослідження, гонорарів та інших форм винагород.
Інформація про внесок кожного учасника: Ханюков О.О. — концепція і дизайн дослідження, огляд літератури з теми; Головач І.Ю. — концепція і дизайн дослідження, підготовка статті до друку; Єгудіна Е.Д. — огляд літератури згідно з проблемою, написання тексту; Калашникова О.С. — підготовка ілюстрацій, редагування тексту.
1. Серцево–судинні захворювання. Класифікація, стандарти діагностики та лікування / За ред. В.М. Коваленка, М.І. Лутая, Ю.М. Сіренка, О.С. Сичова — К.: МОРІОН, 2016. — 189 с.
2. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: the Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT) / N. Galie, M. Humbert, J.L. Vachiery [et al.] // Eur. Heart J. — 2016. — Vol. 37. — P. 67–119.
3. Діагностика та лікування легеневої гіпертензії. Рекомендації робочої групи з легеневих гіпертензій / Л.Ф. Конопльова, В.М. Коваленко, К.М. Амосова та ін. // Укр. кардіол. журн. — 2014. — Додаток 3. — С. 3–40.
4. McGoon M.D. REVEAL: a contemporary US pulmonary arterial hypertension registry / M.D. McGoon, D.P. Miller // Eur. Respir. Rev. — 2012. — Vol. 21. — P. 8–18.
5. Prevalence of pulmonary hypertension in systemic sclerosis in European Caucasians and metaanalysis of 5 studies / J. Avo–uac, P. Airo, C. Meune [et al.] // J. Rheumatol. — 2010. — Vol. 37. — P. 2290–2298.
6. Updated clinical classification of pulmonary hypertension / G. Simonneau, M.A. Gatzoulis, I. Adatia [et al.] // J. Am Coll. Cardiol. — 2013. — Vol. 62, Suppl. 25. — P. 34–41.
7. Волков А.В. Легочная артериальная гипертензия при системных заболеваниях соединительной ткани / А.В. Волков // Научно–практическая ревматология. — 2015. — Т. 53, № 1. — C. 69–77.
8. Pulmonary arterial hypertension: pathogenesis and clinical management / T. Thenappan, M.L. Ormiston, J.J. Ryan, S.L. Archer // BMJ. — 2018. — Vol. 360. — P. 5492.
9. Role of prostacyclin in pulmonary hypertension / J.A. Mitchell, B. Ahmetaj–Shala, N.S. Kirkby [et al.] // Glob. Cardiol. Sci Pract. — 2014. — Vol. 2014, № 4. — P. 382–393.
10. Проценко Г.О. Легенева гіпертензія у хворих на системну склеродермію / Г.О. Проценко, Ю.М. Сіренко // Укр. ревм. журн. — 2016. — № 4(66). — C. 75–78.
11. Fibrous remodeling of the pulmonary venous system in pulmonary arterial hypertension associated with connective tissue diseases / P. Dorfmuller, M. Humbert, F. Perros [et al.] // Hum. Pathol. — 2007. — Vol. 38. — P. 893–902.
12. Pulmonary arterial hypertension in limited cutaneous systemic sclerosis: a distinctive vasculopathy / M.J. Overbeek, M.C. Vonk, A. Boonstra [et al.] // Eur. Respir. J. — 2009. — Vol. 34. — P. 371–379.
13. Computed tomography findings of pulmonary venoocclusive disease in scleroderma patients presenting with precapillary pulmonary hypertension / S. Gunther, X. Jais, S. Maitre [et al.] // Arthritis Rheum. — 2012. — Vol. 64. — P. 2995–3000.
14. Disproportionate elevation of N–terminal pro–brain natriuretic peptide in scleroderma–related pulmonary hypertension / S.C. Mathai, M. Bueso, L.K. Hummers [et al.] // Eur. Respir. J. — 2010. — Vol. 35. — P. 95–104.
15. Right ventricular remodeling in idiopathic and scleroderma–associated pulmonary arterial hypertension: two distinct phenotypes / B.W. Kelemen, S.C. Mathai, R.J. Tedford [et al.] // Pulm. Circ. — 2015. — Vol. 5. — P. 327–334.
16. Biventricular interplay in patients with systemic sclerosis–associated pulmonary arterial hypertension: detection by cardiac magnetic resonance / A. Noguchi, M. Kato, M. Kono [et al.] // Mod. Rheumatol. — 2017. — Vol. 27. — P. 481–488.
17. Cardiac remodeling in patients with systemic sclerosis with no signs or symptoms of heart failure: an endomyocardial biopsy study / F. Fernandes, F.J. Ramires, E. Arteaga [et al.] // J. Card. Fail. — 2003. — Vol. 9. — P. 311–317.
18. High prevalence of occult left heart disease in scleroderma–pulmonary hypertension / B.D. Fox, A. Shimony, D. Langleben [et al.] // Eur. Respir. J. — 2013. — Vol. 42. — P. 1083–1091.
19. Asherson R.A. Pulmonary hypertension and systemic lupus erythematosus / R.A. Asherson, C.M. Oakley // J. Rheumatol. — 1986. — Vol. 13. — P. 1–5.
20. The development of marked collateral circulation due to inferior vena cava filter occlusion in a patient with chronic thromboembolic pulmonary hypertension complicated with anti–phospholipid syndrome / H. Kasai, N. Tanabe, K. Koshikawa [et al.] // Intern. Med. — 2017. — Vol. 56. — P. 931–936.
21. Pulmonary Hypertension / M.M. Hoepe, H.A. Ghofrani, E. Grünig [et al.] // Dtsch. Arztebl. Int. — 2017. — Vol. 114, № 5. — P. 73–84.
22. Bilirubin as a prognostic marker in patients with pulmonary arterial hypertension / Y. Takeda, Y. Takeda, S. Tomimoto [et al.] // BMC Pulm. Med. — 2010. — Vol. 10. — P. 22.
23. Chin K.M. The right ventricle in pulmonary hypertension / K.M. Chin, N.H. Kim, L.J. Rubin // Coron. Artery Dis. — 2005. — Vol. 16. — P. 13–8.
24. Recommendations for screening and detection of connective tissue disease–associated pulmonary arterial hypertension / D. Khanna, H. Gladue, R. Channick [et al.] // Arthritis Rheum. — 2013. — Vol. 65. — P. 3194–3201.
25. Evidence–based detection of pulmonary arterial hypertension in systemic sclerosis: the DETECT study / J.G. Coghlan, C.P. Denton, E. Grunig [et al.] // Ann. Rheum. Dis. — 2014. — Vol. 73. — P. 1340–1349.
26. Serum uric acid levels correlate with the severity and the mortality of primary pulmonary hypertension / N. Nagaya, M. Uematsu, T. Satoh [et al.] // Am. J. Respir. Crit. Care Med. — 1999. — Vol. 160. — P. 487–92.
27. Uric acid in chronic heart failure: A marker of chronic inflammation / F. Leyva, S.D. Anker, I.F. Godsland [et al.] // Eur. Heart J. — 1998. — Vol. 19. — P. 1814–22.
28. Significance of plasma N–terminal pro–brain natriuretic peptide in patients with systemic sclerosis–related pulmonary arterial hypertension / D. Mukerjee, L.B. Yap, A.M. Holmes [et al.] // Respir. Med. — 2003. — Vol. 97. — P. 1230–6.
29. N–terminal pro–brain natriuretic peptide in a novel screening algorithm for pulmonary arterial hypertension in systemic sclerosis: a case–control study / V. Thakkar, W.M. Stevens, D. Prior [et al.] // Arthritis Res. Ther. — 2012. — Vol. 14. — R143.
30. Kato M. Pulmonary arterial hypertension associated with connective tissue diseases: A review focusing on distinctive clinical aspects / M. Kato, T. Atsumi // Eur. J. Clin. Invest. — 2018. — Vol. 48. — e12876.
31. Weatherald J., Boucly A., Sitbon O. Risk stratification in pulmonary arterial hypertension / J. Weatherald, A. Boucly, O. Sitbon // Curr. Opin. Pulm. Med. — 2018. — Vol. 24, N 5. — P. 407–415.
32. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT) / N. Galie, M. Humbert, J.L. Vachiery [et al.] // Eur. Respir. J. — 2015. — Vol. 46. — P. 903–975.
33. Characterization of patients with borderline pulmonary arterial pressure / G. Kovacs, A. Avian, M. Tscherner [et al.] // Chest. — 2014. — Vol. 146. — P. 1486–1493.
34. Borderline mean pulmonary artery pressure in patients with systemic sclerosis: transpulmonary gradient predicts risk of developing pulmonary hypertension / C.J. Valerio, B.E. Schreiber, C.E. Handler [et al.] // Arthritis Rheum. — 2013. — Vol. 65. — P. 1074–1084.
35. Diversity of borderline pumonary arterial pressure associated with systemic sclerosis: 3 case series / E. Sugawara, M. Kato, T. Sato [et al.] // Mod. Rheumatol. Case Rep. — 2017. — Vol. 1. — P. 9–14.
36. Effect of Warfarin treatment on survival of patients with pulmonary arterial hyper–tension (PAH) in the registry to evaluate early and long–term PAH Disease Management (REVEAL) / I.R. Preston, K.E. Roberts, D.P. Miller [et al.] // Circulation. — 2015. — Vol. 132. — P. 2403–2411.
37. Survival and quality of life in incident systemic sclerosis–related pulmonary arterial hypertension / K. Morrisroe, W. Stevens, M. Huq [et al.] // Arthritis Res. Ther. — 2017. — Vol. 19. — P. 122.
38. Anticoagulation and survival in pulmonary arterial hypertension: results from the Comparative, Prospective Registry of Newly Initiated Therapies for Pulmonary Hypertension (COMPERA) / K.M. Olsson, M. Delcroix, H.A. Ghofrani [et al.] // Circulation. — 2014. — Vol. 129, № 1. — P. 57–65.
39. Bosentan therapy for pulmonary arterial hypertension / L.J. Rubin, D.B. Badesch, R.J. Barst [et al.] // N. Engl. J. Med. — 2002. — Vol. 346. — P. 896–903.
40. Macitentan and morbidity and mortality in pulmonary arterial hypertension / T. Pulido, I. Adzerikho, R.N. Channick [et al.] // New Engl. J. Med. — 2013. — Vol. 369. — P. 809–18.
41. Sildenafil citrate therapy for pulmonary arterial hypertension / N. Galie, H.A. Ghofrani, A. Torbicki [et al.] // New Engl. J. Med. — 2005. — Vol. 353. — P. 2148–57.
42. Pulmonary arterial hypertension associated with connective tissue disease: meta–analysis of clinical trials / M. Kuwana, H. Watanabe, N. Matsuoka, N. Sugiyama // BMJ Open. — 2013. — Vol. 3. — P. 45–52.
43. Riociguat for the treatment of pulmonary arterial hypertension associated with connective tissue disease: results from
PATENT–1 and PATENT–2 / M. Humbert, J.G. Coghlan, H.A. Ghofrani [et al.] // Ann. Rheum. Dis. — 2017. — Vol. 76. — P. 422–426.
44. Selexipag for the treatment of connective tissue disease–associated pulmonary arterial hypertension / S. Gaine, K. Chin, G. Coghlan [et al.] // Eur. Respir. J. — 2017. — Vol. 50. — P. 1602493.
45. Initial combination therapy with ambrisentan and tadalafil in connective tissue disease–associated pulmonary arterial hypertension (CTD–PAH): subgroup analysis from the AMBITION trial / J.G. Coghlan, N. Galie, J.A. Barbera [et al.] // Ann. Rheum. Dis. — 2017. — Vol. 76. — P. 1219–1227.
46. Riociguat for patients with pulmonary hypertension caused by systolic left ventricular dysfunction: a phase IIb double–blind, randomized, placebo–controlled, dose–ranging hemodynamic study / D. Bonderman, S. Ghio, S.B. Felix [et al.] // Circulation. — 2013. — Vol. 128. — P. 502–511.
47. Long–term response to calcium–channel blockers in non–idiopathic pulmonary arterial hypertension / D. Montani, L. Savale, D. Natali [et al.] // Eur. Heart. J. — 2010. — Vol. 31. — P. 1898–1907.
48. The short–term role of corticosteroid therapy for pulmonary arterial hypertension associated with connective tissue diseases: report of five cases and a literature review / M. Kato, H. Kataoka, T. Odani [et al.] // Lupus. — 2011. — Vol. 20. — P. 1047–1056.
49. Predictors of favorable responses to immunosuppressive treatment in pulmonary arterial hypertension associated with connective tissue disease / H. Yasuoka, Y. Shirai, Y. Tamura [et al.] // Circ. J. — 2018. — Vol. 82, N 2. — P. 546–554.
50. Pulmonary arterial hypertension in systemic lupus erythematosus may benefit by addition of immunosuppression to vasodilator therapy: an observational study / S. Kommireddy, S. Bhyravavajhala, K. Kurimeti [et al.] // Rheumatology (Oxford). — 2015. — Vol. 54. — P. 1673–1679.
51. Treatment of vasodilator–resistant mixed connective tissue disease–associated pulmonary arterial hypertension with glucocorticoid and cyclophosphamide / E. Sugawara, M. Kato, R. Hisada [et al.] // Intern. Med. — 2017. — Vol. 56. — P. 445–448.
52. Intensive immunosuppressive therapy improves pulmonary hemodynamics and long–term prognosis in patients with pulmonary arterial hypertension associated with connective tissue disease / S. Miyamichi–Yamamoto, Y. Fukumoto, K. Sugiura [et al.] // Circ. J. — 2011. — Vol. 75. — P. 2668–2674.
53. Pulmonary hypertension in systemic lupus erythematosus: Evaluation of clinical characteristics and response to immunosuppressive treatment / E. Tanaka, M. Harigai, M. Tanaka [et al.] // J. Rheumatol. — 2002. — Vol. 29. — P. 282–287.
54. Immunosuppressive therapy in lupus– and mixed connective tissue disease–associated pulmonary hypertension: A retrospective analysis of twenty–three cases / X. Jais, D. Launay, A.Yaici [et al.] // Arthritis Rheum. — 2008. — Vol. 58. — P. 521–531.
55. Interventional and surgical modalities of treatment in pulmonary hypertension / A.M. Keogh, E. Mayer, R.L. Benza [et al.] // J. Am. Coll. Cardiol. — 2009. — Vol. 54, № 1. — P. 67–77.

/35-1.jpg)
/36-1.jpg)
/39-1.jpg)
/40-1.jpg)
/42-1.jpg)