Резюме
Актуальність. Гонартроз (гонартрит) та коксартроз (коксартрит) — найчастіші захворювання ортопедичного профілю, які завдають відчутного медико-соціального збитку хворим людям і суспільству в цілому. Гонококсартроз (ГКА) супроводжується мікроелементозом, що перебігає з порушенням в організмі рівнів багатьох металів. Дослідження ролі металів, що містяться в крові хворих на ГКА, при патогенетичних побудовах ускладнень ендопротезування колінних і кульшових суглобів, стало актуальною проблемою. Після імплантації штучних металевих зчленувань при ГКА в перипротезних тканинах виявляється підвищення рівнів алюмінію (Al), кобальту (Co), хрому (Cr), молібдену (Mo), нікелю (Ni), титану (Ti) і ванадію (V). Мета дослідження: оцінити характер динаміки показників в сироватці крові хворих на ГКА металів (Al, Сo, Cr, Mo, Ni, Ti, V) до і після ендопротезування суглобів. Матеріали та методи. Однобічне ендопротезування суглобів проведено 11 хворим на ГКА (7 жінок і 4 чоловіки віком 46–65 років). Штучні протези кульшових зчленувань імплантовані 6 пацієнтам, колінних — 5. У двох випадках виконано цементну фіксацію. До операції при сонографії виразний синовіт констатований у 8 випадках, у 4 спостереженнях була IV стадія захворювання, у 7 — III, остеохондроз хребта діагностований у 10 пацієнтів, спондилоартроз дуговідросчастих зчленувань — у 5, системний остеопороз — у 4, поліартроз встановлений у 6 хворих. Результати. Вміст початкових параметрів (до імплантації штучних зчленувань) Al становив 2,70 ± 0,45 мкг/л, Co — 12,50 ± 1,52 мкг/л, Cr — 1,50 ± 0,23 нг/л, Mo — 2,00 ± 0,28 мкг/л, Ni — 5,2 ± 0,8 мкг/л, Ti — 2,50 ± 0,17 мкг/л, V — 1,90 ± 0,29 мкг/л. При ГКА на 1/2 від конт-рольних значень в групі здорових виявились більшими параметри Со і на 1/4 — Ti. Через 2–3 місяці після операції ендопротезування суглобів констатовано вірогідне збільшення на 89,1 % Co, на 75,2 % — Cr, на 43,9 % — Mo, на 49,4 % — Ni і на 45,4 % — Ti (концентрації Со і Cr стали ще більше — відповідно на 23,3 і 40,2 % порівняно з початковими значеннями). Мали місце кореляційні зв’язки показників в крові з параметрами металів у волоссі і з рівнем їх в грунті регіонів проживання хворих, від чого залежав клінічний перебіг захворювання. Чинниками ризику значних кістково-деструктивних змін та накопичення металів в організмі хворих на ГКА після ендопротезування суглобів є показники в грунті Co > 3 мг/кг, Cr > 260 мг/кг, Ti > 520 мг/кг і V > 160 мг/кг. Висновки. Посилення існуючого мікроелементозу металів при ГКА після імплантації штучних зчленувань необхідно враховувати при плануванні програми ендопротезування суглобів і прогнозування можливих ускладнень операції.
Актуальность. Гонартроз (гонартрит) и коксартроз (коксартрит) — одни из самых частых заболеваний ортопедического профиля, которые наносят ощутимый медико-социальный ущерб больным людям и обществу в целом. Гонококсартроз (ГКА) сопровождается микроэлементозом, протекающим с нарушением в организме уровней многих металлов. Исследование роли металлов, содержащихся в крови больных ГКА, при патогенетических построениях осложнений эндопротезирования коленных и тазобедренных суставов стало актуальной проблемой. После имплантации искусственных металлических сочленений при ГКА в перипротезных тканях обнаруживается повышение уровней алюминия (Al), кобальта (Co), хрома (Cr), молибдена (Mo), никеля (Ni), титана (Ti) и ванадия (V). Цель исследования: оценить характер динамики показателей в сыворотке крови больных ГКА металлов (Al, Сo, Cr, Mo, Ni, Ti, V) до и после эндопротезирования суставов. Материалы и методы. Одностороннее эндопротезирование суставов проведено 11 больным ГКА (7 женщин и 4 мужчины в возрасте 46–65 лет). Искусственные протезы тазобедренных сочленений имплантированы 6 пациентам, коленных — 5. В двух случаях выполнена цементная фиксация. До операции при сонографии выраженный синовит констатирован в 8 случаях, в 4 наблюдениях была IV стадия заболевания, в 7 — III, остеохондроз позвоночника диагностирован у 10 пациентов, спондилоартроз дугоотростчатых сочленений — у 5, системный остеопороз — у 4, полиартроз — у 6 больных. Результаты. Содержание исходных параметров (до имплантации искусственных сочленений) Al составило 2,70 ± 0,45 мкг/л, Co — 12,50 ± 1,52 мкг/л, Cr — 1,50 ± 0,23 нг/л, Mo — 2,00 ± 0,28 мкг/л, Ni — 5,2 ± 0,8 мкг/л, Ti — 2,50 ± 0,17 мкг/л, V — 1,90 ± 0,29 мкг/л. При ГКА на 1/2 от контрольных значений в группе здоровых оказались большими параметры Со и на 1/4 — Ti. Спустя 2–3 месяца после операции эндопротезирования суставов констатировано достоверное увеличение на 89,1 % Co, на 75,2 % — Cr, на 43,9 % — Mo, на 49,4 % — Ni и на 45,4 % — Ti (концентрации Со и Cr стали еще больше — соответственно на 23,3 и 40,2 % по сравнению с исходными значениями). Имели место корреляционные связи показателей в крови с параметрами металлов в волосах и с уровнем их в почве регионов проживания больных, от чего зависело клиническое течение заболевания. Факторами риска выраженных костно-деструктивных изменений и накопления металлов в организме больных ГКА после эндопротезирования суставов являются показатели в почве Co > 3 мг/кг, Cr > 260 мг/кг, Ti > 520 мг/кг и V > 160 мг/кг. Выводы. Усиление существующего микроэлементоза металлов при ГКА после имплантации искусственных сочленений необходимо учитывать при планировании программы эндопротезирования суставов и прогнозирования возможных осложнений операции.
Background. Gonarthrosis and coxarthrosis are one of the most frequent orthopedic diseases that cause significant medical and social damage to sick people and society as a whole. Knee and hip osteoarthritis (KHO) is accompanied by microelementosis, which occurs with a violation in body levels of many metals. The study of the role of metals contained in the body of patients with KHO, with pathogenetic constructions of complications in the knee and hip replacement, has become an urgent problem. After the implantation of artificial metal joints in HCA, an increase in the levels of Al, Co, Cr, Mo, Ni, Ti, and V in periprosthetic tissues was detected. Purpose of the study: to assess the nature of the dynamics of the blood levels of metals (Al, Co, Cr, Mo, Ni, Ti, V) in patients with KHO before and after joint arthroplasty. Materials and methods. Unilateral arthroplasty was performed in 11 patients with KHO (7 women and 4 men aged 46–65 years). Artificial prostheses of the hip joints were implanted in 6 patients, knee joints — in 5. In two cases, cement fixation was applied. Before surgery, during sonography, manifested synovitis was detected in 8 cases, in 4 cases, there was stage IV of the disease, in 7 — III, osteochondrosis of the spine was diagnosed in 10 patients, spondyloarthritis of facet joints — in 5, systemic osteoporosis — in 4, polyarthrosis was detected in 6 patients. Results. The initial content (before implantation of artificial joints) of Al was 2.70 ± 0.45 μg/l, Co — 12.50 ± 1.52 μg/l, Cr — 1.50 ± 0.23 ng/l, Mo — 2.00 ± 0.28 μg/l, Ni — 5.20 ± 0.80 μg/l, Ti — 2.50 ± 0.17 μg/l, V — 1.90 ± 0.29 μg/l. In KHO, Co values turned out to be 1/2 higher than control values in the group of healthy individuals, Ti — 1/4 higher. Two-three months after arthroplasty, a significant increase was observed: by 89.1 % — in Co level, 75.2 % — Cr, 43.9 % — Mo, 49.4 % — Ni and 45.4 % — Ti (Co and Cr content became even higher — by 23.3 and 40.2 %, respectively, compared with the baseline values). There were correlations of the blood indicators with the parameters of metals in the hair and their level in the soil of the patients’ regions of residence, on which the clinical course of the disease depended. The risk factors for the significant bone-destructive changes and the accumulation of metals in the body of patients with KHO after arthroplasty are the soil indices of Co > 3 mg/kg, Cr > 260 mg/kg Ti > 520 mg/kg and V > 160 mg/kg. Conclusions. The progression of the existing microelements in KHO after implantation of artificial joints should be taken into account when planning the program of arthroplasty and predicting possible complications of the operation.
Введение
Гонартроз и коксартроз являются одними из наиболее частых заболеваний ортопедического профиля [9, 10, 15], которые наносят ощутимый медико-социальный ущерб больным людям и обществу в целом [13, 18].
Гонококсартроз (ГКА) сопровождается микроэлементозом с нарушением в крови уровней хрома (Cr), меди (Cu), железа (Fe), марганца (Mn), молибдена (Mo), цинка (Zn) и других металлов [1], а в артикулярном хряще возрастает содержание только Cu [8]. Необходимо отметить, что ГКА у каждого десятого больного протекает с кобальтовым микроэлементозом [14] и зачастую имеют место повышенные уровни в крови никеля (Ni) [4, 17].
Для эндопротезирования коленных и тазобедренных суставов обычно используются искусственные сочленения, содержащие кобальт (Co), Cr, Mo, титан (Ti), ванадий (V) [19]. H.A. Kazi et al. [5] установили, что после двух лет существования в организме больных ГКА таких эндопротезов только уровень V в крови не изменяется, тогда как концентрации остальных микроэлементов значительно возрастают. J. Lützner et al. [11] в случаях эндопротезирования суставов по поводу ГКА не обнаружили повышения в крови показателей Co, Cr, Mo и Ni, входящих в состав сплава использованных протезов. J. Czekaj et al. [2] считают, что кобальто-хромовые эндопротезы способны вызывать синдром эндогенной интоксикации, а J. Steinberg et al. [16] было показано, что неблагоприятное течение ГКА после эндопротезирования суставов искусственными сочленениями, содержащими кобальто-хромовый сплав, сопровождается увеличением в крови уровней и Со, и Cr. По мнению I.A. Malek et al. [12], все-таки диагностическая и прогностическая значимость уровней Со и Cr в крови до эндопротезирования малоинформативна, поскольку имеет место весьма значительная изменчивость показателей этих металлов при ГКА, хотя подобные исследования требуют своего продолжения. В свою очередь, J.C. Hill et al. [3], M. Kiran и P.J. Boscainos [6] придерживаются иного мнения, а параметры кобальт- и хромемии предлагаются в качестве критериев мониторинга за больными после Co-Cr-эндопротезирования суставов.
Цель исследования: оценить характер динамики показателей в сыворотке крови больных ГКА металлов (алюминий (Al), Сo, Cr, Mo, Ni, Ti, V) до и после эндопротезирования суставов.
Материалы и методы
Одностороннее эндопротезирование суставов проведено 11 больным ГКА (7 женщин и 4 мужчины в возрасте 46–65 лет). Искусственные протезы тазобедренных сочленений имплантированы 6 пациентам, коленных — 5 (были использованы искусственные сочленения «ОРТЭН», Украина, Zimmer-CPT и Stryker-Exeter, США). В двух случаях выполнена цементная фиксация. До операции при сонографии выраженный синовит констатирован в 8 случаях, в 4 наблюдениях была IV стадия заболевания, в 7 — III, остеохондроз позвоночника диагностирован у 10 пациентов, спондилоартроз дугоотростчатых сочленений — у 5, системный остеопороз — у 4, полиартроз установлен у 6 больных.
Перед операцией пациентам выполняли рентгенологическое (аппарат Multix-Compact-Siеmens, Германия) и ультразвуковое (сонограф Envisor-Philips, Нидерланды) исследование суставов, двух-энергетическую рентгеновскую остеоденситометрию проксимального отдела бедренной кости (аппарат QDR-4500-Delphi-Hologic, США) и магнитно-резонансную томографию коленных суставов (томограф Signa-Excite-HD, Германия). Подсчитывали индекс тяжести ГКА (WI) по формуле: WI = (S2 + Σ) : Т, где S — стадия заболевания, Σ — сумма клинико-инструментальных признаков ГА, Т — длительность его клинической манифестации. В крови и волосах –изучали концентрации тех металлов, которые входят в состав используемых суставных эндопротезов, — Al, Co, Cr, Fe, Mo, Ni, Ti, V. Применяли атомно-абсорбционный спектрометр SolAAr-Mk2-MOZe с электрографитовым атомизатором (Великобритания). В качестве контроля обследовано 44 практически здоровых человека в возрасте от 19 до 62 лет, среди которых было 17 мужчин и 27 женщин.
Гигиеническая оценка антропогенного загрязнения почвы 34 регионов Донецкой области (55 % городских и 45 % сельских) выполнена региональными отделениями Государственных комитетов по гидрометеорологии, контролю природной среды и экологической безопасности. Исследованы показатели Co, Cr, Mo, Ni, Ti и V.
Статистическая обработка полученных результатов проведена с помощью компьютерного вариационного непараметрического корреляционного одно- (ANOVA) и многофакторного (ANOVA/MANOVA) дисперсионного анализа (программы Microsoft Excel и Statistica Stat-Soft, США). Оценивали средние значения (M), их стандартные ошибки (SE) и отклонения (SD), коэффициенты параметрической корреляции Пирсона (r) и непараметрической Кендалла (τ), критерии однофакторной (D) и многофакторной дисперсии Уилкоксона — Рао (WR), различий Стьюдента (t) и достоверность статистических показателей (р).
Результаты
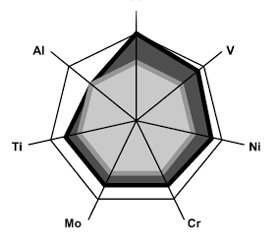
Первым этапом работы было сопоставление уровней металлов в крови больных ГКА, подлежащих эндопротезированию суставов, с аналогичными показателями у условно здоровых людей контрольной группы. Содержание исходных параметров (до имплантации искусственных сочленений) Al составило 2,70 ± 0,45 мкг/л, Co — 12,50 ± 1,52 мкг/л, Cr — 1,50 ± 0,23 нг/л, Mo — 2,00 ± 0,28 мкг/л, Ni — 5,2 ± 0,8 мкг/л, Ti — 2,50 ± 0,17 мкг/л, V — 1,90 ± ± 0,29 мкг/л. Оказалось, что при ГКА на 1/2 от контрольных значений в группе здоровых оказались большими параметры Со (t = 2,26, p = 0,028) и на 1/4 — Ti (t = 4,31, p < 0,001). Через 2–3 месяца после операции (рис. 1) уже было достоверно большим содержание в крови Со — на 89 % (t = 3,61, p = 0,001), Cr — на 75 % (t = 4,87, p < 0,001), Mo — на 44 % (t = 2,78, p = 0,007), Ni — на 49 % (t = 2,77, p = 0,008) и Ti — на 45 % (t = 8,53, p < 0,001).
/15-1.jpg)
При сравнении одних и тех же больных основной группы до и после операции установлено (рис. 2), что эндопротезирование суставов вызывает еще большее возрастание в крови показателей Со — на 23 % (t = 2,32, p = 0,043) и Cr — на 40 % (t = 2,81, p = 0,018). Необходимо отметить, что, по данным литературы, у лиц с имплантированными Co-Cr-протезами повышаются уровни в крови этих микроэлементов, а степень увеличения их содержания прямо соотносится с числом отдаленных после операции осложнений [2, 11, 16].
Обсуждение
Cо относится к контактным аллергенам, поэтому наиболее интенсивно изучается его возможная роль в суставном воспалении после артропластики с использованием протезов с этим металлом. Иммуноциты на воздействие Со реагируют пролиферативным ответом, причем такой эффект может нивелироваться противофибробластными антителами. Воспалительная реакция на металлические имплантаты, содержащие Co и Cr, зачастую сопровождается формированием асептических остеонекрозов. Было отмечено, что после эндопротезирования суставов примерно через 6–9 месяцев происходит увеличение в сыворотке крови концентрации Co и Cr, но после 15 месяцев эти показатели постепенно приходят к исходному уровню [16]. В содержащих Со протезах этот металл изменяет местную активность в параартикулярных тканях моноцитов/макрофагов с последущей гиперпродукцией провоспалительных цитокинов.
Степень изменений концентрации Al в крови после эндопротезирования суставов прямо коррелирует с исходным уровнем Со в волосах (r = +0,604, p = 0,048), которые, как известно, длительно накап-ливают металлы, а динамика Cr прямо соотносится с содержанием в волосах Ti (r = +0,738, p = 0,010). Степень изменений в крови параметров Ti имеет обратные корреляционные связи Пирсона со значениями в волосах Ni (r = –0,793, p = 0,004) и того же Ti (r = –0,634, p = 0,036). Сказанное относится также к параметрам ванадиемии (соответственно r = –0,715, p = 0,013, и r = –0,637, p = 0,035).
Течение ГКА тесно связано с параметрами металлов в окружающей среде проживания больных [7, 20], что оказывает существенное влияние на характер микроэлементоза в организме таких пациентов, но эти данные требуют своего уточнения [8, 21]. Существуют корреляционные связи степеней динамики отдельных металлов в крови после эндопротезирования суставов с уровнем их в почве регионов проживания больных ГКА. Так, показатель изменений Мо прямо соотносится с содержанием в грунте Cr (r = +0,931, p < 0,001), V — c Ni (r = +0,629, p = 0,038) и V (r = +0,605, p = 0,047), а изменения Co обратно связаны с содержанием в почве Ti (r = –0,597, p = 0,048). Повышение уровня Мо в крови больных ГКА определяется содержанием в почве Cr. В этой связи отметим, что соединения Cr, присутствующие в почве, весьма токсичны, а являясь сильными окислителями, они нарушают нормальное течение метаболических процессов в суставах, угнетают активность ферментных систем и способствуют молибденовому дисметаболизму в хряще и синовии [20].
Обратная связь динамики показателя кобальтемии при ГКА от уровня Ті в почве оказалась несколько неожиданной, поскольку примеси в суставных имплантатах Ti оказывают стимулирующее действие на увеличение содержания в крови Co. Этот металл изменяет местную активность в параартикулярных тканях макрофагов с последущей гиперпродукцией провоспалительных цитокинов.
По данным многофакторного дисперсионного анализа Уилкоксона — Рао, на интегральную динамику показателей металлов в крови больных ГКА после имплантации протезов суставов оказывают воздействие исходный показатель WI (WR = 45,34, p = 0,001) и тяжесть течения спондилоартроза дугоотростчатых соединений (WR = 9,23, p = 0,042). Как свидетельствует однофакторный дисперсионный анализ, на степень изменений показателей Со и Cr после эндопротезирования суставов влияет исходная рентгенологическая стадия заболевания (соответственно D = 10,59, p = 0,011, и D = 4,41, p = 0,047), а на динамику содержания Ni — CWI (D = 5,05, p = 0,041). Непараметрический анализ Кендалла показал, что динамические значения ванадиемии и хромемии прямо коррелируют с выраженностью синовита коленных сочленений (соответственно τ = +0,490, р = 0,036, и τ = +0,694, p = 0,018), уровни Al и Mo — с остеохондрозом позвоночника/спондилоартрозом (τ = +0,587, p = 0,045, и τ = +0,470, p = 0,044).
По данным литературы, у лиц с имплантированными протезами возрастают уровни в крови металлов, входящих в состав искусственных суставных сочленений, а степень увеличения их содержания прямо соотносится с числом отдаленных после операции осложнений [2, 16]. Было замечено, что повышение уровней микроэлементов зачастую вызывает вокруг металлического эндотрансплантата формирование воспалительного псевдоопухолевого процесса, который может сопровождаться формированием асептических остеонекрозов. Мы обследовали больных спустя 2–3 месяца после эндопротезирования суставов (в среднем 2,70 ± 0,31 месяца), и за этот срок каких бы то ни было осложнений выявлено не было.
Выводы
При ГКА по сравнению с контрольными значениями в группе здоровых людей увеличивается в крови содержание Со и Ti, тогда как спустя 2–3 месяца после имплантации искусственного сочленения уже констатируется достоверное нарастание концентраций Со и Cr — соответственно на 23 и 40 %, при этом становятся большими по сравнению с исходными значениями на 44 % показатели Mo, на 49 % — Ni и на 45 % — Ti. Динамика уровня микроэлементов в крови больных ГКА после операции имеет корреляционные связи с параметрами металлов в волосах и содержанием их в почве регионов проживания больных, зависит от клинического течения заболевания, что необходимо учитывать при планировании программы эндопротезирования суставов.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Colotti G., Ilari A., Boffi A., Morea V. Metals and metal derivatives in medicine // Mini Rev. Med. Chem. — 2013. — 13(2). — Р. 211-21.
2. Czekaj J., Ehlinger M., Rahme M., Bonnomet F. Metallosis and cobalt-chrome intoxication after hip resurfacing arthroplasty // J. Orthop. Sci. — 2016. — 21(3). — P. 389-94. doi: 10.1016/j.jos.2015.06.001.
3. Hill J.C., Diamond O.J., O'Brien S., Boldt J.G., Stevenson M., Beverland D.E. Early surveillance of ceramic-on-metal total hip arthroplasty // Bone Joint J. — 2015. — 97(3). — Р. 300-5. doi: 10.1302/0301-620X.97B3.33242.
4. Hofer J.K., Ezzet K.A. A minimum 5-year follow-up of an oxidized zirconium femoral prosthesis used for total knee arthroplasty // Knee. — 2014. — 21(1). — Р. 168-71. doi: 10.1016/j.knee.2013.08.015.
5. Kazi H.A., Perera J.R., Gillott E., Carroll F.A., Briggs T.W. A prospective study of a ceramic-on-metal bearing in total hip arthroplasty. Clinical results, metal ion levels and chromosome analysis at two years // Bone Joint J. — 2013. — 95(8). — Р. 1040-4. doi: 10.1302/0301-620X.95B8.31574.
6. Kiran M., Boscainos P.J. Adverse reactions to metal debris in metal-on-polyethylene total hip arthroplasty using a titanium-molybdenum-zirconium-iron alloy stem // J. Arthroplasty. — 2015. — 30(2). — Р. 277-81. doi: 10.1016/j.arth.2014.06.030.
7. Kosheleva N.E., Vlasov D.V., Korlyakov I.D., Kasimov N.S. Сontamination of urban soils with heavy metals in Moscow as affected by building development // Sci. Total. Environ. — 2018. — 636(5). — Р. 854-63. doi: 10.1016/j.scitotenv.2018.04.308.
8. Kubaszewski L., Zioła-Frankowska A., Frankowski M., Rogala P., Gasik Z., Kaczmarczyk J. et al. Comparison of trace element concentration in bone and intervertebral disc tissue by atomic absorption spectrometry techniques // J. Orthop. Surg. Res. — 2014. — 25(9). — Р. 99-109. doi: 10.1186/s13018-014-0099-y.
9. Lamberg E.M., Streb R., Werner M., Kremenic I., Penna J. The 2- and 8-week effects of decompressive brace use in people with medial compartment knee osteoarthritis // Prosthet. Orthot. Int. — 2016. — 40(4). — Р. 447-53. doi: 10.1177/0309364615589537.
10. Leung Y.Y., Ma S., Noviani M., Wong S.B., Lee C.M., Soh I.A. et al. Validation of screening questionnaires for evaluation of knee osteoarthritis prevalence in the general population of Singapore // Int. J. Rheum. Dis. — 2017. — 21(12). — Р. 132-8. doi: 10.1111/1756-185X.13252.
11. Lützner J., Hartmann A., Dinnebier G., Spornraft-Ragal-ler P., Hamann C., Kirschner S. Metal hypersensitivity and metal ion levels in patients with coated or uncoated total knee arthroplasty: a randomised controlled study // Int. Orthop. — 2013. — 37(10). — Р. 1925-31. doi: 10.1007/s00264-013-2010-6.
12. Malek I.A., Rogers J., King A.C., Clutton J., Winson D., John A. The interchangeability of plasma and whole blood metal ion measurement in the monitoring of metal on metal hips // Arthritis. — 2015. — 2015. — 216785. doi: 10.1155/2015/216785.
13. Malzahn J. Conservative and operative treatment of working age patients with gonarthritis. Economic considera-tions // Orthopade. — 2014. — 43(6). — Р. 503-6; 508-10. doi: 10.1007/s00132-014-2295-1.
14. Matharu G.S., Judge A., Murray D.W., Pandit H.G. Outcomes after metal-on-metal hip revision surgery depend on the reason for failure: a propensity score-matched study // Clin. Orthop. Relat. Res. — 2018. — 476(2). — Р. 245-58. doi: 10.1007/s11999.0000000000000029.
15. Nelson A.E. Osteoarthritis year in review 2017: clinical // Osteoarthritis Cartilage. — 2017. — 8(12). — Р. 348-51. doi: 10.1016/j.joca.2017.11.014.
16. Steinberg J., Shah K.M., Gartland A., Zeggini E., Wilkinson J.M. Effects of chronic cobalt and chromium exposure after metal-on-metal hip resurfacing: An epigenome-wide association pilot study // J. Orthop. Res. — 2017. — 18(1). — Р. 133-9. doi: 10.1002/jor.23525.
17. Stejskal V., Reynolds T., Bjørklund G. Increased frequency of delayed type hypersensitivity to metals in patients with connective tissue disease // J. Trace Elem. Med. Biol. — 2015. — 31. — Р. 230-6. doi: 10.1016/j.jtemb.2015.01.001.
18. Vina E.R., Kwoh C.K. Epidemiology of osteoarthritis: –literature update // Curr. Opin. Rheumatol. — 2017. — 8(12). — Р. 142-9. doi: 10.1097/BOR.0000000000000479.
19. Weber P., Steinbrück A., Paulus A.C., Woiczinski M., Schmidutz F., Fottner A. et al. Partial exchange in total hip arthroplasty: what can we combine? // Orthopade. — 2017. — 46(2). — Р. 142-7. doi: 10.1007/s00132-016-3380-4.
20. Wu X., Hao C., Kumar J., Kuang H., Kotov N.A., Liz-Marzán L.M. et al. Environmentally responsive plasmonic nanoassemblies for biosensing // Chem. Soc. Rev. — 2018. — 8(5). — 00894. doi: 10.1039/c7cs00894e.
21. Yang T.H., Yuan T.H., Hwang Y.H., Lian I.B., Meng M., Su C.C. Increased inflammation in rheumatoid arthritis patients living where farm soils contain high levels of copper // J. Formos. Med. Assoc. — 2016. — 115(11). — Р. 991-6. doi: 10.1016/j.jfma.2015.10.001.

/15-1.jpg)
/15-2.jpg)