Журнал «Почки» Том 7, №4, 2018
Вернуться к номеру
Склеродермічна ниркова криза: питання патогенезу, клініка та сучасні підходи до лікування
Авторы: Головач І.Ю.(1), Єгудіна Є.Д.(2)
(1) — Клінічна лікарня «Феофанія» Державного управління справами, м. Київ, Україна
(2) — ДЗ «Дніпропетровська державна медична академія МОЗ України», м. Дніпро, Україна
Рубрики: Нефрология
Разделы: Справочник специалиста
Версия для печати
Склеродермічна ниркова криза (СНК) є одним із найтяжчих ускладнень у пацієнтів із системною склеродермією (ССД). СНК виникає приблизно в 5–25 % всіх хворих на ССД. Вона характеризується злоякісною гіпертензією та оліго-/ануричною гострою нирковою недостатністю. Близько 10 % випадків СНК можуть з’являтися при нормальному артеріальному тиску — це так звана нормотензивна ниркова криза. Припускається, що етіопатогенез СНК обумовлений пошкодженням нирок, що призводить до ушкодження ендотелію, проліферації інтими та звуження ниркових артеріол, зумовлюючи зниження кровотоку, гіперплазію юкстагломерулярного апарату, гіперренiнемію та розвиток злоякісної артеріальної гіпертензії. Розвиток СНК у пацієнтів із ССД часто провокується нефротоксичними препаратами або зменшенням внутрішньосудинного об’єму крові. СНК частіше реєструється в перші роки захворювання на ССД та при дифузній її формі. Розвиток СНК частіше відзначається в пацієнтів, які отримують глюкокортикоїди, ризик збільшується відповідно до збільшення дози. Характерними є також такі клінічні ускладнення, як лівошлуночкова серцева недостатність та гіпертонічна енцефалопатія. Тромботична мікроангіопатія виявляється в 43 % випадків СНК. Антитіла до РНК-полімерази III наявні в одній третини хворих, у яких розвинулася СНК. За умови класичного перебігу СНК проведення нефробіопсії не рекомендується. Проте цей метод може допомогти визначити прогноз та підходи до лікування при нетипових формах. Прогноз СНК різко покращився з використанням інгібіторів ангіотензинперетворюючих ферментів. Проте виживаність протягом 5 років у пацієнтів із СНК залишається низькою (65 %). Лікування СНК опирається на агресивний контроль артеріального тиску за допомогою інгібіторів ангіотензинперетворюючих ферментів, якщо потрібне поєднання з іншими видами антигіпертензивних препаратів. Доволі часто хворі потребують проведення гемодіалізу, але при контролі артеріального тиску він може бути припиненим. Пацієнти, яким потрібен діаліз більше 2 років, мають показання до трансплантації нирок. СНК залишається важливою причиною захворюваності та смертності при ССД. Швидка діагностика та лікування можуть допомогти запобігти несприятливим наслідкам та поліпшити виживаність.
Склеродермический почечный криз (СПК) является одним из самых тяжелых осложнений у пациентов с системной склеродермией (ССД). СПК возникает примерно у 5–25 % пациентов, страдающих склеродермией. Он характеризуется злокачественной гипертензией и олиго-/анурической острой почечной недостаточностью. Около 10 % случаев СПК могут сопровождаться нормальным артериальным давлением — это так называемый нормотензивный почечный кризис. Предполагается, что этиопатогенез СПК обусловлен повреждением почек, что приводит к поражению эндотелия, пролиферации интимы и сужению почечных артериол, вызывая снижение кровотока, гиперплазию юкстагломерулярного аппарата, гиперренинемию и развитие злокачественной артериальной гипертензии. Развитие СПК у пациентов с ССД часто провоцируется нефротоксичными препаратами или уменьшением внутрисосудистого объема крови. СПК наиболее часто встречается в первые годы развития склеродермии и при диффузной ее форме. Появление СПК чаще встречается у пациентов, получающих глюкокортикоиды, риск увеличивается с увеличением дозы. Характерные также такие клинические признаки, как левожелудочковая сердечная недостаточность и гипертоническая энцефалопатия. Тромботическая микроангиопатия появляется в 43 % случаев СПК. Антитела к РНК-полимеразе III присутствуют у одной трети больных, у которых развился СПК. При классическом течении СПК проведение нефробиопсии не рекомендуется. Однако этот метод исследования может помочь определить прогноз и методы лечения при нетипичных формах. Прогноз СПК резко улучшился с использованием ингибиторов ангиотензинпревращающего фермента. Однако выживаемость в течение 5 лет у пациентов с СПК остается низкой (65 %). Лечение СПК опирается на агрессивный контроль артериального давления с помощью ингибиторов ангиотензинпревращающего фермента, если необходимо сочетание с другими видами антигипертензивных препаратов. Довольно часто больные нуждаются в проведении гемодиализа, но при контроле артериального давления он может быть прекращен. Пациентам, которым необходим диализ более 2 лет, показана трансплантация почек. СПК остается важной причиной заболеваемости и смертности при склеродермии. Быстрая диагностика и лечение могут помочь предотвратить неблагоприятные последствия и улучшить выживание таких пациентов.
Scleroderma renal crisis (SRC) is a major complication in patients with systemic sclerosis. SRC occurs in about 5–25 % of all patients with scleroderma. It is characterized by malignant hypertension and olig-/anuric acute renal failure. Around 10 % of SRC cases may present with normal blood pressure, termed normotensive renal crisis. The etiopathogenesis is presumed to be a series of insults to the kidneys resulting in endothelial injury, intimal proliferation, and narrowing of renal arterioles leading to decreased blood flow, hyperplasia of the juxtaglomerular apparatus, hyperreninemia, and accelerated hypertension. SRC is often triggered by nephrotoxic drugs and/or intravascular volume depletion. SRC occurs particularly in the first years of disease and in its diffuse form. The occurrence of SRC is more common in patients treated with glucocorticoids, the risk increases with increasing dose. Left ventricular insufficiency and hypertensive encephalopathy are typical clinical features. Thrombotic microangiopathy is detected in 43 % of the cases. Anti-RNA-polymerase III antibodies are present in one third of patients who develop SRC. Renal biopsy is not necessary if SRC presents with classical features. However, it can help to establish prognosis and approaches to the treatment in atypical forms. The prognosis of SRC has dramatically improved with the introduction of angiotensin-converting enzyme inhibitors. However, 5-year survival in patients with systemic sclerosis who develop the full picture of SRC remains low (65 %). The treatment of SRC is based on aggressive control of blood pressure with angiotensin-converting enzyme inhibitors, if needed, in combination with other types of antihypertensive drugs. Dialysis is frequently indicated, but can be stopped in approximately half of patients, mainly in those with good control of blood pressure. Patients who need dialysis for more than 2 years qualify for renal transplantation. SRC still remains an important cause of morbidity and mortality in scleroderma. Prompt diagnosis and treatment may help prevent adverse outcomes and improve survival.
склеродермічна ниркова криза; системна склеродермія; функція нирок; нефробіопсія; діагностика; клінічна картина; лікування; інгібітори ангіотензинперетворюючого ферменту; огляд
склеродермический почечный криз; системная склеродермия; функция почек; нефробиопсия; диагностика; клиническая картина; лечение; ингибиторы ангиотензинпревращающего фермента; обзор
scleroderma renal crisis; systemic scleroderma; kidney function; nephrobiopsy; diagnosis; clinical manifestations; treatment; angiotensin-converting enzyme inhibitors; review
Вступ
Системна склеродермія (прогресуючий системний склероз, ССД) — це стадійне поліорганне захворювання з характерними вазоспастичними судинними реакціями за типом синдрому Рейно й облітеруючою судинною патологією з ішемічними порушеннями, при яких розвиваються специфічні автоімунні розлади, що супроводжуються активацією фіброзоутворення та надлишковим відкладанням колагену в тканинах [1]. Ураження нирок є надважливим та прогнозовизначальним клінічним проявом системного склерозу. Зокрема, склеродермічна ниркова криза (СНК) є критичним клінічним проявом ураження нирок при ССД і переважною причиною смерті в таких пацієнтів. Виживаність пацієнтів із СНК останнім часом значно покращилася [2]. Безсумнівно, рутинне застосування інгібіторів ангіотензинперетворюючого ферменту (ІАПФ) в поєднанні з іншими сучасними методами лікування СНК суттєво модифікували наслідки цього стану, що є одним із найважливіших і яскравих досягнень у терапії ССД. Однак, незважаючи на явне зменшення ранньої смертності в результаті СНК, довгостроковий прогноз для цих пацієнтів виявляється вельми несприятливим через супутні ускладнення й наслідки: ураження життєво важливих органів та органів-мішеней при ССД, прогресування хвороби, необхідність тривалої нирковозамісної терапії. Отже, СНК залишається зламним проявом хвороби, з огляду на це необхідність ранньої діагностики цього стану та призначення своєчасної відповідної терапії залишаються актуальною проблемою ревматології та нефрології на сьогодні.
Ураження нирок при ССД
Незважаючи на те, що СНК є найтяжчим і частим ускладненням ураження нирок при ССД, маніфестуючи, як правило, злоякісною артеріальною гіпертензією (АГ) і гострим ушкодженням нирок (ГУН), необхідно враховувати й інші ураження нирок, властиві ССД. До них відносять інтерстиціальний нефрит, гломерулонефрит, АНЦА-асоційований нирковий васкуліт [3, 4], хронічну ниркову васкулопатію і нирковий паренхіматозний фіброз [5, 6]. Крім того, у хворих на ССД має місце висока частота мікроскопічної гломерулярної або тубулярної протеїнурії, довгострокове значення яких все ще остаточно не з’ясовано.
Історичні аспекти ураження нирок при ССД
Швидкопрогресуюча ниркова недостатність при ССД уперше була описана H. Auspitz у 1863 році [7]. Спочатку існували протиріччя щодо специфіки і патогномонічності цього ускладнення саме для ССД, проте зв’язок було встановлено впродовж наступних 90 років. У 1952 році Н.С. Moore і H.L Sheehan [8] уперше відокремили й описали характерні зміни для істинної склеродермічної нирки. Вчені представили трьох пацієнтів із ССД із гостро виниклою АГ та прогресуючою нирковою недостатністю, які померли за 6–8 тижнів від початку клінічної маніфестації. Гістологічно було виявлено концентричне потовщення внутрішньолобулярних артерій, у поєднанні з перерахованими вище клінічними ознаками даний стан був визначений терміном «склеродермічна ниркова криза». Незважаючи на подібності СНК до інших форм тромботичної мікроангіопатії, що асоціюється з ГУН, існували специфічні особливості СНК, які відображали автоімунні процеси і впливали на тяжкість захворювання і прогноз [9]. До кінця 70-х років минулого століття провідною причиною смерті хворих на ССД була власне справжня склеродермічна нирка, яка реєструвалася у 12–18 % пацієнтів і практично завжди була фатальним проявом ССД [10].
Визначення
Гостра склеродермічна нефропатія, або СНК, характеризується вперше виявленою злоякісною АГ
і/або швидко прогресуючим олігуричним варіантом ниркової недостатності на тлі встановленого ССД. Не слід думати, що злоякісна гіпертензія без уремії або інших проявів ураження нирок є власне нирковою кризою [11]. Аналогічно, зміни в аналізах сечі
і/або помірна уремія в пацієнтів із ССД без АГ також не повинні розглядатися як СНК [11]. Існують деякі відмінності між критеріями, які використовували для визначення СНК у різних дослідженнях. Окрім того, СНК, як відмітний прояв ССД, не знайшла відображення в класифікаційних критеріях ACR/EULAR 2013 щодо ССД, оскільки цей симптомокомплекс не додав чутливості й специфічності діагностиці цього захворювання [12]. З іншого боку, у діагностичні критерії ССД були включені антитіла до РНК-полімерази III, які тісно асоційовані з СНК.
Епідеміологія
Поширеність СНК варіює, за даними різних джерел, від 25 до 5 % [13, 14]. Для дифузної форми ССД (дССД) частота СНК становить у середньому 14 %, для лімітованої форми набагато менше — приблизно 3 % [15]. Захворюваність на ниркову кризу, мабуть, зменшилася відтоді, як почали застосовуватися ІАПФ, хоча в літературі немає прямих доказів того, що ця група препаратів запобігає СНК. Натомість є дані двох незалежних когортних досліджень, що попереднє використання ІАПФ асоціювалося з гіршим довгостроковим прогнозом і більш високою частотою довготривалого діалізу після СНК [16–18]. Механізм цього факту є незрозумілим, ймовірно, низька доза ІАПФ, що використовується в пацієнтів з АГ, виявилася неадекватною для корекції сплеску реніну при запуску СПК, але водночас замаскувала гострі прояви хвороби, які зазвичай приводять пацієнта до лікаря, перетворюючи таким чином це захворювання на менш оборотний і хронічний процес.
Ниркова криза найчастіше спостерігається в жінок та на ранній стадії ССД: до 75 % випадків СНК маніфестує в терміни від 7,5 міс. до 4 років від дебюту захворювання [11]. Дослідження продемонстрували також, що у афроамериканців СНК розвивається в три рази частіше, аніж у європейців [15].
Патогенез
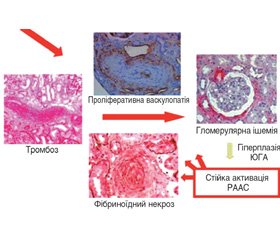
Основними ланками патогенезу ССД є взаємодія вродженої й адаптивної імунних систем, порушений метаболізм сполучної тканини і позаклітинного матриксу, вазопатія мікроциркуляторного русла і порушення артеріального кровотоку в нирках. Відповідно до теорії V.D. Steen і співавторів [19], у генетично схильних осіб внаслідок розвитку автоімунних реакцій, васкулопатії і фіброзу виникає специфічне пошкодження органів [20], у тому числі й нирок. При СНК відбуваються пошкодження ендотелію, проліферація інтими та звуження ниркових артеріол, зумовлюючи зниження кровотоку, гіперплазію юкстагломерулярного апарату, гіперренiнемію та виникнення АГ [11]. На рис. 1 схематично подано послідовність патогенетичних механізмів, які обумовлюють розвиток СНК.
Тригером розвитку СНК є вазоспазм ниркових судин (нирковий синдром Рейно), що призводить до пошкодження ендотеліальних клітин, проліферативної васкулопатії переважно дугових й інтралобулярних ниркових артерій із фібриновими тромбами і фібриноїдним некрозом [11]. Надалі відбуваються фіброз і ущільнення екстрацелюлярного матриксу клубочків і канальцевого інтерстицію, мукоїдне набухання інтими судин і концентрична гіпертрофія інтралобулярних артерій за типом «цибулевого лушпиння» [21]. Адвентиціальний і періадвентиціальний фіброз — ознака хронічної васкулопатії, що спостерігається в пацієнтів із СНК. Цікаво, що на відміну від інших захворювань нирок ступінь інтерстиціального склерозування не має прогностичної цінності, тоді як маркери гострого судинного ушкодження (включаючи фібриноїдний некроз і тромбоз судин) пророкують погані наслідки [21]. Ураження клубочків є вторинним і розвивається внаслідок розладнання внутрішньониркової гемодинаміки зі зростаючою ішемією ниркової тканини.
Кінцевим результатом СНК є ініціація самовідтвореного каскаду гломерулярної гіпоперфузії, активація прозапальних цитокінів і зростання вивільнення реніну з активованого ренін-ангіотензин-альдостеронового циклу за оберненим зв’язком [21]. Гіперпродукція реніну — це один із ключових моментів патогенезу СНК, що зумовлює спазм артеріол ниркових клубочків із подальшим наростанням порушень внутрішньониркової гемодинаміки, які посилюються зростанням системного артеріального тиску (АТ), додатково негативно впливаючи на гломерулярні капіляри. Водночас гіперренінемія рідко зустрічається перед гострим початком СНК і не може виступати предиктором розвитку СНК.
Окрім пошкодження ендотеліальних клітин і порушення їх бар’єрної функції, в розвиток і прогресування СНК залучена також їх активація з експресією ними маркерів ендотелійзалежної ланки гемостазу і медіаторів фіброгенезу. У пацієнтів із СНК встановлено збільшення рівня вазоконстрикторних молекул (циркулюючого ендотеліну-1 (ET-1) й ангіотензину II), трансформуючого фактора росту і розчинної молекули адгезії (sVCAM) [22]. Маркери пошкодження нирок при СНК суттєво зростають. Крім того, є підтверджені дані щодо підвищення сироваткових рівнів sVCAM-1 та фактора Віллебранда (vWF) як у дебюті СНК, так і на попередніх докризових етапах [22]. Описано також підвищення концентрацій у крові й інших маркерів пошкодження, наприклад таких, як адипокіни. Так, рівень ліпокаліну-2 вірогідно зростає при гострому автоімунному пошкодженні нирок [23], він корелює зі швидкістю клубочкової фільтрації (ШКФ) у пацієнтів із ССД. Разом із цим дослідники повідомили про асоціації між сироватковим рівнем ліпокаліну-2 і поширенням ураження шкіри (позитивна кореляція) та систолічним тиском правого шлуночка в суб’єктів із нормальною ШКФ (негативна кореляція). Нарешті, дефіцит транскрипційного фактора Fli1, що бере участь у формуванні васкулопатії при ССД, індукує експресію ліпокаліну-2 на ендотеліальних клітинах [23]. Необхідні подальші дослідження для підтвердження цих результатів, зокрема встановлення значення ліпокаліну-1 як біомаркера для СНК, а також чи відіграє ліпокалін-1 причинну роль у патогенезі ССД.
На рис. 2 схематично зображено послідовність патогістологічних змін та патогенетичних подій, що лежать в основі розвитку СНК.
Фактори ризику (предиктори) розвитку СНК
Характеристики типового пацієнта із СНК добре описані в класичній літературі. Багато з цих ознак або лабораторних показників можуть бути ідентифіковані до розвитку самого невідкладного стану, саме тому необхідна ретельна базова оцінка всіх випадків ССД для вірогідної оцінки ризику розвитку ГУН. ДССД розглядається як один з основних факторів ризику СНК. У групі пацієнтів із дССД у 20–25 % розвивався СНК, що становить 75–80 % усіх випадків СНК [25]. Набагато менше пацієнтів із лімітованою формою склеродермії (CREST-синдромом) мають ризик розвитку СНК. Ще менше випадків ниркової кризи задокументовано в пацієнтів із лімітованою склеродермією і високими титрами антицентромірних антитіл [19]. Таким чином, переважна більшість випадків СНК (75–80 %) припадає на пацієнтів із дифузним ураженням шкіри, крім того, слід підкреслити, що швидке прогресування потовщення шкіри пов’язано з більш високою ймовірністю розвитку СНК [19].
Однак слід бути вкрай обережними, оскільки СНК може зустрічатися в пацієнтів і з незначно вираженим утягненням шкіри, але у яких згодом розвивається типова дССД, хоча під час діагнозу ниркової кризи вони мали мінімальні зміни шкіри або навіть відсутність дермопатії. Отже, стратифікація пацієнтів, у яких у подальшому, ймовірно, розгорнеться дССД, є вкрай важливою, тому що в таких пацієнтів діагноз СНК зазвичай встановлюється на підставі результатів посмертної біопсії нирок [24]. Існує кілька характерних ознак, які допомагають ідентифікувати таких пацієнтів: це пацієнти, які майже завжди мають короткий анамнез захворювання, часто менше 1 року, поліартрит/поліартралгії, подушкоподібний щільний набряк переважно проксимальних відділів кистей і стоп (puffy fingers), тунельний синдром зап’ястного каналу [26, 27]. Хоча феномен Рейно в кінцевому підсумку майже повсюдно виявляється при склеродермії, його відсутність при ранній дССД не є чимось незвичайним [28]. Наявність шуму тертя (крепітації) сухожиль, що визначається пальпаторно під час руху ліктьових, променевозап’ясткових, колінних або гомілковостопних суглобів, у 65 % пацієнтів є надзвичайно корисною і прогнозоважливою ознакою дССД ще до розвитку дифузного шкірного ураження; менше 5 % пацієнтів із лімітованою формою склеродермії мають цю ознаку [29]. Цей симптом пов’язаний із відкладенням фібринозних депозитів на поверхні сухожильних піхв і фасцій і нерідко передує змінам шкіри. Ураження сухожилків нерідко призводить до формування згинальних контрактур. У проспективному дослідженні EUSTAR, яке включало 1301 пацієнта із ССД із тривалістю захворювання ≤ 3 роки, підтверджено, що шум тертя сухожилків (HR 2,33, 95% CI 1,03–6,19) є незалежним предиктором розвитку СНК [30].
Автоантитіла можуть бути корисними для оцінки прогнозу СНК. Антинуклеарні антитіла (АNА) спостерігаються в 95 % пацієнтів зі склеродермією, тому їх виявлення в периферичної крові в пацієнтів зі злоякісною гіпертензією може бути важливою ознакою. Антитіла до РНК-полімерази III — це власне склеродермічне специфічне антитіло, що визначається виключно при дССД; у понад 50 % пацієнтів із цим імунологічним показниками розвивається СНК [31]. Цікаво відзначити недавній звіт The Royal Free когортного дослідження, в якому порівнювали частоту виявлення антитіл до РНК-полімерази III при СНК [32]: з 150 клінічних випадків із підтвердженим діагнозом СНК 61 (41 %) пацієнт був позитивним за даним імунологічним показником, ці пацієнти з більшою ймовірністю потребували діалізу (51 проти 29 %, p = 0,07) та водночас мали кращу виживаність (p = 0,003). З огляду на ці дані антитіла до РНК-полімерази III можна використовувати як надійний предиктор розвитку СНК. Навпаки, тільки в 10 % пацієнтів з антитілами до топоізомерази І, які також пов’язані з дифузним захворюванням шкіри, розвивається ниркова криза [20]. Антицентромерні антитіла, які спостерігаються при класичній лімітованій формі склеродермії (або CREST-синдромі), так само рідко асоціюються з нирковою кризою [33].
Пацієнтам із ранньою дССД рекомендується регулярно контролювати кров’яний тиск і відразу ж повідомляли своїх лікарів, коли АТ має тенденцію до зростання, тому що в більшості пацієнтів (до 75 %) із дифузною формою системного склерозу СНК розвивається в термін від 7,5 місяця до 4 років [11].
Гіпертензія в анамнезі зазвичай не властива СНК, більш типовою ознакою є вперше виявлена гостра значна АГ — раптове незвичне різке неконтрольоване підвищення (наростання в динаміці) АТ. З огляду на дані клінічних спостережень нормальний кров’яний тиск було зареєстровано протягом 24 годин до початку СНК, крім того, виявлено, що патологія в загальному аналізі сечі та підвищений рівень креатиніну сироватки крові так само не є предикторами розвитку СНК [25].
Деякі позаниркові ураження можуть передувати СНК — це безсимптомний перикардіальний випіт, застійна серцева недостатність та/або аритмія [19]. Анемія — незвичний і нечастий прояв склеродермії, але вона також може бути ранньою ознакою ниркової кризи, особливо за наявності гемолізу і тромбоцитопенії [34].
У багатьох дослідженнях підтверджено, що раннє використання високих доз глюкокортикоїдів (ГК) (> 15 мг/добу в еквіваленті преднізолону) часто передує розвитку СНК [35, 36]. У дослідженні «випадок — контроль» було виявлено, що ниркова криза розвивалася в три рази частіше протягом наступних 6 місяців у пацієнтів із ССД, які отримували ГК (преднізолон) у дозі > 15 мг/добу. Також є дані про розвиток СНК на тлі прийому циклоспорину [20].
Деякі з найбільш надійних предикторів розвитку, що перераховані вище, знайшли своє підтвердження в недавньому міжнародному дослідження International Scleroderma Renal Crisis Survey [18]: середня тривалість захворювання від початку перших симптомів ССД до діагнозу СНК становила 1,5 року, у 75 % пацієнтів діагностовано дССД, майже в половини були виявлені антитіла, асоційовані з дифузним ураженням шкіри (ANA, анти-РНК-полімераза III). Крім того, в цьому дослідженні встановлена асоціація між прийомом ГК і ризиком смерті від СНК: так, кожний міліграм преднізолону збільшував ризик смерті на 4 % [18].
Учені зіткнулися зі складністю виявлення специфічних клінічних і серологічних детермінант цього тяжкого клінічного стану, так були зроблені спроби визначення генетичної схильності до виникнення СНК. Повідомлялося про асоціацію між СНК і різними гаплотипами MHC класу I, а саме HLA-DRB1*0407 і HLA-DRB1*1304 [37]. Був виявлений предикторний взаємозв’язок рівня комплементу і таких генів, як EPHA5, GRIA3, HECW2 і CTNND2 [38].
Як можливий маркер ризику розвитку СНК розглядається збільшення рівня sCD147 — позаклітинного інгібітора матриксної металопротеїнази. У дослідженні K. Yanaba і співавторів зазначено, що в пацієнтів із підвищеним рівнем sCD147 (ELISA) частіше розвивався СНК, ніж у пацієнтів із нормальним рівнем (13 і 0 % відповідно; р < 0,05) [39].
У табл. 1 підсумовані предиктори розвитку СНК.
Діагностичні критерії СНК
Для діагностики СНК на сьогодні не існує золотого стандарту. Були запропоновані критерії, що подані нижче: обов’язкова наявність двох критеріїв злоякісної (гіперренінової) АГ і швидко прогресуючої ниркової недостатності, а також наявність як мінімум одного клініко-інструментального критерію з третьої групи [12, 40].
Клінічні критерії склеродермічної ниркової кризи
1. Уперше виявлена артеріальна гіпертензія, АТ ≥ 150/851, отриманий щонайменше двічі протягом 24-годинного періоду або збільшення САТ ≥ 30 мм рт.ст. і/або ДАТ ≥ 20 мм рт.ст. від звичайних цифр.
2. Зниження функції нирок: зменшення ШКФ на не менше ніж 10 %, або ШКФ нижче 90 мл/хв/
1,73 м2, або збільшення рівня креатиніну сироватки на 50 %, або більше відносно базального рівня, або 120 % чи вище від верхньої межі норми для даної лабораторії.
3. І будь-яка з нижче перерахованих ознак:
— ретинопатія, типова для гострого гіпертонічного кризу;
— уперше виявлені (за винятком інших причин):
а) протеїнурія 2+ або > 500 мг/добу і більше;
б) гематурія 2+ і більше або > 10 клітин у полі зору;
в) тромбоцитопенія < 100 • 109/л;
г) гемолітична анемія (у тому числі виявлення фрагментів еритроцитів, шистоцитів або ретикулоцитоз);
— гіпертензивна енцефалопатія;
— гострий набряк легень;
— олігурія або анурія;
— біопсія нирок із типовими особливостями, включаючи потовщення інтими внутрішньониркових артерій й артеріол із клітинної проліферацією («цибулинне лушпиння»), фібриноїдний некроз і зморщування гломерул.
Примітки: 1 — цей рівень АТ визначено Нью-Йоркською асоціацією кардіологів як виражена гіпертензія; АТ — артеріальний тиск; САТ — систолічний артеріальний тиск; ДАТ — діастолічний артеріальний тиск; ШКФ — швидкість клубочкової фільтрації.
Основною діагностичною перевагою біопсії нирок у разі СНК є виключення інших патологій, оцінка довгострокової перспективи й уявлення про подальший прогноз. Однак біопсія може бути проведена тільки за умови стабільного стану пацієнта з контрольованим АТ і нормальним рівнем тромбоцитів. Біопсія нирок необхідна при сумнівах із приводу остаточного діагнозу, якщо є будь-яка невизначеність щодо діагнозу, нетиповий перебіг, виключення іншої етіології ураження нирок, особливо гломерулонефриту. Біопсія нирок також може дати цінну прогностичну інформацію щодо подальшого перебігу ураження нирок при ССД.
Близько 10 % випадків СНК можуть з’являтися при нормальному АТ [41]. Повідомляється, що саме такі випадки нормотензивного СНК мають особливо поганий прогноз [41]. Згідно з діагностичними критеріями треба звернути увагу, що в першій групі є не тільки фіксоване збільшення АТ вище 150/90 мм рт.ст., але й збільшення САТ на 30 мм рт.ст. та/або ДАТ на 20 мм рт.ст. від звичайних цифр для кожного конкретного пацієнта, тобто в останньому випадку може мати місце нормотензивний варіант СНК.
Клінічна картина
Пацієнти можуть скаржитися на сильний головний біль, порушення зору або інші симптоми гіпертензивної енцефалопатії, пов’язані з різким підвищенням АТ. Так само характерна велика кількість неспецифічних симптомів: підвищена втома, кволість, задишка або загальне нездужання. Пацієнтів із ССД та високим ризиком розвитку СНК згідно з наявністю факторів ризику (прогнознегативних чиників) необхідно навчити пильно відстежувати ці симптоми і самостійно контролювати рівні власного АТ.
Більшість пацієнтів мають значне й раптове підвищення цифр АТ як маніфестний прояв СНК. 90 % пацієнтів мають рівні АТ понад 150/90 мм рт.ст., а в 30 % відмічене підвищення рівня діастолічного АТ понад 120 мм рт.ст. До 10 % клінічних випадків СНК супроводжуються нормальним АТ, хоча нормальне значення АТ має бути інтерпретовано в кожному конкретному випадку, як вже зазначалося вище [41]. Таким чином, будь-яка раптова й неочікувана зміна АТ у бік збільшення повинна насторожити лікаря і пацієнта, спонукати до подальшого спостереження й моніторингу. Для діагностики нормотензивної ниркової кризи необхідна наявність інших ознак, насамперед швидкопрогресуючої незрозумілої азотемії і/або гемолітичної анемії з тромбоцитопенією. У нещодавно опублікованому Міжнародному дослідженні із СНК (International Scleroderma Renal Crisis Survey) наведено 75 клінічних випадків: 70 пацієнтів мали гіпертензивну форму СНК, 5 — нормотензивну, хоча в жодному останньому випадку не було проведено нефробіопсії [18]. Слід зазначити, що за відсутності біопсії нирок діагноз нормотензивної СНК є сумнівним. Усі пацієнти з діагнозом «гіпертензивна СНК» відповідали набору критеріїв, поданих вище, тоді як тільки два з п’яти хворих із нормотензивною СНК мали достатню кількість ознак для встановлення діагнозу СНК. Парадоксально, але, згідно з багатьма дослідженнями, більш високий систолічний або діастолічний АТ пов’язані з кращим довгостроковим прогнозом і наслідками при СНК [21].
Таким чином, хоча діагностика гіпертонічної СНК на сьогодні достатньо обґрунтована, необхідні подальші дослідження для діагностики нормотензивного варіанта СНК і, зокрема, для визначення необхідності біопсії нирок і/або інших серологічних і генетичних біомаркерів. Питання специфічності також є важливим, оскільки інші форми тромботичної мікроангіопатії можуть мати разючу подібність до СНК, і тому наявність ознак ССД є критичним аспектом діагностики. З огляду на неспецифічність використовуваних критеріїв можливо припустити, що під діагнозом СНК, а особливо нормотензивного СНК, у пацієнтів із ССД можуть ховатися інші варіанти ураження нирок. А високий рівень смертності таких пацієнтів обумовлений труднощами встановлення діагнозу і, як наслідок, помилковими підходами до терапії.
У табл. 2 подана диференціальна діагностика гострих уражень нирок при ССД.
Одним із характерних клінічних проявів, що іноді супроводжують СНК, є легенева кровотеча — рідкісний загрозливий життю стан [45]. Безумовно, дана патологія ускладнює діагностику та є поганою прогностичною ознакою.
Достатньо часто в пацієнтів із СНК можна виявити клінічні ознаки застійної серцевої недостатності (задишка, пароксизмальна нічна задишка або навіть набряк легень), серйозні шлуночкові аритмії (навіть зупинка серця) і/або масивний перикардіальний випіт, розвиток гострого кардіоренального синдрому (1, 3 або 5-го типу) [43, 46, 47]. Безумовно, це зумовлено насамперед стресовим впливом високого АТ на міокард, ефектами гіперренінемії і перевантаженням об’ємом внаслідок олігуричної стадії ниркової недостатності, але робить свій внесок у цей стан і залучення до патологічного процесу міокарда, властивого для ССД. Описано асоціацію СНК із дифузним геморагічним альвеолітом, тромботичною мікроангіопатією і тромбоцитопенічною пурпурою [48, 49]. На відміну від тромбоцитопенічної пурпури для тромботичної мікроангіопатії, асоційованої із ССД, не характерна наявність вираженого дефіциту ферменту металопротеїнази ADAMTS 13 [50], а формування тромбів відбувається не в капілярах клубочків, а в малих ниркових судинах [51].
Лабораторні феномени
Лабораторне підтвердження ГУН при СНК є основним напрямком початкової діагностики. Як правило, у загальному аналізі сечі можна виявити протеїнурію і мікрогематурію. Протеїнурія є незначною або помірною (зазвичай < 2 г/добу), при мікроскопії сечі кількість еритроцитів становить 5–100 у полі зору, можуть зустрічатися поодинокі гранулоцитарні циліндри [44]. Креатинін сироватки зазвичай становить не менше 150 % від початкового значення. Перераховані вище ознаки є 1-ю стадією ГУН згідно з міжнародними консенсусними рекомендаціями щодо ведення пацієнта з ГУН [43]. Знову ж таки нормальна функція нирок повинна інтерпретуватися з обережністю, оскільки значення креатиніну може досягти відносного збільшення на 150 %, не піднімаючись вище нормального абсолютного діапазону.
Рівень креатиніну швидко збільшується в перші кілька днів від початку ниркової кризи, як правило, продовжує збільшуватися навіть після адекватного контролю АТ та становить 0,5–1,0 мг/дл креатиніну в день. Часто виникає питання, чи впливають безпосередньо ІАПФ на це збільшення, однак не було пацієнтів, у яких зменшився б рівень креатиніну в сироватці після припинення прийому ІАПФ [46]. На жаль, у клінічній практиці існують ситуації, коли рівень креатиніну продовжує зростати, у пацієнта прогресує ниркова недостатність, незважаючи на адекватний контроль АТ за допомогою IАПФ. Слід пам’ятати, що призначення ГК, імунодепресантів, проведення плазмаферезу не впливають на прогноз і виживаність при СНК.
Мікроангіопатична гемолітична анемія, що характеризується нормохромними, фрагментованими еритроцитами, ретикулоцитозом і тромбоцитопенією, зустрічається майже в половини пацієнтів із СНК. Кількість тромбоцитів рідко буває нижче за 20 000/мм3, і нормалізація рівня цих клітинних елементів є першою ознакою адекватної відповіді на терапію, навіть незважаючи на те, що триває зростання рівня креатиніну в сироватці крові. Тромбоцитопенія при СНК зазвичай малосимптомна, а ось анемія може сприяти розвитку серцевої недостатності. В опублікованих дослідженнях вказується, що частота тромбоцитопенії й анемії є приблизно однаковою в пацієнтів із СНК і становить 50 і 52 % відповідно [21]. Завжди слід упевнитися в наявності гемолізу в пацієнтів із СНК, доказом тому є зниження рівня гаптоглобіну в сироватці, підвищення концентрації лактатдегідрогенази та білірубіну за рахунок непрямої фракції. Оскільки залишаються певні діагностичні невизначеності в цій галузі, то, якщо в пацієнта із ССД підозрюється TTП або гемолітикоуремічний синдром, рекомендується використовувати ІАПФ у поєднанні з плазмаферезом.
Лікування
Найважливішим аспектом менеджменту пацієнтів із нирковою кризою є рання діагностика цього стану. Надзвичайно важливими є виявлення пацієнтів із високим ризиком розвитку даного ускладнення, забезпечення навчання цих пацієнтів регулярного самостійного моніторингу АТ щонайменше 2 рази на день і при появі гострих симптомів — головного болю, задишки, запаморочення або синкопе в поєднанні з високим АТ — негайне звернення до лікаря. Також повинна бути регулярна оцінка аналізів сечі і біохімічних показників, що оцінюють функцію нирок. Це особливо важливо при тривалості анамнезу дССД менше 4 років. Якщо пацієнт із ССД спостерігається сімейним лікарем, при виникненні маніфестної АГ або інших відповідних симптомів, аномалії аналізу сечі або ниркової недостатності важливо негайно проконсультувати пацієнта в ревматолога і/або нефролога. Таким чином, можна своєчасно запідозрити СНК і вчасно розпочати лікування.
У разі встановлення діагнозу СНК пацієнт повинен бути негайно госпіталізований. Відповідно до сучасних рекомендацій [52] АГ при СНК повинна коригуватися призначенням ІАПФ або збільшенням їх дози при попередньому прийомі. ІАПФ короткого дії краще використовувати при гемодинамічно нестабільних ситуаціях. Зниження цифр АТ є стрижневою метою в терапії СНК, проте для цього може знадобитися кілька днів, протягом яких необхідно збільшити дози ІАПФ до максимальних, можливо подвоювати кожні 24 години. Необхідний також ретельний моніторинг пацієнта з щоденними оцінками загального аналізу крові і функції нирок. Потрібно пам’ятати, що функція нирок може прогресивно погіршуватися впродовж перших кількох діб, незважаючи на розпочате лікування. Це ключовий момент, оскільки доктор може необґрунтовано скасувати або зменшити дозу ІАПФ, міркуючи про їх неефективність або побічні ефекти, але цього не треба робити.
При збереженні високої АГ на тлі максимальної дози ІАПФ до лікування додають блокатори кальцієвих каналів, альфа-блокатори (доксозазин), моксонідин, нітропрусид і клонідин. Метою лікування СНК є досягнення нормального АТ. Блокатори рецепторів ангіотензину при ізольованому прийомі є менш ефективними, аніж ІАПФ для лікування СНК що, ймовірно, пов’язано з відсутністю брадикінінпотенційного ефекту [53]. Бета-блокатори протипоказані при СНК через вплив на периферичний кровообіг. Зазвичай для лікування АГ при СНК немає необхідності в парентеральних антигіпертензивних засобах, хоча інфузія нітратів може бути необхідна при виникненні гострої лівошлуночкової недостатності і набряку легень на тлі СНК.
Останнім часом з’явилися дані про використання антагоністів ендотелінових рецепторів (бозентану та ситаксентану) при СНК [54], що є обґрунтованим підходом, зважаючи на високі рівні циркулюючого ендотеліну-1 (ЕТ-1), а також підвищену експресію рецепторів і лігандів ендотеліну [55].
Було проведено одне відкрите дослідження бозентану, доданого до стандартного лікування при СНК, де виявлена його значна ефективність [54]. Подібність патогенезу СНК і прекапілярної легеневої артеріальної гіпертензії дозволяє припустити необхідність і дієвість застосування антагоністів рецепторів ендотеліну в лікуванні як гострого стану при СНК, так і у післякризовому періоді для відновлення судин.
Додатково рекомендується використовувати при СНК ілопрост — стабільний аналог простациклину, що має вазодилатуючі й антиагрегантні властивості. При довенному використанні ілопрост збільшує нирковий плазмотік, розширюючи приносну та виносну артеріоли [56].
За потреби замісної ниркової терапії методами вибору є гемофільтрація або гемодіаліз. Результати останніх досліджень показують, що гемодіаліз потрібний половині пацієнтів із СНК або через перевантаження об’ємом внаслідок зниження ниркової функції або для контролю АТ при резистентній АГ [57]. За оптимальної терапії діаліз можливо перервати в 16–55 % хворих на СНК. Іноді при повільно прогресуючих варіантах СНК можна скористатися перитонеальним діалізом як ініціальною терапією. Водночас при несприятливих варіантах перебігу СНК єдиним варіантом лікування може бути трансплантація нирки [58]. У зв’язку з існуючою можливістю відновлення ниркової функції операцію слід проводити не раніше ніж через 18–24 місяців після розвитку СНК. Проте частота повторного розвитку СНК у нирковому трансплантаті сягає 20–50 % [59].
Різні біологічні агенти, включаючи інгібітори TGF-a, анти-CD20 (ритуксимаб), моноклональні антитіла до інтерлейкіну-6 (IL-6), екулізумаб й інгібітори тирозинкінази, проходять дослідження для оцінки ефективності і безпечності при СПК [60].
Плазмаферез на сьогодні не розглядається як метод вибору при СНК, оскільки ефективність даного методу лікування при СНК є вкрай низькою. Однак плазмаферез є провідним методом лікування при деяких асоційованих станах, як, наприклад, ТТП, тяжка мікроангіопатична гемолітична анемія і коагулопатія споживання [61].
Лікування ускладнень СНК у вигляді ураження життєво важливих органів, таких як набряк легень, гіпертензивна енцефалопатія, повинні проходити відповідно до чинних стандартів і рекомендацій для лікування цих станів. На рис. 3 наведений узагальнений алгоритм ведення хворих із СНК.
Профілактика
Навчання пацієнтів разом зі стратифікацією ризику і пильним моніторингом АТ, аналізів сечі і рівнів креатиніну має вирішальне значення в профілактиці СНК. Немає жодних доказів того, що ІАПФ мають профілактичний ефект. Нещодавні результати британського та французького когортного дослідження вказують на гірший довгостроковий прогноз у вигляді необхідності діалізу в пацієнтів, які приймали ІАПФ або БРА під час діагностики СНК [18, 34]. Велике контрольоване дослідження ІАПФ квінаприлу продемонструвало, що останній не справляв профілактичного ефекту щодо судинних ускладнень при ССД [62]. Однак у це дослідження були включені тільки пацієнти з лімітованою формою ССД або феноменом Рейно, тобто обидві групи належали до когорти з низьким ризиком виникнення СНК. Таким чином, на сьогодні питання про профілактичну роль ІАПФ для СНК залишається невирішеним.
Прогноз
Завдяки широкій доступності ІАПФ виживаність при СНК значно покращилася і становить 10 % протягом першого року і 60 % протягом наступних 5 років [38]. 35–45 % пацієнтів із нирковою кризою не вимагають діалізу. Рівень креатиніну повільно нормалізується або знижується, отже, у пацієнтів рідко розвивається хронічна ниркова недостатність у разі, якщо АТ контролюється достатньою мірою [63]. Використання ІАПФ повинно бути достатньо тривалим.
Більше половини пацієнтів, які спочатку потребували діалізу, припиняють його за 3–18 місяців. Більшість пацієнтів після припинення діалізу мають достатню функцію нирок, що не погіршується ще до тих пір, поки контролюється АТ.
Спонтанне відновлення ниркової функції у хворих на системний склероз зустрічалося значно частіше, ніж при інших нефропатіях (10 і 1 %; р < 0,001 відповідно) [64]. Згідно з даними національного регістру Австралії і Нової Зеландії ANZDATA [63], середня виживаність у хворих із термінальною хронічною нирковою недостатністю на тлі системного склерозу виявилася значно нижчою, ніж у пацієнтів з іншими причинами хронічної ниркової недостатності (2,43 і 6,02 року відповідно), а середній час відновлення ниркової функції після СНК становив 1 рік; у подальшому ймовірність знижується і наближається до нуля через три роки проведення нирковозамісної терапії [63]. До поганих прогностичних факторів щодо наслідків СНК належить збільшення рівня N-кінцевого фрагмента мозкового натрійуретичного пептиду (NP-proBNP) більше 360 пг/мл
(р = 0,019), а зростання рівня NP-proBNP більше 1494 пг/мл високо корелює з неминучістю проведення гемодіалізу (OR = 70; p < 0,005) [65]. Про несприятливий прогноз СНК свідчить виникнення аритмії, міокардиту або перикардиту [25] у період розвитку ниркової кризи та післякризовий період.
Незважаючи на значне збільшення виживаності пацієнтів із СНК із початком ери ІАПФ, гостра склеродермічна нефропатія є високофатальним проявом ССД. Пацієнти цієї групи вимагають ретельного лікарського контролю, починаючи від виділення груп ризику, своєчасного і правильного встановлення діагнозу, проведення інтенсивної терапії з тісною міждисциплінарною взаємодією разом із проведенням нирковозамісної терапії і трансплантації нирки.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів, при цьому автори не отримували від окремих осіб й організацій фінансової підтримки дослідження, гонорарів та інших форм винагород.
Інформація про внесок кожного учасника: І.Ю. Головач — концепція і дизайн роботи, огляд літератури з проблеми, корекція тексту; Є.Д. Єгудіна — огляд літератури з проблеми, написання тексту, підготовка статті до друку.
Рецензенти: проф. О.В. Сіняченко, проф. А.А. Ханюков.
1. Desbois A.C. Systemic sclerosis: an update in 2016 / A.C. Desbois, P. Cacoub // Autoimmun. Rev. — 2016. — Vol. 15. — P. 417-426.
2. Scleroderma renal crisis: a retrospective multicentre study on 91 patients and 427 controls / Guillevin L., Bérezné A., Seror R. et al. // Rheumatology (Oxford). — 2012. — Vol. 51, № 3. — P. 460-7.
3. Номенклатура, класифікація, критерії діагностики та програми лікування ревматичних хвороб / За ред. В.М. Коваленка, Н.М. Шуби. — К., 2004. — 156 с.
4. ANCA-related crescentic glomerulonephritis in systemic sclerosis: revisiting the “normotensive scleroderma renal crisis” / L. Arnaud, A. Huart, E. Plaisier et al. // Clin. Nephrol. — 2007. — Vol. 68, № 3. — P. 165-70.
5. Нейко Є.М., Яцишин Р.І. Патологія нирок при системній склеродермії // Галицький лікарський вісник. — 2001. — № 3. — С. 77-79.
6. Kidney disease other than renal crisis in patients with diffuse scleroderma / V.D. Steen, A. Syzd, J.P. Johnson et al. // J. Rheumatol. — 2005. — Vol. 32, № 4. — P. 649-55.
7. Auspitz H. Ein beit zur lehre vom haute-sklerem der erwachsenen / H. Auspitz // Wrin. Med. Wschr. — 1863. — Vol. 13. — P. 739-55.
8. Moore H.C. The kidney of scleroderma / H.C. Moore, H.L. Sheehan // The Lancet. — 1952. — 259.6698. — Vol. 12, № 1. — Р. 68-70.
9. Scleroderma renal crisis or thrombotic thrombocytopenic purpura: seeing through the masquerade / E. Keeler, G. Fioravanti, B. Samuel, S. Longo // Lab. Med. — 2015. — Vol. 46, № 2. — P. 39-44.
10. Steen V.D., Medsger T.A. Change in causes of death in systemic sclerosis, 1972–2002 // Ann. Rheum. Dis. — 2007. — Vol. 66, № 7 —Р. 940-944.
11. Shanmugam V.K. Renal disease in scleroderma: an update on evaluation, risk stratification, pathogenesis and management / V.K. Shanmugam, V.D. Steen // Curr. Opin. Rheumatol. — 2012. — Vol. 24, № 6. — Р. 669-676.
12. 2013 classification criteria for systemic sclerosis: an American college of rheumatology/European league against rheumatism collaborative initiative / F. van den Hoogen, D. Khanna, J. Fransen et al. // Ann. Rheum. Dis. — 2013. — Vol. 72, № 11. — P.1747-55.
13. Steen V.D. Assessment of kidney involvement / V.D. Steen, M.D. Mayes, P.A. Merkel // Clin. Exp. Rheumatol. — 2003. — Vol. 21, № 3. — P. 29-31.
14. Scleroderma renal crisis: a retrospective multicentre study on 91 patients and 427 controls / L. Guillevin, A. Bérezné, R. Seror et al. // Rheumatology (Oxford). — 2012. — Vol. 51, № 3. — P. 460-7.
15. Prediction of pulmonary complications and long-term survival in systemic sclerosis / S.I. Nihtyanova, B.E. Schreiber, V.H. Ong et al. // Arthritis Rheumatol. — 2014. — Vol. 66, № 6. — P. 1625-35.
16. Scleroderma renal crisis: patient characteristics and long-term outcomes / H. Penn, A.J. Howie, E.J. Kingdon et al. // QJM. — 2007. — Vol. 100, № 8. — P. 485-94.
17. Mortality and risk factors of scleroderma renal crisis: a French retrospective study of 50 patients / L. Teixeira, L. Mouthon, A. Mahr et al. // Ann. Rheum. Dis. — 2008. — Vol. 67, № 1. — P. 110-6.
18. Exposure to ACE inhibitors prior to the onset of scleroderma renal crisis-results from the International Scleroderma Renal Crisis Survey / M. Hudson, M. Baron, S. Tatibouet et al. // Semin. Arthritis Rheum. — 2014. — Vol. 43, № 5. — P. 666-72.
19. Factors predicting development of renal involvement in progressive systemic sclerosis / V.D. Steen, T.A. Medsger Jr, T.A. Osial Jr et al. // Am. J. Med. — 1984. — Vol. 76, № 5. — P. 779-86.
20. Renal complications and scleroderma renal crisis / C.P. Denton, G. Lapadula, L. Mouthon, U. Muller-Ladner // Rheumatology (Oxford). — 2009. — Vol. 48, № 3. — P. 32-5.
21. Scleroderma renal crisis: patient characteristics and long-term outcomes / H. Penn, A.J. Howie, E.J. Kingdon et al. // QJM. — 2007. — Vol. 100, № 8 — Р. 485-494.
22. Targeting the endothelin axis in scleroderma renal crisis: rational and feasibility / N. Penn, N. Quillinan, K. Khan et al. // QJMed. — 2013. — Vol. 106, № 9. — Р. 839-848.
23. A possible contribution of lipocalin-2 to the development of dermal fibrosis, pulmonary vascular involvement, and renal dysfunction in systemic sclerosis / T. Takahashi, Y. Asano , S. Noda et al. // Br. J. Dermatol. — 2015. — Vol. 173, № 3. — P. 681-9.
24. Scleroderma: From Pathogenesis to Comprehensive Management / J. Varga, C.P. Denton, F.M. Wigley, Y. Allanore, M. Kuwana // Springer. — 2016. — 743 p.
25. Shanmugam V.K. Renal disease in scleroderma: an update on evaluation, risk stratification, pathogenesis and management / V.K. Shanmugam, V.D. Steen // Curr. Opin. Rheumatol. — 2012. — Vol. 24, № 6. — P. 669-76.
26. Нейко Є.М. Основні дебютні прояви системної склеродермії / Є.М. Нейко, Р.І. Яцишин // Галицький лікарський вісник. — 2001. — Т. 8, № 2. — С. 45-47.
27. Bellando-Randone S. Very early diagnosis of systemic sclerosis / S. Bellando-Randone, S. Guiducci , M. Matucci-Cerinic // Pol. Arch. Med. Wewn. — 2012. — Vol. 122, № 1. — P. 18-23.
28. Головач И.Ю. Феномен Рейно и дигитальные язвы при системной склеродермии: вопросы патофизиологии и менеджмента на современном этапе / И.Ю. Головач, Т.М. Чипко, Н.Н. Корбут // Украинский ревматологический журнал. — 2017. — № 70(4). — C. 15-23.
29. Early systemic sclerosis: short-term disease evolution and factors predicting the development of new manifestations of organ involvement / V. Gabriele, S. Vettori, G. Cuomo et al. // Arthritis Res. Ther. — 2012. — Vol. 14, № 4. — P. 188.
30. Joint and tendon involvement predict disease progression in systemic sclerosis: a EUSTAR prospective study / J. Avouac, U.A. Walker , E. Hachulla et al. // Ann. Rheum. Dis. — 2016. — Vol. 75, № 1. — P. 103-9.
31. Association of RNA polymerase III antibodies with scleroderma renal crisis / B. Nguyen, S. Assassi, F.C. Arnett, M.D. Mayes // J. Rheumatol. — 2010. — Vol. 37, № 5. — P. 1068.
32. The prognosis of scleroderma renal crisis in RNA- polymerase III antibody-positive compared to RNA-polymerase III antibody-negative patients / B. Lynch, H. Penn, J. Harvey et al. // The Rheumatology. — 2014. — Vol. 53, № 1. — P. 179.
33. Sugimoto T. Is scleroderma renal crisis with anti-centromere antibody-positive limited cutaneous systemic sclerosis overlooked in patients with hypertension and/or renal dysfunction? / T. Sugimoto, M. Sanada, A. Kashiwagi // Nephrology (Carlton). — 2008. — Vol. 13, № 2. — P. 179-80.
34. Bose N. Scleroderma renal crisis / N. Bose, A. Chiesa-Vottero, S. Chatterjee // Semin. Arthritis Rheum. — 2015. — Vol. 44, № 6. — P. 687-94.
35. Corticosteroids and the risk of scleroderma renal crisis: a systematic review / G. Trang, R. Steele, M. Baron, M. Hudson // Rheumatol Int. — 2012. — Vol. 32(3). — Р. 645-653.
36. Steen V.D. Case-control study of corticosteroids and other drugs that either precipitate or protect from the development of scleroderma renal crisis / V.D. Steen, T.A. Medsger // Arthritis Rheum. — 1998. — Vol. 41. — Р. 1613-19.
37. HLA-DRB1*0407 and *1304 are risk factors for scleroderma renal crisis / B. Nguyen, M.D. Mayes, F.C. Arnett et al. // Arthritis Rheum. — 2011. — Vol. 63, № 2. — P. 530-4.
38. Endothelin axis polymorphisms in patients with scleroderma / C. Fonseca, E. Renzoni, P. Sestini et al. // Arthritis Rheum. — 2006. — Vol. 54, № 9. — P. 3034-42.
39. Increased serum soluble CD147 levels in patients with systemic sclerosis: association with scleroderma renal crisis / K. Yanaba, Y. Asano, Y. Tada et al. // Clin. Rheum. — 2012. — Vol. 31, № 5. — Р. 835-839.
40. Towards developing criteria for scleroderma renal crisis: A scoping review / S. Hoa, E.P. Stern, C.P. Denton, M. Hudson // Autoimmun Rev. — 2017. — Vol.16, № 4. — P. 407-415.
41. Denton C.P. Renal manifestations of systemic sclerosis — clinical features and outcome assessment / C.P. Denton // Rheumatology. — 2008. — Vol. 47, № 5. — P. 54-56.
42. Manadan A.M. Thrombotic thrombocytopenic purpura in the setting of systemic sclerosis / A.M. Manadan, C. Harris, J.A. Block // Semin. Arthritis Rheum. — 2005. — Vol. 34, № 4. — P. 683-8.
43. KDIGO. Clinical practice guideline for acute kidney injury (AKI) // Kidney Int. Suppl. — 202. — Vol. 2, № 1. — P. 4.
44. Penn H. Diagnosis, management and prevention of scleroderma renal disease / H. Penn, C.P. Denton // Curr. Opin. Rheumatol. — 2008. — Vol. 20, № 6. — P. 692-6.
45. Pulmonary-renal syndrome in systemic sclerosis / J. Bar, M. Ehrenfeld, J. Rozenman et al. // Semin. Arthritis Rheum. — 2001. — Vol. 30, № 6. — P. 403-10.
46. Angiotensin-converting enzyme gene does not contribute to genetic susceptibility to systemic sclerosis in European Caucasians / J. Wipff, G. Gallier, P. Dieude et al. // J. Rheumatol. — 2009. — Vol. 36, № 2. — P. 337-40.
47. Sachin S.S. Cardio-renal syndrome type 5: epidemiology, pathophysiology and treatment / S.S. Sachin, C. Ronco, R. Pophale // Semin. Nephrol. — 2012. — Vol. 32, № 1. — Р. 49-56.
48. Pulmonary-renal syndrome in systemic sclerosis: a report of three cases and review of the literature / T. Naniwa, S. Banno, Y. Sugiura et al. // Mod. Rheumatol. — 2007. — Vol. 17, № 1. — Р. 37-44.
49. Differentiating scleroderma renal crisis from other causes of thrombotic microangiopathy in a postpartum patient / M. Abudiab, M.L. Krause, M.E. Fidler et al. // Clin. Nephrol. — 2013. — Vol. 80, № 4. — P. 293-297.
50. Lian E.C. Pathogenesis of thrombotic thrombocytopenic purpura: ADAMTS13 deficiency and beyond / E.C. Lian // Semin. Thromb. Hemost. — 2005. — Vol. 31, № 6. — P. 625-32.
51. Scleroderma renal crisis: a pathology perspective / I. Batal, R.T. Domsic, T.A. Medsger, S. Bastacky // Int. J. Rheumatol. — 2010. — P. 543705.
52. EULAR recommendations for the treatment of systemic sclerosis: a report from the EULAR Scleroderma Trials and Research group (EUSTAR) / O. Kowal-Bielecka, R. Landewe, J. Avouac et al. // Ann. Rheum. Dis. — 2009. — Vol. 68, № 5. — P. 620-8.
53. Late recurrence of scleroderma renal crisis in a renal transplant recipient despite angiotensin II blockade / W.Y. Cheung, I.W. Gibson, D. Rush et al. // Am. J. Kidney Dis. — 2005. — Vol. 45, № 5. — P. 930-4.
54. Izzedine H. Endotelin receptor antagonism- based treatment for scleroderma renal crisis / H. Izzedine, P. Rouvier, G. Deray // Am. J. Kidney Dis. — 2013. — Vol. 62(2). — Р. 394-395.
55. Endothelin-1 expression in scleroderma renal crisis / L. Mouthon, M. Mehrenberger, L. Teixeira et al. // Hum. Pathol. — 2011. — Vol. 42, № 1. — P. 95-102.
56. Long-term cyclic intravenous iloprost in systemic sclerosis: clinical experience from a single center / R.S. Casigliani, R.A. Della, P. Pepe et al. // Reumatismo. — 2012. — Vol. 64, № 3. — P. 158-65.
57. Scleroderma renal crisis / L. Mouthon, G. Bussone, A. Berezné et al. // J. Rheumatol. — 2014. — Vol. 41. — P. 1040-1048.
58. Scleroderma renal crisis and renal involvement in systemic sclerosis / T.G. Woodworth, Y.A. Suliman, D.E. Furst, P. Clements // Nat. Rev. Nephrol. — 2016. — Vol. 12. — P. 678-691.
59. Late recurrence of scleroderma renal crisis: poor outcome despite angiotensin II blockade / W.Y. Cheung, I.W. Gibson, D. Rush et al. // Am. J. Kidney Dis. — 2005. — Vol. 45. — Р. 930-934.
60. Complement activation and effect of eculizumab in scleroderma renal crisis / A. Devresse, S. Aydin, M. Le Quintrec et al. // Medicine (Baltimore). — 2016. — Vol. 95, № 30. — P. 4459.
61. Thrombotic thrombocytopenic purpura in a case of scleroderma renal crisis treated with twice-daily therapeutic plasma exchange / E.M. Kfoury, Baz, R.A. Mahfouz, A.F. Masri, G.W. Jamaleddine // Ren. Fail. — 2001. — Vol. 23, № 5. — P. 737-42.
62. Prevention of vascular damage in scleroderma and autoimmune Raynaud’s phenomenon: a multicenter, randomized, double-blind, placebo-controlled trial of the angiotensin-converting enzyme inhibitor quinapril / A.E. Gliddon, C.J. Doré, C.M. Black et al. // Arthritis Rheum. — 2007. — Vol. 56, № 11. — P. 3837-46.
63. End-stage kidney disease due to scleroderma-outcomes in 127 consecutive ANZDATA registry cases / B. Siva, S.P. McDonald, C.M. Hawley et al. // Nephrol. Dial. Transplant. — 2011. — Vol. 26, № 10. — Р. 3165-3171
64. Chu J.K. Renal function recovery in chronic dialysis patients / J.K. Chu, V.W. Folkert // Semin Dial. — 2010. — Vol. 23, № 6. — P. 606-613.
65. N-terminal pro Brain Natriuretic Peptide as predictor of outcome in scleroderma renal crisis / C.B. Chighizola, F. Pregnolato, P.L. Meroni et al. // Clin. Exp. Rheumatol. — 2016. — Vol. 34, № 100. — P. 122-128.

/82-1.jpg)
/84-1.jpg)
/85-1.jpg)
/87-1.jpg)
/89-1.jpg)