Остеопороз (ОП) в Украине, как и во всем мире, представляет одну из важнейших проблем здраво–охранения, поскольку частота его распространения в последние десятилетия значительно увеличивается. Согласно материалам Всемирного конгресса по ОП, это одно из наиболее распространенных заболеваний, которое наряду с сердечно-сосудистой патологией, сахарным диабетом и онкологическими болезнями занимает ведущее место в структуре заболеваемости и смертности населения [29].
ОП — это наиболее частое метаболическое заболевание костной ткани, характеризующееся нарушением ее структуры в виде снижения массы и прочности, что часто служит причиной переломов [75]. Количество пациентов с ОП продолжает расти из-за быстрого старения населения во всем мире [75]. В настоящее время считается, что более 200 миллионов человек во всем мире страдают от этой болезни [8]. Примерно 30 % всех женщин в постменопаузе и 15–30 % мужчин старше 50 лет страдают ОП в Соединенных Штатах Америки [46], в Европе стандартизованная по возрасту частота морфометрического перелома составляет 10,7 и 5,7 на 1000 человеко-лет у женщин и мужчин соответственно [27]. Эти цифры значительно увеличиваются с возрастом как у женщин, так и у мужчин [8].
Несмотря на то, что ОП считают более распространенным заболеванием у женщин, было подсчитано, что до одной трети новых переломов вследствие ОП происходит именно у мужчин [31]. Тем не менее ОП продолжают считать болезнью «с женским лицом», и, как следствие, ОП у мужчин плохо диагностируется, часто остается недооцененным и нелеченным, что существенно повышает риск переломов [26].
Подверженность ОП в первую очередь женщин обусловлена значительным влиянием менопаузы на состояние костной ткани. Кроме того, различия в ремоделировании костной ткани у мужчин и женщин определяются как анатомическими особенностями кости (больше размер кости и общей костной массы у мужчин по сравнению с женщинами), так и меньшими темпами потери костной ткани у мужчин, что обусловливает большую устойчивость периферических костей к переломам [39]. Более того, у мальчиков и юношей по мере взросления формируется более высокая пиковая масса костной ткани, что превышает показатели у женщин на 8–10 % [6]. Следует отметить, что у мужчин по сравнению с женщинами обнаружена также и микроархитектурная разница: более высокие толщина трабекулы и объем кости [22]. Кроме того, костной ткани мужчин присущ периостальный костный прирост, компенсирующий потерю эндостиальной кости, что позволяет сохранять ее прочность почти десятилетия после того, как у женщины уже развивается ОП. Конечно же, с возрастом данные изменения стираются, и после шестого десятилетия риски развития остеопоротических переломов уравновешиваются.
Многочисленные эпидемиологические исследования демонстрируют более низкую частоту переломов шейки бедра и костей предплечья у мужчин по сравнению с женщинами [64]. Вместе с тем известно, что распространенность переломов позвонков у мужчин примерно такая же, как и у женщин [30]. Часто это связывают с тяжелым физическим трудом или c предшествующей травмой, особенно у относительно молодых мужчин [69]. Определенное значение имеет и меньшая продолжительность жизни у мужчин, что также сказывается на более низкой частоте переломов у них, поскольку риск переломов и у мужчин, и у женщин повышается экспоненциально с увеличением возраста. И становится все более очевидным, что с увеличением продолжительности жизни населения земного шара ОП оказывает значительное влияние и на мужчин, имея серьезные последствия. Следует отметить, что быстрое повышение риска переломов у обоих полов наступает примерно в 70 лет [10]. Установлено, что стареющие мужчины теряют костную минеральную плотность со скоростью 1 % в год [25] и каждый пятый мужчина страдает остеопоротическими переломами в течение жизни [40]. Считается, что частота ОП-ассоциированных переломов у мужчин аналогична частоте инфаркта миокарда у них и превосходит частоту карциномы легкого и рака предстательной железы [9]. Тревожным фактом является и то, что после перелома шансы на выживание у мужчин значительно снижаются. Исходы для мужчин-пациентов после перелома бедра выглядят удручающе: одна треть (32 %) умирает в течение первого года после перелома бедра [69], и только 21 % способны самостоятельно жить в обществе через год после перелома, причем 26 % получают уход на дому и 53 % живут в специализированных учреждениях до конца жизни [41]. К сожалению, мужчины с ОП имеют более высокий уровень смертности, чем женщины, и продолжительность иммобилизации после переломов превышает такие сроки у женщин, составляя 120 дней против 60 [35]. Возможно, это связано с тем, что переломы у мужчин происходят на 10 лет позднее, чем у женщин, следовательно, состояние их здоровья на момент перелома значительно хуже и риск развития осложнений значительно выше.
Поскольку мужчины живут все дольше и при этом страдают от нарастающего числа низкоэнергетических переломов, в том числе перелома проксимального отдела бедра, в последнее время большее число рандомизированных клинических исследований по ОП включает мужчин либо фокусируется именно на них. Однако данные о лечении для мужчин, тем более в старшей возрастной группе, весьма ограниченны. Более новые руководства по лечению ОП в настоящее время включают мужчин, но рекомендации по скринингу и лечению крайне мало учитывают гендерную специфику.
Факторы риска и механизмы развития ОП у мужчин
Изучение факторов риска развития остеопоротических переломов показало, что большая их часть, описанная для женщин в постменопаузе, относится и к мужчинам старше 50 лет [35, 37]. К ведущим факторам риска возрастной потери костной массы у мужчин относятся: предшествующие переломы костей после 40 лет, особенно компрессионные переломы позвонков; прием глюкокортикоидов (ГК) более 3 месяцев; возраст старше 65 лет; состояния, ассоциирующиеся с низкой минеральной плотностью костной ткани (МПКТ); отягощенная наследственность по ОП — переломы костей у родителей; злоупотребление алкоголем; низкое количество кальция и витамина D в рационе; недостаток тестостерона длительностью более 5 лет; низкая масса тела (ИМТ < 20 кг/м2); курение; прием аналогов гонадотропин-рилизинг-гормона, применяемых для лечения рака предстательной железы; снижение уровня инсулиноподобного фактора роста 1 [37] (рис. 1).
/7-1.jpg)
Сочетание нескольких факторов риска у одного пациента увеличивает риск ОП и переломов. У лиц, имеющих 3 перечисленных фактора и более, риск переломов повышен в 5 раз по сравнению с теми, у кого они отсутствуют [43].
Учитывая, что особенностью ОП у мужчин является относительно высокая по сравнению с женщинами частота вторичного ОП (30–60 %) [10, 65], хотелось бы остановиться подробнее на некоторых из перечисленных выше причин ОП у мужчин.
Гормональный дисбаланс. Гипогонадизм — это наиболее частая причина вторичного ОП у мужчин. Исследования, проведенные в домах престарелых, продемонстрировали, что среди гериатрических лиц, перенесших перелом бедра, 66 % имели снижение уровня половых гормонов [23]. С возрастом, безусловно, уровень гормонов снижается. Ключевую роль в патогенетических построениях развития ОП у мужчин играет снижение уровня андрогенов [42, 52]. Так, уровень общего тестостерона снижается со скоростью 0,8 % в год, а уровни свободного и связанного тестостерона — 2 % в год. Кроме того, у мужчин с низким индексом массы тела и саркопенией снижается уровень и эстрогенов [76]. Тестостерон является предшественником эстрогена, и хорошо известно, что низкий уровень эстрогена играет большую роль в увеличении резорбции кости [45]. Однако подавляющее большинство (до 80 %) мужских эстрогенов, оказывающих свое влияние на состояние костного метаболизма, образуется из тестостерона вне костной ткани в результате ароматизации в периферических органах и тканях (печень, кожа, жировая ткань) [45]. Таким образом, несмотря на то, что наиболее выраженный остеомоделирующий эффект у мужчин, как и у женщин, имеют эстрогены, у первых они образуются непосредственно из тестостерона, следовательно, для здоровья костной ткани у мужчин более важен нормальный уровень эндогенного тестостерона. Оба гормона, работая как синергисты, важны для мужчин в поддержании МПКТ и обратно связаны с риском перелома у пожилых мужчин, вызванным уменьшением МПКТ [73]. С другой стороны, возрастает уровень глобулинов, связывающих половые гормоны (ГСПГ) [53]. Эти белки, связываясь с тестостероном, снижают количество свободного или биодоступного тестостерона [84]. Помимо изменений уровня половых гормонов, у мужчин с переломами позвонков наблюдается также снижение уровня инсулиноподобного фактора роста 1 [84]. Более того, низкие уровни половых гормонов приводят к атрофии мышц и уменьшению общей мышечной массы [49], а саркопения, как известно, является фактором риска развития ОП.
Побочные эффекты лекарственных препаратов. Прием определенных групп лекарственных препаратов приводит к развитию ОП. Прежде всего это гормональная терапия рака предстательной железы (андрогенная депривация), ассоциирующаяся с повышенным риском переломов [70]. При проведении измерения МПКТ у этих пациентов обнаружена потеря костной массы на 6,5–17,3 % через полгода лечения [70].
В относительно недавних исследованиях выявлено, что противодиабетические препараты, такие как тиазолидиндионы, также вызывают потерю костной ткани, причем в большей степени у мужчин [66]. Эти препараты изменяют структуру кости за счет увеличения пористости, также тиазолидиндионам присуще большее влияние на плотность длинных костей, а не позвонков [7]. Существует несколько исследований, в которых объясняется механизм того, каким образом противодиабетические средства вызывают потерю костной массы: у мужчин глитазоны уменьшают биосинтез андрогенов, увеличивают их связывание с ГСПГ и ослабляют активацию андрогеновых рецепторов, тем самым снижая физиологические действия тестостерона, вызывая относительную и абсолютную недостаточность андрогенов [15].
Несмотря на наличие клинических преимуществ при применении ГК у больных с хроническими воспалительными заболеваниями, длительный прием данных препаратов, особенно пероральный, часто вызывает развитие серьезных неблагоприятных реакций [14, 77]. Одним из осложнений терапии ГК являются потеря костной массы и сопутствующие этому переломы [78]. Длительный прием ГК более 5 мг в день на протяжении более 3 месяцев является одним из ведущих факторов риска развития ОП. Переломы костей скелета имеют различную локализацию, однако наиболее высокий риск отмечался для переломов позвонков, которые, как правило, протекают бессимптомно [77]. Увеличение риска переломов на фоне длительного приема ГК регистрировалось во всех возрастных группах и было одинаковым у мужчин и женщин [34]. Развитие ОП связано с прямым действием ГК на клетки костной ткани: препараты усиливают костную резорбцию и подавляют косте–образование. Кроме того, ГК вызывают повышенную экспрессию лиганда RANKL и макрофагального колониестимулирующего фактора остеобластами и подавляют экспрессию остеопротегерина, что приводит к усилению остеокластогенеза, продолжительности жизни и активности остеокластов и повышению резорбции кости [14].
Также следует отметить ряд препаратов, имеющих резорбтивное действие с эффектами, более выраженными у мужчин, — это противосудорожные препараты [19]: фенитоин, фенобарбитал, карбамазепин; препараты, повышающие уровень пролактина в сыворотке крови; опиоиды [16].
Диагностические мероприятия
После оценки факторов риска развития ОП, выявления болезней и состояний, ассоциированных с этим заболеванием, следующим важным этапом является диагностика ОП у мужчин. Следует опираться на оценку клинических проявлений, анамнестических сведений, а также результатов инструментального и лабораторного обследования. Основные направления диагностического поиска:
— рентгеновская остеоденситометрия (L1–L4 позвоночника, бедра, иногда лучевой кости);
— оценка индивидуального 10-летнего риска переломов (по шкале Fracture risk assessment tool — FRAX);
— рутинное обследование для дифференциальной диагностики;
— выявление низкотравматичного перелома в анамнезе (боковая рентгенография позвоночника, КТ и/или МРТ позвоночника).
Клинический диагноз ОП производится на основе широко распространенных критериев Т-балльной оценки МПКТ, установленных Всемирной организацией здравоохранения (ВОЗ). ВОЗ определила четыре диагностические категории [36]:
— норма: T-критерий больше –1,0 SD от пиковой костной массы;
— остеопения (низкая костная масса): T-крите-рий –1,0–(–)2,5 SD;
— ОП: Т-критерий –2,5 SD или ниже;
— тяжелый или установленный ОП: Т-крите-рий –2,5 SD или ниже, но при наличии одного или нескольких переломов в анамнезе.
Критерии ВОЗ были опубликованы в 1994 году [36] и разработаны для использования у белых женщин в постменопаузе. Разработка новых технологий для измерения МПКТ с обогащением знаний об ОП у мужчин привела к спорам о том, подходят ли критерии ВОЗ для мужчин [32]. Обновленные рекомендации совместной работы ВОЗ и Международного фонда ОП (NOF) [55] нацеливают на использование вышеуказанных диагностических пороговых значений Т-критерия у мужчин в возрасте 50 лет и старше и рекомендуют измерение МПКТ с использованием двухэнергетической рентгеновской абсорбциометрии (DXA) в проксимальном отделе бедренной кости (шейка бедра) в качестве эталонного стандарта для диагностики ОП у мужчин. Канадское общество остеопороза [61] и Европейское эндокринологическое общество по остеопорозу (EES) [81] рекомендуют использовать DXA для диагностики ОП не только в проксимальном отделе бедренной кости, но и в поясничном отделе позвоночника. Также EES рекомендует использовать предплечье (1/3 радиуса) при невозможности интерпретации данных сканирования позвоночника или бедра, а также для мужчин с гиперпаратиреозом или получающих депривационную андрогенную терапию в случае рака предстательной железы.
Показания для проведения оценки МПКТ при первичном обследовании, согласно рекомендациям Международного общества клинической денситометрии, следующие [82]:
— мужчины в возрасте 70 лет и старше;
— мужчины со значительным (2 см или более) снижением роста;
— мужчины моложе 70 лет c клиническими факторами риска переломов;
— мужчины, перенесшие остеопоротические низкоэнергетические переломы;
— мужчины с заболеваниями или состояниями, факторами риска, ассоциирующимися с низкой костной массой или костными потерями;
— мужчины, принимающие медикаментозные препараты, ассоциирующиеся со снижением костной массы или костными потерями;
— мужчины, которым назначена антиостеопоротическая терапия (для оценки эффективности лечения).
Для оценки МПКТ у мужчин моложе 50 лет предпочтительнее использовать Z-критерии, а не Т-критерии. Т-критерий представляет собой количество стандартных отклонений от среднего значения МПКТ здоровых лиц в возрасте 20–30 лет, Z-критерий оценивается в сравнении со средними значениями, нормативными для данного возраста и пола:
— Z-критерий –2,0 SD или менее оценивается как «ниже ожидаемых показателей для возраста», а Z-критерий выше –2,0 SD оценивают как «в пределах ожидаемых показателей для возрастной группы» [71];
— диагноз ОП не может устанавливаться у мужчин моложе 50 лет на основании только данных МПКТ.
Оценка по МПКТ у мужчин в возрасте 50 лет и старше:
— предпочтительнее использовать Т-критерии;
— для диагностики используют денситометрическую классификацию.
При оценке денситометрии позвоночника у мужчин следует учитывать, что значение МПКТ позвоночника часто бывает завышено из-за дегенеративных заболеваний позвоночника, обызвествления его связочного аппарата, кальцификации стенки брюшной аорты, что часто наблюдается у пожилых мужчин [83]. Поэтому в сомнительных случаях более предпочтительной является боковая проекция позвоночника.
Следует подчеркнуть, что только низкая МПКТ не является предиктором перелома у мужчин, при этом в исследовании S.C. Schuit и соавт. (2004) было показано, что только у 21 % пожилых мужчин, которые имели переломы позвонков в анамнезе, и у 39 % мужчин, у которых был перелом бедра, T-критерий был ниже –2,5 SD, у остальных же МПКТ не была оценена как характерная для ОП [67]. Кроме того, 44 % переломов периферических костей у женщин и только 21 % переломов у мужчин были у лиц с показателями МПКТ менее –2,5 SD по Т-критерию [67]. Это указывает на необходимость использовать и другие инструменты, предсказывающие риск перелома независимо от МПКТ или в дополнение к ней.
Использование инструментов оценки риска, которые включают клинически значимые факторы риска для прогнозирования риска перелома, все чаще включается в рекомендации скрининга и лечения ОП. В качестве скрининга наиболее целесообразен алгоритм FRAX.
Именно алгоритм FRAX (http://www.shef.ac.uk/FRAX/index.aspx) был включен во многие национальные и международные руководства по скринингу и лечению ОП во всем мире. FRAX — это компьютеризированный алгоритм, который вычисляет 10-летнюю вероятность перелома шейки бедра и 10-летнюю вероятность крупного остеопоротического перелома с использованием клинических факторов риска с определением (или неопределением) МПКТ бедренной кости. Факторами риска, включенными в FRAX, являются: возраст, пол, вес, рост, предыдущий перелом, перелом бедра у родителей, курение в настоящее время, вторичный ОП, прием ГК, ревматоидный артрит, три или более единицы алкоголя в день и МПКТ шейки бедра, вычисленная с использованием DXA при возможности проведения исследования. Модели FRAX в настоящее время существуют в 53 странах и откалиброваны для отражения эпидемиологии переломов и смертности по странам [33]. С 2016 года такая модель доступна в украиноязычной версии [4].
Модель может быть использована для принятия решения о лечении пациентов, которые отвечают следующим трем условиям:
— мужчины 50 лет и старше;
— пациенты с низкой плотностью костной ткани (остеопения);
— пациенты, не принимающие медикаментозного лечения ОП.
Применение FRAX позволяет начать лечение пациентам на этапе, когда показатели МПКТ находятся в пределах остеопенических значений и в наличии дополнительные факторы риска. Хотя у таких пациентов риск переломов ниже, чем у пациентов с ОП, все же большая доля переломов приходится именно на эту категорию, так как их пропорция в целом в популяции выше, чем у пациентов с ОП [18].
Вероятность перелома более 20 % — показание к началу фармакотерапии. В случае умеренной вероятности перелома (5–10 %) следует принимать во внимание дополнительные факторы, повышающие реальный риск перелома, такие как доза ГК и риск падения. Всегда следует учитывать визуализацию грудного и поясничного отделов позвоночника (рентгенография, КТ, МРТ) для исключения или подтверждения наличия «немых» переломов позвонков. У мужчин до 80 % переломов позвонков происходят без четкого клинического проявления. В то же время предыдущий остеопоротический перелом является наиболее важным фактором риска для последующих переломов, увеличивая вероятность последующего в несколько раз и формируя так называемый остеопоротический каскад. Поэтому, согласно действующим рекомендациям, остеопоротический перелом позвоночника или бедра является абсолютным показанием для начала лечения независимо от наличия других факторов риска ОП [40].
Из-за того, что ОП отражает скорее количественный, чем качественный состав костной ткани, результаты традиционных биохимических исследований у пациентов с неосложненным ОП остаются в целом в пределах нормы. Однако они имеют решающее значение для исключения вторичных причин потери костной массы или патологических переломов, а у мужчин именно вторичный ОП занимает лидирующие позиции по сравнению с первичным [10]. Основные лабораторные тесты для дифференциальной диагностики ОП включают общий анализ крови, определение уровеней общего и ионизированного кальция, креатинина и общего белка, тестостерона (общий, свободный), сывороточной щелочной фосфатазы и витамина D3 (25(OH)D3). На дальнейших этапах диагностической процедуры необходимо обследовать уровень суточной экскреции кальция в моче и паратиреотропного гормона, тиреотропного гормона, антитела к глиадину и тканевой трансглутаминазе для диагностики целиакии, PSA или другие маркеры опухолей, моноклональные белки или провести биопсию костного мозга для исключения миеломы. В табл. 1 представлены наиболее частые причины развития вторичного ОП у мужчин [3, 65].
/10-1.jpg)
В настоящее время существует несколько рекомендаций для скрининга, диагностики и лечения ОП у мужчин [17, 55, 61, 81, 82]. Эти руководства являются частью комплексного подхода, направленного на выявление мужчин, которые должны пройти диагностическую оценку МПКТ с использованием DXA для принятия решения о лечении. Хотя рекомендации по скринингу варьируют в зависимости от организации и страны, большинство опираются на возраст пациентов и идентификацию других клинических факторов риска для выявления высокого риска перелома.
В табл. 2 приведено описание нескольких северо-американских и европейских рекомендаций по скринингу ОП у мужчин.
Резюмируя вышесказанное, следует отметить трудности диагностики ОП у мужчин и отсутствие какого-либо одного одновременно чувствительного и специфического метода диагностики [3]. В большинстве случаев требуется учет совокупности клинических и инструментальных методов. В постановке диагноза нельзя опираться лишь на показатели денситометрии по критериям ВОЗ. При наличии факторов риска диагноз ОП у мужчин устанавливается по Т-критерию –1,5 SD и меньше, а у мужчин моложе 50 лет — по Z-критерию. При наличии ОП лабораторная диагностика показана всем мужчинам в связи с высокой вероятностью вторичного ОП.
Кого лечить?
Ведение мужчин с остеопорозом может представлять еще более сложную задачу, чем ведение женщин. Это обусловлено, в частности, тем, что остеопороз у мужчин считается редкой патологией, и отсутствие настороженности приводит к тому, что многие пациенты остаются без лечения. Кроме того, медикаментозное лечение данной категории больных характеризуется низкой комплайентностью [3].
Рекомендации по лечению ОП у мужчин основаны на результатах скрининга МПКТ и наличии клинических факторов риска для отбора пациентов с высоким риском перелома для проведения фармакологической терапии. В табл. 3 обобщены и проанализированы рекомендации Национальной фундации ОП (NOF), эндокринного общества, Национального общества по изучению ОП и Канадского общества по изучению ОП для лечения ОП у мужчин.
Подытоживая категории мужчин с высоким риском развития переломов костей, следует выделить группы, которым показано проведение противоостеопоротического лечения:
— мужчины 65 лет и старше с Т-критерием менее –2,5 SD (в любой области измерения);
— мужчины 50 лет и старше с низкоэнергетическими переломами периферических костей или с переломами позвонков и Т-критерием менее –1,5 SD;
— мужчины любого возраста с глюкокортикоидным ОП и Т-критерием менее –1,5 SD;
— мужчины любого возраста с клиникой гипогонадизма и Т-критерием менее –1,5 SD;
— мужчины от 40 до 50 лет с предшествующими низкоэнергетическими переломами при низком уровне травмы и значениями Z-критерия ниже –2,0 SD.
Данные показания принципиально совпадают с рекомендациями по лечению постменопаузального остеопороза [2]. Лечению подлежат пациентки с высоким риском переломов: с низкоэнергетическими переломами в анамнезе, низкой костной массой (Т-критерий ≤ –2,5 SD по данным DXA) и с остеопеническим синдромом и высоким риском возникновения остеопоротических переломов (по данным алгоритма FRAX®).
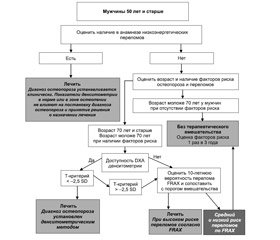
На рис. 2 представлен алгоритм лечения мужчин с ОП и в группах риска.
Чем лечить?
Рекомендации по питанию, физической активности и профилактике падений для мужчин основываются на рекомендациях, разработанных для женщин. Необходимость физических упражнений, безусловно, не вызывает сомнений с учетом ассоциации уменьшенной физической активности с потерей костной массы и переломами у пожилых [62]. Упражнения с нагрузкой массой тела при исключении прыжков и упражнений со сгибанием позвоночника — основа физических упражнений у мужчин с ОП [44]. Кроме того, пациентам следует избегать курения и чрезмерного употребления алкоголя.
Всем мужчинам для профилактики и лечения ОП следует рекомендовать прием кальция в виде препаратов или продуктов питания. Для мужчин до 50 лет потребность в кальции составляет 1000 мг/сут, для мужчин 50 лет и старше потребность в кальции — 1500 мг/сут. Потребность в витамине D для мужчин составляет 800 МЕ/сут. Пожилые люди, находящиеся по состоянию здоровья в закрытых помещениях, и другие группы высокого риска могут иметь более низкие концентрации 25-гидроксивитамина D в сыворотке, и поэтому у них может потребоваться применение более высоких доз витамина D.
В настоящее время фармацевтический рынок предлагает широкий спектр препаратов для лечения ОП, однако для лечения ОП у мужчин FDA одобрило несколько препаратов: терипаратид, деносумаб и бисфосфонаты — алендронат, ризедронат и золедроновую кислоту [38, 68, 75]. Несмотря на то, что доказательная база по этим препаратам именно у мужчин достаточно мала, современные данные не предполагают наличия гендерных различий результатов лечения при аналогичных значениях МПКТ [48].
Препаратами первого выбора лечения ОП у мужчин являются бисфосфонаты (алендронат, ризендронат, золедроновая кислота) и терипаратид. Препарат второго выбора у мужчин с высоким риском переломов — деносумаб [54].
Бисфосфонаты. Бисфосфонаты назначают в качестве препаратов первой линии для предотвращения переломов у мужчин [58]. Во многих исследованиях доказана высокая терапевтическая эффективность алендроната у мужчин с первичным ОП: прирост МПКТ в поясничном отделе позвоночника к концу 3-го года лечения алендронатом составил +8,8 %, в шейке бедра — +4,2 %; отмечено значительное снижение риска переломов позвонков: ОШ 0,44 (95% ДИ 0,23–0,83) [24, 57]. Увеличение МПКТ на фоне лечения алендронатом у мужчин сопоставимо с аналогичным увеличением ее при приеме алендроната у женщин в постменопаузе [12].
Ризедронат также продемонстрировал снижение частоты переломов у мужчин. В ходе исследования отмечено значительное увеличение МПКТ в поясничном отделе позвоночника по сравнению с плацебо: на 4,5 % (95% ДИ 3,5–5,6; р < 0,001). Кроме того, терапия ризедронатом в течение 4 лет у мужчин с ОП была столь же эффективной и безопасной, как и у женщин с постменопаузальным ОП в течение того же периода [63].
Золедроновая кислота способствует приросту МПКТ в поясничном отделе позвоночника. Так, в исследовании K.W. Lyles и соавт. (2007) среднее увеличение МПКТ по сравнению с исходным составило 4,5 % (95% ДИ 3,5–5,6, р < 0,001), при этом в шейке бедренной кости значительного увеличения МПКТ не отмечено [47]. По результатам исследования HORIZON, золедроновая кислота, назначенная после перелома проксимального отдела бедра у мужчин, снижает частоту всех новых клинических переломов и риск летальных исходов, а увеличение МПКТ у мужчин статистически аналогично таковому у женщин с недавним переломом бедренной кости [11, 13].
Интересны результаты исследования, проведенного E.S. Orwoll и соавт. (2010), в котором осуществлен сравнительный анализ эффективности золедроновой кислоты и алендроната у мужчин с низкой МПКТ [60]. На протяжении 24 месяцев в обеих группах наблюдалось одинаковое увеличение МПКТ, а изменения биохимических маркеров костного метаболизма были более значимыми для золедроновой кислоты в ранние сроки после внутривенного введения, но сопоставимыми по значению в обеих группах при оценке через 12 и 24 месяца.
С учетом более ограниченного клинического опыта применения бисфосфонатов у мужчин по сравнению с женщинами в постменопаузе безопасность их применения у мужчин следует рассматривать на основании доказанной безопасности у женщин. Наиболее частыми осложнениями их приема являются редкое возникновение остеонекроза челюсти и атипичный перелом бедренной кости.
Терипаратид является единственным анаболическим агентом, который одобрен FDA для лечения тяжелого или ГК-индуцированного ОП у мужчин [5], а также для мужчин, страдающих первичным или гипогонадизм-ассоциированным ОП с высоким риском развития переломов костей. Было доказано, что терипаратид значительно снижает частоту переломов позвонков [38], увеличивает МПКТ в позвоночнике на 5,9 % у пациентов, которые получали 20 мкг/сут, и на 9,0 % у больных, которым вводили 40 мкг/сут терипаратида, а МПКТ бедренной кости увеличилась на 1,5 и 2,9 % соответственно [56]. В исследовании у пациентов, получавших терипаратид, наблюдалось дозозависимое увеличение маркеров костеобразования, уменьшение костной резорбции [56]. Были проведены исследования, в которых у мужчин с ОП сравнивали эффекты монотерапии терипаратидом, монотерапии алендронатом и комбинированной терапии алендронатом и терипаратидом. Установили, что монотерапия терипаратидом является наиболее эффективной, если судить по изменениям МПКТ и биохимическим маркерам, а также то, что одновременное использование бисфосфонатов проявляется прямым анаболическим действием терипаратида на кости [20, 21]. Таким образом, терипаратид — единственный доступный остеоанаболический агент для лечения тяжелого ОП у мужчин. Утвержденный FDA режим лечения терипаратидом составляет 20 мкг ежедневно в течение 24 месяцев из-за возможного развития побочных эффектов при более длительном приеме [28], после чего пациента необходимо перевести на антирезорбтивный препарат.
Деносумаб является первым биологическим агентом для лечения остеопороза с уникальным механизмом действия. Открытие сигнальной системы, состоящей из рецептора активатора ядерного фактора kВ (RANK), его лиганда (RANKL) и остеопротегерина (OPG), являющейся основным регулятором процессов дифференцировки, функционирования и апоптоза остеокластов, совершило прорыв в понимании патофизиологии ОП. Деносумаб является моноклональным антителом с высокой степенью аффинности к лиганду рецептора активатора ядерного фактора kB (RANKL). Он связывает RANKL и предотвращает его взаимодействие с соответствующим рецептором, полностью имитируя тем самым физиологическую функцию OPG, останавливая костную резорбцию путем подавления дифференцировки, функции и выживаемости остеокластов [1].
Было показано, что деносумаб, недавно одобренный FDA для лечения ОП у мужчин, значительно увеличивает МПКТ в поясничном отделе позвоночника, бедренной кости, шейке бедренной кости, вертеле у мужчин с низкой плотностью костной ткани по истечении 2 лет лечения [59, 72]. У мужчин, получавших терапию андрогенной депривации по поводу рака предстательной железы, деносумаб уменьшал частоту новых переломов позвонков [74]. Исследования по применению деносумаба у мужчин не выявили никаких гендерно-специфических осложнений, возможны редкие, но серьезные побочные эффекты, которые включают в себя потенциально тяжелые реакции гиперчувствительности, гипокальциемию, остеонекроз челюсти и атипичный перелом бедренной кости.
Роль тестостерона в терапии ОП. Мужчины с гипогонадизмом имеют комбинированный дефицит эстрогенов и андрогенов. Гипогонадизм в подростковом возрасте препятствует приобретению оптимальной пиковой массы костной ткани, при лечении тестостероном наблюдается обратимость дефицита костной массы у молодых мужчин, страдающих гипогонадизмом, однако ограничение лечения обусловлено ранним закрытием эпифизарных хрящей на фоне терапии.
Гипогонадизм у взрослых мужчин вызывает состояние повышенной потери костной массы и повышенного риска переломов. Как правило, к ним относятся мужчины, получающие андрогенную депривационную терапию (хирургическая кастрация или прием аналогов гонадотропин-рилизинг-гормона) при раке предстательной железы [51]. У пожилых мужчин потеря костной массы и риск перелома более связаны с относительным дефицитом эстрогенов, чем с возрастным снижением уровня андрогенов [50, 52].
Тестостерон не одобрен FDA для лечения ОП, но может быть рекомендован мужчинам с симптомами гипогонадизма при отсутствии противопоказаний [80]. В исследованиях не показано снижение риска переломов при лечении тестостероном, и не было исследований, в которых показанием для назначения тестостерона была бы низкая МПКТ [80], не проводилась оценка долгосрочных эффектов заместительной терапии тестостероном на кости у молодых мужчин с гипогонадизмом, однако существуют единичные данные наблюдений, свидетельствующие о положительном эффекте тестостерона на МПКТ [79]. Тем не менее влияние лечения на риск переломов неизвестно, и соотношение риска и пользы при длительном лечении у пожилых мужчин не было установлено. Терапию тестостероном у пожилых людей следует рассматривать только в том случае, если уровень тестостерона в сыворотке крови, измеренный утром, оказался достоверно низким и в наличии явные симптомы гипогонадизма, ОП же не является показанием для его применения [23].
В табл. 4 обобщены данные о препаратах, одобренных FDA для лечения ОП у мужчин.
Важность проблемы диагностики ОП у мужчин по-прежнему недооценивается и подвергается недостаточному вниманию [3]. Эта проблема в последние годы становится все актуальнее в связи со старением населения и теми осложнениями, которые характерны для этого заболевания. Как правило, врачи обращают больше внимания на диагностику ОП у женщин, однако у мужчин пожилого и старческого возраста эта проблема также возникает достаточно часто, о чем должен помнить врач общей практики. Остеопоротические переломы у мужчин приводят к увеличению заболеваемости неинфекционными болезнями, росту коморбидности и смертности среди мужского населения. В настоящее время имеется больше информации о диагностике и лечении вторичного ОП у мужчин, чем первичного [65]. Для усовершенствования диагностики и лечения многие общества по борьбе с ОП предлагают клинические рекомендации для скрининга и лечения ОП у мужчин.
Абсолютные инструменты оценки риска, такие как FRAX, могут играть важную роль в выявлении мужчин с риском перелома при нормальном или немного сниженном показателе МПКТ, хотя необходимы дополнительные исследования для разработки и проверки этих инструментов в мужских популяциях. Утвержденные фармакологические методы лечения показали снижение частоты переломов позвонков у мужчин и увеличение МПКТ, но доказательная база в отношении эффективности этих методов лечения слишком мала, чтобы составлять отдельные рекомендации по ОП у мужчин. Необходимы дополнительные исследования для устранения этого пробела и изучения сравнительной эффективности различных методов лечения ОП. Своевременные диагностика и профилактика этого заболевания могут способствовать раннему его выявлению, позволят начать адекватную терапию и уменьшить число переломов у таких больных. Препаратами выбора являются бисфосфонаты и терипаратид, а также деносумаб; последний препарат особо показан для мужчин, получающих антиандрогенную терапию при раке предстательной железы. Важно подчеркнуть, что выбор терапевтического агента должен быть индивидуальным и учитывать такие факторы, как наличие переломов в анамнезе, тяжесть ОП (по Т-критерию), риск переломов бедра, паттерн минеральной плотности кортикальных и губчатых костей, сопутствующие заболевания (например, язвенная болезнь, гастроэзофагеальная рефлюксная болезнь, синдром мальабсорбции, злокачественные новообразования и т.д.), стоимость и другие факторы. Следует также не забывать о важности немедикаментозных методов лечения ОП, таких как отказ от вредных привычек, правильное питание, богатое кальцием, и выполнение физических упражнений, направленных на снижение риска падений и переломов.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов, при этом авторы не получали от отдельных лиц и организаций финансовой поддержки исследования, гонораров и других форм вознаграждений.
Информация о вкладе каждого автора: Головач И.Ю. — концепция и дизайн исследования, обзор литературы по проблеме, написание текста; Егудина Е.Д. — обзор литературы по проблеме, написание текста, подготовка статьи к печати.
Список литературы
1. Головач И.Ю. Новая цель таргетной терапии остеопороза — ингибитор RANKL деносумаб // Укр. ревматол. журнал. — 2013. — 51(1). — С. 12-20.
2. Головач И.Ю. Современная стратегия диагностики и долговременного лечения постменопаузального остео-пороза // Укр. ревматол. журнал. — 2018. — 72(2). — С. 9-16.
3. Лесняк О.М. Остеопороз у мужчин — проблема, недооцененная клинической медициной // Эффективная фармакотерапия. — 2016. — 17. — С. 28-32.
4. Поворознюк В.В., Григор’єва Н.В., Kanis J.A., McCloskey E.V., Johansson H. Українська версія FRAX: від створення до валідизації // Боль. Суставы. Позвоночник. — 2016. — 3(23). — С. 6-14.
5. Adler R.A. Osteoporosis in men: recent progress // Endocrine. — 2013. — 44(1). — С. 40-46. DOI: 10.1007/s12020-013-9880-7.
6. Amin S., Khosla S. Sex- and age-related differences in bone microarchitecture in men relative to women assessed by high-resolution peripheral quantitative computed tomo–graphy // J. Osteoporos. — 2012. — 2012. — 129760. DOI: 10.1155/2012/129760.
7. Aubert R.E., Herrera V., Chen W., Haffner S.M., Pendergrass M. Rosiglitazone and pioglitazone increase fracture risk in women and men with type 2 diabetes // Diabetes Obes. Metab. — 2010. — 12(8). — Р. 716-721. doi: 10.1111/j.1463-1326.2010.01225.x.
8. Ballane G., Cauley J.A., Luckey M.M., El-Hajj Fuleihan G. Worldwide prevalence and incidence of osteoporotic vertebral Fractures // Osteoporos Int. — 2017. — 28(5). — Р. 1531-1542. DOI: 10.1007/s00198-017-3909-3
9. Binkley N. A perspective on male оsteoporosis // Best Pract. Res. Clin. Rheumatol. — 2009. — 23(6). — Р. 755–768. doi: 10.1016/j.berh.2009.10.001.
10. Binkley N. Osteoporosis in men // Arq. Bras. Endocrinol. Metabol. — 2006. — 50(4). — Р. 764-774.
11. Boonen S., Orwoll E., Magaziner J. et al. Once-yearly zoledronic acid in older men compared with women with recent hip fracture // J. Am. Geriatr. Soc. — 2011. — 59. — 2084e90. DOI: 10.1111/j.1532-5415.2011.03666.x.
12. Boonen S., Orwoll E.S., Wenderoth D., Stoner K.J., Eusebio R., Delmas P.D. Once-weekly risedronate in men with osteoporosis: results of a 2-year, placebocontrolled, double-blind, multicenter study // J. Bone Miner. Res. — 2009. — 24. — 719e25. DOI: 10.1359/jbmr.081214.
13. Boonen S., Reginster J.Y., Kaufman J.M. et al. Fracture risk and zoledronic acid therapy in men with osteoporosis // N. Engl. J. Med. — 2012. — 367. — 1714e23. DOI: 10.1056/NEJMoa1204061.
14. Canalis E. Mechanisms of glucocorticoid-induced osteoporosis // Curr. Opin. Rheumatol. — 2003. — 15(4). — Р. 454-7. PMID: 12819474.
15. Carruthers M., Trinick T.R., Jankowska E., Traish A.M. Are the adverse effects of glitazones linked to induced testoste-rone deficiency? // Cardiovasc. Diabetol. — 2008. — 7. — Р. 30. doi: 10.1186/1475-2840-7-30.
16. Coluzzi F., Pergolizzi J., Raffa R.B., Mattia C. The unsolved case of “bone-impairing analgesics”: the endocrine effects of opioids on bone metabolism // Ther. Clin. Risk Manag. — 2015. — 11. — Р. 515-523. doi: 10.2147/TCRM.S79409.
17. Compston J., Bowring C., Cooper A. et al. National Osteoporosis Guideline Group Diagnosis and management of osteoporosis in postmenopausal women and older men in the UK: National Osteoporosis Guideline Group (NOGG) update 2013 // Maturitas. — 2013. — 75(4). — Р. 392-396. doi: 10.1016/j.maturitas.2013.05.013.
18. Davey D.A. Osteoporosis, osteopenia and fracture risk: Widening the therapeutic horizons // S. Afr. Med. J. — 2012. — 102(5). — Р. 285-288.
19. Farhat G., Yamout B., Mikati M.A., Demirjian S., Sawaya R., El-Hajj Fuleihan G. Effect of antiepileptic drugs on bone density in ambulatory patients // Neurology. — 2002. — 58(9). — Р. 1348-1353.
20. Finkelstein J.S., Hayes A., Hunzelman J.L., Wyland J.J., Lee H., Neer R.M. The effects of parathyroid hormone, alendronate, or both in men with osteoporosis // N. Engl. J. Med. — 2003. — 349. — 1216e26. DOI: 10.1056/NEJMoa035725.
21. Finkelstein J.S., Leder B.Z., Burnett S.M. et al. Effect of teriparatide, alendronate, or both on bone turnover in osteoporotic men // J. Clin. Endocrinol. Metab. — 2006. — 91. — 2882e7. DOI: 10.1210/jc.2006-0190.
22. Gennari L., Bilezikian J.P. Osteoporosis in men: pathophysiology and treatment // Curr. Rheumatol. Rep. — 2007. — 9(1). — Р. 71-77.
23. Golds G., Houdek D., Arnason T. Male Hypogona-dism and Osteoporosis: The Effects, Clinical Consequences, and Treatment of Testosterone Deficiency in Bone Health // Int. J. Endocrinol. — 2017. — 2017. — 4602129. doi: 10.1155/2017/4602129.
24. Gonnelli S., Cepollaro C., Montagnani A. et al. Alendronate treatment in men with primary osteoporosis: a three-year // Calcif. Tissue Int. — 2003. — 73(2). — Р. 133-139. DOI: 10.1007/s00223-002-1085-7.
25. Hannan M.T., Felson D.T., Dawson-Hughes B. et al. Risk factors for longitudinal bone loss in elderly men and women: the Framingham Osteoporosis Study // J. Bone Mi-ner. Res. — 2000. — 15(4). — Р. 710-720. DOI: 10.1359/jbmr.2000.15.4.710.
26. Harvey N., Dennison E., Cooper C. Osteoporosis: impact on health and economics // Rev. Rheumatol. — 2010. — 6. — 99e105. DOI: 10.1007/s11657-014-0182-3.
27. Hernlund E., Svedbom A., Ivergård M. et al. Osteoporosis in the European Union: medical management, epidemio-logy and economic burden. A report prepared in collaboration with the International Osteoporosis Foundation (IOF) and the European Federation of Pharmaceutical Industry Associations (EFPIA) // Arch. Osteoporos. — 2013. — 8(1–2). — Р. 136. doi: 10.1007/s11657-013-0136-1.
28. Herrera A., Lobo-Escolar A., Mateo J., Gil J., Ibarz E., Gracia L. Male osteoporosis: a review // World J. Orthop. — 2012. — 3(12). — Р. 223-234. doi: 10.5312/wjo.v3.i12.223.
29. IOF World Congress on Osteoporosis and 10th European Congress of Clinical and Economic aspects of Osteoporosis and Osteoarthritis // Osteoporosis Int. — 2010. — 21(5). — Р. 1-6. doi: 10.1007/s00198-010-1244-z.
30. Jackson S.A., Tenenhouse A., Robertson L., the CaMos Study Group. Vertebral Fracture Definition from Population. Based Data: Preliminary Results from the Canadian Multicenter Osteoporosis Study (CaMos) // Osteoporos. Int. — 2000. — 11. — Р. 680-687. DOI: 10.1007/s001980070066.
31. Johnell O., Kanis J.A. An estimate of the worldwide pre-valence and disability associated with osteoporotic fractures // Osteoporos Int. — 2006. — 17. — 1726e33. — DOI: 10.1007/s00198-006-0172-4.
32. Kanis J.A., Bianchi G., Bilezikian J.P. et al. Towards a diagnostic and therapeutic consensus in male osteoporosis // Osteoporos Int. — 2011. — 22(11). — Р. 2789-2798. doi: 10.1007/s00198-011-1632-z.
33. Kanis J.A., Johansson H., Oden A., Cooper C., McCloskey E.V. Epidemiology and Quality of Life Working Group of IOF. Worldwide uptake of FRAX // Arch. Osteoporos. — 2014. — 9. — Р. 166. DOI: 10.1007/s11657-013-0166-8.
34. Kanis J.A., Johansson H., Oden A. et al. A meta-analysis of prior corticosteroid use and fracture risk // J. Bone Miner. Res. — 2004 Jun. — 19(6). — Р. 893-9. doi: 10.1359/jbmr.040134.
35. Kanis J.A., Johnell O., Oden A., De Laet C., Mellstrom D. Epidemiology of osteoporosis and fracture in men // Calcif. Tissue Int. — 2004. — 75(2). — Р. 90-9. DOI: 10.1007/s00223-004-0287-6.
36. Kanis J.A., Melton L.J., Christiansen C., Johnston C.C., Khaltaev N. The diagnosis of osteoporosis // J. Bone Miner. Res. — 1994. — 9(8). — Р. 1137-1141.
37. Kanis J.A., Oden A., Johnell O. et al. The use of clinical risk factors 2007 enhances the performance of BMD in the prediction of hip and osteoporotic fractures in men and wo–men // Osteoporos Int. — 2007. — 18(8). — Р. 1033-1046. DOI: 10.1007/s00198-007-0343-y.
38. Kaufman J.M., Orwoll E., Goemaere S. et al. Teriparatide effects on vertebral fractures and bone mineral density in men with osteoporosis: treatment and discontinuation of therapy // Osteoporos. Int. — 2005. — 16(5). — Р. 510-516. DOI: 10.1007/s00198-004-1713-3.
39. Khan A.A., Hodsman A.B., Papaioannou A., Kendler D., Brown J.P., Olszynski W.P. Management of osteoporosis in men: an update and case example // CMAJ. — 2007. — 176(3). — Р. 345-348. doi: 10.1503/cmaj.050816.
40. Khosla S. Update in male osteoporosis // J. Clin. Endocrinol. Metab. — 2010. — 95(1). — Р. 3-10. doi: 10.1210/jc.2009-1740.
41. Lambert J.K., Zaidi M., Mechanick J.I. Male osteoporosis: epidemiology and the pathogenesis of aging bones // Curr. Osteoporos. Rep. — 2011. — 9(4). — Р. 229-36. doi: 10.1007/s11914-011-0066-z.
42. Leder B.Z., LeBlanc K.M., Schoenfeld D.A., Eastell R., Finkelstein J.S. Differential effects of androgens and estrogens on bone turnover in normal men // J. Clin. Endocrinol. Metab. — 2003. — 88(1). — Р. 204-210. DOI: 10.1210/jc.2002-021036.
43. Lewis C.E., Ewing S.K., Taylor B.C. et al. Predictors of non-spine fractures in elderly men: the MrOS study // J. Bone Miner. Res. — 2007. — 22(2). — Р. 211-219. DOI: 10.1359/jbmr.061017.
44. Lirani-Galvão A.P., Lazaretti-Castro M. Physical approach for prevention and treatment of osteoporosis // Arq. Bras. Endocrinol. Metabol. — 2010 Mar. — 54(2). — Р. 171-8.
45. Litman H.J., Bhasin S., Link C.L., Araujo A.B., McKinlay J.B. Serum androgen levels in black, Hispanic, and white men // J. Clin. Endocrinol. Metab. — 2006. — 91(11). — Р. 4326-4334. DOI: 10.1210/jc.2006-0037.
46. Looker A.C., Sarafrazi I.N., Fan B., Shepherd J.A. Trends in osteoporosis and low bone mass in older US adults, 2005–2006 through 2013–2014 // Osteoporos. Int. — 2017 Jun. — 28(6). — Р. 1979-1988. doi: 10.1007/s00198-017-3996-1.
47. Lyles K.W., Colon-Emeric C.S., Magaziner J.S. et al. Zoledronic acid and clinical fractures and mortality after hip fracture // N. Engl. J. Med. — 2007. — 357. — 1799e809. DOI: 10.1056/NEJMoa074941.
48. MacLean C., Newberry S., Maglione M. et al. Systema-tic review: comparative effectiveness of treatments to prevent fractures in men and women with low bone density or osteoporosis // Ann. Intern. Med. — 2008. — 148(3). — Р. 197-213.
49. Meier C., Nguyen T.V., Handelsman D.J. et al. Endogenous Sex Hormones and Incident Fracture Risk in Older Men. The Dubbo Osteoporosis Epidemiology Study // Arch. Intern. Med. — 2008. — 168. — Р. 47-54. doi: 10.1001/archinternmed.2007.2.
50. Mellstrom D., Vandenput L., Mallmim H. et al. Older men with low serum estradiol and high serum SHBG have an increased risk of fractures // J. Bone Miner. Res. — 2008. — 23. — 1552e60. DOI: 10.1359/jbmr.080518.
51. Mittan D., Lee S., Miller E., Perez R.C., Basler J.W., Bruder J.M. Bone loss following hypogonadism in men with prostate cancer treated with GnRH analogs // J. Clin. Endocrinol. Metab. — 2002. — 87. — 3656e66. DOI: 10.1210/jcem.87.8.8782.
52. Mohr B.A., Guay A.T., O’Donnell A.B., McKinlay J.B. Normal, bound and nonbound testosterone levels in normally ageing men: results from the Massachusetts Male Ageing Study // Clin. Endocrinol. (Oxf.) — 2005. — 62(1). — Р. 64-73. DOI: 10.1111/j.1365-2265.2004.02174.x.
53. Muller M., den Tonkelaar I., Thijssen J.H., Grobbee D.E., van der Schouw Y.T. Endogenous sex hormones in men aged 40–80 years // Eur. J. Endocrinol. — 2003. — 149(6). — Р. 583-589.
54. Murad M.H., Drake M.T., Mullan R.J. et al. Clinical review. Comparative effectiveness of drug treatments to prevent fragility fractures: a systematic review and network meta-analysis // J. Clin. Endocrinol. Metab. — 2012. — 97(6). — Р. 1871-1880. doi: 10.1210/jc.2011-3060.
55. National Osteoporosis Foundation. Clinician’s Guide to Prevention and Treatment of Osteoporosis.Washington, DC: National Osteoporosis Foundation; 2014. — Available from: http://nof.org/hcp/clinicians-guide. — Accessed: April 11, 2014.
56. Niimi R., Kono T., Nishihara A. et al. Analysis of daily teriparatide treatment for osteoporosis in men // Osteoporos. Int. — 2015. — 26(4). — Р. 1303-9. doi: 10.1007/s00198-014-3001-1.
57. Olszynski W.P., Davison K.S., Ioannidis G. et al. Effectiveness of alendronate and etidronate in the treatment of osteoporosis in men: a prospective observational study // Osteoporos. Int. — 2006. — 17(2). — Р. 217-224. DOI: 10.1007/s00198-005-1965-6.
58. Orwoll E., Ettinger M., Weiss S. et al. Alendronate for the treatment of osteoporosis in men // N. Engl. J. Med. — 2000. — 343(9). — Р. 604-610. DOI: 10.1056/NEJM200008313430902.
59. Orwoll E., Teglbjærg C.S., Langdahl B.L. et al. A randomized, placebo-controlled study of the effects of denosumab for the treatment of men with low bone mineral density // J. Clin. Endocrinol. Metab. — 2012 Sep. — 97(9). — Р. 3161-9. doi: 10.1210/jc.2012-1569.
60. Orwoll E.S., Miller P.D., Adachi J.D. et al. Efficacy and safety of a once-yearly i.v. infusion of zoledronic acid 5 mg versus a once-weekly 70-mg oral alendronate in the treatment of male osteoporosis: a randomized, multicenter, double-blind, active-controlled study // J. Bone Miner. Res. — 2010. — 25. — 2239e50. DOI: 10.1002/jbmr.119.
61. Papaioannou A., Morin S., Cheung A.M. et al. Scientific Advisory Council of Osteoporosis Canada. 2010 clinical practice guidelines for the diagnosis and management of osteoporosis in Canada: summary // CMAJ. — 2010. — 182(17). — Р. 1864-73. doi: 10.1503/cmaj.100771.
62. Pasco J.A., Henry M.J., Korn S., Nicholson G.C., Kotowicz M.A. Morphometric vertebral fractures of the lower thoracic and lumbar spine, physical function and quality of life in men // Osteopor. Int. — 2009. — 20. — 787e92. doi: 10.1007/s00198-008-0744-6.
63. Reginster J., Minne H.W., Sorensen O.H. et al. Vertebral Efficacy with Risedronate Therapy (VERT) Study Group Randomized trial of the effects of risedronate on vertebral fractures in women with established postmenopausal osteoporosis // Osteoporos Int. — 2000. — 11. — Р. 83-91.
64. Rochira V., Balestrieri A., Madeo B., Zirilli L., Granata A.R., Carani C. Osteoporosis and male age-related hypogonadism: role of sex steroids on bone (patho)physiology // Eur. J. Endocrinol. — 2006. — 154(2). — Р. 175-85.
65. Romagnoli E., Del Fiacco R., Russo S. et al. Secondary osteoporosis in men and women: clinical challenge of an unresolved issue // J. Rheumatol. — 2011 Aug. — 38(8). — Р. 1671-9. doi: 10.3899/jrheum.110030.
66. Sardone L.D., Renlund R., Willett T.L., Fantus I.G., Grynpas M.D. Effect of rosiglitazone on bone quality in a rat model of insulin resistance and osteoporosis // Diabetes. — 2011. — 60(12). — Р. 3271-3278. doi: 10.2337/db10-1672.
67. Schuit S.C., van der Klift M., Weel A.E. et al. Fracture incidence and association with bone mineral density in elderly men and women: the Rotterdam Study // Bone. — 2004. — 34(1). — Р. 195-202.
68. Schwarz P., Jorgensen N.R., Mosekilde L., Vestergaard P. The evidence for efficacy of osteoporosis treatment in men with primary osteoporosis: a systematic review and meta-analysis of antiresorptive and anabolic treatment in men // J. Osteoporos. — 2011. — 2011. — 259818. Doi: 10.4061/2011/259818.
69. Seeman E., Bianchi G., Khosla S., Kanis J.A., Orwoll E. Bone fragility in men — where are we // Osteoporos Int. 2006. — 17(11). — Р. 1577–1583.
70. Shahinian V.B., Kuo Y.F., Freeman J.L., Goodwin J.S. Risk of fracture after androgen deprivation for prostate cancer // N. Engl. J. Med. — 2005. — 352(2). — Р. 154-164. DOI: 10.1056/NEJMoa041943.
71. Sheu A., Diamond T. Bone mineral density: testing for osteoporosis // Aust. Prescr. — 2016. — 39(2). — Р. 35-39. doi: 10.18773/austprescr.2016.020.
72. Silverman S., Agodoa I., Kruse M., Parthan A., Orwoll E.Denosumab for Elderly Men with Osteoporosis: A Cost-Effectiveness Analysis from the US Payer Perspective // J. Osteoporos. — 2015. — Article ID: 627631. doi: 10.1155/2015/627631
73. Sinnesael M., Boonen S., Claessens F., Gielen E., Vanderschueren D. Testosterone and the male skeleton: a dual mode of action // J. Osteoporos. — 2011;. — 2011. — 240328. Doi: 10.4061/2011/240328.
74. Smith M.R., Egerdie B., Hernandez Toriz N. et al. Denosumab in men receiving androgen-deprivation therapy for prostate cancer // N. Engl. J. Med. — 2009. — 361. — 745e55. DOI: 10.1056/ NEJMoa0809003.
75. Sözen T., Özışık L., Çalık Başaran N. An overview and management of osteoporosis // Eur. J. Rheumatol. — 2017. — 4(1). — Р. 46-56. doi: 10.5152/eurjrheum.2016.048.
76. Van Pottelbergh I., Goemaere S., Zmierczak H., Kaufman J.M. Perturbed sex steroid status in men with idiopathic osteoporosis and their sons // J. Clin. Endocrinol. Metab. — 2004. — 89(10). — Р. 4949-4953. DOI: 10.1210/jc.2003-032081.
77. Van Staa T.P., Leufkens H.G., Abenhaim L. et al. Use of oral corticosteroids and risk of fractures // J. Bone Miner. Res. — 2000 Jun. — 15(6). — Р. 993-1000. doi: 10.1359/jbmr.2000.15.6.993.
78. Van Staa T.P., Leufkens H.G., Cooper C. The epidemiology of corticosteroid-induced osteoporosis: a meta-analysis // Osteoporos. Int. — 2002. — 13(10). — Р. 777-87. doi: 10.1007/s001980200108.
79. Vanderschueren D., Vandenput L., Boonen S., Lindberg M.K., Bouillon R., Ohlsson C. Androgens and bone // Endocr. Rev. — 2004. — 25. — 389e425. DOI: 10.1210/er.2003-0003.
80. Wald M., Meacham R.B., Ross L.S., Niederberger C.S. Testosterone replacement therapy for older men // J. Androl. — 2006. — 27(2). — Р. 126-32.
81. Watts N.B., Adler R.A., Bilezikian J.P. et al. Endocrine Society Osteoporosis in men: an Endocrine Society clinical practice guideline // J. Clin. Endocrinol. Metab. — 2012. — 97(6). — Р. 1802-1822. doi: 10.1016/j.jocd.2013.08.001.
82. Watts N.B., Leslie W.D., Foldes A.J., Miller P.D. 2013 International Society for Clinical Densitometry Position Development Conference: Task Force on Normative Databases // J. Clin. Densitom. — 2013. — 16(4). — Р. 472-481.
83. Willson T., Nelson S.D., Newbold J., Nelson R., LaFleur J. The clinical epidemiology of male osteoporosis: a review of the recent literature // Clin. Epidemiol. — 2015. — 7. — Р. 65-76. doi: 10.2147/CLEP.S40966.
84. Yeap B.B. Testosterone and ill-health in aging men // Nat. Clin. Pract. Endocrinol. Metab. — 2009. — 5(2). — Р. 113-121. doi: 10.1038/ncpendmet1050.

/7-1.jpg)
/10-1.jpg)
/11-1.jpg)
/11-2.jpg)
/12-1.jpg)
/14-1.jpg)