Боль и удовольствие — две гигантские движущие силы, определяющие поведение человека. Боль является субъективным ответом на ноцицептивную информацию, пришедшую в мозг, и может абсолютно не соответствовать параметрам интенсивности и продолжительности повреждающего воздействия. Ощущение боли может зависеть от ряда эмоциональных и когнитивных факторов, включая тревогу, ожидание (предчувствие) боли, опыт прошлых переживаний.
Для выбора правильной тактики при лечении болевых синдромов, как правило сопряженных с нарушением качества жизни, с тревожными, депрессивными расстройствами, нарушением сна, необходимо понимание тонких патогенетических механизмов боли.
Деление боли по механизмам возникновения на ноцицептивную, вызванную повреждением тканей и, как следствие, воспалительной реакцией в них, раздражающей ноцицепторы, и нейропатическую (НБ), обусловленную вовлечением в патологический процесс структур чувствительного анализатора на любом протяжении, — весьма условное и искусственное. Длительная и мощная болевая импульсация в результате повреждения тканей (например, воспалительный процесс в суставах или неспецифическая боль в спине при повреждении межпозвоночных суставов, мышц, дисков, связочного аппарата) рано или поздно вовлекает структуры нервной системы, приводя к гиперактивности заднего рога, лимбических структур, снижению плотности серого вещества дорсолатеральной префронтальной коры, т.е. возникают проявления так называемой нейропатической боли. И в этой ситуации к противовоспалительной терапии и миорелаксантам должны быть добавлены препараты, восстанавливающие чрезмерную активность чувствительных структур нервной системы, влияющие на периферическую и центральную сенситизацию. С другой стороны, первичное повреждение периферических нервов, приводящее к центральной сенситизации в виде гиперактивности заднего рога, сопряжено с воспалительными реакциями в микроглии заднего рога. Воспаление, как результат неврального повреждения, индуцирует активацию макрофагов в нервном волокне и спинальном ганглии, синтез провоспалительных цитокинов, таких как фактор некроза опухоли α. Активированная микроглия также высвобождает иммунные модуляторы, поддерживающие НБ [10, 11]. Эти воспалительные процессы в окружающих нервные окончания тканях вносят свой вклад в периферическую сенситизацию в виде снижения болевых порогов и повышения мембранной возбудимости [12], что требует не только лечения нейропатической боли, но и противовоспалительного влияния.
Диабетическая полинейропатия, постгерпетическая, тригеминальная невралгия, постинсультная боль, боль при других неврологических заболеваниях (например, рассеянном склерозе или болезни Паркинсона), травмах или опухолях периферических нервов, спинного или головного мозга — лишь небольшой перечень причин формирования НБ. Повреждение афферентных путей на любом уровне является необходимым фактором для формирования НБ [2], причем к ее развитию может вести одновременно несколько механизмов, не зависящих от причины заболевания. Например, не все пациенты с диабетом и полинейропатией имеют диабетическую полинейропатию. У 10–50 % пациентов с диабетом имеются дополнительные потенциальные причины для развития полинейропатии: нейротоксическое действие медикаментов, алкоголь, дефицит витамина В12, почечная недостаточность, метаболический синдром, хроническая демиелинизирующая полинейропатия, наследственная нейропатия и васкулиты. Сложность в подборе лечебной тактики вызвана еще и тем, что единые этиологические факторы вызывают различные патогенетические механизмы повреждения структур нервной системы и механизмы формирования нейропатической боли.
Клинические проявления механизмов боли (периферическая или центральная сенситизация) приобретают колоссальное значение при определении лечебной тактики, так как для воздействия на различные механизмы требуются свои терапевтические стратегии. Поэтому в настоящее время большую актуальность приобретает сопоставление клинических проявлений с патогенетическими механизмами боли [2].
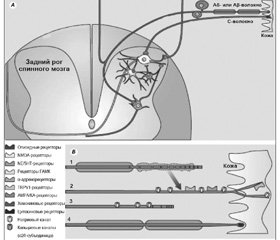
После периферического повреждения нерва любой этиологии спонтанная активность обнаруживается как в поврежденных, так и в сохраняющих контакт с кожей волокнах за счет экспрессии на них Na+-каналов (рис. 1) [3–5].
Доказательство ключевой роли Na+-каналов в патогенезе НБ было получено в результате изучения боли у пациентов с эритромелалгией, проявляющейся тяжелой продолжительной болью в различных частях тела. Это наследственное заболевание связано с мутацией в гене SCN9A, кодирующем потенциалзависимые Na+-каналы [7]. При эритромелалгии эктопическая активность ноцицептивных афферент вызвана первичным нарушением функции Na+-каналов, а не повреждением нерва, являющимся триггером в дальнейшем развитии каналопатии, как при других видах нейропатий [8, 9].
Механизм боли, обусловленный экспрессией Na+-каналов на нервных волокнах, отражает процессы компенсаторной нейропластичности в ответ на повреждение нерва или корешка, но становится дезадаптивным, приводя к избыточной эктопической импульсации, направленной к заднему рогу, и обусловливая его гиперактивность, что и подразумевается под термином «центральная сенситизация». Эктопическая активность в результате синтеза Na+-каналов на поверхности нервных волокон в структуре периферического нерва проявляется спонтанной болью, механической аллодинией, жжением, парестезиями и является мишенью для блокаторов Na+-каналов — карбамазепина и лидокаина, в то время как гиперактивность заднего рога является мишенью для прегабалина и габапентина.
Продолжающиеся разряды в измененных ноцицептивных волокнах способствуют высвобождению возбуждающих аминокислот и нейропептидов в заднем роге [15], происходит деполяризация постсинаптической мембраны, открывающая потенциалзависимые Са2+-каналы в нейронах заднего рога, вход Са2+ в клетку, высвобождение глутамата и распространение возбуждающего потенциала по дендритам (рис. 2).
Это объясняет эффективность антиконвульсантов (преимущественно изменяющих активность Са2+-каналов — габапентина и прегабалина), а клиническим отличительным признаком центральной сенситизации является гипералгезия на уколы.
Подобные механизмы возникают не только на уровне спинного мозга, но и на супраспинальных уровнях [16–18]. Гиперактивность ноцицептивных нейронов заднего рога при снижении тормозящих ГАМК-влияний создает предпосылки для нарушения регулирующего влияния надсегментарных (лимбических) структур, в которых формируются очаги возбуждения, а это создает условия для поддержания ощущения боли даже после удаления ее источника. Прегабалин имеет преимущества во влиянии на надсегментарные структуры, однако при его недостаточной эффективности приходится присоединять антидепрессанты (в основном двойного действия) в лечении хронической нейропатической боли. Антидепрессанты усиливают нисходящие модулирующие боль пути посредством серотонинергических и норадренергических проекций.
Лечение нейропатической боли остается сложной задачей во многих случаях. Эти сложности являются результатом гетерогенности патогенетических механизмов при НБ и частого сочетания с психологическими и эмоциональными аспектами хронической боли.
Например, боль в нижней части спины является гетерогенным страданием, т.к. различные боль-генерирующие механизмы могут комбинироваться у одного больного. Например, у 25–40 % пациентов с болью в нижней части спины при сочетании обоих компонентов боли преобладающим оказывается нейропатический [37]. Причем следует принять во внимание, что нейропатические механизмы боли также полимодальны. Например, при боли в нижней части спины разрастание (спраутинг) волокон синувертебрального нерва в дегенерированном диске, как результат цитокиновых провоспалительных реакций, создает локально-нейропатический механизм боли, требующий назначения правильно подобранных эффективных и безопасных для данного больного нестероидных противовоспалительных препаратов; механическая компрессия корешка обусловливает механически-нейропатическую корешковую боль, при которой блокаторы Na+-каналов типа лидокаина в виде корешковых или эпидуральных блокад порой оказывают драматический эффект; медиаторы воспаления, возникающие в ответ на дегенеративные изменения в диске, без какой бы то ни было механической компрессии, вносят вклад в развитие воспалительно-нейропатического повреждения корешка [38]. Длительная болевая импульсация из периферических отделов в задний рог приводит к центральной сенситизации, боль начинает носить характер спонтанной, иррадиирующей вниз по конечности, сопровождается механической аллодинией, парестезиями, гипералгезией на уколы. Возникает необходимость назначения специфических для нее препаратов — антиконвульсантов, модуляторов активности Са2+-каналов прегабалина и габапентина. Данные антиконвульсанты имеют сродство к белковому фрагменту α2-δ Са-канала на центральных терминалях афферентных ноцицепторов, снижая высвобождение глутамата и таким образом уменьшая гипервозбудимость нейронов заднего рога и супраспинальных структур. Оба антиконвульсанта широко изучены для лечения периферической нейропатической боли, однако большинство исследований последних лет указывает на особую эффективность прегабалина при НБ центрального происхождения [44]. К этому следует добавить, что при постгерпетической невралгии, диабетической полинейропатии, боли в нижней части спины сочетание прегабалина с агонистами опиоидных рецепторов, прегабалина с лидокаином местного применения [45] показало лучший обезболивающий эффект при более низких дозах, чем применение одного препарата без прегабалина. Обнадеживают результаты исследований по оценке комбинированной терапии с нортриптилином [45–47].
К указанным механизмам нейропатической боли у этих больных присоединяются коморбидные состояния, такие как тревога, депрессия, нарушения сна, что оказывает влияние на переносимость болевого синдрома и торпидность к лечению. При недостаточной эффективности прегабалина и габапентина, которые снижают гиперактивность не только заднего рога, но и надсегментарных модулирующих структур, имеющих отношение к эмоционально-поведенческим реакциям, приходится добавлять антидепрессанты двойного, серотонинергического и норадренергического действия (венлафаксин, дулоксетин).
К препаратам с доказанной эффективностью для лечения НП относятся агонисты опиоидных рецепторов (морфин, оксикодон, метадон, леворфанол, трамадол); блокаторы Na-каналов (5% лидокаиновые пластыри); антидепрессанты (трициклические — амитриптилин и нортриптилин; а также ингибиторы обратного захвата норадреналина и серотонина — венлафаксин и дулоксетин) и антиконвульсанты — модуляторы активности Са+-каналов (прегабалин и габапентин) [39–43].
Известный факт повышения частоты нейропатической боли с возрастом и у больных с деменцией позволяет объяснить еще один механизм ее формирования, связанный со снижением активности наиболее мощного, модулирующего боль источника нисходящего пути, тормозящего восходящие болевые сигналы, — дорсолатеральной префронтальной коры (DLPFC). При снижении ее активности нарушается баланс между двумя системами — болевой и противоболевой [19]. Роль лобных отделов мозга в модулировании боли подтверждает факт снижения ответа на плацебо-аналгезию у больных с деменцией [20]. C другой стороны, снижение плотности серого вещества в DLPFC происходит у больных с хронической болью в спине, продолжающейся как минимум в течение года. Не вызывает сомнения тот факт, что длительный болевой синдром всегда является хроническим стрессом для мозга, сопровождается негативным аффектом и формирует подкорковую лимбическую доминанту независимо от этиологии заболевания. Длительная боль создает отрицательную эмоциональную доминанту с активацией Amg, нарушением контроля над синтезом адренокортикотропного гормона и кортизола, мишенью для которого становится ингибирование нейрогенеза в гиппокампе, что, в свою очередь, приводит к истощению нейротрофических возможностей мозга. Это является еще одним подтверждением эффективности антидепрессантов, способных восстанавливать активность DLPFC, сниженную в результате развития депрессии и тревоги, ассоциированных с болью, а также антиконвульсантов, способных гасить патологическую доминанту в лимбических структурах. В целом эмоционально-когнитивный механизм является ведущим в развитии хронических болевых синдромов. Потерю серого вещества DLPFC обусловливают также медикаменты или наркотические вещества, оказывающие токсическое влияние на DLPFC. Необходимо учитывать это при лечении и не злоупотреблять обезболивающими средствами, длительное применение которых может привести к снижению болевого порога. Тем не менее острая боль должна быть купирована для предупреждения образования патологической доминанты в мозге и хронизации болевого синдрома.
Склонность пожилых людей к развитию нейропатической боли, а также исследования последних нескольких десятилетий, делающие очевидным, что глутамат играет важную роль в ноцицептивной обработке и патогенезе развития НБ, привели к идее использования антагонистов N-метил-d-аспартата, среди которых мемантин обладает самым безопасным профилем побочных эффектов и уже давно одобрен при болезни Альц-геймера. За последние пять лет проводились исследования мемантина при постгерпетической невралгии, диабетической полинейропатии, послеоперационной боли, комплексном региональном болевом синдроме, хронической фантомной боли в конечностях, опиоидной рефрактерной боли и фибромиалгии. Результаты были неубедительными из-за исследований с низким уровнем доказательности при небольшой выборке пациентов. Однако два недавних рандомизированных исследования показали значительную эффективность мемантина: в одном из них продемонстрирована его эффективность в профилактике послеоперационной невралгии и связанных с болью психологических нарушений; в другом мемантин облегчал боль и улучшал показатели качества жизни при фибромиалгии. Оба исследования показали также безопасность мемантина у пациентов с НБ.
Как показал анализ результатов 176 рандомизированных плацебо-контролируемых исследований за последние 5 лет, пациенты с диабетической полинейропатией с болевым синдромом, постгерпетической невралгией, травмами периферических нервов, полинейропатией на фоне СПИДа, а также другими полинейропатиями испытывали лишь частичное облегчение боли на фоне приема трициклических антидепрессантов, селективных ингибиторов обратного захвата серотонина и норадреналина, антиконвульсантов габапентина и прегабалина, опиатов, несмотря на то, что эти препараты имеют самую лучшую доказательную базу для лечения нейропатической боли. А превосходное соотношение пользы и риска мемантина, показанное в последних исследованиях, способствует дальнейшему изучению этого препарата как средства профилактики и лечения нейропатической боли в более крупномасштабных исследованиях и дает основание для его назначения в сочетании с другими средствами для лечения нейропатической боли в труднокупируемых случаях.
Новые открытия приближают к мысли о глобальной универсальности патогенетических механизмов многих страданий. Это, в свою очередь, сужает арсенал средств, оставляя только поражающие своей убедительной универсальностью. К таким препаратам относится и антиконвульсант прегабалин (Зоник), зарегистрированный не только для лечения парциальных эпиприпадков и различных видов НБ, но и генерализованного тревожного расстройства, а также препарат для лечения деменции и, как показывают современные данные, нейропатической боли — мемантин (Денигма).
Конфликт интересов. Не заявлен.
От редакции
В Украине зарегистрирован препарат Зоник производства Kusum Healthcare Pvt. Ltd., Индия. –Показания к применению: нейропатическая боль периферического или центрального происхождения у взрослых; фибромиалгия; генерализованное тревожное расстройство у взрослых; в качестве дополнительного лечения при парциальных судорожных припадках со вторичной генерализацией или без таковой у взрослых. Зоник (прегабалин) выпускается в виде капсул по 150 мг № 14, № 28 в блистерах.
В Украине зарегистрирован препарат Денигма производства Kusum Healthcare Pvt. Ltd., Индия. –Показания к применению: болезнь Альцгеймера — от легкой степени тяжести до тяжелых форм. –Денигма (мемантина гидрохлорид) выпускается в виде таблеток, покрытых оболочкой, по 10 мг № 140 в блистерах.
Список литературы
1. Baron R. Neuropathic pain: diagnosis, pathophysiological mechanisms and treatment // The Lancet. — 2010. — Vol. 9. — P. 807-819.
2. Baron R. Mechanisms of disease: neuropathic pain — a clinical perspective // Nat. Clin. Pract. Neurol. — 2006. — Vol. 2. — P. 95-106.
3. Amir R., Kocsis J.D., Devor M. Multiple interacting sites of ectopic spike electrogenesis in primary sensory neurons // J. Neurosci. — 2005. — Vol. 25. — P. 2576-2585.
4. Wu G., Ringkamp M., Murinson B.B. et al. Degeneration of myelinated efferent fibers induces spontaneous activity in uninjured C-fiber afferents // J. Neurosci. — 2002. — Vol. 22. — P. 7746-7753.
5. Bostock H., Campero M., Serra J., Ochoa J.L. Temperature-dependent double spikes in C-nociceptors of neuropatic pain patients // Brain. — 2005. — Vol. 128. — P. 2154-2163.
6. Hains B.C., Waxman S.C. Sodium channel expression and the molecular pathophysiology of pain after SCI // Prog. Brain Res. — 2007. — Vol. 161. — P. 195-203.
7. Dib-Hajj S.D., Black J.A., Waxman S.C. Voltage-gated sodium cannels: therapeutic targets for pain // Pain Med. — 2009. — Vol. 10. — P. 1260-1269.
8. Orstavik K., Jorum E. Microneurographic findings of relevance to pain in patients with erythromelalgia and patients with diabetic neuropathy // Neurosci Lett. — 2010. — Vol. 470. — P. 108-114.
9. Orstavik K., Weidner C., Schmidt R. et al. Pathological C-fibres in patients with a chronic painful condition // Brain. — 2003. — Vol. 126. — P. 567-578.
10. Scholz J., Woolf C.J. The neuropathic pain triad: neurons, immune cells and glia // Nat. Neurosci. — 2007. — Vol. 10. — P. 1361-1368.
11. Saab C.Y., Waxman S.C., Hauns B.C. Alarm or curse? The pain of neuroinflammation // Brain Res Rev. — 2008. — Vol. 58. — P. 226-235.
12. Milligan E.D., Watkins I.R. Pathological and protective roles of glia in chronic pain // Nat. Rev. Neurosci. — 2009. — Vol. 10. — P. 23-36.
13. Moore K.A., Kohno T., Karchewski I.A. et al. Partial periphe-ral nerve injury promotes a selective loss of GABAergic inhibition in the superficial dorsal horn of the spinal cord // J. Neurosci. — 2002. — Vol. 22. — P. 6724-6731.
14. Scholz J., Broom D.C., Youn D.N. et al. Blocking caspase activity prevents transsinaptic neuronal apoptosis and the loss of inhibition in lamina II of the dorsal horn after peripheral nerve injury // J. Neurosci. — 2005. — Vol. 25. — P. 7317-7323.
15. Hains B.C., Saab C.Y., Klein J.P., Craner M.J., Waxman S.C. Altered sodium channel expression in second-order spinal sensory neurons contributes to pain after peripheral nerve injury // J. Neurosci. — 2004. — Vol. 24. — P. 4832-4839.
16. Finnerup N.B., Jensen T.S. Spinal cord injury pain-mechanisms and treatment // Eur. J. Neurol. — 2004. — Vol. 11. — P. 73-82.
17. Ducreux D., Attal N., Parker F., Bouhasstra D. Mechanisms of central neuropathic pain: a combined psychophysical and fMRI study in syringomyelia // Brain. — 2006. — Vol. 128. — P. 963-976.
18. Wasner G., Lee B.B., Engel S., McLachlan E. Residual spinothalamic tract pathways predict development of central pain after apinal cord injury // Brain. — 2008. — Vol. 131. — P. 2387-2400.
19. Benedetti F. Loss of expectated-related mechanism in Alzheimer’s disease makes analgetic therapies less effective // Pain. — 2006. — Vol. 121. — P. 133-144.
20. Apkarian A.V., Sosa Y., Sonty S. et al. Chronic back pain is associated with decreased prefrontal and thalamic gray matter density // J. Neurisci. — 2004. — Vol. 24(46). — P. 10410-10415.
21. Wiech, K., Ploner, M. & Tracey, I. Neurocognitive aspects of pain perception // Trends Cogn. Sci. — 2008. — Vol. 12. — P. 306-31.
22. Tracey, I. et al. Imaging attentional modulation of pain in the periaqueductal gray in humans // J. Neurosci. — 2002. — Vol. 22. — P. 2748-2752.
23. Valet, M. et al. Distraction modulates connectivity of the cingulo-frontal cortex and the midbrain during pain — an fMRI analysis // Pain. — 2004. — Vol. 109. — P. 399-408.
24. Wiech K. & Tracey I. The influence of negative emotions on pain: behavioral effects and neural mechanisms // Neuroimage. — 2009. — Vol. 47. — P. 987-994.
25. Wiech K. et al. Anterolateral prefrontal cortex mediates the analgesic effect of expected and perceived control over pain // J. Neurosci. — 2006. — Vol. 26. — P. 11501-11509.
26. Wager T.D., Davidson M.L., Hughes B.L., Lindquist M.A. & Ochsner K.N. Prefrontal-subcortical pathways mediating successful emotion regulation // Neuron. — 2008. — Vol. 59. — P. 1037-1050.
27. Ochsner K.N. et al. Your pain or mine? Common and distinct neural systems supporting the perception of pain in self and other // Soc. Cogn. Affect. Neurosci. — 2008. — Vol. 3. — P. 144-160.
28. Phelps E.A., Delgado M.R., Nearing K.I. & LeDoux J.E. Extinction learning in humans: role of the amygdala and vmPFC // Neuron. — 2004. — Vol. 43. — P. 897-9.
29. Ploghaus A. et al. Exacerbation of pain by anxiety is associated with activity in a hippocampal network // J. Neurosci. — 2001. — Vol. 21. — P. 9896-9903.
30. Tracey I. getting the pain you expect: mechanisms of placebo, nocebo and reappraisal effects in humans // Nature Medicine. — 2010. — Vol. 16 (11). — P. 1277-1283.
31. Koyama T., McHaffie J.G., Laurienti P.J. & Coghill R.C. The subjective experience of pain: where expectations become reality // Proc. Natl. Acad. Sci. USA. — 2005. — Vol. 102. — P. 12950-12955.
32. Zubieta J.K. et al. Placebo effects mediated by endogenous opioid activity on μ-opioid receptors // J. Neurosci. — 2005. — Vol. 25. — P. 7754-7762.
33. Wager T.D., Scott D.J. & Zubieta J.K. Placebo effects on human μ-opioid activity during pain // Proc. Natl. Acad. Sci. USA. — 2007. — Vol. 104. — P. 11056-1106.
34. Wasan A.D., Kaptchuk T.J., Davar G., Jamison R.N. The association between psychopathology and placebo analgesia in patients with discogenic low back pain // Pain Med. — 2006. — Vol. 7. — P. 217-228.
35. Geers A.L., Helfer S.G., Kosbab K., Weiland P.E. & Land-ry S.J. Reconsidering the role of personality in placebo effects: dispositional optimism, situational expectations,and the placebo response // J. Psychosom. Res. — 2005. — Vol. 58. — P. 121-127.
36. Gelfland D.M., Gelfland S., Radin M. Some personality factors associated with placebo responsivity // Psychol. Rep. — 1965. — Vol. 17. — P. 555-562.
37. Bhandary A.K., Chimes G.P., Malanga G.A. Investigation pharmacology for low back pain // J. Pain Res. — 2010. — Vol. 3. — P. 169-181.
38. Freynhagen R., Baron R. Thee valuation of neuropatic components in low back pain // Curr. Pain Headache Rep. — 2009. — Vol. 13 (3). — P. 185-190.
39. Cruccu G., Sommer C., Anand P. et al. EFNS guidelines on neuropathic pain assessment: revised 2009 // Eur. J. Neurol. — 2010.
40. Finnerup N.B., Sindrup H.S., Jensen T.S. The evidence for pharmacological treatment of neuropathic pain // Pain. — 2010. — Vol. 150. — P. 573-581.
41. O’Connor A.B., Dworkin R.H. Treatment of neuropathic pain: an overview of recent guidelines // Am. J. Med. — 2009. — Vol. 122. — P. S22-32.
42. Dworkin R.H., O’Connor A.B., Audette J. et al. Recommendations for the pharmacological management of neuropathic pain: an overview and literature update // Mayo Clin. Proc. — 2010. — Vol. 85. — P. S3-14.
43. Attal N., Cruccu G., Baron R. et al. EFNS guidelines on the pharmacological treatment on neuropathic pain: 2009 revision // Eur. J. Neurol. — 2010; published online April 9.
44. Martinez J.A., Kasamatsu M., Rosales-Hernandes A., Hanson L.R. Comparison of central versus peripheral delivery of pregabaline // Mol. Pain. — 2012. — Vol. 8 (Published online 2012 January 11. doi: 10.1186/1744-8069-8-3).
45. Baron R., Mayoral V., Leijon G., Binder A., Steigerwald I., Serpell M. Efficacy and safety of combination therapy with 5 % lidocaine medicated plaster and pregabalin in post-herpetic neuralgia and diabetic polyneuropathy // Curr. Med. Res. Opin. — 2009. — Vol. 25. — P. 1677-1687.
46. Gilron I., Bailey J.M., Tu D., Holden R.R. et al. Morphine, gabapentin, or their combination for neuropathic pain // N. Engl. J. Med. — 2005. — Vol. 352. — P. 1324-1334.
47. Hanna M., O’Brien C., Wilson M.C. Prolonged-release oxycodone enhances the eff ects of existing gabapentin therapy in painful diabetic neuropathy patients // Eur. J. Pain. — 2008. — Vol. 12. — P. 804-813.
48. Сергеев А.В., Табеева Г.Р., Азимова Ю.Э. Центральная нейрональная гипервозбудимость — предиспозиция к мигрени // Российский журнал боли. — 2010. — № 2. — С. 3-9.
49. Schwedt J., Dodick D.W. Advanced neuroimaging of migraine // Lancet. — 2009. — Vol. 8. — P. 560-568.
50. Pizzolato R., Villani V., Prosperini L. Efficacy and tolerability of pregabalin as preventive treatment for migraine: a 3-month follow-up study // J. Headache Pain. — 2011. — Vol. 12(5). — P. 521-525.
51. Calandre E.P., Garcia-Leiva J.M., Rico-Villademoros F., Vilchez J.S., Rodriguez-Lopez C.M. Pregabalin in the treatment of chronic migraine: an open-label study // Clin. Neuropharmacol. — 2010. — Vol. 33(1). — P. 35-39.

/18-1.jpg)
/19-1.jpg)