Резюме
Актуальність. Вивчення структури епілептичних нападів, часу їх появи, зв’язку з характером черепно-мозкової травми дозволяє виявити групу потерпілих, які потребуватимуть невідкладної хірургічної корекції їх стану, профілактичного призначення протиепілептичних препаратів, а також уточнити вплив епілептичних нападів на наслідки травми. Мета: вивчити структуру епілептичних нападів у гострому періоді черепно-мозкової травми для оптимізації діагностичних і лікувальних заходів у відповідної категорії пацієнтів. Матеріали та методи. Проведено клінічне, інструментальне обстеження й проаналізовано результати лікування 779 хворих із черепно-мозковою травмою, у яких при надходженні та/або перебуванні в стаціонарі мали місце епілептичні напади. Середній вік пацієнтів становив 35,5 ± 7,8 року. Більшість спостережень — кримінальна травма — 320 хворих (41,1 %), у 272 осіб травма була наслідком дорожньо-транспортної пригоди (34,9 %), 109 хворих отримали травму при падінні з висоти власного росту (13,9 %), у 78 хворих обставини травми були невідомі (10,0 %). Результати. Епілептичні напади виникають у 8,4 % хворих у гострому періоді черепно-мозкової травми. У 81,4 % мали місце негайні епілептичні напади, у 15,7 % — ранні епілептичні напади, у 2,9 % — пізні епілептичні напади. Для негайних і ранніх епілептичних нападів характерними були парціальні епілептичні судоми, у структурі пізніх епілептичних нападів у гострому періоді черепно-мозкової травми переважали генералізовані епілептичні напади. 422 хворих (54,2 %) прооперовано в ургентному порядку. Хірургічне лікування після попередньої консервативної терапії виконано у 232 хворих (29,8 %). Консервативна терапія проведена в 125 пацієнтів (16,0 %). Висновки. Неврологічне обстеження хворих з епілептичними нападами в гострому періоді черепно-мозкової травми обов’язково повинне доповнюватися проведенням комп’ютерної томографії головного мозку, незалежно від рівня порушення свідомості пацієнта. Екстрене хірургічне втручання в таких хворих, спрямоване на усунення прогресуючого дислокаційного синдрому, часто є основним методом лікування. Терапія протиепілептичними препаратами повинна проводитись після появи одиничного епілептичного нападу протягом короткого періоду часу, за наявності неспровокованих епілептичних нападів і їх повторюваності прийом протиепілептичних препаратів повинен бути тривалим.
Актуальность. Изучение структуры эпилептических припадков, времени их появления, связи с характером черепно-мозговой травмы позволяет выявить группу пострадавших, требующих неотложной хирургической коррекции их состояния, профилактического назначения противоэпилептических препаратов, а также уточнить влияние эпилептических припадков на последствия травмы. Цель: изучить структуру эпилептических припадков в остром периоде черепно-мозговой травмы для оптимизации диагностических и лечебных мероприятий у соответствующей категории пациентов. Материалы и методы. Проведено клиническое, инструментальное обследование и проанализированы результаты лечения 779 больных с черепно-мозговой травмой, у которых при поступлении и/или пребывании в стационаре имели место эпилептические припадки. Средний возраст пациентов составил 35,5 ± 7,8 года. Большинство наблюдений представлены криминальной травмой — 320 больных (41,1 %), у 272 травма была следствием ДТП (34,9 %), 109 больных получили травму при падении с высоты собственного роста (13,9 %), у 78 больных обстоятельства травмы были неизвестны (10,0 %). Результаты. Эпилептические припадки возникают у 8,4 % больных в остром периоде черепно-мозговой травмы. У 81,4 % имели место немедленные эпилептические припадки, у 15,7 % — ранние эпилептические припадки, у 2,9 % — поздние эпилептические припадки. Для немедленных и ранних эпилептических припадков характерны были парциальные эпилептические судороги, в структуре поздних эпилептических припадков в остром периоде черепно-мозговой травмы преобладали генерализованные эпилептические припадки. 422 больных (54,2 %) прооперировали в ургентном порядке. Хирургическое лечение после предварительной консервативной терапии выполнено у 232 больных (29,8 %). Консервативная терапия проведена у 125 пациентов (16,0 %). Выводы. Неврологическое обследование больных с эпилептическими припадками в остром периоде черепно-мозговой травмы обязательно должно дополняться проведением компьютерной томографии головного мозга, независимо от степени нарушения сознания пациента. Экстренное хирургическое вмешательство у таких больных, направленное на устранение прогрессирующего дислокационного синдрома, часто является основным методом лечения. Терапия противоэпилептическими препаратами должна проводиться после появления единичного эпилептического припадка в течение кратковременного периода, при наличии неспровоцированных эпилептических припадков и их повторяемости прием противоэпилептических препаратов должен быть длительным.
Background. The study of the structure of seizures, the time of their occurrence, the relationship with the type of traumatic brain injury help identify a group of patients who will need urgent surgical correction of their condition, the preventive use of antiepileptic drugs, as well as clarifying the impact of seizures on the outcome. The purpose is to study the structure of epileptic seizures in acute traumatic brain injury for optimization of diagnostic measures and therapy in these patients. Materials and methods. Clinical and instrumental examination was carried out and the results of the treatment of 779 patients with traumatic brain injury who had seizures were analyzed. The average age of patients was 35.5 ± 7.8 years. Most of the observations were criminal trauma — 320 cases (41.1 %), 272 injuries were the result of road accidents (34.9 %), 109 patients were traumatized when they fell from own height (13.9 %), in 78 patients, causes of trauma were unknown (10.0 %). Results. Epileptic seizures occur in 8.4 % of patients with acute traumatic brain injury. 81.4 % of persons had immediate epileptic seizures, 15.7 % — early epileptic seizures and 2.9 % — late epileptic seizures. Immediate and early seizures were more likely partial, in the structure of late epileptic seizures in acute traumatic brain injury, generalized seizures dominated. 422 patients (54.2 %) underwent urgent surgery. Surgery after neurological treatment was performed in 232 patients (29.8 %), conservative therapy was carried out in 125 patients (16.0 %). Conclusions. Neurological examination of patients with epileptic seizures in acute traumatic brain injury must be supplemented by computed tomography, regardless of the level of impaired consciousness in the patient. Emergency surgical intervention in such patients aimed at eliminating progressive dislocation is often the main method of treatment. Therapy by antiepileptic drugs should be performed after the appearance of a single seizure within a short period of time; in the presence of unprovoked epileptic seizures and their recurrence, the administration of antiepileptic drugs should be prolonged.
Вступ
Судомний синдром у клінічній картині черепно-мозкової травми (ЧМТ) найчастіше проявляєтеся епілептичними нападами (ЕН) [1, 2, 5]. Час появи й частота розвитку ЕН залежать від виду, локалізації й об’єму вогнища ушкодження мозку, преморбідного фону хворого (наявність цереброваскулярної хвороби, повторні ЧМТ в анамнезі, генетична схильність, хронічний алкоголізм тощо) [7, 8].
У хворих із ЧМТ епілептичні напади призводять до підвищення внутрішньочерепного тиску, порушення церебральної перфузії, ішемії й наростання набряку мозку, що погіршує стан хворих і зумовлює незадовільні наслідки захворювання [2].
Вивчення структури ЕН, часу їх появи, зв’язку з морфологічними змінами мозку дозволяє виявити групу потерпілих, які потребують невідкладної хірургічної корекції їх стану, профілактичного призначення протиепілептичних препаратів (ПЕП), а також уточнення впливу ЕН на наслідки травми.
Мета: вивчити структуру ЕН у гострому періоді ЧМТ для оптимізації діагностичних і лікувальних заходів у відповідної категорії пацієнтів.
Матеріали та методи
Проведено ретроспективний аналіз 9272 історій хвороб пацієнтів із черепно-мозковою травмою, які перебували на обстеженні й лікуванні в клініці нейротравми Київської міської клінічної лікарні швидкої медичної допомоги, за 2011–2014 роки. У 779 хворих (8,4 %) при надходженні та/або перебуванні в стаціонарі мав місце судомний синдром. Під посттравматичним ЕН мали на увазі судоми, які спостерігалися в гострому періоді ЧМТ, тобто могли мати причинно-наслідковий зв’язок із самою травмою. Дещо змінена загальновизнана дефініція понять при класифікації часових параметрів судом у хворих у гострому періоді ЧМТ. Незмінним залишилося в дослідженні визначення негайних ЕН — це судоми, що виникли протягом перших 24 годин із моменту отримання ЧМТ. Ранніми називали ЕН, які виникали з 2-ї по 7-му добу з моменту отримання ЧМТ. Під пізніми ЕН у хворих мали на увазі судоми, що виникали з 8-ї доби після ЧМТ під час лікування в стаціонарі.
Серед хворих значно переважали особи чоловічої статі: 624 проти 155 жінок. Розподіл спостережень за віком був проведений згідно з класифікацією ВООЗ (2015 р.): пацієнтів молодого віку (25–44 років) — 538 (69,2 %), чоловіків було 422 (67,7 %), жінок — 116 (74,8 %); середнього віку (45–60 років) — 171 (21,9 %), чоловіків було 142 (22,7 %), жінок — 29 (18,71 %); похилого віку (61–75 років) — 70 (8,9 %), чоловіків — 60 (9,6 %), жінок — 10 (6,5 %) (табл. 1). Отже, найбільшу групу хворих із травмою голови з епілептичними нападами становили хворі молодого віку — 69,2 %. Хворих із ЧМТ із судомними нападами віком понад 60 років було найменше — 8,9 % (табл. 1).
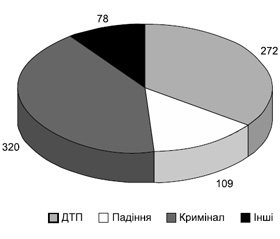
Більшість спостережень — це кримінальна травма — 320 хворих (41,1 %), у 272 травма була наслідком ДТП (34,9 %), 109 хворих отримали травму при падінні з висоти (13,9 %), у 78 хворих обставини травми невідомі (10,0 %) (рис. 1).
Усім хворим для визначення характеру ушкодження головного мозку проводили комп’ютерну томографію (КТ), за потреби — магнітно-резонансну томографію (МРТ) та електроенцефалографію (ЕЕГ). Загальноклінічні обстеження, якщо це дозволяв стан хворих, проводились у стандартному обсязі й включали огляд терапевта, електрокардіографію, за необхідності — додаткові інструментальні дослідження (оглядова рентгенографія органів грудної порожнини, УЗД, ЕЕГ тощо). Оцінка рівня свідомості на момент надходження і в динаміці захворювання проводилася згідно зі шкалою коми Глазго (The Glascow Coma Scale). Для оцінки результатів лікування наших хворих використано шкалу наслідків Глазго (Glasgow Outcome Scale).
У стані алкогольного сп’яніння надійшло 337 хворих (43,3 %). У більшості випадків зловживання алкоголем спостерігалось протягом багатьох років, і ЕН у цих осіб розвинувся на фоні тривалого запою або абстинентного синдрому.
У більшості спостережень діагностовано тяжку черепно-мозкову травму — 463 спостереження (59 %). ЧМТ середньої тяжкості мала місце в 192 хворих (25 %), легка ЧМТ — у 124 хворих (15,9 %).
Струс головного мозку діагностовано в 46 хворих (5,9 %), внутрішньочерепні гематоми — у 691 хворого (88,7 %), ізольовані вдавлені переломи — у 42 хворих (5,4 %). Субдуральну гематому діагностовано в 338 хворих (43,4 %), епідуральну гематому — у 87 хворих (11,2 %), внутрішньомозкову гематому — у 137 хворих (17,6 %), множинні гематоми — у 104 хворих (13,3 %), внутрішньошлуночкові гематоми — у 25 хворих (3,2 %).
Результати
У всіх 779 хворих у гострому періоді ЧМТ мав місце судомний синдром. Ми намагалися проаналізувати його періодизацію, встановити особливості структури ЕН різних періодів і вивчити типи судом у гострому періоді ЧМТ (табл. 2).
У гострому періоді ЧМТ негайні ЕН (протягом 24 год з моменту отримання травми) мали місце в 414 хворих (53,2 %). Ранні ЕН (до 7-ї доби з моменту виникнення ЧМТ) нами спостерігалися у 262 хворих (33,6 %). Починаючи із 7-ї доби ЧМТ ЕН (пізні) виникали в 103 хворих (13,2 %). На нашому матеріалі статистично значущим було переважання в структурі судомного синдрому в гострому періоді ЧМТ негайних ЕН (р = 0,035).
Середній інтервал між початком ЧМТ і ранніми ЕН становив 2,1 ± 1,6 дня, а для пізніх посттравматичних судом — 12,7 ± 3,8 дня. Різниця в часовому інтервалі до появи судомного синдрому у хворих з ранніми й пізніми ЕН була статистично значущою (р = 0,011).
У гострому періоді ЧМТ у хворих, які вживали алкоголь, ЕН в основному спостерігались на фоні алкогольної інтоксикації в період елімінації алкоголю в першу добу — 252 хворих (60,9 %). Судоми, що виникали в цієї патогенетичної групи пацієнтів на 2-гу — 7-му добу, були розцінені як ЕН періоду абстинентного синдрому — 74 спостереження (28,4 %). Поява ЕН на 8-му — 30-ту добу ЧМТ була характерною для осіб, в анамнезі яких мало місце тривале вживання алкоголю — 11 пацієнтів (10,7 %).
У хворих у гострому періоді ЧМТ при аналізі структури судомного синдрому виявлені такі особливості. 331 хворий мав генералізовані ЕН (42,5 %), 448 — фокальні ЕН з генералізацією або без неї (57,5 %). Серед 331 хворого з генералізованими ЕН у 326 мали місце генералізовані тоніко-клонічні судоми, у 5 — міоклонічні судоми. З 448 хворих із парціальними ЕН у 144 (32,1 %) спостерігалася генералізація судом.
Судоми, що з’являлися протягом першої доби з моменту появи ЧМТ, були парціальними ЕН у 272 хворих (65,7 %). Генералізовані ЕН мали місце в 142 випадках (34,3 %). У 87 хворих фокальні ЕН переросли в генералізовані.
Ранні ЕН у вигляді парціальних судом спостерігалися у 155 хворих (59,1 %), ранні генералізовані — у 107 хворих (40,9 %). Вторинно-генералізовані ЕН мали місце в 49 хворих.
Пізні фокальні напади мали місце у 21 хворого (20,3 %), із них 8 переросли в генералізовані. Пізні генералізовані спостерігалися у 82 пацієнтів (79,7 %).
Частота судом в гострому періоді ЧМТ була такою: 435 мали один епізод судом (55,9 %), 308 — більше ніж один епізод (39,4 %), у 36 був епілептичний статус (4,7 %). Звертала на себе увагу більша частота епістатусів саме після 8-го дня з моменту ЧМТ у хворих на фоні алкогольної інтоксикації — 8 спостережень (72,7 %). На нашу думку, це явище зумовлене прогресуючим послабленням відновлювальних ресурсів мозку на фоні ЧМТ, поєднаної з алкогольною інтоксикацією, і відстроченим безпосереднім стимулюючим впливом екзогенного фактора (алкоголю) на появу безперервної пароксизмальної електричної активності нейронів головного мозку в таких хворих.
У 422 хворих (54,2 %) проведено ургентне хірургічне втручання в період до 3 годин з моменту появи клінічних симптомів. Хірургічне лікування після консервативної терапії, спрямованої на стабілізацію стану хворих (маніт, фуросемід, дексаметазон), проведене у 232 хворих (29,8 %). Консервативна терапія проведена в 125 пацієнтів (16,0 %).
Очікуваним результатом проведеного дослідження було те, що частка задовільних і добрих функціональних наслідків була найбільшою у хворих із легкою й середньої тяжкості ЧМТ. У хворих із тяжкою ЧМТ добрий результат лікування згідно зі шкалою наслідків Глазго мав місце в 155 (33,2 %) осіб, помірна інвалідизація — у 51 (11,0 %), груба інвалідизація — у 19 (4,1 %), вегетативний стан — у 7 (1,5 %), помер 231 хворий (49,8 %).
Серед загальної кількості хворих, які вижили, було значно більше пацієнтів із добрим відновленням — 446 спостережень, ніж хворих із помірною або глибокою інвалідизацією чи вегетативним станом — 66, 19 і 7 спостережень відповідно.
Загальна летальність серед 779 хворих становила 30,8 % (240 хворих), післяопераційна летальність становила 31,2 % (211 хворих). Причинами летальних результатів були набряк і дислокація мозку — у 125 випадках (52,1 %), пневмонія — 65 спостережень (27,1 %), запальні внутрішньочерепні ускладнення — у 27 пацієнтів (11,3 %), гнійно-септичні ускладнення — в 15 хворих (6,3 %) і тромбоемболія легеневої артерії — у 8 хворих (3,3 %). Більш високою була летальність у хворих із негайними ЕН у гострому періоді ЧМТ — 55,3 %. При ранніх судомах летальність становила 2,7 %, при пізніх — 3,7 %. Серед хворих із генералізованими ЕН померло 108 (32,6 %), серед хворих із парціальними ЕН — 132 (29,5 %).
Метою медикаментозного лікування судомного синдрому (вальпроати, бензодіазепіни, похідні іміно–стильбену) в наших хворих було повне припинення ЕН без нервово-психічних, соматичних побічних ефектів ПЕП, з подальшою високою професійною й соціальною адаптацією пацієнта. Стандартний підхід полягав у призначенні ПЕП лише тим, хто мав гострий симптоматичний ЕН при ЧМТ. Як правило, призначали ПЕП не менше від 7 днів пацієнтам, які перенесли ранні спровоковані судоми. Протягом тривалого періоду часу ПЕП рекомендували для профілактики розвитку неспровокованих судом у тих, хто мав пізні судоми. Підставами для припинення протиепілептичної терапії при пізніх ЕН при подальшому тривалому спостереженні може бути наявність електроенцефалограми без епілептиформних змін і відсутність ЕН протягом 2 років.
Обговорення
Інтерпретація ЕН гострого періоду ЧМТ — складна проблема, оскільки, крім цілеспрямованого вивчення анамнезу й відповідного інструментального обстеження, потрібне динамічне спостереження. Поява ЕН у хворого з травмою голови повинна викликати підозру на ускладнення у вигляді забою мозку чи внутрішньочерепної гематоми. При легкій ЧМТ ситуація може виявитися ще складнішою. Доцільно розмежувати декілька найбільш ймовірних варіантів. За відсутності преморбідної епілептичної та іншої неврологічної патології даний епізод можна розцінити як епілептичну реакцію на надпороговий фізичний вплив. Це прогностично найбільш сприятливий варіант, хоч він і вказує на певну схильність до епілепсії й послаблення протиепілептичних механізмів. Іншу категорію становлять епілептичні синдроми — прояви актуального пошкодження ЦНС. Так, ЕН може характеризувати більш тяжку, ніж струс головного мозку, травму (у тому числі з внутрішньочерепною гематомою), що зазвичай підтверджується її клінічною динамікою й результатами КТ-дослідження. Нерідко судомний синдром у гострому періоді легкої ЧМТ буває обумовлений токсичним ураженням нервової системи, алкогольною абстиненцією або починається алкогольним делірієм. Нарешті, травма голови може спровокувати розгорнутий ЕН у хворого на епілепсію. Отже, при черепно-мозкових ушкодженнях (у тому числі легкій ЧМТ) може спостерігатися весь спектр епілептичних явищ.
Судомний синдром у гострому періоді ЧМТ може бути як безпосереднім, так і відстроченим результатом ЧМТ, але в будь-якому випадку він тільки поглиблює тяжкість стану хворого. Патогенез розвитку ранніх і пізніх ЕП при ЧМТ різний. Виникнення ранніх ЕН обумовлено цитотоксичними й метаболічними змінами у вогнищі ушкодження мозку, а також компресійним впливом травматичного вогнища на структури мозку. Пізні ЕП пов’язують з поступовим формуванням епілептичного фокусу (посттравматичної кісти, рубця або коркової атрофії). Як правило, у постраждалих із ЧМТ, у яких ЕН уперше виник через кілька тижнів або місяців після ЧМТ, у подальшому розвивається посттравматична епілепсія (ПТЕ) [1, 2, 4]. Ряд авторів, з якими ми повністю погоджуємося, окремо виділяють негайні ЕН (розвиваються в перші 24 год з моменту травми), підкреслюючи їх важливу роль у визначенні прогнозу розвитку ПТЕ [5, 8]. Так, за даними N.R. Temkin (2003), ризик розвитку ПТЕ у постраждалих з ЧМТ і наявністю в анамнезі негайних ЕП становить 28 % [7].
Загалом ЕН виникають найчастіше при забоях головного мозку середнього й тяжкого ступеня, в основному при оболонкових гематомах. Характерно, що при внутрішньочерепних гематомах судоми виникають на фоні прогредієнтного порушення свідомості, частіше це фокальні судоми, які визначають вогнище ураження (подразнення) чи здавлювання мозку. Судоми можуть розпочинатися як з вогнищевих, з наступною трансформацією в генералізовані тоніко-клонічні, так і з загальних тоніко-клонічних, особливо при гостро наростаючій компресії й дислокації мозку. Типовим є післянападний період, що характеризується погіршенням ступеня тяжкості стану хворого: порушенням свідомості, поглибленням вогнищевої симптоматики. Із кожним судомним нападом симптоматика наростає. На цьому фоні з’являються симптоми внутрішньочерепної гіпертензії. При хронічних субдуральних гематомах судомний синдром може бути єдиним клінічним проявом хвороби [2].
У випадку ЕН усім пацієнтам рекомендується невідкладне проведення КТ головного мозку. За відсутності будь-яких гострих травматичних змін доцільне обстеження за допомогою МРТ. Допоміжним цінним діагностичним методом може служити електроенцефалографія. Локальні зміни біоелектричної активності можуть бути непрямим свідченням вогнищевого забою головного мозку. Однак не будь-яка пароксизмальна активність на ЕЕГ у таких хворих є епілептичною і тим більше вказує на ризик розвитку ПТЕ. Вірогідно оцінити ситуацію можна в процесі спостереження й повторних обстежень.
Абсолютними критеріями визначення показань до хірургічного лікування хворих із судомним синдромом у гострому періоді ЧМТ є клінічні симптоми розвитку й прогресування дислокаційного синдрому. Без урахування даних нейровізуалізації судомний синдром не може бути абсолютним критерієм вибору методу лікування, хоча він є дуже сильним прогностичним фактором наявності нейрохірургічної патології за даними КТ/МРТ. Так, патологічні радіологічні знахідки виявлено в 733 наших пацієнтів (94,1 %) із 779 хворих, у яких мав місце судомний синдромом у гострому періоді ЧМТ.
Ще нещодавно тривалий прийом ПЕП після перенесеної ЧМТ з метою профілактики ПТЕ був стандартною поширеною рекомендацією. Дослідження останніх років показало, що тривале профілактичне застосування ПЕП у гострому періоді ЧМТ не знижує ймовірність розвитку в подальшому ПТЕ і з цих позицій, без урахування додаткових факторів і особливостей травми, є недоцільним [6]. У той же час призначення ПЕП у гострому періоді травми (особливо в перші 7 днів) вірогідно зменшує небезпеку розвитку ранніх ЕН і може рекомендуватись протягом 1–2 тижнів особам із високим епілептичним ризиком (при розвитку внутрішньочерепних гематом, проникних і вогнепальних черепно-мозкових пораненнях, вогнищевих геморагічних ударах, вдавлених переломах черепа, зловживанні алкоголем і ЕН в анамнезі). Очевидно й те, що ПЕП ефективні й необхідні при виникненні ранніх ЕН. І хоча результати ЧМТ (летальність, обмеження дієздатності) при цьому істотно не змінюються [3, 5, 6, 8], таку рекомендацію можна вважати виправданою. Лікування ж ПТЕ проводиться з урахуванням стандартних підходів до лікування епілептичної хвороби [3, 6]. При цьому розвиток першого і єдиного ЕН, можливо, посттравматичного генезу є приводом для відповідного обстеження й спостереження, але ще не є підставою для призначення протиепілептичної терапії.
Висновки
ЕН виникають у 8,4 % хворих у гострому періоді ЧМТ. У 81,4 % з них розвиваються негайні ЕН, у 15,7 % — ранні ЕН, у 2,9 % — пізні ЕН. Для негайних і ранніх ЕН більш характерними є парціальні ЕН, у структурі пізніх ЕН у гострому періоді ЧМТ переважають генералізовані ЕН.
Клініко-неврологічне обстеження хворих із судомним синдромом у гострому періоді ЧМТ обов’язково повинне доповнюватися проведенням КТ головного мозку, незалежно від рівня порушення свідомості пацієнта. Частота патологічних радіологічних знахідок у таких пацієнтів становить 85 %.
Екстрене хірургічне втручання у хворих із судомним синдромом у гострому періоді ЧМТ, спрямоване на усунення прогресуючого дислокаційного синдрому, часто проводиться за життєвими показаннями і є безальтернативним методом лікування.
Терапія ПЕП повинна проводитись після факту появи одиничного ЕН протягом короткого періоду часу, за наявності неспровокованих ЕН і їх повторюваності прийом ПЕП повинен бути тривалим.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.

/12-2.jpg)
/12-1.jpg)
/13-1.jpg)