Журнал «Боль. Суставы. Позвоночник» Том 8, №3, 2018
Вернуться к номеру
Метаболические факторы, определяющие эффективность гипоурикемического лечения подагрического артрита
Авторы: Синяченко О.В., Федоров Д.М., Ермолаева М.В., Пилипенко В.В.
Донецкий национальный медицинский университет, г. Лиман, Украина
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
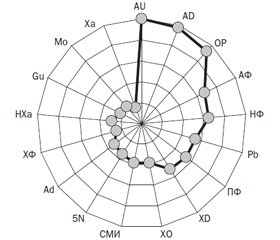
Резюме. Актуальність. На сьогодні лікування деяких форм артикулярної патології при подагрі залишається недостатньо ефективним, а досягнення нормальних значень показників урикемії на тлі застосування уратнормалізуючих медикаментозних препаратів досить часто відсутнє. Мета дослідження: оцінити ступінь впливу початкових параметрів пуринового метаболізму і молекул середньої маси (МСМ) різних фракцій на ефективність урикодепресивної й урикозуричної терапії подагричного артриту. Матеріали та методи. Під спостереженням перебували 105 хворих на первинну подагру, серед яких було 92 % чоловіків і 8 % жінок віком 26–76 років. Перед початком лікування в сироватці крові вивчали вміст чинників пуринового метаболізму (сечової кислоти (AU), оксипуринолу (ОР), аденіну, гуаніну, ксантину, гіпоксантину, ксантиноксидази, ксантиндезамінази, аденозиндезамінази, 5-нуклеотидази, молібдену, свинцю), а також МСМ різних фракцій (амінопептидної (АФ), пептидної (ПФ), нуклеотидної (НФ), хроматофорної (ХФ)) та інтегрального середньомолекулярного індексу. Використовували спектрофотометр СФ46, біоаналізатор Olympus-AU640 і атомно-абсорбційний спектрометр з електрографітовим атомізатором SolAAr-Mk2-MOZe. Ефективність лікування оцінювали за 3–5 тижнів. Результати. У 27 % випадків констатовано незначне поліпшення, у 68 % — поліпшення, у 8 % — значне поліпшення. Первинна подагра перебігає з порушеннями метаболізму AU, ОР, пуринових основ, ферментів обміну пуринів і пуринасоційованих мікроелементів, інтегральні зміни яких залежать від форми суглобового синдрому, наявності периферійних і кісткових тофусів, визначають кістково-деструктивні артикулярні ушкодження, при цьому прогнознегативним чинником щодо тяжкості артропатії є високий рівень в крові пуринових основ. При подагрі вірогідно зростають в крові концентрації АФ, ПФ, НФ, ХФ і СМІ, при цьому вміст АФ тісно пов’язаний з тяжкістю перебігу суглобового синдрому, визначає ступінь звуження суглобових щілин і субхондрального склерозу, розвиток остеоузур і змін менісків, а показники МСМ різних фракцій мають кореляційний зв’язок з параметрами пуринового метаболізму. Значне поліпшення й поліпшення в процесі патогенетичної терапії спостерігається у 3/4 від числа хворих, що щільно пов’язане з формою артриту, наявністю тофусов і внутрішньосуглобових тіл Гоффа, а також з типом гіперурикемії, залежить від використання в комплексі лікувальних заходів фебуксостату, статинів і фібратів, визначається початковим станом пуринового обміну, рівнями МСМ фракцій НФ і ХФ. Висновки. Вивчені метаболічні чинники не лише беруть участь в патогенезі подагричного артриту, але й впливають на ефективність уриконормалізуючих препаратів.
Актуальность. В настоящее время лечение некоторых форм артикулярной патологии при подагре остается недостаточно эффективным, а достижение нормальных значений показателей урикемии на фоне применения уратнормализующих медикаментозных препаратов зачастую отсутствует. Цель исследования: оценить степень влияния исходных параметров пуринового метаболизма и молекул средней массы (МСМ) разных фракций на эффективность урикодепрессивной и урикозурической терапии подагрического артрита. Материалы и методы. Под наблюдением находились 105 больных первичной подагрой, среди которых было 92 % мужчин и 8 % женщин в возрасте 26–76 лет. Перед началом лечения в сыворотке крови изучали содержание факторов пуринового метаболизма (мочевой кислоты (AU), оксипуринола (ОР), аденина, гуанина, ксантина, гипоксантина, ксантиноксидазы, ксантиндезаминазы, аденозиндезаминазы, 5-нуклеотидазы, молибдена, свинца), а также МСМ разных фракций (аминопептидной (АФ), пептидной (ПФ), нуклеотидной (НФ), хроматофорной (ХФ)) и интегрального среднемолекулярного индекса. Использовали спектрофотометр СФ46, биоанализатор Olympus-AU640 и атомно-абсорбционный спектрометр с электрографитовым атомизатором SolAAr-Mk2-MOZe. Эффективность лечения оценивали спустя 3–5 недель. Результаты. В 27 % случаев констатировано незначительное улучшение, в 68 % — улучшение, в 8 % — значительное улучшение. Первичная подагра протекает с нарушениями метаболизма AU, ОР, пуриновых оснований, ферментов обмена пуринов и пуринассоциированных микроэлементов, интегральные изменения которых зависят от формы суставного синдрома, наличия периферических и костных тофусов, определяют костно-деструктивные артикулярные повреждения, при этом прогнознегативным фактором в отношении тяжести артропатии является высокий уровень в крови пуриновых оснований. При подагре достоверно возрастают в крови концентрации АФ, ПФ, НФ, ХФ и СМИ, при этом содержание АФ тесно связано с тяжестью течения суставного синдрома, определяет степень сужения суставных щелей и субхондрального склероза, развитие остеоузур и изменений менисков, а показатели МСМ разных фракций имеют корреляционные связи с параметрами пуринового метаболизма. Значительное улучшение и улучшение в процессе патогенетической терапии наблюдается у 3/4 от числа больных, что тесно связано с формой артрита, наличием тофусов и внутрисуставных тел Гоффа, а также с типом гиперурикемии, зависит от использования в комплексе лечебных мероприятий фебуксостата, статинов и фибратов, определяется исходным состоянием пуринового обмена, уровнями МСМ фракций НФ и ХФ. Выводы. Изученные метаболические факторы не только участвуют в патогенезе подагрического артрита, но и оказывают влияние на эффективность уриконормализующих препаратов.
Background. The treatment of some forms of articular pathology with gout remains insufficiently effective, and often it’s impossible to achieve normal indicators of uricemia on the background of uric acid-normalizing medicines. The purpose of the study is to evaluate the effect of the initial parameters of purine metabolism and molecules of medium mass (MMM) of different fractions on the effectiveness of uricodepressive and uricosuric therapy of gouty arthritis. Materials and methods. One hundred five patients with primary gout were examined: 92 % of men and 8 % of women aged 26 to 76 years. Before the beginning of the treatment, the content of purine metabolism factors (uric acid, oxypurinol, adenine, guanine, xanthine, hypoxanthine, xanthine oxidase, xanthine deaminase, adenosine deaminase, 5-nucleotidase, molybdenum, lead), as well as MMM of different fractions (aminopeptide (AF), peptide (PF), nucleotide (NF), chromatographic (ChF)) and integral medium molecular index (MMI) were studied in the blood serum. A spectrophotometer SF46, Olympus-AU640 bioanalyzer and an atomic absorption spectrometer with SolAAr-Mk2-MOZe electrographitic atomizer were used. The efficacy of treatment was assessed after 3–5 weeks. Results. In 27 % of cases, a slight improvement was observed, in 68 % — an improvement, in 8 % — a significant improvement. Primary gout occurs with disturbances in the metabolism of uric acid, oxypurinol, purine bases, purine metabolism enzymes and purine-associated microelements. The integral changes of them depend on the type of the joint syndrome, the presence of peripheral and bone tophi, determine bone-destructive articular injuries, while the predictive factor for the severity of arthropathy is considered to be the high level of purine bases in the blood. In cases of gout, the concentration of AF, PF, NF, ChF increases, as well as MMI. Meanwhile, the AF content is closely related to the severity of the joint syndrome, it determines the degree of joint space narrowing and subchondral sclerosis, the development of bone erosions and meniscus changes, and the MMM of different fractions correlate with the parameters of purine metabolism. A significant improvement and improvement during the pathogenetic therapy is observed in 3/4 of patients that is closely related to the form of arthritis, the presence of tophi and intraarticular Hoffa’s bodies, as well as the type of hyperuricemia, depends on the use of febuxostat, statins and fibrates, the state of purine metabolism, levels of MMM, NF and ChF fractions. Conclusions. The studied metabolic factors are not only involved in the pathogenesis of gouty arthritis, but also have an impact on the efficacy of uric acid-normalizing drugs.
подагра; артрит; чинники метаболізму; лікування; ефективність
подагра; артрит; факторы метаболизма; лечение; эффективность
gout; arthritis; metabolic factors; treatment; efficacy
Введение
Материалы и методы
Результаты и обсуждение
Выводы
- Bolzetta F, Veronese N, Manzato E, Sergi G. Chronic gout in the elderly. Aging Clin Exp Res. 2013;25(2):129-37.
- Manara M, Bortoluzzi A, Favero M, Prevete I, Scire CA, Bianchi G et al. Italian society of rheumatology recommendations for the management of gout. Reumatismo. 2013;65(1):4-21. doi: 10.1074/jbc.M115.649855.
- Hayward RA, Rathod T, Roddy E, Muller S, Hider SL, Mallen CD. The association of gout with socioeconomic status in primary care: a cross-sectional observational study. Rheumatology. 2013;52(11):2004-8.
- Richette P, Garay R. Novel drug discovery strategies for gout. Expert Opin Drug Discov. 2013;8(2):183-9. doi: 10.1517/17460441.2013.742061.
- Singh JA, Cleveland JD. Comparative effectiveness of allopurinol versus febuxostat for preventing incident renal disease in older adults: an analysis of Medicare claims data. Ann Rheum Dis. 2017;76(10):1669-78. doi: 10.1136/annrheumdis-2017-211210.
- Kiadaliri AA, Uhlig T, Englund M. Burden of gout in the Nordic region, 1990-2015: findings from the Global Burden of Disease Study 2015. Scand J Rheumatol. 2018;29(1):1-8. doi: 10.1080/03009742.2017.1405461.
- Kuo CF, Grainge MJ, See LC, Yu KH, Luo SF, Zhang W, Doherty M. Epidemiology and management of gout in Taiwan: a nationwide population study. Arthritis Res Ther. 2016;23(17):13-9. doi: 10.1186/s13075-015-0522-8.
- Sivera F, Andres M, Carmona L, Kydd AS, Moi J, Seth R, Sriranganathan M. Multinational evidence-based recommendations for the diagnosis and management of gout: integrating systematic literature review and expert opinion of a broad panel of rheumatologists in the 3e initiative. Ann Rheum Dis. 2014;73(2):328-35. doi: 10.1136/annrheumdis-2013-203325.
- Crittenden DB, Pillinger MH. The year in gout: 2012-2013 – a walk through the 2012 ACR Gout Treatment Guidelines. Bull Hosp J Dis. 2013;71(3):189-93.
- Dubreuil M, Neogi T, Chen CA, Choi HK, Chaisson CE, Hunter DJ, Zhang Y. Increased risk of recurrent gout attacks with hospitalization. Am J Med. 2013;126(12):1138-41. doi: 10.1016/j.amjmed.2013.06.026.
- Fang ZH, Waizy H. Current concepts in the treatment of gouty arthritis. Orthop Surg. 2013;5(1):6-12. doi: 10.1111/os.12024.
- Zarowitz BJ, O'Shea TE. Demographic and clinical profile of nursing facility residents with gout. Consult Pharm. 2013;28(6):370-82. doi: 10.4140/TCP.n.2013.370.

/16-1.jpg)
/17-1.jpg)
/17-2.jpg)