Резюме
Актуальність. Streptococcus salivarius K12 (SsK12) — пробіотичний штам, що належить до I класу лантибіотиків та інтенсивно пригнічує in vitro ріст Streptococcus pyogenes, Streptococcus pneumoniaе, Haemophilus influenzaе і Moraxella catarrhalis, які є одними з основних етіологічних чинників бактеріальних інфекцій респіраторного тракту в дітей. Даний антагонізм перш за все пов’язаний із виділенням саліварицину А2 (бактеріостатик), що порушує синтез мембран бактерій і гальмує їх розмноження, і саливарицину В (бактерицид), що руйнує стінки клітин чутливих до них бактерій і призводить до їх загибелі. Лантибіотик характеризується вираженою антибактеріальною чутливістю й має високий профіль безпеки. Після перорального прийому SsK12 колонізує порожнину рота й носоглотки та зберігається там протягом місяця після прийому останньої дози, конкуруючи з патогенною мікрофлорою. Мета: клінічна оцінка ефективності застосування лантибіотиків у дітей для профілактики рекурентних інфекцій глотки на основі визначення в них частоти рецидивів інфекції, пов’язаної з бета-гемолітичним стрептококом групи А, хронічним тонзилітом, динаміки клінічного регресу симптомів гіпертрофії глоткового мигдалика (ГГМ), вивчення бактеріальної колонізації глотки впродовж 6 місяців після проведеного лікування у хворих. Матеріали та методи. Проведено контрольоване проспективне відкрите рандомізоване за допомогою комп’ютерного розподілу моноцентрове клінічне дослідження, що включало обстеження 57 пацієнтів дитячого віку з рекурентними захворюваннями глотки. У 22 з них було діагностовано хронічний тонзиліт, у 17 осіб дана інфекція була пов’язана з бета-гемолітичним стрептококом групи А, у 18 дітей виявлено гіпертрофію глоткового мигдалика. Результати. На основі отриманих результатів дослідження встановлено, що застосування лантибіотика SsK12 у дітей із рекурентними хворобами глотки при динамічному спостереженні протягом 6 місяців сприяє суттєвому зменшенню частоти загострень рекурентних інфекцій глотки, зменшенню потреби в прийомах антибіотиків і покращанню мікробіоценозу піднебінних мигдаликів. Призначення препарату Бактобліс протягом 30 днів в основній групі пацієнтів дозволило вірогідно зменшити клінічний індекс хронічного запалення ГГМ порівняно з контрольною групою. Висновки. Результати клінічного дослідження показали ефективність Streptococcus salivarius K12, що розширює можливості його застосування в клінічній дитячій практиці й відкриває нові можливості профілактики рекурентних інфекцій глотки в дітей на амбулаторному й стаціонарному етапі лікування хворих.
Актуальность. Streptococcus salivarius K12 (SsK12) — пробиотический штамм, относящийся к I классу лантибиотиков и интенсивно подавляющий in vitro рост Streptococcus pyogenes, Streptococcus pneumoniaе, Haemophilus influenzaе и Moraxella catarrhalis, которые являются одними из основных этиологических факторов бактериальных инфекций респираторного тракта у детей. Данный антагонизм прежде всего связан с выделением саливарицина А2 (бактериостатик), нарушающего синтез мембран бактерий и тормозящего их размножение, и саливарицина В (бактерицид), разрушающего стенки клеток чувствительных к ним бактерий и приводящего к их гибели. Лантибиотик характеризуется выраженной антибактериальной чувствительностью и имеет высокий профиль безопасности. После приема SsK12 колонизирует полость рта и носоглотки и сохраняется там в течение месяца после приема последней дозы, конкурируя с патогенной микрофлорой. Цель: клиническая оценка эффективности применения лантибиотиков у детей для профилактики рекуррентных инфекций глотки на основе определения у них частоты рецидивов инфекции, связанной с бета-гемолитическим стрептококком группы А, хроническим тонзиллитом, динамики клинического регресса симптомов гипертрофии глоточной миндалины (ГГМ), изучение бактериальной колонизации глотки в течение 6 месяцев после проведенного лечения у больных. Материалы и методы. Проведено контролируемое проспективное открытое рандомизированное с помощью компьютерного распределения моноцентровое клиническое исследование, которое включало обследование 57 пациентов детского возраста с рекуррентными заболеваниями глотки. У 22 из них был диагностирован хронический тонзиллит, у 17 человек данная инфекция была связана с бета-гемолитическим стрептококком группы А, у 18 детей выявлена гипертрофия глоточной миндалины. Результаты. На основании полученных результатов исследования установлено, что применение лантибиотика SsK12 у детей с рекуррентными болезнями глотки при динамическом наблюдении в течение 6 месяцев способствует существенному уменьшению частоты обострений рекуррентных инфекций глотки, уменьшению потребности в приемах антибиотиков и улучшению микробиоценоза небных миндалин. Назначение препарата Бактоблис в течение 30 дней в основной группе пациентов позволило достоверно уменьшить клинический индекс хронического воспаления ГГМ по сравнению с контрольной группой. Выводы. Полученные результаты клинического исследования установили высокую эффективность Streptococcus salivarius K12, что расширяет возможности его применения в клинической детской практике и открывает новые возможности профилактики рекуррентных инфекций глотки у детей на амбулаторном и стационарном этапе лечения больных.
Background. Streptococcus salivarius K12 (SsK12) is a probiotic strain that belongs to class I lantibiotics and strongly inhibits in vitro growth of Streptococcus pyogenes, Streptococcus pneumoniae, Haemophilus influenzae and Moraxella catarrhalis, which are one of the main etiological factors of bacterial respiratory tract infections in children. This antagonism is primarily due to the release of salivaricin A2 (bacteriostatic) that impaired the synthesis of bacterial membranes and inhibits their reproduction, and salivaricin B (bactericide), which destroys the cell walls of bacteria susceptible to them and leads to their death. Lantibiotic is characterized by a significant antibacterial sensitivity and has a high safety profile. After oral administration, SsK12 colonizes the oral and nasopharyngeal cavity and remains there for one month after receiving the last dose, competing with the pathogenic microflora. Objective: clinical evaluation of the effectiveness of lantibiotic use in children to prevent recurrent infections of the pharynx based on the determination of the incidence of recurrent infections associated with group A beta-hemolytic streptococcus, chronic tonsillitis, dynamics of clinical regression of pharyngeal tonsil hypertrophy symptoms, studying the bacterial colonization of the pharynx for 6 months after treatment in patients. Materials and methods. A controlled, prospective, randomized, open-label, computer-assisted, single-center clinical study was performed, which included examination of 57 children with recurrent pharyngeal disease. Twenty-two of them were diagnosed with chronic tonsillitis, in 17 cases, this infection was associated with group A beta-hemolytic streptococcus, and 18 children had pharyngeal tonsil hypertrophy. Results. Based on the results of the study, it was found that the use of SsK12 antibiotic in children with recurrent pharyngeal diseases, during 6 months of dynamic observation, contributes to a significant decrease in the incidence of exacerbations of recurrent infections of the pharynx, reduction of the need for antibiotics and improvement of microbiocenosis of the palatal tonsils. Administration of Bactoblis for 30 days in the main group of patients allowed decreasing the clinical index of chronic inflammation of pharyngeal tonsils as compared to the control group. Conclusions. The obtained results of clinical research have established the high efficiency of Streptococcus salivarius K12, which extends the possibilities of its use in clinical pediatric practice and opens up new possibilities for the prevention of recurrent infections of the pharynx in children at the outpatient and inpatient stages of treatment.
Вступ
Незважаючи на значний прогрес у лікуванні хронічних інфекційно-запальних захворювань лімфоепітеліальних структур глотки протягом останніх десятиліть, проблема медикаментозної терапії хронічного тонзиліту (ХТ) у дітей і дорослих залишається актуальною й невирішеною [2, 6].
Часті загострення ХТ і рекурентні інфекції глотки в дитячому віці вимагають серйозної уваги в практичній діяльності отоларинголога, а також педіатра й сімейного лікаря. Це пояснюється не тільки достатньо високою поширеністю даного захворювання, але й сучасною точкою зору на функцію лімфаденоїдної тканини, етіологію, патогенез і способи лікування її хронічного запалення.
Піднебінні мигдалики (ПМ) найбільш часто схильні до гострого й хронічного запалення, що поряд із захисною функцією змушує розглядати їх як вогнище хронічної інфекції в організмі. Хронічний запальний процес у них спричиняє значні зрушення у функціонуванні місцевого й загального імунітету. Визначається дисбаланс в імунному статусі: перерозподіл Т- і В-лімфоцитів і їх субпопуляцій, наявність циркулюючих імунних комплексів, сенсибілізація гранулоцитів до інфекційних алергенів. Циркулюючі імунні комплекси «антиген — антитіло», що фактично є прикладом незавершеного фагоцитозу, виявляють хемотаксичну активність і підвищують протеолітичну здатність ферментів макрофагів, що призводить до лізису власної тканини мигдаликів, денатурації білків, які в результаті набувають антигенних властивостей. Потрапляючи в кров, вони викликають утворення автоантитіл, а в процесі тривалої персистенції мікрофлори відбувається індукція толерантності до неї. Це стає підставою для спотворення імунної відповіді макроорганізму. При ХТ різко знижуються рівень sIgA в ротоглотковому секреті, рівень рецепторів до регуляторних пептидів-цитокінів, зменшується кількість В-лімфоцитів — потенційних продуцентів sIgA та IgM, змінюється субпопуляційний склад Т-лімфоцитів, дендритних клітин [5]. Унаслідок таких відхилень змінюється загальний рівень протиінфекційного захисту, формуються імунопатологічні синдроми, що згодом спричиняють ускладнення з боку інших органів і систем.
Запальні процеси в глотці можуть бути викликані різними мікроорганізмами. Розвитку захворювання майже завжди сприяє зниження імунітету, у тому числі місцевого, викликане дією фізичних і хімічних факторів на слизову оболонку глотки. Проте використання системних препаратів, передусім антибіотиків, при низці запальних захворювань глотки є недоцільним, а часом і просто шкідливим. Це пояснюється тим, що, крім бактеріальних агентів, велику роль у патології хронічних хвороб глотки відіграють такі етіологічні фактори, як віруси, гриби й інші групи мікроорганізмів [1, 4].
Проблема зростання антибіотикорезистентності в сучасних умовах дає нагоду застосовувати інші ефективні засоби, що розглядаються як альтернатива антибіотикам, зокрема бактеріоцини, пробіотичні бактерії й бактеріофаги. Зокрема, саме лантибіотики в найближчому майбутньому можуть посісти гідне місце в арсеналі антимікробних засобів, що застосовуються лікарями в клінічній практиці. Варто зазначити, що лантибіотики — це протимікробні пептиди, до яких чутливі більшість грампозитивних бактерій і частково грамнегативні. Одним із першим лантибіотиків, що був відкритий ще у 20-х роках минулого сторіччя (Rogers & Whittier, 1928) як безпечний харчовий консервант, був нізин Z, який у високих концентраціях ефективний проти Esche–richia coli, Neisseria й Helicobacter pylori.
Дослідження щодо застосування лантибіотиків знову відновилися на тлі інтенсивно зростаючої антибіотикорезистентності, а саме зниження чутливості Staphylococcus aureus до метициліну, Enterococcus faecium до ванкоміцину, полірезистентності грамнегативних патогенів — Pseudomonas aeruginosa й ентеробактерій [7]. Із цього часу сотні лантибіотиків були відкриті й описані, але більшість із них виробляються грампозитивними бактеріями й широко застосовуються у харчовій промисловості для виробництва молочних продуктів.
Streptococcus salivarius K12 (SsK12; Bacteriocin-Like Inhibitory Substances К12 — BLIS K12) — пробіотичний штам, що належить до I класу лантибіотиків та інтенсивно пригнічує in vitro ріст Streptococcus pyogenes, Streptococcus pneumoniaе, Haemophilus influenzaе і Moraxella catarrhalis, які є одними з основних етіологічних чинників бактеріальних інфекцій респіраторного тракту в дітей [8]. Даний антагонізм перш за все пов’язаний із виділенням саліварицину А2 (бактеріостатик), що порушує синтез мембран бактерій і гальмує їх розмноження, і саліварицину В (бактерицид), що руйнує стінки клітин чутливих до них бактерій і призводить до їх загибелі. Лантибіотик характеризується вираженою антибактеріальною чутливістю й має високий профіль безпеки. Після перорального прийому SsK12 колонізує порожнину рота й носоглотки та зберігається там протягом місяця після прийому останньої дози, конкуруючи з патогенною мікрофлорою [9].
Завдяки спектру дії SsK12 і активності саліварицинів регулярне застосування препарату демонструє позитивний ефект щодо профілактики рецидивів фаринготонзилітів і отитів [3, 11]. Є також пілотні закордонні дослідження, що демонструють активність даного перорального пробіотика протягом тривалого періоду застосування (до 90 днів) щодо профілактики вірусних інфекцій шляхом індукції гамма-інтерферону, при цьому рівні інтерлейкіну-1β і фактора некрозу пухлини α залишаються незмінними [10]. Це дає можливість рекомендувати даний пробіотичний штам для профілактики не тільки респіраторних інфекцій у дітей, але й з хронічних хвороб глотки, що потребують клінічного й лабораторного підтвердження.
Саме тому метою даного дослідження була клінічна оцінка ефективності застосування лантибіо–тиків у дітей для профілактики рекурентних інфекцій глотки на основі визначення в них частоти рецидивів інфекції, пов’язаної з бета-гемолітичним стрептококом групи А (БГСА), ХТ, динаміки клінічного регресу симптомів гіпертрофії глоткового мигдалика (ГГМ), вивчення бактеріальної колонізації глотки впродовж 6 місяців після проведеного лікування у хворих.
Матеріали та методи
Проведено контрольоване проспективне відкрите рандомізоване за допомогою комп’ютерного розподілу моноцентрове клінічне дослідження, що включало обстеження 57 пацієнтів дитячого віку з рекурентними захворюваннями глотки. У 22 з них було діагностовано хронічний тонзиліт, у 17 дана інфекція була пов’язана із бета-гемолітичним стрептококом групи А, у 18 дітей виявлено гіпертрофію глоткового мигдалика.
Усі діти, залучені до дослідження, перебували на амбулаторному лікуванні у лор-відділенні міської дитячої клінічної лікарні № 1 м. Києва, що є базою кафедри дитячої оториноларингології, аудіології та фоніатрії Національної медичної академії післядипломної освіти імені П.Л. Шупика. Набір пацієнтів проводився із січня по березень 2018 року. Учасниками були діти молодшого шкільного віку (від 6 до 10 років). Хлопчиків було 33, дівчаток — 24, середній вік — 7,3 ± 1,5 року.
Клінічна оцінка хворих різних груп спостереження проводилась на основі даних анамнезу щодо рекурентності хвороб глотки, особливостей їх клінічного перебігу й регресу симптомів, швидкості досягнення лікувального ефекту при застосуванні стандартних методів терапії, наявності утруднення носового дихання при ГГМ.
Діагностика рекурентних хвороб глотки (РХГ) проводилась за клінічною шкалою McIsaac: за наявності ≥ 2 балів (лімфаденопатія, лихоманка 38 °С, відсутність кашлю, казеозно-гнійний ексудат у піднебінних мигдаликах, вік хворого) + підтвердження наявності БГСА за допомогою Streptatest. РХГ у дітей визначалися як три й більше загострення процесу протягом 6 місяців або понад чотири епізодів протягом 12 місяців.
Основну групу становили 36 дітей, яким амбулаторно призначали протирецидивну терапію РХГ. До групи контролю увійшов 21 пацієнт аналогічного віку (по 7 у кожній підгрупі), цим дітям профілактика рецидивів даних захворювань не проводилась (табл. 1).
Діти основної групи приймали лантибіотик (Бактобліс) за схемою відповідно до інструкції (по 1 табл. 1 раз на день безпосередньо перед сном, розсмоктуючи в порожнині рота) протягом 20 днів. Кожна таблетка препарату містить один мільярд одиниць, що утворюють колонії Streptococcus salivarius K12. Дослідження проходили в два етапи: І — період прийому препарату Бактобліс (30 днів); ІІ — катамнез, що включав спостереження за хворими протягом 6 місяців.
Критеріями включення в дослідження були: згода пацієнта брати участь у дослідженні й виконувати його вимоги; вік хлопчиків і дівчаток від 6 до 10 років; встановлений діагноз ХТ, ГГМ, підтвердження БГСА й відсутність загострення хронічного процесу в глотці.
Критеріями виключення дітей із дослідження були: наявність імунодефіцитних станів, уроджені захворювання бронхолегеневої системи, аномалії щелепно-лицевої ділянки, автоімунні захворювання, туберкульоз, а також виключались діти, яким була проведена операція на лімфаденоїдному глотковому кільці (аденотомія, аденотонзилотомія, тонзилектомія).
Усі обстежені діти перебували під динамічним спостереженням дитячого отоларинголога й педіатра з оцінкою показників локального статусу. Для порівняння результатів спостереження за дітьми з РХГ протягом 6 місяців було використано точний критерій Фішера й непараметричний U-критерій Манна — Уїтні.
Результати
Аналіз отриманих результатів щодо профілактики рецидивів РХГ, пов’язаних із БГСА, показав, що діти, які отримували Бактобліс протягом 30 днів, у період спостереження за ними протягом 6 місяців мали вірогідно менше епізодів рекурентних інфекцій (РІ), ніж до лікування (р < 0,05). Ці дані відображено в табл. 2.
Вивчаючи динаміку клінічного індексу, що характеризує хронічне запалення в групі дітей із ГГМ, проводили оцінку за такими критеріями: утруднене носове дихання, відкритий рот і храп під час сну, кашель, переважно вночі й зранку, виділення з носа, зниження слухової функції.
Отже, аналізуючи результати проведеного дослідження, встановили вірогідний регрес клінічної симптоматики ГГМ у групі дітей, які отримували Бактобліс, порівняно з групою хворих, які не отримували Бактобліс протягом 30 днів. Слід зазначити, що в перші дні лікування хворих тенденції до зменшення клінічних симптомів вірогідно не відрізнялись, однак при подальшому проведенні терапії й оцінки симптомів ГГМ у динаміці спостереження розрив клінічного індексу між групами значно збільшився.
У групі дітей із ХТ, які становили більшість пацієнтів у загальній групі обстежених хворих, вивчали ефективність профілактичного лікування SsK12 на основі визначення бактеріальної колонізації ротової частини глотки, зокрема ПМ. Так, усім дітям із ХТ (n = 22) було проведено бактеріологічне дослідження мазків із ротоглотки, результати якого відображено в табл. 3.
Як видно з табл. 3, вірогідної різниці за частотою виявлення бактерій і грибів у обох групах спостереження не відмічалось (р > 0,05). Однак бактеріологічні дослідження в дітей обох клінічних груп визначили стан мікробіоценозу ПМ, для якого було характерно те, що патогенні мікроорганізми практично не висівалися у вигляді монокультур, що вказувало на значне порушення стану колонізаційної резистентності в ПМ.
Після проведеного лікування SsK12 протягом 30 днів у дітей основної групи спостерігалась виражена позитивна динаміка, що характеризувалась вірогідним зменшенням колонізації Staphylococcus aureus і Streptococcus pneumoniae ПМ порівняно з дітьми, яким профілактика рецидивів РІ не проводилась.
Наступним етапом дослідження ефективності застосування лантибіотиків SsK12 у хворих дітей із РХГ було визначення частоти епізодів гострого назофарингіту (ГНФ), гострого фаринготонзиліту (ГФТ), гострого післявірусного риносинуситу (ГПРС) і гострого середнього отиту (ГСО) впродовж 6 місяців, включаючи період лікування, в усіх групах спостереження. Ці дані подано у табл. 4.
Отже, отримані дані, які подано у табл. 4, наочно демонструють позитивний ефект застосування лантибіотика SsK12 у профілактиці рекурентних епізодів РХГ у дитячому віці. Очевидним є факт ефективності препарату при спостереженні за хворими протягом 6 місяців, що підтверджено вірогідним зменшенням їх кількості в дітей основної групи.
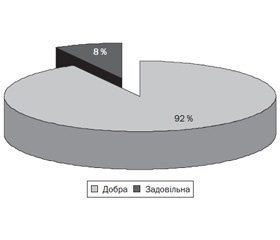
Щодо оцінки переносимості препарату Бактобліс слід відмітити відсутність побічних реакцій під час його застосування в дітей, що підтверджує його високий профіль безпеки й сприяє підвищенню комплаєнтності проведеного лікування. Ці дані наведено на рис. 2.
Обговорення
Враховуючи результати даного клінічного дослідження, варто зазначити, що питання застосування лантибіотиків у практичній діяльності лікаря — дитячого отоларинголога, педіатра залишаються відкритими, оскільки їх клініко-лабораторна ефективність потребує також підтвердження імунологічних механізмів реалізації даних клінічних ефектів.
Слід зазначити, що на сьогодні вже доведено факт здатності SsK12 моделювати імунну відповідь, реалізувати протизапальну й антивірусну активність [2]. Встановлений факт ефективної вторинної профілактики хронічних захворювань глотки, пов’язаних із наявністю на слизових оболонках лімфоепітеліальних структур БГСА, що обумовлено нормалізацією біоценозу в порожнині рота, представленого здебільшого в дитячому віці умовно-патогенною мікрофлорою, і характерною імунною компетенцією. Унаслідок цього проявляється протизапальний механізм дії, що пояснює позитивний клінічний ефект препарату Бактобліс при комплексному лікуванні таких хворих із ГГМ.
Встановлений хронічний осередок інфекції в ПМ і ГГМ є надзвичайно важливим тригером при виникненні рекурентних захворювань глотки, і це диктує необхідність застосування SsK12 для їх профілактики, що сприяє перш за все швидкому зменшенню бактеріальної колонізації глотки. При цьому важливим аспектом ефективності є дозозалежний ефект застосування лантибіотика не менше від 30 днів, а також призначення його повторних курсів через 6 місяців для забезпечення більш тривалої й стійкої ремісії РХГ.
Висновки
1. На основі отриманих результатів дослідження встановлено, що застосування лантибіотика SsK12 у дітей із РХГ при динамічному спостереженні протягом 6 місяців сприяє суттєвому зменшенню частоти загострень рекурентних інфекцій глотки, зменшенню потреби в прийомі антибіотиків і покращанню мікробіоценозу ПМ.
2. Призначення препарату Бактобліс протягом 30 днів в основній групі пацієнтів дозволило вірогідно зменшити клінічний індекс хронічного запалення ГГМ з 45 % (контрольна група) до 10 % (група, що приймала Бактобліс).
3. Отримані результати клінічного дослідження встановили високу ефективність Streptococcus salivarius K12, що розширює можливості його застосування в клінічній дитячій практиці й відкриває нові можливості профілактики рекурентних інфекцій глотки у дітей на амбулаторному та стаціонарному етапі лікування хворих.
4. З огляду на добру переносимість Streptococcus salivarius K12 і відсутність побічних явищ протягом 30-денного прийому, а також необхідність тривалого застосування з метою досягнення максимального терапевтичного ефекту рекомендовано проводити хворим повторні курси 2–3 рази на рік.
Конфлікт інтересів. Не заявлений.
Список литературы
1. Гавриленко Ю.В. Мікробіоценоз піднебінних мигдаликів у дітей, хворих на цукровий діабет 1 типу з наявністю хронічного тонзиліту / Ю.В. Гавриленко, А.А. Лайко, О.М. Головня // Журн. вуш., нос. і горл. хвороб. — 2014. — № 5. — С. 49-54.
2. Дитяча оториноларингологія: Підручник / За ред. А.А. Лайка. — К.: Логос, 2013. — 575 с.
3. Крючко Т.А. Можливості застосування лантибіотиків у профілактиці рекурентних інфекцій верхніх дихальних шляхів у дітей // Здоровье ребенка. — 2017. — Т. 12, № 8. — С. 2-7.
4. Леженко Г.О., Абатуров О.Є., Пашкова О.Є. Роль ендогенних антимікробних пептидів у бактеріальній колонізації носоглотки в дітей із гіперплазією ретроназальної мигдалини / Г.О. Леженко // Здоровье ребенка. — 2016. — № 6(74). —
С. 74-80.
5. Мельников О.Ф., Пелешенко Н.А., Заболотна Д.Д., Рыльская О.Г. Иммуномодуляция фитопрепаратами в терапии воспалительных заболеваний верхних дыхательных путей. — К., 2013. — 108 с.
6. Abazi B., Shaqiri B., Ajvazi H., Lutaj P. Clinical Impact of Chronic Tonsillitis on Weight and Height Parameters // Med. Arch. — 2015. — 69(5). — Р. 323-326.
7. Burton J.P. Evaluation of safety and human tolerance of the oral probiotic Streptococcus salivarius K12: a randomized, placebo-controlled, double-blind study / J.P. Burton, S. Cowley, R.R. Simon, J. McKinney, P.A. Wescombe, J.R. Tagg // Food Chem. Toxicol. — 2011. — 49(9). — 2356-2364. doi:10.1016/j.fct.2011.06.038.
8. Di Pierro F. Clinical evaluation of the oral probiotic Streptococcus salivarius K12 in the prevention of recurrent pharyngitis and/or tonsillitis caused by Streptococcus pyogenes in adults / F. Di Pierro, T. Adami, G. Rapacioli, N. Giardini, C. Streitberger // Expert Opin. Biol. Ther. — 2013. — 13(3). — 339-343. doi:10.1517/14712598.2013.758711.
9. Horz H.P. Distribution and persistence of probiotic Streptococcus salivarius K12 in the human oral cavity as determined by real-time quantitative polymerase chain reaction / H.P. Horz, A. Meinelt, B. Houben, G. Conrads // Oral Microbiol. Immunol. — 2007. — 22(2). — 126-130. doi:10.1111/j.1399-302X.2007.00334.x
10. Power D.A. Preliminary investigations of the colonisation of upper respiratory tract tissues of infants using a paediatric formulation of the oral probiotic Streptococcus salivarius K12 / D.A. Power, J.P. Burton, C.N. Chilcott, P.J. Dawes, J.R. Tagg // Eur. J. Clin. Microbiol. Infect. Dis. — 2008. — 27(12). — 1261-1263. doi:10.1007/s10096-008-0569-4.
11. Wescombe P.A. Developing oral probiotics from Streptococcus salivarius / P.A. Wescombe, J.D. Hale, N.C. Heng, J.R. Tagg // Future Microbiol. — 2012. — 7(12). — 1355-1371. doi:10.2217/fmb.12.113.

/42-1.jpg)
/41-1.jpg)
/42-3.jpg)
/42-2.jpg)