Журнал «Актуальная инфектология» Том 6, №4, 2018
Вернуться к номеру
Мікрофлора інфікованих ран, отриманих під час землетрусів
Авторы: Трихліб В.І.
Українська військово-медична академія, м. Київ, Україна
Рубрики: Инфекционные заболевания
Разделы: Справочник специалиста
Версия для печати
Резюме
Проведено огляд літератури щодо мікрофлори інфікованих ран, отриманих під час землетрусів.
Проведен обзор литературы относительно микрофлоры инфицированных ран, полученных во время землетрясений.
The article presents the review of literature on the microbiology of infected wounds received during the earthquakes
Ключевые слова
мікрофлора інфікованих ран; землетруси; огляд
микрофлора инфицированных ран; землетрясения
microbiology of infected wounds; earthquakes; review
Серед надзвичайних подій важливе місце посідають землетруси, що пов’язано зі значною кількістю загиб–лих, економічними збитками, можливістю виникнення спалахів інфекційних захворювань тощо.
З початку 1980-х років спостерігається збільшення кількості землетрусів і постраждалих. Близько 81 % найбільших землетрусів у світі відбулось у Тихоокеанському регіоні. Часті землетруси реєструвались у Північній та Південній Америці, Південно-Східній Азії, Східному Середземномор’ї. Але найбільший вплив землетрусів був у західній частині Тихого океану, на їх частку припадає близько 44 % смертей і 60 % постраждалих. За даний період від землетрусів постраждало близько 61,5 млн осіб, у тому числі 16 млн стали безхатченками.
Прикладів катастрофічних землетрусів багато. Так, у 1967 р. 250 тис. людей стали жертвами дуже сильного Тянь-Шанського землетрусу в Китаї. У 1980 р. 3 тис. людей загинули під час землетрусу в Італії; 2,5 тис. осіб — у 1981 р. в Іраку; понад 25 тис. — у 1988 р. у –Вірменії; понад 2 тис. осіб — у 1995 р. на Сахаліні (РФ); понад 14 тис. — у 1999 р. в Афганістані.
У постраждалих фіксувалась значна кількість травм. Травми реєструвались лише в 56,9 % випадків, усього їх було близько 995 219 (діапазон: 845 345–1 145 093). Із 687 землетрусів зі смертельними наслідками тільки в 61 % випадків була надана інформація про травми. Орієнтовно під час 267 землетрусів зареєстровано від 29 392 до 1 267 864 травм, окрім того, за цей час були й землетруси, про які не сповіщалось. Найбільше смертей відбулось у будинках. Ступінь руйнування будинків був предиктором коефіцієнту смертності. Також на частоту травм впливають і такі фактори: під час землетрусів уночі, у вихідні дні, свята (коли люди знаходяться у приміщеннях) реєструється більше травмованих, ніж коли подія реєструється в будні і вдень [1].
Cеред травм переважали ураження м’яких тканин і переломи, переважно кінцівок. Реєструвалась і значна кількість випадків синдрому розтрощення. В Ірані переломи кінцівок зареєстровані в 19 %, переломи хребта — у 4 % осіб. На Гаїті переважали травми колін, гомілок, щиколоток, стоп (36 %), травми голови (18 % постраждалих). У дітей частіше реєструвались травми колін, гомілок, щиколоток, стоп — у 19 %, травми черевної порожнини, нижньої частини спини, поперекового відділу хребта, таза, стегон — у 15 %. У Перу поширеними були переломи кінцівок. У Китаї — тупі травми, травми внаслідок падіння, найбільш часто уражались нижні кінцівки (у 39 % осіб), переважали переломи нижніх кінцівок, таза, хребта. У Пакистані переважали травми нижніх кінцівок (у 66 % осіб), переломи, зареєстровані в 52 % поранених, також були травми верхніх кінцівок і комбіновані травми [2].
У регіонах землетрусів в ураженого населення під час обстеження відзначалося зниження резистентності до інфекційних захворювань, що сприяло зростанню рівня захворюваності на ряд інфекційних захворювань. Навіть за відносно сприятливої епід–обстановки до початку землетрусу на постраждалій території спостерігалося зростання захворюваності з повітряно-крапельним механізмом передачі порівняно з аналогічним періодом до події. Усе це було обумовлено впливом факторів ризику: перебуванням людей на вулиці, сприйнятливістю до зараження у зв’язку зі стресом.
При землетрусах епідеміологічна обстановка додатково обтяжується за рахунок приєднання вторинних факторів ризику (повені, аварії на хімічно небезпечних об’єктах тощо). Так, під час землетрусу (потужністю 6,5 бала) 25 травня 2003 року у Рискуловському районі Жамбильської області Казахстану було зруйновано понад 60 % приватних будівель, пошкоджені водопроводи, лікувальні установи, об’єкти харчування й торгівлі. Дослідженнями встановлено, що в регіоні землетрусу 9,3 % проб питної води за бактеріологічними показниками не відповідали гігієнічним вимогам.
Яскравим прикладом впливу землетрусу на рівень інфекційної захворюваності був і землетрус у 1948 р. у районі Ашгабату (Туркменістан). Населення втратило житло, були зруйновані електростанції, водопровід, каналізація, банно-пральні установи. Склалася надзвичайно тяжка й складна обстановка. Для тимчасового проживання людей, які залишилися без житла, були створені наметові містечка, організовано харчування, водопостачання та медичне забезпечення. У результаті вжитих заходів вдалося уникнути розвитку великих епідемій інфекційних хвороб, проте значне погіршення санітарно-епідеміологічної обстановки в місті в результаті руйнування епідеміологічно значущих об’єктів істотно загострило епідеміологічну ситуацію з ряду інфекцій. У 1949 р. порівняно з 1948 р. захворюваність на черевний тиф в Ашгабаті зросла на 36 %, на дизентерію — на 22 %, на дифтерію — на 30 %, на скарлатину — на 15 %, на кір — на 43 %.
Окрім інфекційних захворювань, постраждалі мог–ли мати тяжкі порушення дихання, кровообігу; ураження голови, шиї (30 %); внутрішніх органів, грудної клітини, хребта, спинного мозку, третина з яких потребувала хірургічного втручання. Частка постраждалих із закритими переломами, розтягненнями, відкритими переломами, ураженням судин і нервів, за даними P. Wuthisuthimethawee et al. (2015), становила 22, 6, 11–54 і 6 % [3].
Частка синдрому розтрощення серед постраждалих, які одужали, становила від 2 до 15 %. При синдромі розтрощення розвивалась гостра ниркова недостатність на фоні гіповолемії, рабдоміолізу у зв’язку з ураженням м’язів, їх ішемією тощо. Вважається, що скелетні м’язі є толерантними до ішемії протягом 2–4 годин, у той же час необоротні зміни можуть розвиватись протягом 1 години, особливо при комбінованих ураженнях. Смертельні випадки часто стають наслідком гіповолемії, гіперкаліємії. Летальність могла доходити до 48 %. Одужання залежало від кількості уражених органів і систем організму, ступеня порушення їх функцій. Прогностичними критеріями розвитку ниркової недостатності були: час знаходження під уламками, множинні травми, чоловіча стать, наявність інфікування, рівень креатинкінази. Креатинфосфокіназа є чутливим біохімічним маркером, збільшення її понад 5000 Од/л є кращим предиктором розвитку гострої ниркової недостатності із смертністю від 14 до 48 %, а при рівні її 20 000 Од/л необхідно терміново починати лікування. Визначення міоглобіну також є корисним при проведенні сортування постраждалих. З метою покращення лікування, ранньої діагностики ускладнень також пропонується при лікуванні постраждалих 3–4 рази на день проводити визначення в сироватці крові рівня калію, креатинфосфокінази, рН артеріальної крові, моніторинг серцевої діяльності. Встановлено, що раннє призначення інфузійної терапії може сприяти запобіганню розвит–ку гострої ниркової недостатності. При її проведенні слід забезпечувати форсований діурез із досягненням виділення сечі по 100–200 мл/год, підлужнювати сечу (рН 6,5 і більше), підтримувати артеріальну рН < 7,5. Гемодіаліз призначати при рівні креатиніну більше ніж 1,5 мг/дл [3]. Встановлено, що при розвитку гострої ниркової недостатності зростає ризик розвитку інфекційних ускладнень.
Крім того, під час землетрусів у постраждалих реєструється значна кількість поранень з ураженням шкіри, м’яких тканин, кісток, їх руйнуванням, забрудненням брудом, піском, екскрементами тощо. Велика частка інфікованих ран обумовлена забрудненням, значним ураженням тканин, неадекватною або відстроченою очисткою й хірургічною обробкою ран, передчасним закриттям ран. Встановлено, що відстрочена хірургічна допомога, обробка ран пізніше ніж через 24 години після отримання травми, раннє закриття ран були незалежними предикторами вторинної ранової інфекції.
З урахуванням того, що землетруси періодично реєструються в Україні, а також значної кількості осіб, які перебувають у районах у зоні ризику землетрусів, де відбуваються значні руйнування, і які можуть постраждати, метою даної роботи було встановити перелік –мікрофлори інфікованих ран, отриманих під час землетрусів, з метою покращання наслідків лікування.
Проведено огляд літератури стосовно мікрофлори інфікованих ран, отриманих під час землетрусів.
Серед постраждалих у Веньчуані у 2008 році 66,7 % осіб були інфіковані через 48 годин після землетрусу. Ці особи тривалий час перебували під уламками. Встановлено, що тривалість перебування під уламками, ниркова недостатність, фасціотомія — фактори ризику розвитку інфікування [4]. На ранні терміни інфікування також вказують T. Wang et al. (2010). За їхніми даними, у 92,8 % постраждалих інфікування відбулось через 48 годин після госпіталізації [5].
З посиланням на одне дослідження R. Kazancioglu et al. (2002) вказують, що у 81 % прооперованих, яким була проведена фасціотомія, відбулось інфікування, і в подальшому це стало причиною розвитку сепсису, від якого померло 22 % осіб [6].
При вивченні мікрофлори з ран було встановлено, що патогени, які були виділені з ран під час землетрусу у 2008 р. у Китаї, відрізнялись від мікрофлори, що виділялась до події. До початку землетрусу із ран переважно виділялись такі збудники: Escherichia coli (27 %), Staphylococcus aureus (23 %), коагулазонегативні стафілококи (9 %). У 62 % постраждалих дітей з інфікованими ранами було виявлено зростання збудників, причому приблизно в половини виявлена мікст-інфекція. Через місяць після землетрусу в постраждалих виділялась така флора: грампозитивна — у 16,16 %, грамнегативна — у 81,82 % (81 штам), гриби — у 2,02 % (16 штамів). Серед грампозитивної флори виділялись Staphylococcus aureus (5 штамів, 5,05 %), Enterococcus faecalis (3 штами, 3,03 %), Enterococcus faecium (2 штами, 2,02 %); серед грамнегативних, як правило, виділялись Acinetobacter baumanii (27 штамів, 27,27 %), Enterobacter cloacae (18 штамів, 18,18 %), Pseudomonas aeruginosa (13 штамів, 13,13 %). Acinetobacter baumanii був найбільш поширеним збудником, що виділявся з ран. Він також пов’язаний з тривалим лікуванням й ускладненим перебігом у зв’язку з високою резистентністю до різноманітних антибіотиків [7, 8].
За іншими даними, протягом місяця після землетрусу переважно виділялись: Acinetobacter baumannii (16,7 %), Staphylococcus haemolyticus (16,7 %), Escherichia coli (12,5 %), Klebsiella pneumoniae (12,5 %) і Candida tropicalis (8,3 %), у той же час протягом місяця до події реєструвались: Escherichia coli (18,2 %), Staphylococcus aureus (11,4 %), Candida glabrata (11,4 %), Klebsiella pneumoniae (11,4 %) і Staphylococcus epidermidis (9,1 %) [9].
Як вказують Т. Wang et al. (2010), при обстеженні ран постраждалих були виділені грамнегативні, грампозитивні збудники й гриби (72,4; 20,0 і 7,6 % ізолятів відповідно) [5]. Також за даними С. Tao et al. (2009), із ран виділялись переважно грамнегативні збудники — у 73,2 %, грампозитивні — у 24,4 % [10].
За даними інших досліджень, із відібраних зразків постраждалих в 67,2 % випадків була виділена флора, причому з ран — у 55,2 %, із легень — у 37,9 %. Серед них основними ізолятами з ран були Acinetobacter baumannii, Pseudomonas aeruginosa [5]. Із грампозитивної флори найбільш часто виділявся Staphylococcus aureus [4, 10].
Найбільш поширеними збудниками при розтрощених ранах були представники грамнегативної флори (67 %), зокрема Acinetobacter (36 % зразків), Pseudomonas aeruginosa (21 %), грампозитивні коки (17 %), Enterobacter (12 %). Прикладом є такі дані: після землетрусу у 2008 р. у Веньчуані, Китай, у 50 із 98 поранених дітей розвинулись ранові інфекції. Acinetobacter baumanii, Enterobacter cloacae, P.aeruginosa були найбільш поширеними патогенами. У той же час до землетрусу інфекції частіше викликались Escherichia coli, Staphylococcus aureus.
При синдромі розтрощення після землетрусу з ран виділялись неферментуючі грамнегативні збудники (у 67 % постраждалих), грампозитивні коки (12 %), ентеробактеріальні й дріжджоподібні гриби (4 %) [6].
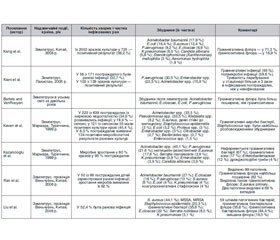
Сумарні дані щодо збудників з інфікованих ран, пов’язаних зі надзвичайними ситуаціями, подані в табл. 1 (Wuthisuthimethawee P. et al., 2015) [3].
Із виявлених збудників 40,9 % були мультирезистентними. Тому Т. Wang із співавт. (2010) зробили висновок, що постраждалі із синдромом розтрощення є групою підвищеного ризику інфікування й важкого лікування [5].
Після землетрусу мультирезистентні форми реєструвались значно частіше, ніж до нього. Так, частіше виділялись метицилінрезистентні Staphylococcus aureus, збудники, які продукують бета-лактамази розширеного спектра: E.cloacae, E.coli, Klebsiella pneumoniae, а також A.baumannii [7, 8].
Рівень виявлення MRSA після землетрусу був нижче, а Escherichia coli, Klebsiella pneumoniae й Klebsiella oxytoca, які продукують бета-лактамази поширеного спектра, — значно вище, ніж у звичайних хірургічних хворих до землетрусу [9].
Acinetobacter (36 %), Pseudomonas aeruginosa (21 %) — основні ізоляти з розтрощених ран — були стійкі до карбапенемів, але чутливі до хінолінів. Встановлено, що під час тривалого лікування змінювалась флора. З крові й катетерів виділялись MRSA, грампозитивні коки, неферментуючі грамнегативні збудники [6].
Отримані рани можуть вплинути на діяльність багатьох внутрішніх органів, викликати масивні кровотечі з розвитком геморагічного шоку. Тому важливими етапами в наданні медичної допомоги були: рання медична допомога, спрямована на забезпечення вільного дихання, адекватної вентиляції легень, зупинка кровотечі.
Дослідниками пропонується при наданні медичної допомоги в першу чергу оцінити наявність загрозливих станів у постраждалого, вжити заходів для стабілізації стану й уже потім надавати допомогу стосовно травм кінцівок. Перевіряється стан ран, ураження кісток, суглобів, ураження судинно-нервового пучка. Тяжкі ураження реєструються приблизно в 1 з 20 постраждалих. При оцінці стану ран оцінюється ступінь забруднення, кількість девіталізованих тканин, наявність сторонніх тіл, що може вплинути на обсяг хірургічної допомоги. Як правило, рани закриваються із затримкою. У нечастих випадках, коли було проведено ретельне обстеження рани, видалення девіталізованих тканин проводилось протягом 6 годин після травми. У випадках локалізації ран у ділянці обличчя, шиї, кінцівок постраждалі повинні отримувати лікування згідно з принципами надання медичної допомоги щодо ризику розвитку ранньої інфекції більше ніж 50 %. Очистка ран, проведення їх ревізії протягом 48 годин після отримання травми дозволяє запобігти значній кількості ранових інфекцій. У випадках, коли при повторній перевірці ран є еритема, гнійний ексудат, некротичні маси, набряк м’яких тканин, що є протипоказанням для закриття рани, необхідно провести їх повторну обробку, проводити антибактеріальну терапію з наступною ревізією через 48 годин.
Постраждалі з відкритими переломами повинні отримати раннє лікування антибактеріальними препаратами й профілактику правця. З урахуванням проведених результатів досліджень слід проводити екстрену антибіотикопрофілактику, яка буде спрямована на різноманітну мікрофлору, але в більшості випадків — на грамнегативну. При її застосуванні рекомендують комбіновану антибіотикотерапію.
Як вказують P. Wuthisuthimethawee із співавт. (2015), профілактичне застосування фузидієвої кислоти, флуклоксациліну, еритроміцину ефективне для запобігання інфікуванню шкіри й м’яких тканин. За даними різноманітних досліджень, патогенна флора має антибіотикорезистентність до амоксиклаву/клавуланату, цефтріаксону, клоксациліну. У той же час мікрофлора була чутлива до аміноглікозидів (гентаміцину, амікацину), піперациліну-тазобактаму, цефалоспоринів третього й четвертого поколінь, хінолінів, іміпенему, меропенему. Профілактика антибіотиками широкого спектра сприяє зниженню інфікування й швидшому загоєнню ран. У випадках, коли першочергові антибактеріальні препарати неефективні, до них підключають хіноліни [3].
До осіб із високим ризиком розвитку правця належать постраждалі, які мають великі рани (більше від 1 см, розірвані) із значною кількістю девіталізованих тканин, значно забруднені брудом, слиною, фекаліями, коли медична допомога не надавалась понад 6 годин. Для профілактики правця важлива правильна рання хірургічна обробка ран. Профілактика правця залежить від стану імунізації. Якщо статус імунізації невідомий, поранений отримав менше ніж три дози правцевої вакцини, слід призначати протиправцеву сироватку, анатоксин і протиправцевий імуноглобулін. Другу дозу сироватки, анатоксину слід призначити протягом наступних 2 місяців, третю — через 6–12 міс. У випадку, коли є завершена імунізація протягом попередніх 5 років, не треба вводити протиправцеву сироватку, анатоксин або імуноглобулін. Якщо завершена імунізація була проведена більше ніж 5 років до поранення, постраждалим слід призначати одну дозу протиправцевого анатоксину. Діти (до 7 років) можуть бути щеплені проти дифтерії, кашлюку, правця замість протиправцевого анатоксину [3].
Висновки
Флора в інфікованих ранах залежала від країни, де відбувся землетрус, та часу після події. Найбільш поширеним збудником в інфікованих ранах була грамнегативна флора. Також реєструвались полімікробні асоціації. Після землетрусу мультирезистентні форми реєструвались значно частіше.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Doocy S. The Human Impact of Earthquakes: a Historical Review of Events 1980-2009 and Systematic Literature Review / S. Doocy, A. Daniels, C. Packer, A. Dick, T.D. Kirsch [Електронний ресурс]. — Режим доступу: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3644288.
2. Motamedi M.H.K. Major Earthquakes of the Past Decade (2000–2010): A Comparative Review of Various Aspects of Management / M.H.K. Motamedi, M. Sagafinia, A. Ebrahimi, E. Shams, M.K. Motamedi // Trauma Mon. — 2012. — Vol. 17(1). — P. 219-229.
3. Wuthisuthimethawee Prasit. Wound Management in Disaster Settings / Prasit Wuthisuthimethawee, Samuel J. Lindquist, Nicola Sandler, Ornella Clavisi, Stephanie Korin, David Watters, Russell L. Gruen / World J. Surg. — 2015. — Vol. 39(4). — P. 842-853.
4. Infections in crush syndrome: a retrospective observational study after the Wenchuan earthquake / Chen X., Zhong H., Fu P., Hu Z., Qin W., Tao Y. // Emerg. Med. J. — 2011. — Vol. 28(1). — P. 14-7.
5. Wang T. The microbiological characteristics of patients with crush syndrome after the Wenchuan earthquake / Wang T., Li D., Xie Y., Kang M., Chen Z., Chen H., Fan H., Wang L., Tao C. // Scand. J. Infect. Dis. — 2010. — Vol. 42(6–7). — P.479-83.
6. Kazancioglu R. The characteristics of infections in crush syndrome / Kazancioglu R., Cagatay A., Calangu S., Korular D., Turkmen A., Aysuna N., Sahin S., Bozfakioglu S., Sever M.S. // Clin. Microbiol. Infect. — 2002. — Vol. 8(4). — P. 202-6.
7. Ran Y.C. Distribution and drug resistance of pathogenic bacteria isolated from infected wounds of children after Wenchuan earthquake / Y.C. Ran, X.X. Ao, L. Liu, Y.L. Fu, H. Tuo, F. Xu // Zhonghua Er Ke Za Zhi. — 2009. — Vol. 47(5). — P. 332-7. — Режим доступу: https://www.ncbi.nlm.nih.gov/pubmed/19573398.
8. Microbiological study of pathogenic bacteria isolated from paediatric wound infections following the 2008 Wenchuan earthquake / Ran Y.C., Ao X.X., Liu L., Fu Y.L., Tuo H., Xu F. // Scand. J. Infect. Dis. — 2010. — Vol. 42(5). — P. 347-50. — Режим доступу: https://www.ncbi.nlm.nih.gov/pubmed/20095936.
9. Etiology of infections in the wounded victims of Wenchuan Earthquake / Xie Y., Chen Z.X., Tao C.M., Kang M., Chen H.L., Fan H., Wang L.L. // Zhonghua Yi Xue Za Zhi. — 2009. — Vol. 17, № 89(6). — Р. 366-70. — Режим доступу: https://www.ncbi.nlm.nih.gov/pubmed/19567109.
10. Tao C. Microbiologic study of the pathogens isolated from wound culture among Wenchuan earthquake survivors / Tao C., Kang M., Chen Z., Xie Y., Fan H., Qin L., Ma Y. // Diagn. Microbiol. Infect. Dis. — 2009 Mar. — 63(3). — 268-70.

/183-1.jpg)