Фіброз печінки — особливий стан, що розвивається у відповідь на її тривале ушкодження. За печінкового фіброгенезу паренхіма органа зазнає фундаментальної перебудови, що характеризується прогресивним накопиченням екстрацелюлярного матриксу (ЕЦМ), а при поглибленні патологічного процесу — розвитком цирозу — вузлової регенерації печінкової паренхіми [1].
Патофізіологія фіброзу
Фіброгенез обумовлений постійним пошкодженням печінки через численні механізми та може розглядатися як надмірна реакція у відповідь на запалення та некроз гепатоцитів. Прогресування від нормального стану печінки до її цирозу потребує 15–20 років безперервного ураження, у результаті чого кількість ЕЦМ збільшується у сім разів [2]. Саме ця тканина витісняє нормальну паренхіму, призводить до функціональної недостатності печінки та перебудови системи кровопостачання, результатом чого є виникнення портальної гіпертензії (ПГ).
Основним джерелом позаклітинного матриксу є міо–фібробласти — фібробластоподібні клітини з контрактильними здатностями різного походження, які після активації починають синтезувати ЕЦМ. Якщо в нормі сполучну тканину печінки здебільшого становить колаген ІV та VІ типу, то в процесі фіброгенезу міофібробласти продукують патологічний фібрилярний колаген І, ІІІ типу та фібронектин. Відкладання цих елементів в ендотелії та просторі Діссе призводить до так званої капіляризації синусоїдів, появи в них базальної мембрани, що в нормі відсутня, та розвитку ПГ [3]. Зміни в ендотелії синусоїдів є чинником ендотеліальної дисфункції, що робить внесок у поглиблення ПГ шляхом підвищення синтезу вазоконстрикторів (ендотеліну та тромбоксану А) та пригнічення продукції вазодилататорів (нітриту азоту) [4].
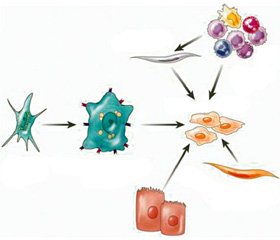
Пул міофібробластів в основному (80–96 %) становлять активовані печінкові зірчасті клітини (ПЗК) (рис. 1). Крім ПЗК міофібробластну активність проявляють також портальні міофібробласти: вони відповідальні за фіброгенез при холестатичних захворюваннях, тому що розташовані навколо біліарних та портальних трактів, та міофібробласти, що мають кістково-мозкове походження [5]. В експериментальних дослідженнях продемонстровано можливість переходу мезотеліальних клітин на поверхні печінки в міофібробласти, наприклад, при ушкодженні гепатоцитів тетрахлоретаном (так званий мезотеліально-епітеаліальний перехід (МЕП)) [6]. Також обговорюють можливість того, що самі гепатоцити та холангіоцити здатні через епітеліально-мезенхімальне трансдиференціювання (ЕМТ) перетворюватись у міофібробласти, але можливість їх у подальшому секретувати ЕЦМ ще не доведена [7–9].
У підтримці міофібробластів у постійному активованому стані для безперервного фіброгенезу беруть участь численні механізми, що сприяють некрозу та апоптозу гепатоцитів, виникненню запалення, виділенню медіаторів, цитокінів та хемокінів.
Схема цих подій така: тривалий вплив патогенів (вірусів, токсинів, жовчних кислот, автоантитіл) індукує ураження гепатоцитів та їх апоптоз; у відповідь запускається реакція, що призводить до запалення та депозиції позаклітинного матриксу. По суті, це захисна реакція, що спочатку відмежовує здорову тканину від уражених ділянок, але при тривалій дії патогенів лізис ЕЦМ відстає від його утворення та дієздатна паренхіма замінюється елементами нефункціонуючої сполучної тканини. У результаті паракринної дії цитокінів/хемокінів активуються різноманітні сигнальні шляхи, що викликають проліферацію, міграцію та диференціацію мезенхімальних клітин-попередників (так званих перицитів та резидентних фібробластів) у фіброгенні фібробласти та підтримують їх активований стан [11, 12].
Антифібротичні стратегії полягають або у пригніченні проліферації ПЗК, або у стимуляції їх апоптозу, крім того, доцільною є боротьба з наслідками активації фібробластів, а саме зниження продукції колагену та прискорення його деградації [13].
Вплив похідних солодки на загальні механізми фіброгенезу
Локриця (Glycyrrhí́za glábra) добре відома в традиційній китайській медицині. У Китаї вона зветься gancaо — «солодка трава», про її властивості згадується в трактаті Шень-Нуна ще близько двох тисячоліть до нашої ери. Локриця містить понад 20 тритерпеноїдів і близько 300 флавоноїдів. Серед них основні терапевтичні властивості мають гліциризин (ГЛ) та 18β-гліциризинова кислота, наступні за значущістю — ліктиригенін, лікохалкон A, лікохалкон E, глабридин. Як у китайській фармакопеї, так і в традиційній європейській медицині серед складових солодки здебільшого використовується саме ГЛ. В організмі він гідролізується на фармакологічно активні метаболіти — гліциризинову кислоту, що пригнічує 11β-гідроксистероїд дегідрогеназу та інші ензими, що залучені в метаболізм кортикостероїдів. Різні дослідження виявили такі його властивості, як противірусна та антимікробна активність, здатність гальмувати розвиток раку тощо [14]. Внутрішньовенні інфузії ГЛ почали використовуватись у Японії для лікування хронічних гепатитів та цирозів печінки ще з 1977 року.
Численними, у тому числі експериментальними дослідженнями доведено багатогранну дію ГЛ на різні шляхи фіброгенезу. Він бере участь як у пригніченні активації ПЗК, так і в деградації ЕЦМ. Стимули, що надходять унаслідок апоптозу клітин, слугують одним із факторів збудження ПЗК та запуску фіброгенезу. Апоптоз паренхімальних клітин відіграє важливу роль в ініціації та підтримці активації ПЗК. У той же час апоптоз саме ПЗК — корисна подія, оскільки при зменшенні кількості цих клітин відбувається пригнічення печінкового фіброзу. Таким чином, позитивним є як пригнічення апоптозу паренхіматозних клітин, так і активація апоптозу зірчастих клітин [15]. Низкою експериментальних робіт показано, що під дією ГЛ зменшується експресія каспаз, особливих протеаз, що відіграють центральну роль у механізмі апоптозу [16]. Каспази розподіляються на прозапальні і проапоптотичні залежно від їх участі в цих клітинних програмах. Вони синтезуються як інертні зимогени у вигляді проферментів і після одержання апоптичних стимулів протеолітично розщеплюються та перетворюються в ефекторні каспази-3, -6 і -7. Bo Liang, Xiao-Ling Guo з колегами досліджували дію ГЛ на апоптоз ПЗК. Для виявлення апоптотичних клітин ними використовувався TUNEL-метод. Порівнювались тканини експериментальних щурів, що зазнали дії CCl4. У групі після лікування ГЛ кількість TUNEL-позитивних (апоптотичних) клітин була значно зменшена порівняно з групою без лікування, що доводило зниження експресії розщепленої каспази-3 як типової ознаки апоптозу. Експресія α-SMA — маркера активованих ПЗК — та мРНК була значно підвищеною після дії CCl4 та знижувалась після терапії ГЛ [17]. Інші роботи довели зменшення апоптозу шляхом пригнічення ГЛ фактора транскрипції — білка р53. Цей білок акумулюється в гепатоцитах при різних дифузних захворюваннях печінки та бере участь у транскрипції генів, що сприяють апоптозу — P21, PUMA, NOXA та Bax [18]. І якщо у випадку канцерогенезу цей протеїн є захисним фактором, бо сприяє знищенню дефектних клітин, то в інших умовах він призводить до посилення фіброгенезу. Так, його синтез збільшується при інтенсивному запаленні на фоні зниження продукції антиапоптотичного білка Bcl-2 при неалкогольному стеатогепатиті. Результати досліджень X.L. Guo, B. Liang, X.W. Wang та співавт. показали, що при тіоацетамід-індукованому печінковому фіброзі та цирозі відбувається активація р53, у результаті чого збільшується вміст каспази-3, білків Вах та Bad. ГЛ супресує активність р53, результатом чого є зростання Bcl-2 — блокатора апоптотичного білка Вах та відповідне зменшення Bax [19].
І навпаки, ГЛ дозозалежно індукує апоптоз ПЗ шляхом блокування транслокації NF-κB до ядра. Так, експеримент in vitro виявив, що ГЛ впливає на клітинний цикл, пригнічуючи фазу циклу G2/M, а саме кінцевий етап підготовки клітини до ділення, саме в такій спосіб індукуючи апоптоз ПЗК. NF-κB — ключовий компонент клітинної відповіді на велику кількість екстрацелюлярних стимулів. Оскільки цей протеїн є потужним транскрипційним фактором в активації ПЗК, його пригнічення призводить до зниження вищезазначеної фази мітозу та може викликати запрограмовану смерть зірчастих клітин [20].
При фіброзі існує дисбаланс між деградацією та продукцією позаклітинного матриксу, у результаті чого значно підвищується рівень колагену І та ІІІ типів. Активація ПЗК призводить до переходу їх в особливий проліферативний, фіброгенний стан, у якому ці клітини можуть синтезувати велику кількість колагену вищезазначених типів, що відкладається в субендотеліальному просторі Діссе [1, 21]. Головним медіатором у формуванні матриксу є фактор росту сполучної тканини (CTGF), що синтезується як гепатоцитами, так і ПЗК. CTGF також відіграє роль в епітеліально-мезенхімальному переході та збільшенні кількості фібробластів [22]. У дослідженні Bo Liang, Xiao-Ling Guo, Jing Jin та співавт. виявлено, що експресія колагену та відкладання його у вигляді сполучної тканини після дії CCl4 значно підвищувалися, а після лікування ГЛ вірогідно знижувались порівняно із групою, яка не отримувала препарат. Це супроводжувалось зниженням експресії CTGF [17].
TGF-β1 є іншим найбільш профіброгенним цитокіном, що поряд із CTGF стимулює перехід ПЗК у активний стан — міофібробластоподібний фенотип, експресію колагену І типу та модулює гомеостаз ключових елементів ЕЦМ [23]. Підвищення в тканинах TGF-β1 при фіброгенезі вже доведено численними дослідженнями. Castilla et al. встановили, що експресія мРНК TGF-β1 тісно корелює з експресією мРНК проколагену І, ІІІ типу та індексом гістологічної активності [24]. Y. Qu, L. Zong, M. Xu з колегами в експерименті на щурах показали, що ГЛ пригнічує транскрипцію мРНК та синтез цих видів колагену у цитоплазмі гепатоцитів за рахунок руйнування сигнальних шляхів TGF-β/Smad [25].
ГЛ є потужним антифібротичним засобом і завдяки впливу на імунні клітини. Так, C.T. Tu, J. Li, F.P. Wang досліджували ефект ГЛ на Т-клітини в печінці та селезінці мишей в експерименті після дії конканаваліну протягом 8 тижнів. Миші, які отримували ГЛ, були захищені від печінкового запалення та фіброзу. ГЛ запобігав інфільтрації T-хелперами (Th) 1, 2, 17 типів та регуляторними Т-клітинами (Treg) печінки та селезінки в моделі мишачого фіброзу, регулював баланс лімфоцитів Th1/Th2 та Treg/Th17 із відносним домінуванням в печінці ліній Th1 і Treg. Крім того, під дією ГЛ підвищувалися рівні антифібротичних цитокінів інтерферону γ (IFN-γ) та інтерлейкіну (IL) 10. Автори показали вплив ГЛ на сигнальні шляхи, завдяки яким регулюється транскрипція цитокінів та синтез мРНК у ядрі гепатоцитів [26].
У процесі синтезу міофібробластами патологічного колагену відбувається деградація нормального матриксу в екстрацелюлярному просторі. Так, активовані ПЗК генерують металопротеїнази (МПП) 2, 3, 9, які руйнують базальну мембрану, відбувається додаткове залучення запальних клітин до місця ураження [27–29]. У вищевказаному дослідженні Bo Liang, Xiao-Ling Guo, Jing Jin та співавт. було показано, що лікування ГЛ зменшувало експресію цих металопротеїназ, призводило до зниження запальних сигналів та запобігало пошкодженню ендотелію у просторі Діссе [17].
Гліциризин при фіброзі печінки вірусного походження
Відомо, що хронічне ураження гепатотропними вірусами — один із головних факторів ризику фіброзу печінки [30]. Незважаючи на розвиток ефективних противірусних засобів прямої дії, популяційні рівні ерадикації неможливо буде досягнути ще декілька десятиріч. Тому гальмування фіброзу печінки в цієї категорії пацієнтів ще залишається досить актуальною задачею. Вірусні гени та протеїни можуть прямо або побічно впливати на активацію ПЗК. І хоча вірус гепатиту С не інфікує саме ПЗК, його ядерні та структурні протеїни індукують запальні та профібротичні шляхи, що діють на ПЗК. Вірус С впливає на активність ПЗК, а отже, і на фіброгенез за допомогою декількох механізмів. Ядерний антиген вірусу стимулює експресію інтерлейкіну-34 та фактора росту макрофагів (M-CSF). Ці два цитокіни промотують дозрівання периферичних моноцитів до макрофагів, а останні, у свою чергу, є стимуляторами ПЗК за допомогою TGF-β1 та фактора росту тромбоцитів бета (PDGF-β). Крім того, макрофаги роблять внесок у розвиток фіброзу, стимулюючи синтез матриксної металопротеїнази 1 (ММР-1) та пригнічуючи синтез антифіброгенного цитокіну — IFN-γ натуральними кілерами (NK) [31, 32]. Крім того, фрагменти вірусу С стимулюють експресію протеїну позаклітинного матриксу — тромбоспондину-1, що впливає на жорсткість ЕЦМ, та поглиблюють явища ПГ [33, 35].
Щодо гепатиту, асоційованого з вірусом В, то, як показано в експериментальних дослідженнях, фрагмент ядерної оболонки вірусу — HBeAg безпосередньо індукує активацію та проліферацію ПЗК у щурів in vitro через TGFβ, а ядерні протеїни core та X активують клітини людини LX-2 через фактор росту тромбоцитів (PDGFβ) [34].
Нормалізація рівня трансаміназ у хворих на хронічний гепатит С (ХГС) після лікування ГЛ була продемонстрована ще у 90-х роках [36, 37]. Внутрішньовенне введення ГЛ знижувало рівні печінкових ензимів та клітинне ураження в інфікованих пацієнтів [37, 38]. У дослідженні Melhem та співавт. 50 пацієнтів із ХГС протягом 20 тижнів перорально отримували суміш семи антиоксидантів (ГЛ, шизандра, силімарин, ліпоєва кислота, аскорбінова кислота, L-глутатіон та альфа-токоферол), що супроводжувалось внутрішньовенним введенням ГЛ двічі на тиждень протягом перших 10 тижнів. У пацієнтів відмічалося зниження активності печінкових ферментів до нормальних рівнів у 44 % випадків, 25 % хворих продемонстрували зниження вірусного навантаження більше ніж на один логарифм. Гістологічне покращення було зафіксовано у 36,1 % пацієнтів [39].
Дослідження, що проводились у країнах Азії та Європи, довели, що використання ГЛ у пацієнтів із ХГС призводило до зменшення некрозапалення та активності трансаміназ. Ефект спостерігався також у пацієнтів із відсутністю відповіді на терапію інтерферонами. Зниження рівня трансаміназ було швидким, лінійним та стійким у режимі три інфузії на тиждень при різній тривалості терапії [36, 37, 40]. Автори дослідження пов’язували ефект із прямим зв’язуванням ГЛ із компонентом клітинних мембран — ліпокортином-1. Крім того, ГЛ бере участь у фосфориляції таких прозапальних ензимів, як фосфоліпаза А2, що є початковим ферментом у метаболічній системі арахідонової кислоти, та ліпоксигеназа, яка сприяє продукції запальних медіаторів. У подальшому ГЛ та його похідні інгібують продукцію хемокінів ІL-8 та еотаксину, які є потужними хемоатрактантами, що посилюють запалення, залучаючи до нього лейкоцити [41].
Більша частина інформації щодо дії похідних гліциризинової кислоти отримана в країнах Азії. Але одне з найбільших та триваліших проспективних досліджень було проведене на європейських пацієнтах. Вивчалась ефективність застосування ГЛ у хворих на ХГС, які або не отримали відповідь на стандартну в той час терапію інтерферонами та рибавірином, або мали протипоказання до цієї терапії. Ця третя фаза клінічних випробувань ГЛ проходила у 73 центрах 11 європейських країн (Україна в їх числі) за участю 379 пацієнтів протягом 4 років (із жовтня 2002 по квітень 2006). Першою фазою 52-тижневого курсу було 12 тижнів подвійного сліпого, другою — 40 тижнів відкритого дослідження ГЛ. Із плацебо порівнювалось 3- та 5-разове внутрішньовенне введення препарату. Число пацієнтів із зниженням АЛТ більше 50 % після 12 тижнів було вірогідно більшим незалежно від кратності введення ГЛ порівняно з плацебо: 5 разів на тиждень у 28,7 % хворих (р < 0,0001), 3 рази на тиждень — у 29,0 % пацієнтів (р < 0,0001) та в групі плацебо — у 7,0 %. Частка від загальної кількості хворих зі зменшенням некрозапалення після 52 тижнів становила 44,9 % із 5-тижневим та 46,0 % — із 3-тижневим введенням препарату відповідно. Переносимість ГЛ була задовільною протягом усього тривалого періоду лікування [42].
Тривале, протягом 12 місяців, внутрішньовенне введення препарату, до складу якого входить ГЛ, продемонструвало позитивний ефект щодо регресу хронічного гепатиту В (ХГВ) ще у 1992 р. У половини хворих, у яких визначався позитивний НВеАg, виникла сероконверсія в антитіла, а гістологічне дослідження виявило зниження активності захворювання [43]. Тим не менше дослідженнями H. Sato, W. Goto, J. Yamamura, M. Kurorawa та співавт. визначено, що тільки певна концентрація ГЛ здатна пригнічувати експресію гепатоцитами HBsAg. Саме тому автори вважають більш доцільним внутрішньовенне введення препарату при лікуванні ХГВ замість його ентерального призначення [44]. Дванадцять років потому китайські вчені вивчали вплив різних доз ГЛ на експресію НВеAg, Toll-like-рецепторів 2, 4 та зміну кількості ДНК вірусу в експерименті. Учені дійшли висновку, що ГЛ у різних дозах може як промотувати, так і пригнічувати синтез антигенів та реплікацію вірусу [45].
У 2017 році опубліковані результати дії ГЛ на показники виживаності у 60 хворих із гострою декомпенсацією ХГВ. Пацієнти були розподілені на групи: перша отримувала специфічне лікування (тенофовір) та ГЛ, друга — тільки ГЛ. Первинна кінцева точка оцінювалася за рівнем трансаміназ та моделлю кінцевої стадії захворювань печінки (MELD); вторинною кінцевою точкою була загальна смертність або необхідність у трансплантації печінки. Був зроблений висновок про безпеку та ефективність додавання ГЛ до основного лікування при гострій декомпенсації [46].
Спільне використання ентекавіру із ГЛ демонструє більш значущий терапевтичний ефект та більш низькі рівні печінкового ураження навіть в імунодепресивних пацієнтів після хіміотерапії [47]. Вивченням змін фармакокінетики ентекавіру, його розподілення у тканинах та клітинах при додатковому використанні ГЛ та причин синергізму цих двох препаратів зайнялись Q. Chen, H. Chen, W. Wang із колегами. Було показано, що первинний активний метаболіт ГЛ — гліциризинова кислота не впливає на фармакокінетику ентекавіру, але сприяє акумуляції препарату в гепатоцитах, збільшує його розподілення в цитоплазмі та ядрах, чим посилює противірусну активність. Ця синергетична активність відбувається насамперед унаслідок інгібуючого ефекту гліциризинової кислоти на мембранні білки-транспортери MRP4 та BCRP, які виводять ентекавір із гепатоцитів [48].
ГЛ та запобігання розвитку гепатоцелюлярної карциноми
Існують дані про зменшення випадків гепатоцелюлярної карциноми (ГЦК) при тривалому використанні ГЛ [49, 50]. Його роль у пригніченні канцерогенезу полягає в здатності впливати на активність факторів транскрипції AP-1/TATA, які блокують синтез дефектних клітин із злоякісним потенціалом [51]. Експериментальні дослідження Shiota et al. на моделі канцерогенезу (під впливом гепатотоксину діетилнітрозаміну) продемонстрували, що активність АСТ і рівні альбуміну вірогідно покращувались, а випадки ГЦК були нижчими у групі тварин, що додатково отримувала ГЛ [52].
Звісно, що проспективні спостереження за розвитком ГЦК на людях утруднені за етичними та медичними чинниками. Саме тому більшість досліджень за участю хворих мають ретроспективний характер.
У мультицентровому подвійному сліпому дослідженні вивчався вплив інфузій Stronger Neo-Minophagen (SNMC) — препарату, що містить ГЛ, на біохімічну активність та частоту розвитку цирозу печінки та ГЦК (період спостереження 13–15 років) у пацієнтів із хронічними вірусними гепатитами. Активність АЛТ зменшувалась у пацієнтів, які отримували SNMC в дозі 40 мл/добу протягом 4 тижнів вірогідно більшою мірою (p < 0,001), ніж у групі контролю, що отримувала плацебо. Введення SNMC в дозі 100 мл/добу протягом 8 тижнів покращувало печінкову гістологію в 40 пацієнтів із хронічним гепатитом паралельно із покращенням рівня АЛТ. Цироз печінки реєструвався менш часто в 178 пацієнтів після тривалого вживання SNMC, ніж у 100 хворих групи контролю (28 проти 40 % до 13 року спостереження, p < 0,002). Випадки ГЦК реєструвалися значно рідше у групі пацієнтів з тривалим вживанням SNMC, ніж у 109 хворих групи контролю (13 проти 25 % після 15 років спостереження, p < 0,002) [36, 49].
Ikeda ретроспективно проаналізував дані 346 пацієнтів із хронічними гепатитами з високою біохімічною активністю, 244 із яких отримали ін’єкції ГЛ. Рівні канцерогенезу в групі пролікованих та нелікованих становили 13,3 та 26,9 % через 5 років та 21,5 і 35,5 % — після 10 років спостереження відповідно [53].
Метою дослідження було оцінити ефективність ГЛ у зниженні числа випадків ГЦК протягом тривалого спостереження після відсутньої відповіді. Нідерландськими вченими було проаналізовано дані пацієнтів 12 великих японських госпіталів між 1990 та 1995 роками, які не продемонстрували стійкої відповіді на інтерферонотерапію. Дослідження включало 1093 пацієнти. Протягом нетривалого періоду спостереження (у середньому 6,1 ± 1,8 року) у 107 пацієнтів розвинулася ГЦК. За допомогою Кокс-регресивного аналізу було показано, що вік, чоловіча стать, високі рівні АЛТ та виражений фіброз були асоційованими з ризиком розвитку ГЦК. У той же час відповідь на лікування ГЛ, що була визначена як зниження АЛТ до рівня менше ніж 1,5 верхньої межи норми, вірогідно асоціювалася зі зниженням числа випадків ГЦК: співвідношення ризику становило 0,39 (95% довірчий інтервал (ДІ) 0,21–0,72; p < 0,01). Дослідження показало, що у хворих на ХГС із фіброзом 3 та 4 стадії та відсутньою вірусологічною відповіддю на інтерферонотерапію вживання ГЛ може зменшити частоту ГЦК за умови нормалізації на терапії рівнів АЛТ [50].
Таким чином, гліциризин, як основна діюча речовина екстракту кореня солодки, є потужним антифібротичним засобом, що втілює терапевтичну дію через пригнічення активації головних продуцентів патологічного ЕЦМ. Основними властивостями ГЛ є пригнічення апоптозу гепатоцитів та збільшення апоптозу активованих зірчастих клітин шляхом впливу на експресію патологічних цитокінів, зменшення некрозапалення та гальмування канцерогенезу.
На вітчизняному фармацевтичному ринку гліциризин представлений під торговою назвою Гепаризин, випускається у 2 формах — ампули (містять 40 мг гліциризину, 400 мг гліцину, 20 мг цистеїну) і капсули (25 мг гліциризину, 25 мг гліцину, 25 мг метіоніну).
Уведення гліцину до складу Гепаризину перешкоджає виникненню побічних ефектів при тривалій терапії та посилює антиоксидантну дію; цистеїн/метіонін інактивують вільні радикали й покращують переносимість препарату.
Гепаризин чинить гепатопротекторну, протизапальну, антифібротичну, антиоксидантну, антиканцерогенну, противірусну й імуномодулюючу дію та рекомендований для ефективної та безпечної профілактики/лікування фіброзу печінки, цирозу печінки та ГЦК.
Конфлікт інтересів. Не заявлений.
Список литературы
1. Pathophysiology of liver fibrosis and the methodological barriers to the development of anti-fibrogenic agents / K. Böttcher, M. Pinzani // Advanced Drug Delivery Reviews. — 2017. — Vol. 121. — P. 3-8.
2. Tissue inhibitors of metalloproteinases, hepatic stellate cells and liver fibrosis / M.J. Arthur, D.A. Mann, J.P. Iredale // J. Gastroenterol. Hepatol. — 1998. — Vol. 13. — S33-S38.
3. Molecular mechanisms of liver fibrogenesis — a homage to the role of activated fat-storing cells / A.M. Gressner, M.G. Bachem // Digestion. — 1995. — Vol. 56. — P. 335-346.
4. Functional aspects on the pathophysiology of portal hypertension in cirrhosis / J.-C. García-Pagán, J. Gracia-Sancho, J. Bosch // J. Hepatol. — 2012. — Vol. 57. — P. 458-461.
5. The phenotypic fate and functional role for bone marrow-derived stem cells in liver fibrosis / T. Kisseleva, D.A. Brenner // J. Hepa–tol. — 2012. — Vol. 56. — P. 965-972.
6. Mesothelial cells give rise to hepatic stellate cells and myofibroblasts via mesothelial-mesenchymal transition in liver injury / Y. Li, J. Wang, K. Asahina // Proc. Natl. Acad. Sci. U.S.A. — 2013. — Vol. 110. — P. 2324-2329.
7. Hepatic stellate cells as key target in liverfibrosis / T. Higashi, Scott L. Friedman, Yu. Hoshida // Advanced Drug Delivery Reviews. — 2017. — Vol. 121. — P. 27-42.
8. Questioning the challenging role of epithelial-to-mesenchymal transition in liver injury / D. Scholten, R.Weiskirchen // Hepato–logy. — 2011. — Vol. 53. — P. 1048-1051.
9. Lineage tracing demonstrates no evidence of cholangiocyte epithelial-to-mesenchymal transition in murine models of hepatic fibrosis / A.S. Chu, R. Diaz, J.J. Hui [et al.] // Hepatology. — 2011. — Vol. 53. — P. 1685-1695.
10. Mechanisms of Hepatic Fibrogenesis / S.L Friedman // Gastroenterology. — 2008. — Vol. 134(6). — P. 1655-1669. doi: 10.1053/j.gastro.2008.03.003.
11. Hepatic stellate cells: protean, multifunctional, and enigmatic cells of the liver / S.L. Friedman // Physiol. Rev. — 2008. — Vol. 88. — P. 125-172.
12. Molecular regulation of hepatic fibrosis, an integrated cellular response to tissue injury / S.L. Friedman // J. Biol. Chem. — 2000. — Vol. 275. — P. 2247-2250.
13. Molecular mechanism of hepatic stellate cell activation and antifibrotic therapeutic strategies / J.T. Li, Z.X. Liao, J. Ping [et al.] // J. Gastroenterol. — 2008. — Vol. 43. — P. 419-28.
14. The antiviral and antimicrobial activities of licorice, awidely-used Chinese herb / L. Wang, R. Yang, B. Yuan, Ying Liun [et al.] // Pharmaceutica Sinica B. — 2015. — Vol. 5(4). — P. 310-315.
15. Caspase-1-mediated regulation of fibrogenesis in diet-induced steatohepatitis / L.J. Dixon, M. Berk, S. Thapaliya [et al.] // Lab. Invest. — 2012.
16. Caspase 3 inactivation protects against hepatic cell death and ameliorates fibrogenesis in a diet-induced NASH model / S. Thapaloya, A. Wree, D. Povero [et аl.] // Dig. Dis. Sci. — 2014. — Vol. 59(6). — P. 1197-206. doi: 10.1007/s10620-014-3167-6. Epub 2014 May 3.
17. Glycyrrhizic acid inhibits apoptosis and fibrosis in carbon-tetrachloride-induced rat liver injury World / B. Liang, X.L. Guo, J. Jin [et al.] // J. Gastroenterol. — 2015. — Vol. 21(17), № 7. — P. 5271-5280.
18. Vousden K.H., Lu X. Live or let die: the cell’s response to p53 // Nat. Rev. Cancer. — 2002. — 2. — 594-604.
19. Glycyrrhizic acid attenuates CCl4-induced hepatocyte apoptosis in rats via a p53-mediated pathway / X.L. Guo, B. Liang, X.W. Wang [et al.] // J. Gastroenterol. — 2013. — Vol. 19(24). — P. 3781-91. doi: 10.3748/wjg.v19.i24.3781.
20. 18α-Glycyrrhizin induces apoptosis and suppresses activation of rat hepatic stellate cells / Y. Qu, W.H. Chen, L. Zong [et al.] // Med. Sci Monit. — 2012. — Vol. 18(1). — P. 24-32.
21. The good and the bad collagens of fibrosis — Their role in signaling and organ function / M.A. Karsdala, S.H. Nielsena, D.J. Leeming [et al.] // Advanced Drug Delivery Reviews. — 2017. — Vol. 121. — P. 43-56.
22. Differential effects of TGF-beta on connective tissue growth factor (CTGF/CCN2) expression in hepatic stellate cells and hepatocytes / O.A. Gressner, B. Lahme, I. Demirci [et al.] // J. Hepatol. — 2007. — Vol. 47. — P. 699-710.
23. TGF-β1 modulates the homeostasis between MMPs and MMP inhibitors through p38 MAPK and ERK1/2 in highly invasive breast cancer cells / L.R. Gomes, L.F. Terra, R.A. Wailemann [et al.] // BMC Cancer. — 2012. — Vol. 12. — P. 26.
24. Transforming Growth Factors β1 and α in Chronic Liver Disease Effects of Interferon Alfa Therapy / A. Castilla, J. Prieto, N. Fausto // N. Engl. J. Med. — 1991. — Vol. 324. — P. 933-940.
25. Effects of 18α-glycyrrhizin on TGF-β1/Smad signaling pathway in rats with carbon tetrachloride-induced liver fibrosis / Y. Qu, L. Zong, M. Xu [et al.] // J. Clin. Exp. Pathol. — 2015. — Vol. 8(2). — P. 1292-1301.
26. Glycyrrhizin regulates CD4+T cell response during liver fibrogenesis via JNK, ERK and PI3K/AKT pathway / C.T. Tu, J. Li, F.P. Wang [et al.] // Int. Immunopharmacol. — 2012. — Vol. 14(4). — P. 410-21. doi: 10.1016/j.intimp.2012.08.013.
27. Cellular and molecular mechanisms of fibrosis / T.A. Wynn // J. Pathol. — 2008. — Vol. 214. — P. 199-210.
28. Molecular pathogenesis of liver fibrosis / D.A. Brenner // Trans. Am. Clin. Climatol. Assoc. — 2009. — Vol. 120. — P. 361-368.
29. Current status of novel antifibrotic therapies in patients with chronic liver disease / M. Cohen-Naftaly, S.L. Friedman // Therap. Adv. Gastroenterol. — 2011. — Vol. 4. — P. 391-417.
30. The global burden of viral hepatitis from 1990 to 2013: findings from the Global Burden of Disease Study 2013 / J.D. Stanaway, A.D. Flaxman, M. Naghavi [et al.] // Lancet. — 2016. — Vol. 388. — P. 1081-1088.
31. IL-34 and macrophage colony-stimulating factor are overexpressed in hepa-titis C virusfibrosis and induce profibrotic macrophages that promote collagen synthesis by hepatic stellate cells / L. Preisser, C. Miot, H. Le Guillou-Guillemette [et al.] // Hepato–logy. — 2014. — 60. — P. 1879-1890.
32. Activation of TGF-beta1 promoter by hepatitis C virus-induced AP-1 and Sp1: role of TGF-beta1 in hepatic stellate cell activation and invasion / L.D. Presser, S. McRae, G. Waris // PLoS One. — 2013. — 8.
33. HCV core-mediated activation of latent TGF-beta via thrombospondin drives the crosstalk between hepatocytes and stromal environment / N. Benzoubir, C. Lejamtel, S. Battaglia [et al.] // J. Hepatol. — 2013. — № 59. — P. 1160-1168.
34. Hepatitis B virus e antigen induces activation of rat hepatic stellate cells / Y. Zan, Y. Zhang, P. Tien // Biochem. Biophys. Res. Commun. — 2013. — Vol. 435. — P. 391-396.
35. Oxidative stress modulation in hepatitis C virus infected Cells Sonia / A. Lozano-Sepulveda, O.L. Bryan-Marrugo, C. Cordova-Fletes [et al.] // J. Hepatol. — 2015. — Vol. 7(29). — P. 2880-2889.
36. The long term efficacy of glycyrrhizin in chronic hepatitis C patients / Y. Arase, K. Ikeda, N. Murashima [et al.] // Cancer. — 1997. — Vol. 79. — P. 1494-1500.
37. Intravenous glycyrrhizin for the treatment of chronic hepatitis C: a double-blind, randomized, placebo-controlled phase I/II trial / van T.G. Rossum, A.G. Vulto, W.C. Hop [et al.] // J. Gastroenterol. Hepatol. — 1999 — Vol. 14. — P. 1093-1099. doi: 10.1046/j.1440-1746.1999.02008.x.
38. Effectiveness of interferon, glycyrrhizin combination therapy in patients with chronic hepatitis C / Y. Abe, T. Ueda, T. Kato // Nihon. Rinsho. — 1994. — Vol. 52. — P. 1817-1822.
39. Treatment of chronic hepatitis C virus infection via antioxidants:results of a phase I clinical trial / A. Melhem, M. Stern, O. Shibolet [et al.] // J. Clin. Gastroenterol. — 2005. — Vol. 39. — P. 737-742. doi: 10.1097/01.mcg.0000174023.7347.
40. Biochemical and histological effects of 26 weeks of glycyrrhizin treatment in chronic hepatitis C: a randomized phase II trial / H. Orlent, B.E. Hansen, M. Willems [et al.] // J. Hepatol. — 2006. — Vol. 45. — P. 539-546.
41. Glycyrrhizin and related com-pounds down-regulate production of inflammatory chemokines IL-8 and eotaxin 1 in a human lung fibroblast cell line / S. Matsui, H. Matsumoto, Y. Sonoda [et al.] // Int. Immunopharmacol. — 2004. — Vol. 4. — P. 1633-1644.
42. Manns M.P., Wedemeyer H., Singer A. et al. European SNMC Study Group. Glycyrrhizin in patients who failed previous interferon alpha-based therapies: biochemical and histological effects after 52 weeks // J. Viral. Hepat. — 2012. — 19. — 537-546.
43. Treatment of chronic hepatitis B. Part 2: Effect of glycyrrhizic acid on the course of illness / J. Eisenburg // Fortschr. Med. — 1992. — Vol. 110(21). — P. 395-398.
44. Therapeutic basis of glycyrrhizin on chronic hepatitis B / H. Sato, W. Goto, J. Yamamura [et al.] // Antiviral. Res. — 1996. — Vol. 30(2–3). — P. 171-177.
45. Effects of glycyrrhizin on the expression of hepatitis B virus and Toll like receptors 2,4 in HepG2.2.15 cells expressing low HBsAg / Y.W. Li, H.Z. Yang, Q.S. Ke [et al.] // Zong Yao Cai. — 2008. — Vol. 31(3). — P. 403-407.
46. A Randomized Controlled Trial of Glycyrrhizin Plus Tenofovir vs. Tenofovir in Chronic Hepatitis B with Severe / Chao-Hung Hung, Kwong-Ming Kee, Chih-Hung Chen [et al.] // Acute Exa–cerbation Clinical and Translational Gastroenterology. — 2017. — № 8. — P. 104. doi: 10.1038/ctg.2017.29; published online 29 June 2017.
47. Hepatitis B virus infection in an HBsAb-positive lymphoma patient who received chemotherapy: A case report / F.B. Kang, L. Wang, D.X. Sun // Medicine (Baltimore). — 2017. — Vol. 96(44). — e. 8518. doi: 10.1097/MD.0000000000008518.
48. Glycyrrhetic acid, but not glycyrrhizic acid, strengthened entecavir activity by promoting its subcellular distribution in the liver via efflux inhibition / Q. Chen, H. Chen, W. Wang [et al.] // J. Pharm Sci. — 2017. — Vol. 106. — P. 313-327. doi: 10.1016/j.ejps.2017.06.015.
49. Long-term treatment of chronic hepatitis C with glycyrrhizin [stronger neo-minophagen C (SNMC)] for preventing liver cirrhosis and hepatocellular carcinoma / H. Kumada // Oncology. — 2002. — Vol. 62(Suppl. 1). — P. 94 -00.
50. Long-term clinical outcome and effect of gly-cyrrhizin in 1093 chronic hepatitis C patients with non-response or relapse to interferon / B.J. Veldt, B.E. Hansen, K. Ikeda [et al.] // Scand. J. Gastroenterol. — 2006. — Vol. 41. — P. 1087-1094.
51. Differential regulation of activator protein 1 activity by glycyr–rhizin / C.Y. Hsiang, I.L. Lai, D.C. Chao [et al.] // Life Sci. — 2002. — Vol. 70. — P. 1643-1656.
52. Inhibition of hepatocellular carcinoma by glycyrrhizin in diethylnitrosamine-treated mice / G. Shiota, K. Harada, M. Ishida [et al.] // Carcinogenesis. — 1999. — Vol. 20. — P. 59-63. doi: 10.1093/carcin/20.1.59.
53. Glycyrrhizin injection therapy prevents hepatocellular carcinogenesis in patients with interferon-resistant active chronic hepatitis C / K. Ikeda // Hepatol. Res. — 2007. — Vol. 37. — P. 287-293. doi: 10.1111/j.1872-034X.2007.00199.x.