Резюме
Актуальність. Муковісцидоз (МВ) — генетичне захворювання, перебіг якого залежить не тільки від мутації гена трансмембранного регулятора МВ, але й від інших генів-модифікаторів. Ген інтерлейкіну-10 (ІЛ-10) входить до переліку таких модифікуючих факторів. Мета. Удосконалення медичної допомоги хворим на МВ шляхом уточнення прогнозу перебігу на підставі визначення патогенетичної ролі поліморфізму гена-модифікатора запалення ІЛ-10. Матеріали та методи. 42 дитини з діагнозом МВ обстежені за стандартною методикою. Визначення поліморфізму G1082A гена IL-10 проводили за допомогою полімеразної ланцюгової реакції в реальному часі. ДНК виділяли з клітин букального епітелію. Результати. У групі дітей, хворих на МВ, із мутацією G1082A гена IL-10 встановлена більш рання маніфестація при кишкових симптомах і більш пізня — при легеневих ознаках, тяжкий перебіг захворювання (зниження об’єму форсованого видоху за 1 секунду — 70,0 (65,0; 72,0) %), ранній розвиток бронхоектазів легенів (72 %) та пневмофіброзу (95,4 %), цирозу печінки (36,4 %), переважання серед респіраторних збудників Pseudomonas aeruginosa (59,1 %) у бактеріальному пейзажі мокротиння, зміни імунного статусу (підвищення циркулюючих імунних комплексів — 8,65 (7,6; 10,55) од. та зниження індексу активності нейтрофілів спонтанного — 0,31 (0,24; 0,78) од. Висновки. Охарактеризовано фенотип МВ, який асоційований з мутацією гена IL-10 G1082A.
Актуальность. Муковисцидоз (МВ) — генетическое заболевание, течение которого зависит не только от мутации гена трансмембранного регулятора МВ, но и от других генов-модификаторов. Ген интерлейкина-10 (ИЛ-10) входит в перечень таких модифицирующих факторов. Цель. Усовершенствование медицинской помощи больным МВ путем уточнения прогноза течения заболевания на основании определения патогенетической роли полиморфизма гена-модификатора воспаления ИЛ-10. Материалы и методы. 42 ребенка с диагнозом МВ обследованы согласно стандартной методике. Определение полиморфизма G1082A гена IL-10 проводили с помощью полимеразной цепной реакции в реальном времени. ДНК выделяли из клеток буккального эпителия. Результаты. В группе больных МВ с мутацией G1082A гена IL-10 установлена более ранняя манифестация при кишечных симптомах и более поздняя — при легочных признаках, тяжелое течение (снижение ОФВ1 — 70,0 (65,0; 72,0) %), раннее развитие бронхоэктаз легких (72 %) и пневмофиброза (95,4 %), цирроза печени (36,4 %), преобладание Pseudomonas aeruginosa (59,1 %) среди респираторных возбудителей в бактериальном пейзажи мокроты, изменения иммунного статуса (повышение циркулирующих иммунных комплексов — 8,65 (7,6; 10,55) ед. и снижение индекса активности нейтрофилов спонтанного — 0,31 (0,24; 0,78) ед. Выводы. Охарактеризован фенотип МВ, ассоциированный с мутацией гена IL-10 G1082A.
Background. Cystic fibrosis (CF) features depend on a number of gene modifiers. Interleukin-10 (IL-10) gene is a one of these gene modifiers. The purpose was to improve medical care for patients with CF by clarifying the pathogenetic role of the IL-10 gene polymorphism in the disease course. Materials and methods. Forty-two children with CF were examined with standard methods during the remission period. Detection of the G1082A polymorphism of the IL-10 gene was carried out using real time polymerase chain reaction. DNA was isolated from buccal epithelium cells. Results. Patients with IL-10 gene mutation (G1082A) were characterized by the earlier manifestation of intestinal symptoms, later manifestation of pulmonary signs, more severe course of CF (bronchiectasis (72 %) and lung fibrosis (95.4 %), severe liver lesions (36.4 %), a decrease in forced expiratory volume in one second (70.0 (65.0; 72.0) %)), Pseudomonas aeruginosa predominance (59.1 %) among respiratory pathological microorganisms in the sputum, immune status changes (an increase of the circulating immune complexes (8.65 (7.6; 10.55) units) and a decrease of spontaneous index of activated neutrophils test (0.31 (0.24; 0.78) units)). Conclusions. CF phenotype associated with the G1082A polymorphism of the IL-10 gene was examined.
Вступ
Муковісцидоз (МВ) (Cystic Fibrosis Transmembrane conductance Regulator — CFTR) — генетично детерміноване поліорганне захворювання, що характеризується значною мінливістю клінічної картини та тяжкості, перебіг якого залежить не тільки від мутації гена трансмембранного регулятора МВ, але й від інших генів-модифікаторів [1–4].
Характерною рисою перебігу МВ є довічне запалення, тому вивчення впливу генетичних дефектів запальних факторів становить певний інтерес [5]. Науковці вказують на вагомий вплив поліморфізму генів запальних цитокінів на перебіг МВ, залежно від наявності яких захворювання набуває відмінних особливостей за умови однакової мутації CFTR [6]. З іншого боку, генетичні дефекти, які є не вагомими для загальної популяції та не супроводжуються патологічними проявами, можуть суттєво впливати на перебіг МВ [2, 7, 8].
Вченими визначено низку генів, які впливають на перебіг МВ: гени інтерлейкінів (ІЛ) — ІЛ-1β, ІЛ-4, ІЛ-8, ІЛ-10, фактора некрозу пухлини альфа (ФНП-α), трансформуючого фактора росту β1, α-1-антитрипсину та ін. [2]. Так, наприклад, мутація гена ФНП-α пов’язана з більш легким перебігом і пізнішим терміном колонізації Pseudomonas aeruginosa (P. aeruginosa) [2].
За умови наявності мутації CFTR одного типу (наприклад, delF508) та поліморфізму різних генів запальних цитокинів спостерігається різний перебіг МВ [6]. Так, описано, що мутації гена ІЛ-1 впливають на тяжкість уражень легенів, гена ФНП-α та ІЛ-6 — на зміну маси тіла хворих на МВ, гена SLC26A9 — на розвиток меконіального ілеусу та панкреатичної недостатності, гена SLC9A3 — на тяжкість ураження легенів і розвиток меконіального ілеусу; ген SLC6A14 асоційований як із розвитком меконіального ілеусу, тяжкістю ураження легенів, так і з віком інфікування P. aeruginosa [9].
Особливий інтерес викликає вивчення поліморфізму гена ІЛ-10 G1082A, адже саме з цією мутацією науковці пов’язують ранню колонізацію Aspergillus fumigatus, що має вагомий вплив на розвиток бронхолегеневого запалення [2]. ІЛ-10 є протизапальним цитокіном, який продукується T-хелперами-2 (Th2), В-лімфоцитами, макрофагами, кератиноцитами, тучними клітинами, тимоцитами. ІЛ-10 є інгібітором запалення й інгібує синтез цитокинів Т-хелперами-1 (Th1), тим самим регулюючи баланс Th1/Th2 (пригнічується клітинна відповідь і підсилюється гуморальна) [10].
Визначення впливу мутацій окремих генів на перебіг МВ дає змогу не тільки розширити наукові знання про патогенез різних фенотипів МВ, але й удосконалити, індивідуалізувати підхід до алгоритму ведення хворого [11, 12].
Мета дослідження: удосконалення медичної допомоги хворим на МВ шляхом уточнення прогнозу перебігу на підставі визначення патогенетичної ролі поліморфізму гена-модифікатора запалення ІЛ-10.
Завдання:
1. Визначити клінічні особливості дітей із МВ залежно від поліморфізму гена ІЛ-10.
2. Визначити параклінічні особливості дітей із МВ залежно від поліморфізму гена ІЛ-10.
Матеріали та методи
Дослідження проведено на базі пульмонологічного відділення КЗОЗ «Обласна дитяча клінічна лікарня № 1» у 2015–2017 роках. Обстеження хворих проводилося згідно з наказами МОЗ України від 29.01.2013 р. № 59 «Про затвердження уніфікованих клінічних протоколів надання медичної допомоги дітям із захворюваннями органів травлення», від 15.07.2016 р. № 723 «Про затвердження уніфікованого клінічного протоколу первинної, вторинної (спеціалізованої) та третинної (високоспеціалізованої) медичної допомоги «Муковісцидоз»».
Під спостереженням перебувало 42 дитини з діагнозом МВ. Контрольну групу становили 54 практично здорові дитини, рандомізовані за віком.
Визначення поліморфізму гена ІЛ-10 G1082A проводили за допомогою полімеразної ланцюгової реакції в режимі реального часу. ДНК виділяли з клітин букального епітелію за допомогою спеціального набору «ДНК-експрес» (виробництво фірми «Літех»).
Визначення системного імунітету (CD3, CD4, CD8, CD16, СD22, CD25, IgА, IgМ, IgG, циркулюючі імунні комплекси, фагоцитоз, комплемент) проводилося за традиційними методиками згідно з наказом МОЗ України від 19.11.2002 р. № 422 «Про подальший розвиток клінічної імунології в Україні».
Визначення в сироватці крові вмісту загального імуноглобуліну класу Е (IgE) проводили за допомогою двосайтового імуноферментного аналізу.
Дослідження проведено з дотриманням прав людини відповідно до діючого в Україні законодавства, відповідає міжнародним етичним вимогам і не порушує етичних норм у науці та стандартів проведення біомедичних досліджень.
Результати опрацьовано програмою IBM SPSS Statistics методами непараметричної статистики, статистично вірогідною вважали різницю між показниками при р < 0,05.
Результати
Під спостереженням перебували 42 дитини. Діагноз МВ встановлено на підставі клініко-параклінічних ознак і підтверджено результатами пілокарпінового тесту. Серед хворих переважали хлопчики (66,7 %). При розподілу дітей за віком встановлено, що більшість становлять діти старшого шкільного віку (табл. 1).
Дослідження поліморфізму гена ІЛ-10 G1082A у дітей, хворих на МВ, показало, що алель А зустрічається у 22 випадках. Хворі розподілені на 3 групи, згідно з генотипами: GG, GA, AA — розподіл подано у табл. 2.
Виявлено, що серед хворих на МВ вірогідно частіше зустрічається мутація G1082A як гетерозиготному, так і у гомозиготному стані (присутня у більше ніж половини пацієнтів — 52,4 %).
Беручи до уваги розподіл дітей і незначну кількість хворих із генотипом АА, клінічні особливості вивчалися в групі дітей з наявністю мутації (у гомо- та гетерозиготному стані) порівняно з пацієнтами без мутації в гені ІЛ-10.
Серед дітей, які ввійшли до дослідження, в обох групах переважали хлопчики (59,1 та 75 % у групі з мутацією та без такої відповідно). Вірогідної різниці у розподілі за статтю не виявлено.
При оцінюванні маніфестації МВ встановлено, що в усіх хворих переважали кишкові ознаки, але в групі з мутацією ІЛ-10 легеневі симптоми зустрічалися частіше, ніж у групі без мутації (35 та 23 % відповідно; p > 0,05). Вірогідної різниці між частотою маніфестації з боку гастроінтестинальної та респіраторної систем не виявлено.
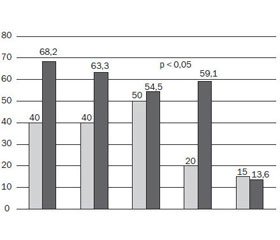
За часом виникнення кишкові ознаки у групі з генотипами GA+AA частіше виникали у періоді новонародженості (59,1 %), а у групі з генотипом GG — у грудному віці (60 %). Стосовно легеневих ознак, то характерна більш пізня їх маніфестація для дітей із мутацією — період раннього віку (54,5 %) порівняно з GG генотипом — грудний період (45 %) (рис. 1).
При оцінці тяжкістю перебігу МВ залежно від мутації гена ІЛ-10 G1082A встановлено, що для пацієнтів з мутацією характерний більш тяжкий перебіг захворювання (не виявлено жодного пацієнта з легким перебігом) — результати подано на рис. 2.
У всіх хворих на МВ патогномонічним є ураження респіраторної системи — при оцінці ураження легенів встановлено, що частота зустрічальності бронхоектазів (72 %) та пневмофіброзу (95,4 %) вірогідно (p < 0,05) вища в групі пацієнтів з мутаціями гена ІЛ-10 порівняно з хворими без мутації (5 та 50 % відповідно).
При дослідженні ступеня ураження печінки було виявлено, що циротичні зміни паренхіми вірогідно частіше зустрічаються у пацієнтів з мутацією гена ІЛ-10 — 36,4 % порівняно з хворими без мутації — 5 % (p < 0,05).
Аналіз бактеріального пейзажу мокротиння показав, що в групі з генотипами GA+AA вірогідно переважала P. aeruginosa (рис. 3).
Інструментальне дослідження функції зовнішнього дихання (ФЗД) проведено в усіх дітей віком понад 5 років (n = 31) — виявлено вірогідне зниження показників у групі з генотипами GA+AA. Результати наведено у відсотках порівняно з нормою (табл. 3).
Під час дослідження загального IgE не було визначено вірогідної різниці рівня даного показника залежно від мутації гена ІЛ-10 G1082A, який становив 89,9 (29,87; 469,45) МО/мл та 48,77 (20,42; 162,41) МО/мл у групі з генотипами GA+AA та GG відповідно.
Дослідження імунного статусу показало вірогідне підвищення циркулюючих імунних комплексів (ЦІК) та зниження індексу активності нейтрофілів (ІАН) спонтанного у дітей з мутацією порівняно з пацієнтами без мутації гена. При порівнянні з контрольною групою встановлено вірогідне підвищення CD3, CD25, фагоцитозу з латексом, ІАН стимульованого (стим.) та зниження CD8, спонтанного тесту з нітросинім тетразолієм (НСТ), ІАН спонтанного (табл. 4).
Обговорення
Поліморфізми гена ІЛ-10 обумовлюють мінливість перебігу багатьох захворювань. Так, вивчався вплив поліморфізму гена ІЛ-10 G1082A на перебіг позалікарняної пневмонії. Під час дослідження науковці визначили, що він знаходиться в переліку тих генів, мутації яких найчастіше зустрічаються у хворих на позалікарняну пневмонію — 86,4 % хворих мали мутацію даного гена, серед яких близько 50 % — у гомозиготному стані [13].
А.Ю. Акпарова та співавт. (2016) повідомляють про зв’язок поліморфізму гена ІЛ-10 з розвитком хронічного обструктивного захворювання легенів і вказують на те, що у хворих на дану патологію поліморфізм G1082A зустрічається частіше та існує підвищений ризик розвитку захворювання за умови наявності мутації гена ІЛ-10 [14].
Існують наукові дослідження, що вказують на зв’язок мутації гена ІЛ-10 з розвитком професійних алергічних дерматозів [10]. Інші автори повідомляють, що під час дослідження не виявлено вірогідних зв’язків між перебігом астми, атопічним дерматитом і поліморфізмом G1082A гена ІЛ-10 [15].
Описано вплив поліморфізму G1082A гена –ІЛ-10 на тяжкість перебігу перипортального фіброзу печінки у жителів Бразилії, інфікованих Schistosoma mansoni, та встановлено відсутність впливу мутації гена ІЛ-10 на рівень даного цитокіну в крові пацієнтів, які перебували під спостереженням [16].
Стосовно впливу поліморфізму гена ІЛ-10 на перебіг МВ існують нечисленні дослідження. Loic Guillot та співавт. (2014) вказують на відсутність впливу мутації G1082A гена IL-10 на колонізацію P. aeruginosa, коли R. Tesse та співавт. свідчать про міцний вірогідний зв’язок між мутацією цього гена та інфікуванням синьогнійною паличкою [2, 17]. У нашому дослідженні виявлено вірогідний зв’язок поширення даного патогену в групі з мутацією.
Відомі дані Leonieke de Vries та співавт., які вивчали поліморфізми TNF-α, ІЛ-8, ІЛ-10, ІЛ-1β та їхній вплив на ступінь ураження легенів у дітей, хворих на МВ. Під час дослідження виявлено вірогідне додаткове зниження функції легенів у хворих, які мали мутацію гена ІЛ-10 (G1082A) [6].
Отже, подальше дослідження впливу генів цитокінів запалення є надзвичайно актуальним, допоможе розширити знання про особливості патогенезу МВ і виділити чинники, що беруть участь у модифікації захворювання.
Висновки
Охарактеризовано фенотип МВ залежно від наявності поліморфізму G1082A гена-модифікатора запалення ІЛ-10, для якого характерна більш рання маніфестація при кишкових симптомах та більш пізня — при легеневих ознаках, тяжкий перебіг захворювання (ранній розвиток бронхоектазів легенів, цирозу печінки, прогресуюче зниження показників ФЗД), переважання серед респіраторних збудників P. aeruginosa у бактеріальному пейзажі мокротиння, зміни імунного статусу (підвищення ЦІК і зниження ІАН спонтанного).
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці даної статті.
Подяки. Велика подяка головному лікарю д.м.н., професору О.В. Піонтковській, завідувачу пульмонологічного відділення О.В. Пасічник; КЗОЗ «Обласна дитяча клінічна лікарня № 1» м. Харкова.
Список литературы
1. Bombieri C. Genotypes and Phenotypes in Cystic Fibrosis and Cystic Fibrosis Transmembrane Regulator — Related Disorders / C. Bombieri, M. Seia, C. Castellani. // Seminars in Respiratory and Critical Care Medicine. — 2015. — № 36. — С. 180-193.
2. Lung disease modifier genes in cystic fibrosis / [L. Guillot, J. Beucher, O. Tabary та ін.]. // The International Journal of Biochemistry & Cell. Biology. — 2014. — № 52. — С. 83-93.
3. Influence of SNPs in Genes that Modulate Lung Disease Seve–rity in a Group of Mexican Patients with Cystic Fibrosis / [E. Yokoyama, M. Chávez-Saldana, L. Orozco та ін.] // Archives of Medical Research. — 2018. — № S0188–4409(18). — С. 30110-3.
4. Капранов Н.И. Муковисцидоз / Н.И. Капранов, Н.Ю. Каширская. — М.: Медпрактика, 2014. — 672 с.
5. Cystic fibrosis pulmonary guidelines: treatment of pulmonary exacerbations / [P.A. Flume, P.J. Mogayzel Jr., K.A. Robinson та ін.]. // American Journal of Respiratory and Critical Care Medicine. — 2009. — № 180(9). — С. 802-808.
6. Cytokine gene polymorphisms and severity of CF lung disease / L. De Vries, A. Griffiths, D. Armstrong, P.J. Robinson. // Journal of Cystic Fibrosis. — 2014. — № 13. — С. 699-705.
7. Cutting G.R. Modifier genes in Mendelian disorders: the –example of cystic fibrosis / Cutting // Annals of the New York Academy of Sciences. — 2010. — № 1214. — С. 57-69.
8. Accurso F.J. Gene modifiers in cystic fibrosis / F.J. Accurso, K. Marci, M.K. Sontag // Journal of Clinical Investigation. — 2008. — № 118(3). — С. 839-841.
9. Unraveling the complex genetic model for cystic fibrosis: pleiotropic effects of modifier genes on early cystic fibrosis-related morbidities / [W. Li, D. Soave, M. Miller та ін.]. // Human Genetics. — 2014. — № 133. — С. 151-61.
10. Kuz`mina L.P. Role of Interleukin-4, Interleukin-10, and Tumor Necrosis Factor-α Polymorphic Genes in the Pathogenesis of Occupational Allergic Dermatoses / L.P. Kuz`mina, N.I. Izmerova, M.M. Kolyaskina // Bulletin of Experimental Biology and Medicine. — 2015. — № 159(6). — С. 779-81.
11. O`Neal W.K. Cystic Fibrosis Disease Modifiers: Complex Genetics Defines the Phenotypic Diversity in a Monogenic Disease / W.K. O’Neal, M.R. Knowles. // Annual Review of Genomics and Human Genetics. — 2018. — № 19.
12. Weiler C.A. Genetic influences on cystic fibrosis lung disease severity / C.A. Weiler, M.L. Drumm // Frontiers in Pharmacology. — 2013. — № 4. — С. 40.
13. Исследование полиморфизмов некоторых генов цитохрома Р450, VCORC1, генов фолатного цикла, ССRDEL32, TNFA и IL-10 при внебольничной пневмонии / [Колюбаева С.Н., Гайворонский И.Н., Мякошина Л.А., Гайворонский И.Н., Мякошина Л.А. та ін.]. // Сборник трудов IХ Всероссийской научно-практической конференции с международным участием. Молекулярная диагностика. — 2017. — С. 61-62.
14. Ассоциация полиморфизма генов IL-10 и IL-17F с хронической обструктивной болезнью легких в казахстанской популяции / [А.Ю. Акпарова, Б.М. Абдрахманова, А.К. Иманбай та ін.]. // Велес. — 2016. — № 1–1(31). — С. 10-12.
15. Associations of TNFα –308G>A, TNFα –238G>A, IL-1α –889C>T and IL-10 –1082G>A Genetic Polymorphisms with Ato–pic Diseases: Asthma, Rhinitis and Dermatitis / Ž. Babić, I. Sabolić Pipinić, V.M. Varnai, J. Macan // International Archives of Allergy and Immunology. — 2016. — № 169(4). — С. 231-40.
16. Association of SNP (–G1082A) IL-10 with increase in seve–rity of periportal fibrosis in schistosomiasis, in the northeast of Brazil / [P.C. Silva, A.V. Gomes, T.K. de Souza та ін.]. // Genetic Testing and Molecular Biomarkers. — 2014. — № 18(9). — С. 646-52.
17. Tesse R. Association of interleukin-10 gene haplotypes with Pseudomonas aeruginosa airway colonization in cystic fibrosis / R. Tesse, F. Cardinale, T. Santostasi // Journal of Cystic Fibrosis. — 2008. — № 7(4). — С. 329-32.

/94-1.jpg)
/95-1.jpg)
/95-2.jpg)
/96-1.jpg)