Вступ
Незважаючи на досягнення в багатьох галузях, сучасна медицина стикається з новими проблемами, до яких належить розвиток небажаних реакцій на фоні застосування різних фармакологічних препаратів. Значною мірою це стосується застосування антибактеріальних препаратів. Найбільш частими негативними наслідками на фоні проведення антибактеріальної терапії є алергічні, токсико-алергічні й диспептичні реакції.
У практичній медицині дані зміни, що розвиваються на фоні антибактеріальної терапії, отримали назву «антибіотик-асоційовані стани», а нозологічні форми — «антибіотик-асоційований коліт» або «антибіотик-асоційована діарея» (ААД).
Відповідно до критеріїв ВООЗ, антибіотик-асоційована діарея — це 3 або більше епізоди неоформлених або водянистих випорожнень протягом 2 або більше днів поспіль, що пов’язані з прийомом антибактеріальних препаратів.
Як показали епідеміологічні дослідження, ААД розвивається в 5–35 % пацієнтів на фоні лікування антибіотиками або протягом 8 тижнів після їх відміни [11, 23]. За даними деяких спостережень, частота ААД досягає 62 % [17, 21]. У дитячому віці частота виникнення ААД становить від 11 до 40 % [2, 20]. В Україні частота ААД у дітей становить 15,5 %, але збільшується в 3 рази при носійстві токсигенних штамів Cl.difficile [3, 12].
Практично будь-який антибіотик може стати причиною ААД, але частіше вона розвивається при застосуванні кліндаміцину (20–30 %), амоксициліну/клавуланату (10–25 %), цефалоспоринів 2–3-го покоління (9–25,8 %), еритроміцину (11–16 %), кларитроміцину й ампіциліну (5–10 %) [2, 23]. Є повідомлення про те, що навіть одноразовий прийом антибіотика може спровокувати розвиток ААД [3].
Виділяють дві форми ААД — ідіопатичну ААД і діарею, що обумовлена розвитком інфекційного запального процесу в кишечнику, етіологічним чинником якого найчастіше є Clostridium difficile. За даними літератури, ідіопатична ААД, при якій інфекційний агент виявити не вдається, становить до 80 % усіх випадків антибіотик-асоційованих станів, а діарея, пов’язана з Cl.difficile, — 10–25 % випадків ААД [2, 11].
Факторами ризику щодо розвитку ААД вважають вік пацієнта до 5 років і після 65 років, хронічні захворювання органів шлунково-кишкового тракту (ШКТ), тяжкі соматичні захворювання в анамнезі, великі дози антибіотиків і порушення режиму їх застосування.
Згідно із сучасними уявленнями, у патогенезі ААД беруть участь такі механізми, як порушення якісного й кількісного складу мікрофлори кишечника, фармакологічна, токсична й алергічна дія антибактеріального препарату. Залежно від провідної патогенетичної ланки виділяють такі види ААД, як осмотична, секреторна, інфекційна, гіпермоторна. У розвитку ААД реалізується, як правило, декілька механізмів, що найчастіше пов’язані між собою. Наприклад, розвиток дисбіозу із зниженням кількості анаеробів у товстій кишці призводить до розвитку одночасно осмотичної, секреторної й інфекційної діареї.
Як показали патоморфологічні дослідження, ідіопатична ААД, як правило, не супроводжується запальним процесом у кишечнику. За деякими даними, найбільш вірогідним патогенетичним механізмом виникнення даної форми ААД вважають порушення складу кишкової мікрофлори, у результаті чого розвивається надмірна декон’югація жовчних кислот, які потрапляють до порожнини товстого кишечника та стимулюють секрецію хлоридів і води (секреторна діарея) [14, 20].
ААД інфекційної етіології обумовлена розвитком запального процесу в кишечнику в результаті його колонізації умовно-патогенними або патогенними видами бактерій (Clostridium spp., Candida spp., Salmonella, Staphyloccus aureus) [11, 14, 18]. Найбільш тяжку форму інфекційної ААД викликає патологічна колонізація Clostridium difficile. Згідно із сучасними уявленнями, ключовою ланкою патогенезу Clostridium difficile-асоційованої діареї й псевдомембранозного коліту є порушення мікроекології кишечника в результаті застосування антибіотиків або інших препаратів з антимікробною активністю, колонізація кишечника токсичними видами Clostridium difficile, продукція збудником токсинів А та/або В і, як наслідок, ушкодження слизової оболонки кишечника й розвиток запального процесу [3].
ААД чинить негативний вплив на лікування пацієнтів, у більшості випадків потребує передчасного припинення антибактеріальної терапії, збільшує ризик розвитку ускладнень та інших нозокоміальних інфекцій, збільшує тривалість госпіталізації хворих, значно збільшує вартість лікування [18, 21].
Це визначає необхідність своєчасної профілактики ААД. З огляду на значну роль дисбіотичних порушень у розвитку ААД патогенетично обґрунтованим можна вважати застосування пробіотиків для профілактики антибіотик-асоційованих станів.
Як свідчать результати досліджень, ефективність пробіотиків у профілактиці ААД пов’язана з безпосередньою дією на патогени та їх токсини, з імуномодулюючою активністю й посиленням бар’єрної функції кишечника.
Чисельними експериментальними й клінічними дослідженнями доведено позитивний ефект від застосування пробіотиків для профілактики ААД [3, 13, 16, 22]. Так, за даними L.V. McFarland (2010), із 41 рандомізованого й плацебо-контрольованого дослідження 58 % показали вірогідну ефективність застосування пробіотиків для профілактики ААД [18]. Узагальнення результатів 16 рандомізованих досліджень показало, що ААД зустрічалась у 9 % в групах пацієнтів, які отримували пробіотики, і 18 % пацієнтів групи контролю [15].
Сьогодні накопичується все більше даних про ефективність застосування пробіотиків-антагоністів, що самоелімінуються, яку пов’язують зі здатністю їх до селективної або неселективної деконтамінації кишечника для пригнічення надлишкової флори [6]. Дослідженнями in vitro доведено, що Bacillus subtilis мають високу антагоністичну активність щодо більшості грампозитивних і грамнегативних бактерій, у тому числі їх антибіотикорезистентних штамів, грибів роду Candida та не впливають на представників нормальної мікрофлори [7]. Встановлено, що стосовно ряду збудників пробіотики на основі Bacillus subtilis демонструють порівнянну, а в деяких випадках — і більш виражену активність, ніж традиційні антибіотики й протигрибкові препарати [5]. Ще однією з важливих властивостей бактерій роду Bacillus, що визначає перспективність застосування пробіотиків на їх основі при антибактеріальному лікуванні пацієнтів з інфекційними захворюваннями, є імуномодулюючі ефекти (підсилення клітинного та гуморального імунітету, синтезу α-2-інтерферону, підвищення неспецифічної резистентності організму людини) [1, 19].
При надходженні до ШКТ бактерії роду Bacillus протягом 2 годин практично повністю (до 90 %) переходять у вегетативні форми й інтенсивно синтезують протеолітичні ферменти, каталазу, дипіколінову кислоту й інші біологічно активні речовини з наступною їх дифузією на слизову оболонку кишечника, а також активують власний синтез антимікробних пептидів епітелієм ШКТ. Це призводить до пригнічення росту патогенних та умовно-патогенних мікроорганізмів, стимуляції обміну й процесів травлення, що створює умови для домінуючого і активного росту власних Lactobacillus і Bifidobacterium [9].
Крім того, перспективність застосування пробіотиків, до складу яких входять бактерії Bacillus subtilis, визначають такі властивості, як нешкідливість переважної більшості представників цього роду бактерій для макроорганізму навіть у високих концентраціях, стійкість до дії антибактеріальних препаратів і літичних ферментів, що обумовлює високу життєдіяльність в ШКТ і можливість застосування з першого дня антибіотикотерапії [3, 5].
Це визначає актуальність даної роботи. Як пробіотик було запропоновано Субалін, форма випуску — порошок у флаконах. Він належить до групи спороутворюючих пробіотиків-антагоністів, що самоелімінуються, до складу яких входять неспецифічні для людини мікроорганізми Bacillus subtilis УКМ В-5020 (в одній дозі препарату міститься не менше від 1 × 109 живих мікробних клітин).
Метою даного дослідження було вивчення клінічної ефективності й безпеки застосування пробіотика на основі Bacillus subtilis для профілактики антибіотик-асоційованої діареї в дітей раннього віку.
Матеріали та методи
У клінічному дослідженні взяли участь 45 пацієнтів раннього дитячого віку (від 1 місяця до 3 років життя), у тому числі 24 хлопчики й 21 дівчинка. Розподіл дітей за віком був таким: віком від 1 до 6 місяців — 11 (24,4 %) дітей, від 6 до 12 місяців — 15 (33,3 %) дітей, дітей 2-го року життя — 10 (22,2 %), 3-го року життя — 9 (20,0 %) пацієнтів. Критерієм включення в дослідження був початок прийому антибіотиків з приводу бактеріальної інфекції.
На початку дослідження всі діти пройшли комплексне клініко-лабораторне й інструментальне обстеження, що дозволило виявити захворювання дихальних шляхів у 23 (51,1 %) дітей, у тому числі гострий або затяжний бронхіт — у 9 (20,0 %) дітей, негоспітальну пневмонію — у 14 (31,1 %) дітей, захворювання лор-органів (гострий отит середнього вуха, тонзиліт, ангіна) — у 9 (20,0 %) дітей, дерматит з елементами інфікування — у 8 (17,8 %), інфекцію сечовивідних шляхів — у 5 (11,1 %) дітей.
Після встановлення діагнозу всі пацієнти починали отримувати лікування основного захворювання згідно з чинними клінічними протоколами.
Серед усіх взятих під спостереження пацієнтів 26 (57,8 %) дітей отримували антибіотик цефалоспоринового ряду, 9 (20,0 %) — напівсинтетичний антибіотик групи пеніцилінів широкого спектра дії, 10 (22,2 %) дітям було призначено антибіотик із групи макролідів. Шлях введення антибіотика у 19 (42,2 %) дітей — парентеральний, у 26 (57,8 %) дітей — пероральний. Тривалість прийому антибіотика в середньому становила 6,4 ± 0,5 доби.
Методом простої рандомізації діти були поділені на дві групи: 1-ша (основна) група (n = 25), пацієнти якої в комплексі терапії отримували пробіотик на основі Bacillus subtilis (Субалін), і 2-га (контрольна) група (n = 20), пацієнти якої отримували антибактеріальну терапію без застосування пробіотиків. Пацієнти основної й контрольної груп були ідентичні за статтю, віком і тяжкістю захворювання. Випадків дострокового вибування пацієнтів із дослідження не було.
Пробіотик Субалін у комплекс терапії дітей 1-ї групи було включено з першої-другої доби антибіотикотерапії в дозі по 1 флакону два рази на добу за 30–40 хвилин до прийому їжі (згідно з інструкцією). Термін лікування становив від 2 до 3 тижнів залежно від динаміки об’єктивних і суб’єктивних проявів захворювання.
Для оцінки ефективності й переносимості пробіотика застосовували такі методи: клініко-епідеміологічний анамнез, реєстрація суб’єктивних скарг батьків, об’єктивне дослідження (загальний стан дитини, характер вигодовування, стан ШКТ, неврологічний статус, стан шкіри, середньодобова прибавка маси тіла, сон, апетит), показники копрограми й бактеріологічного дослідження калу, ультразвукове дослідження органів черевної порожнини. Оцінка динаміки клінічних синдромів проводилась на 1-шу, 3-тю, 7-му, 14-ту добу лікування.
Результати аналізували стандартними методами медичної статистики.
Результати та обговорення
При клінічному обстеженні на початку дослідження в частини дітей (21 дитина — 46,7 %) поряд із клінічними проявами основного захворювання були виявлені гастроінтестинальні розлади, серед яких найбільш часто спостерігались больовий абдомінальний синдром (у 12 дітей — 26,7 %) і зміна частоти й характеру випорожнень (у 16 дітей — 35,6 %). Скарги на зригування або блювання були відмічені в 7 (15,6 %) дітей. У більшості дітей із розладами моторики кишечника відмічались часті розріджені випорожнення (у 12 дітей), а схильність до запору з твердими випорожненнями була тільки в 4 дітей. У 9 (20,0 %) відмічена присутність у випорожненнях слизу, матері 10 (22,2 %) дітей відмічали присутність в фекаліях частково неперетравленої їжі. 11 (24,4 %) дітей при обстеженні на початку дослідження мали клінічні прояви метеоризму (бурчання по ходу кишечника при пальпації, посилена флатуленція). Зменшення апетиту й добового об’єму спожитої їжі на початку дослідження мали майже половина дітей (21 дитина — 46,7 %), що можна розцінювати як прояв основного захворювання й результат функціональних розладів роботи ШКТ (табл. 1).
/64-1.jpg)
При копрологічному обстеженні на старті лікування ознаки запального процесу в кишечнику (підвищена кількість лейкоцитів) виявлені у 8 (17,8 %) дітей, прояви мальдигестії мала майже третина пацієнтів, у тому числі стеаторею — 14 (31,1 %) дітей, креаторею — 9 (20,0 %) дітей, амілорею — 10 (22,5 %) дітей. Копрологічні ознаки порушення мікробіоценозу кишечника (йодофільна мікробна флора у великій або помірній кількості) виявлені у 12 (26,7 %), міцелій грибів — у 4 (8,9 %) дітей.
При бактеріологічному обстеженні пацієнтів на старті лікування дисбіоз різного ступеня був виявлений у 13 (28,9 %) дітей, більше ніж половина з них (8 дітей) мали незначні дисбіотичні розлади (дисбіоз 1-го ступеня), 3 дитини мали дисбіоз 2-го ступеня, у 2 дітей було виявлено глибокі дисбіотичні порушення (дисбіоз 3-го ступеня). Середній рівень індигенної мікрофлори у фекаліях на початку дослідження становив: біфідобактерії — 7,8 ± 0,7 lgКУО/г, лактобактерії — 7,21 ± 0,54 lgКУО/г, загальна кількість кишкових паличок — 6,3 ± 0,55 lgКУО/г. У фекаліях 15 (33,3 %) дітей (9 осіб основної групи та 6 — контрольної) було виявлено збільшення концентрації умовно-патогенних бактерій (УПБ) — стафілококи, протей, клебсієла, ентеробактер. На початку дослідження Staphylococcus аureus у концентрації ≥ 104 було виявлено у 8 (17,8 %) пацієнтів, E.сoli з патогенними властивостями в концентрації ≥ 104 — у 5 (11,1 %) пацієнтів. Підвищення рівня грибів роду Candida було виявлено в 7 (15,6 %) дітей. Асоціації УПБ на старті лікування виявлені в 11 дітей, у тому числі двокомпонентні — у 8 дітей, трикомпонентні — у 3 дітей.
Отже, при обстеженні на початку дослідження в значної частини дітей було виявлено розлади в роботі ШКТ і дисбіотичні порушення кишечника, що обґрунтовує доцільність включення пробіотика в комплекс лікування.
Клінічні спостереження в динаміці лікування показали відсутність збільшення гастроінтестинальних розладів на фоні прийому антибіотиків у переважної більшості дітей основної групи. У цій групі відмічено також швидке зменшення частоти й вираженості діарейного синдрому. Так, на старті лікування діарейний синдром мали 7 (28,0 %) дітей 1-ї групи, у тому числі троє дітей мали незначні прояви, а четверо — помірні прояви. При обстеженні на 3-тю — 7-му добу лікування діарейний синдром (незначні прояви) було виявлено тільки в 3 (16,0 %) дітей даної групи. На –14-ту добу прийому пробіотика на основі Bacillus subtilis частота й характер випорожнень відповідали віковій нормі у 23 (92,0 %) дітей основної групи, незначне розрідження випорожнень і збільшену частоту дефекацій мали тільки 2 дитини даної групи.
У той же час серед дітей контрольної групи, які не отримували пробіотики, на 3-тю — 7-му добу після початку антибактеріальної терапії діарейний синдром було зареєстровано в 50 % пацієнтів, серед них помірні прояви були виявлені в 7 (35 %) дітей, а виражені прояви, у зв’язку з якими було перервано курс антибіотика, — у 3 (15,0 %) дітей. На 14-ту добу спостереження діарейний синдром (незначні або помірні прояви) мали 6 (30,0 %) дітей контрольної групи.
Крім того, клінічне спостереження в динаміці лікування за дітьми основної групи показало позитивний вплив включення пробіотика на основі Bacillus subtilis у комплекс терапії на характер випорожнень (покращення консистенції й кольору, зменшення в калі слизу та інших домішок відмічено батьками 85,0 % дітей), на той час як у 55 % дітей 2-ї групи після проведення антибактеріальної терапії батьки відмічали стійке порушення характеру випорожнень.
Дослідження показали, що включення пробіотика на основі Bacillus subtilis у комплекс лікування дітей дозволило запобігти появі та/або посиленню гастроінтестинальних порушень при проведенні антибактеріальної терапії, насамперед діарейному синдрому й больовому абдомінальному синдрому. Після лікування вірогідні відмінності між порівнюваними групами виявлено за такими показниками, як порушення частоти й характеру випорожнень, больовий абдомінальний синдром, апетит дитини, середньодобова прибавка маси тіла.
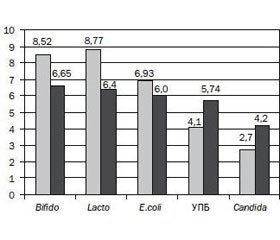
Бактеріологічне дослідження в динаміці лікування показало вірогідне збільшення рівня основних представників індигенної мікрофлори в фекаліях у дітей 1-ї групи: лактобактерій — з 7,45 ± 0,57 lgКУО/г до 8,77 ± 0,76 lgКУО/г, Р < 0,01; біфідобактерій — з 7,38 ± 0,60 lgКУО/г до 8,52 ± 0,82 lgКУО/г, Р < 0,05; E.coli з нормальними властивостями — з 6,30 ± 0,54 lgКУО/г до 6,93 ± 0,53 lgКУО/г, Р < 0,05 (рис. 1). Поряд зі збільшенням рівня індигенної мікрофлори після проведеного лікування в дітей 1-ї групи виявлено вірогідне зниження рівня УПБ (у середньому з 5,30 ± 0,63 lgКУО/г до 4,10 ± 0,34 lgКУО/г, Р < 0,05) та грибів роду Candida — з 4,2 ± 0,5 lgКУО/г до 2,70 ± 0,23 lgКУО/г, Р < 0,01).
/65-1.jpg)
Бактеріологічне обстеження пацієнтів 2-ї групи показало, що концентрація лакто- та біфідобактерій у мікробіоті кишечника в динаміці лікування дітей вірогідно зменшилась (з 7,27 ± 0,63 lgКУО/г до 6,4 ± 0,5 lgКУО/г і з 7,32 ± 0,56 lgКУО/г до 6,65 ± 0,50 lgКУО/г відповідно). Також у них виявлена тенденція до зниження концентрації E.coli з нормальними властивостями (з 6,64 ± 0,60 lgКУО/г до 5,90 ± 0,72 lgКУО/г, Р > 0,05) і вірогідне збільшення концентрації УПБ і грибів роду Candida (після лікування їх рівень становив 5,74 ± 0,62 lgКУО/г і 4,20 ± 0,5 lgКУО/г, Р < 0,05, відповідно). Отримані результати можна пояснити негативним впливом антибіотиків на стан мікробіоценозу кишечника, що підтверджує доцільність включення пробіотиків у комплекс лікування дітей при проведенні антибактеріальної терапії.
Отримані дані свідчать, що включення пробіотика на основі Bacillus subtilis (Субалін) у комплекс терапії дітей раннього віку дозволяє покращити стан мікробіоти кишечника й запобігти розвитку дисбіотичних порушень при застосуванні антибактеріальної терапії.
Загальна оцінка ефективності профілактичного застосування Bacillus subtilis під час проведення антибактеріальної терапії в дітей раннього віку показала: добрий клінічний ефект (відсутність діарейного синдрому, загальне зниження частоти й інтенсивності функціональних розладів ШКТ, нормалізація або покращення показників мікрофлори кишечника) був відмічений у 88,0 % дітей основної групи.
Як показало клінічне спостереження, індивідуальна переносимість пробіотика на основі Bacillus subtilis (Субалін) була доброю у 88,0 % дітей, задовільною — у 12,0 % дітей основної групи. Під час прийому в жодному випадку не спостерігали будь-яких негативних впливів на загальний стан дитини.
Висновки
Як показує клінічна практика, ААД є досить частим ускладненням антибактеріальної терапії, особливо в дітей раннього віку. Виникнення ААД чинить негативний вплив на лікування пацієнтів, у більшості випадків потребує передчасного припинення антибактеріальної терапії, збільшує ризик розвитку ускладнень та інших нозокоміальних інфекцій, збільшує тривалість госпіталізації хворих, значно збільшує вартість лікування. Тому важливою є своєчасна й ефективна профілактика ААД.
Проведені дослідження показали збільшення частоти гастроінтестинальних розладів і поглиблення дисбіотичних порушень мікробіоти кишечника в дітей у динаміці лікування антибіотиками. Це патогенетично обґрунтовує необхідність включення пробіотиків у комплекс лікування дітей при проведенні антибактеріальної терапії.
Такі властивості пробіотика на основі Bacillus subtilis (Субалін), як виражені антагоністичні ефекти щодо більшості патогенних і умовно-патогенних мікроорганізмів, імуномодулюючі властивості (підсилення клітинного й гуморального імунітету, синтезу α-2-інтерферону, підвищення неспецифічної резистентності організму людини), доведена нешкідливість для макроорганізму навіть у високих концентраціях, стійкість до дії антибактеріальних препаратів і літичних ферментів, що обумовлює високу життєдіяльність у ШКТ і можливість застосування з першого дня антибіотикотерапії, обумовлюють перспективність його застосування для профілактики ААД у дітей.
Виражений клінічний ефект від застосування даного пробіотика під час проведення антибактеріальної терапії (відсутність діарейного синдрому, загальне зниження частоти й інтенсивності функціональних розладів ШКТ, нормалізація або покращення показників мікрофлори кишечника) був відмічений у 22 (88,0 %) дітей, які отримували пробіотик на основі Bacillus subtilis (Субалін).
Виходячи із результатів дослідження, для профілактики дисбіозу кишечника й антибіотик-асоційованої діареї в дітей раннього віку можна рекомендувати застосування пробіотика на основі Bacillus subtilis (Субалін) з першого дня антибактеріальної терапії в дозі по 1 флакону 2 рази на добу протягом 2–3 тижнів (залежно від тяжкості захворювання, глибини дисбіотичних розладів й динаміки клінічних проявів під час лікування).
Конфлікт інтересів. Не заявлений.
Список литературы
1. Казмірчук В.Є., Мальцев Д.В. Вивчення ефективності і безпечності застосування Субаліну при лікуванні ГРВІ у часто і тривало хворіючих пацієнтів // Сучасні інфекції. — 2010. — № 3. — С. 100-106.
2. Майданник В.Г. Антибиотико-ассоциированная диарея у детей. — К.: ВБ «Аванпост-Прим», 2011. — 250 с.
3. Майданник В.Г. Антибиотико-ассоциированная диарея у детей: Клинические рекомендации. — К., 2016. — 32 c.
4. Похиленко В.Д. Пробиотики на основе спорообразующих бактерий и их безопасность / В.Д. Похиленко, В.В. Перелыгин // Химическая и биологическая безопасность. — 2007. — № 2–3. — С. 32-33.
5. Псахис И.Б. Современные возможности и перспективы использования пробиотиков группы самоэлиминирующихся антагонистов в терапии инфекционных заболеваний / И.Б. Псахис, Т.Е. Маковская // Здоровье ребенка. — 2014. — Т. 55, № 4. — С. 91-95.
6. Cафонова М.А. Пробиотические препараты для коррекции микроэкологических нарушений кишечника / М.А. Сафонова, О.Ю. Кузнецов // Вестник Ивановской медицинской академии. — 2012. — Т. 17, № 1. — С. 49-54.
7. Скрыпник И.Н. Современные cпорообразующие пробиотики в клинической практике / И.Н. Скрыпник, А.С. Маслова // Сучасна гастроентерологія. — 2009. — № 3, № 47. — C. 81-90.
8. Успенский Ю.П., Захаренко С.М., Фоминых Ю.А. Перспективы использования мультивидовых пробиотиков для профилактики развития антибиотик-ассоциированной диареи // Экспериментальная и клиническая гастроэнтерология. — 2013. — № 2. — С. 54-56.
9. Яковенко Э.П., Аникина Е.В., Яковенко А.В. [и др.]. Инновационные многовидовые мультиштаммовые пробиотики в клинической практике // Лечащий врач. — 2014. — № 5. — С. 15-212.
10. Allen S.J., Wareham K., Wang D., Bradley C., Hut–chings H., Harris W., Dhar A., Brown H., Foden A., Gravenor M.B. Lactobacilli and bifidobacteria in the prevention of antibiotic–associated diarrhoea and Clostridium difficile diarrhoea in older inpatients (PLACIDE): a randomised, double–blind, placebo–controlled, multicentre trial // Lancet. — 2013. — Early Online Publication, 8 August.
11. Bartlett J.G. Antibiotic–associated diarrhea // N. Engl. J. Med. — 2002. — Vol. 346, № 5. — Р. 334–339.
12. Cartman S.T., Heap J.T., Kuehne S.A., Cockayne A., Minton N.P., 2010. The emergence of ‘hypervirulence’ in Clostridium difficile // International Journal of Medical Microbiology. — 2010. — Vol. 300. — P. 387–395.
13. D’Souza A.L., Rajkumar C., Cooke J., Bulpitt C.J. Probio–tics in prevention of antibiotic associated diarrhoea: meta-analysis // BMJ. — 2002. — 324(7350). — 1361.
14. Hogenauer C., Hammer H.F., Krejs G.J., Reisinge E.C. Mechanisms and management of antibiotic–associated diarrhea // Clin. Infect. Dis. — 1998. — Vol. 27. — P. 702–710.
15. Johnston B.C., Goldenberg J.Z., Vandvik P.O., Sun X., Guyatt G.H. Probiotics for the prevention of pediatric antibiotic–associated diarrhea // Cochrane Database Syst. Rev. — 2011, Nov. 9. — № 11. — CD004827. doi: 10.1002/14651858.CD004827.pub3.
16. Koning C.J., Jonkers D.M., Stobberingh E.E., Mulder L. et al. The effect of a multispecies probiotic on the intestinal microbiota and bowel movements in healthy volunteers taking the antibiotic amoxycillin // Am. J. Gastroenterol. — 2008. — 103(1). — 178-89.
17. LaRosa M., Bottaro G., Gulino N. Prevention of antibiotic–associated diarrhea with Lactobacillus sporogens and fructo–oligosaccharides in children: a multicentric double–blind vs. placebo study // Minerva Pediatr. — 2003. — № 55. — Р. 447–452.
18. McFarland L.V., 2010 Probiotics and Diarrhea // Ann. Nutr. Metab. — 2010. — № 57 (suppl. 1). — Р. 10–11.
19. Mongkolthanaruk W. Classification of Bacillus beneficial substances related to plants, humans and animals / W. Mongkolthanaruk // J. Microbiol. Biotechnol. — 2012. — Vol. 22, № 12. — Р. 1597-1604.
20. Turck D., Bernet J.P., Marx J. et al. Incidence and risk factors of oral antibiotic–associated diarrhea in an outpatient pediatric population // J. Pediatr. Gastroenterol. Nutr. — 2003. — № 37. — Р. 22–26.
21. Vonberg R.P., Reichardt C., Behnke M. et al. Cost of nosocomial Clostridium difficile–associated diarrhea // J. Hosp. Infect. — 2008. — Vol. 70. — Р. 15–20.
22. WcFarland L.V. Evidence-based review of probiotics for antibiotic-associated diarrhea and Clostridium difficile infections // Anaerobe. — 2009. — 15(6). — 274-80. Epub 2009
23. Wistrom J., Norrby S.R., Myhre E.B. Frequency of antibiotic–associated diarrhoea in 2462 antibiotic–treated hospitalized patients: a prospective study // J. Antimicrob. Chemother. — 2001. — Vol. 47. — P. 43–50.

/64-1.jpg)
/65-1.jpg)