Введение
Во время инфекционного процесса патогенные бактерии нуждаются в обеспечении питательными веществами и в том числе ионами некоторых металлов, в частности, железа (Fe), марганца (Mn) и цинка (Zn). Учитывая, что макроорганизм ограничивает доступность ионов металлов, микроорганизмы в течение эволюции сформировали специфические молекулярные структуры — металлофоры, позволяющие патогенным бактериям усваивать данные металлы, которые, как правило, находятся в связанном состоянии [15, 27, 32, 34]. Металлы участвуют в многочисленных биохимических процессах, определяющих жизнедеятельность бактерий. Согласно результатам протеомических исследований, около 30 % всех белков используют ионы металлов как кофактор [10, 19]. Продемонстрировано, что ограничение захвата ионов железа, марганца и цинка микроорганизмами сопровождается подавлением роста их колонии и повышает их чувствительность к влиянию механизмов элиминации и антибактериальных средств [7–9, 50].
Ограничение доступа бактерий к ионам железа
Большинство бактерий являются микроорганизмами, для обеспечения жизнедеятельности которых необходимо железо. Механизмы поглощения железа бактерий и клеток млекопитающих существенно отличаются друг от друга. Сидерофоры представлены низкомолекулярными катехолатами, гидроксаматами, гидроксикарбоксилатами, которые с высокой аффинностью хелатируют ионы железа [21]. Установлено, что избыток железа в макроорганизме ассоциирован с развитием хронического течения инфекционного процесса, поскольку высокие уровни ионов железа способствуют формированию биопленки патогенных бактерий. Высокие уровни концентрации ионов железа необходимы для формирования бактериальных кластеров на ранних этапах развития биопленки и созревания биопленок в трехмерные структуры [5, 38, 44]. Снижение уровня доступности железа для патогенных микроорганизмов возможно за счет снижения уровня концентрации доступных ионов железа, ингибирования бактериальных механизмов, отвечающих за поглощение железа, или подмены ионов железа ионами другого металла. Снижение уровня концентрации доступного железа во время развития инфекционного процесса обеспечивают неспеци–фические гепцидин-зависимые механизмы защиты макроорганизма, а ингибирование бактериальных представляет достаточно сложную задачу, так как большинство патогенов имеют несколько систем поглощения железа. Например, у бактерии Pseudomonas aeruginosa идентифицировано более 30 генов, кодирующих Fe-связывающие рецепторы [14]. Из лекарственных средств, которые ограничивают доступ бактериям к железу, можно выделить сидеромицины, препараты галлия и лактоферрин (lactoferrin — LTF). Галлий может быть воспринят механизмами захвата ионов железа бактерий как железо, в связи с чем бактерии вместо железа поглощают галлий, что приводит к гибели микроорганизмов. Также продемонстрировано, что галлий, используя стратегию троянского коня, вытесняет железо из структур бактериальных сидерофоров [12]. Лактоферрин захватывает ионы железа, что приводит к снижению объема пула железа, доступного для патогенных бактерий [39].
Бактериальные сидерофоры
Большинство бактериальных патогенов являются микроорганизмами, жизнедеятельность которых высокозависима от обеспечения железом. Исключение составляют некоторые бактерии, например бактерия Borrelia burgdorferi — возбудитель болезни Лайма, для роста которой не требуется железо [47].
Железо является важнейшим макроэлементом практически всех живых микроорганизмов, действуя как кофактор ферментов, переносчик электронов и кофактор синтеза ДНК и РНК [2].
Бактерии используют ионы железа как химический элемент, который в соединениях может проявлять несколько (1–6) степеней окисления, а в биологических системах чаще всего встречается в двух- или трехвалентной форме [42]. Однако соединения с двухвалентным железом (Fe2+) из-за участия в реакции Фентона способствуют продукции высокого уровня активных кислородсодержащих метаболитов, а соединения с трехвалентным железом (Fe3+) не растворимы в воде и характеризуются низкой степенью биодоступности. Из-за нерастворимости в воде в организме человека уровень концентрации свободного железа чрезвычайно низок, а большинство ионов железа ассоциировано с протеинами депо (ферритином), транспорта (трансферрином, transferrin — TF) и другими железосодержащими протеинами (LTF), с которыми во время инфекционного процесса вступают в конкуренцию бактериальные специфические молекулярные образования — сидерофоры, обладающие высоким аффинитетом к ионам Fe2+ [25]. Бактерии приобретают железо следующими основными способами (рис. 1): захватывая свободные ионы железа и железосодержащие молекулярные образования. Большая часть бактерий поглощает железо при помощи сидерофоров. Некоторые бактерии продуцируют гемофоры (аналогичные сидерофорам), предназначенные для получения железа из экзогенного гема (феррумпротопорфирина). Также часть представителей бактериального мира экспрессируют рецепторы к TF и LTF, что позволяет им использовать железо, связанное с данными протеинами [21, 45].
Впервые сидерофоры были определены в 1953 году J. Francis и соавт. [18], в настоящее время идентифицировано более 500 различных видов сидерофоров (табл. 1).
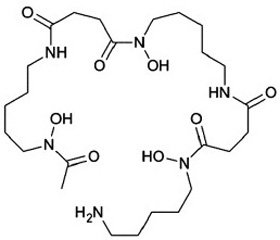
Сидерофоры представляют собой небольшие молекулы (с молекулярной массой от 500 до 1500 дальтон), обладающие высокой степенью аффинитета к трехвалентному железу. Сидерофоры представлены тремя группами низкомолекулярных соединений: катехолатами, гидроксаматами, гидроксикарбоксилатами, которые с высокой аффинностью хелатируют ионы железа (рис. 2) [3, 6].
Помимо захвата и транспорта ионов трехвалентного железа вовнутрь патогенов, бактериальные сидерофоры могут связывать и другие металлы (цинк, марганец, ванадий и молибден) и ионы элементов неметаллической группы (бора, кремния), обеспечивая их поглощение бактериями. Также бактериальные сидерофоры секвестируют ионы тяжелых металлов, предотвращая их проникновение в бактерии. Сидерофоры могут регулировать экспрессию генов и определять активность системы кворум сенсинга (quorum sensing) бактерий [27]. Разные сидерофоры выполняют различные неклассические функции, примеры которых представлены в табл. 2.
/93-1.jpg)
Поглощение сидерофоров у грамположительных и грамотрицательных бактерий имеет существенные отличия. Грамположительные бактерии, характеризующиеся наличием одной мембраны, поглощают сидерофоры при помощи сидерофор-связывающего протеина (siderophore-binding protein — SBP) и ассоциированной с ним пермеазы, расположенной на клеточной мембране [43]. Поглощение сидерофоров грамотрицательными бактериями, обладающими двойной мембраной, представляет собой многоступенчатый процесс. Первоначально сидерофоры, ассоциированные с ионами железа, распознаются специфическими рецепторами наружной мембраны, которые способствуют их транслокации в периплазматическое пространство. В периплазматическом пространстве сидерофоры транспортируются на периплазматическую поверхность внутренней мембраны при помощи периплазматического связывающего протеина (periplasmic binding protein — PBP). На внутренней мембране сидерофоры передают ионы трехвалентного железа при помощи АТФ-связывающих кассет (ATP binding cassette — ABC) во внутренний континуум бактерии и, лишившись ионов железа, транслоцируются через внешнюю мембрану за пределы бактерии. Ионы Fe3+ восстанавливаются до Fe2+ бактериальной –Fe3+-редуктазой [13].
Секрецию сидерофоров осуществляют эффлюксные насосы таких молекулярных семейств, как главного фасилитатора (major facilitator superfamily — MFS) и специфической группы протеинов резистентности грамотрицательной флоры (Gram-negative-specific Resistance-Nodulation-Cell Division — RND) [49].
Бактериальные штаммы, способные к чрезмерной продукции сидерофоров, обладают гипервирулентностью [40]. Избыток доступного железа усугубляет течение инфекционных заболеваний, вызванных различными патогенами (табл. 3).
/94-1.jpg)
Макроорганизм, препятствуя обеспечению железом железозависимых бактерий, реагирует на инфекционный процесс продукцией гепцидина, способствующего развитию анемии воспаления, и липокалина 2 (lipocalin 2 — Lcn2), секвестирующего бактериальные сидерофоры [20, 28]. Липокалин 2 (сидерокалин) является представителем семейства небольших белков, характеризующихся чашеобразной структурой, которая связывает и переносит небольшие гидрофобные органические молекулы. Основная функция Lcn2 заключается в секвестрации бактериальных сидерофоров, таких как энтеробактин. Липокалин 2 у людей продуцируется различными типами эпителиальных клеток, активированными нейтрофилами и макрофагами. Сидерофор-связывающий Lcn2 противодействует развитию бактериальной вирулентности, активность которой зависит от обес–печения патогена железом [20].
Конкуренция макроорганизма с патогенами за обладание железом является критическим процессом при многочисленных инфекционных заболеваниях. Контроль над функционированием механизмов потребления железа патогенами считают важнейшим терапевтическим направлением антибактериальной терапии. На результат конкуренции в процессе приобретения железа влияют различные биологические факторы (табл. 4).
Нарушение обеспечения железом бактерий за счет снижения уровня концентрации доступных ионов железа; ингибирования синтеза бактериальных сидерофоров; применения препаратов, содержащих сидерофоры, конъюгированных с антибиотиками; применения препаратов, содержащих галлий, который конкурентно вымещает железо, может вызвать гибель патогенных микроорганизмов и способствовать процессу выздоровления.
Снижение концентрации доступных для бактерий ионов железа
Хелаторы железа (сидерофоры)
На основе сидерофоров разработаны многочисленные лекарственные средства, захватывающие ионы железа. Железохелатирующие препараты, а также молекулы, связывающие железо (тетрациклины, антрациклины, салицилаты, гидроксимочевина), оказывают влияние на поглощение железа патогенными микроорганизмами и могут ингибировать или стимулировать рост бактериальных колоний [17, 30].
Из многочисленных препаратов, хелатирующих железо, наиболее признанными и одобренными FDA США являются дефероксамин (Desferrioxamine — DFO)-N-{5-[ацетил(гидрокси)амино]пентил}-N-[5-({4-[(5-аминопентил)(гидрокси)амино]-ксобутаноил}амино)пентил]-–
N-гидроксисукцинамид (C25H48N6O8, молекулярная масса 560,68 гмоль–1); деферипрон (deferiprone — DFP)-3-гидрокси-1,2-dimethylpiridin-4(1H)-он; и дефе–расирокс (deferasirox — DFRA)-4-[3,5-бис(2-гидроксифенил)-1Н-1,2,4-триазол-1-ил] бензойная кислота (C21H15N3O4, молекулярная масса 373,36 гмоль–1) [35, 36].
Препараты, хелатирующие железо, в определенных клинических случаях могут сыграть ключевую роль, определяющую эффективность антимикробной терапии [30]. Особенности приема и характеристика терапии данными препаратами представлена в табл. 5.
Полагают, что дефероксамин в зависимости от возбудителя может как способствовать, так и препятствовать бактериальному росту, а деферипрон и деферасирокс предотвращают рост колоний патогенных бактерий. Деферипрон характеризуется самым высоким терапевтическим уровнем пролонгированной антимикробной активности [30].
В частности, Choon-Mee Kim и Sung-Heui Shin [29] продемонстрировали, что стандартный хелатор железа дефероксамин, который предотвращает рост коагулазоотрицательных стафилококков (coagulase-negative staphylococci — CoNS), являющихся основными патогенами у пациентов с перегрузкой железом, способствует росту колоний коагулазоположительного золотистого стафилококка.
Деферипрон при относительно высоких дозах активно ингибирует рост всех стафилококковых штаммов [29]. Авторы считают, что применение деферипрона показано для предотвращения развития стафилококковой инфекции у пациентов с перегрузкой железом.
Деферипрон и такие хелаторы железа, как препараты Apo6619 и VK28, ингибируют рост Pseudomonas aeruginosa, Klebsiella pneumoniae, в то время как дефероксамин не оказывает влияния на рост колоний данных бактерий. Установлено, что хелатор железа VK28 обладает бактериостатическим действием на бактерии Staphylococcus aureus [46].
Таким образом, препараты, хелатирующие железо, в частности деферипрон и деферасирокс, показаны при инфекционных заболеваниях, вызванных антибиотикорезистентными возбудителями, и при инфекциях у пациентов с синдромом перегрузки железом.
Лактоферрин
Молекула LTF обладает уникальной способностью секвестировать ионы железа и, таким образом, подавлять жизнедеятельность бактерий, их токсичность и биопленочную активность. Лактоферрин является представителем трансферринового семейства, также включающего в себя собственно TF и овотрансферрин, меланотрансферрин, ингибитор карбоангидразы [22].
Лактоферрин является одним из компонентов вторичных гранул нейтрофилов. Нейтрофилы выступают клетками депо, которые содержат от 3 до 15 мкг LTF в 106 нейтрофилов, и высвобождают LTF в местах инфицирования. В физиологических условиях в сыворотке крови уровень концентрации LTF очень низок (0,4–2 мкг/мл), однако во время септического процесса уровень его содержания повышается до 0,2 мг/мл [16].
Результаты многочисленных исследований продемонстрировали, что LTF может оказывать бактериостатическое действие за счет железо-хелатирующей активности, но также может проявлять и бактерицидный эффект за счет взаимодействия с липополисахаридами и поринами грамотрицательных бактерий или с тейхоевыми кислотами грамположительных бактерий [16]. В частности, Blanca Iglesias-Figueroa и соавт. [26] убедительно продемонстрировали, что рекомбинантный LTF проявляет антибактериальную активность против бактерий Escherichia coli BL21DE3, Staphylococcus aureus FRI137, в несколько меньшей степени — против бактерий Pseudomonas aeruginosa ATCC 27833. Антимикробная активность LTF зависит от катионных свойств его молекулы, поскольку увеличение положительного заряда молекулы LTF после амидирования повышает его антибактериальную и противовирусную активность, и наоборот, увеличение отрицательного заряда за счет ацилирования нивелирует данные свойства [37].
Лактоферрин оказывает антибактериальное влияние за счет противодействия бактериальному синтезу высокоаффинных хелаторов ионов трехвалентного железа (сидерофоров) и ограничения доступа бактерий к ионам железа, физически связывая его свободные ионы [39].
Снижение концентрации ионов железа за счет секвестирующей активности LTF обусловливает изменение движений фимбрий грам–отрицательных бактерий. Показано, что LTF-ассоциированный специфический тип движения фимбрий, в частности, у бактерий Pseudomonas aeruginosa, не позволяет бактериям прикрепиться к поверхности клеток хозяина и начать формирование микроколоний, в связи с чем подавляется развитие бактериальной биопленки. Антипленочная активность LTF наблюдается даже при очень низкой его концентрации (0,02 мг/мл). Прямое подавление роста бактерий наблюдается при значительно более высоких концентрациях LTF (выше в пять и более раз) [1, 4, 16]. Piera Valenti и соавт. [48] продемонстрировали, что LTF коровьего молока подавляет инвазивность биопленки, формируемой бактериями Burkholderia cenocepacia, которые были выделены из респираторного тракта больных муковисцидозом. Добавление LTF коровьего молока к монослойным культурам эпителиоцитов во время инфицирования бактериями Burkholderia cenocepacia ингибировало продукцию IL-1β.
Ke Chen и соавт. [11] продемонстрировали, что применение молочной смеси, обогащенной LTF (38 мг LTF в 100 г молока), способствует достоверному снижению риска заболевания острыми респираторными инфекциями у детей первого года жизни.
Также LTF обладает выраженным противовоспалительным действием (табл. 6) [31].
В частности, было показано, что внутрибрюшинное введение LTF экспериментальным мышам с острым поражением легкого способствует снижению уровня воспалительной реакции. После введения LTF мышам с острым LPS-индуцированным поражением легкого наблюдается значительное снижение активности легочной миелопероксидазы, концентрации TNF-α и количества иммуноцитов в бронхоальвеолярной лаважной жидкости, а также степени инфильтрации воспалительными клетками ткани пораженных регионов легкого и выраженности отека ткани легких [33].
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Абатуров А.Е. Значение металлосвязывающих белков в неспецифической защите респираторного тракта. 1. Лактоферрин // Здоровье ребенка. — 2009. — № 4(19). — С. 125-128.
2. Aguado-Santacruz G.A.A. Impact of the microbial siderophores and phytosiderophores on the iron assimilation by plants: a synthesis / G.A.A. Aguado-Santacruz, B.A. Moreno-Gómez, B.B. Jiménez-Francisco et al. // Rev. Fitotec. Mex. — 2012. — 35. — Р. 9-21.
3. Ahmed E., Holmström S.J. Siderophores in environmental research: roles and applications // Microb. Biotechnol. — 2014 May. — № 7(3). — Р. 196-208. — doi: 10.1111/1751-7915.12117.
4. Ammons M.C., Copié V. Mini-review: Lactoferrin: a bioinspired, anti-biofilm therapeutic // Biofouling. — 2013. — № 29(4). — Р. 443-55. — doi: 10.1080/08927014.2013.773317.
5. Banin E., Vasil M.L., Greenberg E.P. Iron and Pseudomonas aeruginosa biofilm formation // Proc. Natl. Acad. Sci USA. — 2005 Aug 2. — № 102(31). — Р. 11076-81.
6. Boukhalfa H. Siderophore production and facilitated uptake of iron and plutonium in P. putida / H. Boukhalfa, J. Lack, S.D. Reilly et al. // AIP Conf. Proc. — 2003. — 673. — Р. 343-344.
7. Brophy M.B. Contributions of the S100A9 C-terminal tail to high-affinity Mn(II) chelation by the host-defense protein human calprotectin / M.B. Brophy, T.G. Nakashige, A. Gaillard, E.M. Nolan // J. Am. Chem. Soc. — 2013 Nov 27. — № 135(47). — Р. 17804-17. — doi: 10.1021/ja407147d.
8. Brown L.R. Increased Zinc Availability Enhances Initial Aggregation and Biofilm Formation of Streptococcus pneumoniae / L.R. Brown, R.C. Caulkins, T.E. Schartel et al. // Front. Cell. Infect. Microbiol. — 2017 Jun 7. — 7. — 233. — doi: 10.3389/fcimb.2017.00233.
9. Bruhn K.W., Spellberg B. Transferrin-mediated iron sequestration as a novel therapy for bacterial and fungal infections // Curr. Opin. Microbiol. — 2015 Oct. — 27. — Р. 57-61. — doi: 10.1016/j.mib.2015.07.005.
10. Capdevila D.A., Edmonds K.A., Giedroc D.P. Metallochaperones and metalloregulation in bacteria // Essays Biochem. — 2017 May 9. — № 61(2). — Р. 177-200. — doi: 10.1042/EBC20160076.
11. Chen K. Effect of bovine lactoferrin from iron-fortified formulas on diarrhea and respiratory tract infections of weaned infants in a randomized controlled trial / K. Chen, L. Chai, H. Li et al. // Nutrition. — 2016 Feb. — № 32(2). — Р. 222-7. — doi: 10.1016/j.nut.2015.08.010.
12. Chitambar C.R. The therapeutic potential of iron-targeting gallium compounds in human disease: From basic research to clinical application // Pharmacol. Res. — 2017 Jan. — 115. — Р. 56-64. — doi: 10.1016/j.phrs.2016.11.009.
13. Chu B.C. Siderophore uptake in bacteria and the battle for iron with the host; a bird’s eye view / B.C. Chu, A. Garcia-Herrero, T.H. Johanson et al. // Biometals. — 2010 Aug. — № 23(4). — Р. 601-11. — doi: 10.1007/s10534-010-9361-x.
14. Cornelis P. Iron uptake and metabolism in pseudomonads // Appl. Microbiol. Biotechnol. — 2010 May. — № 86(6). — Р. 1637-45. — doi: 10.1007/s00253-010-2550-2.
15. Deicke M. Metallophore mapping in complex matrices by metal isotope coded profiling of organic ligands / M. Deicke, J.F. Mohr, J.P. Bellenger, T. Wichard // Analyst. — 2014 Dec 7. — № 139(23). — Р. 6096-9. — doi: 10.1039/c4an01461h.
16. Drago-Serrano M.E. Lactoferrin: Balancing Ups and Downs of Inflammation Due to Microbial Infections / M.E. Drago-Serrano, R. Campos-Rodríguez, J.C. Carrero, M. de la Garza // Int. J. Mol. Sci. — 2017 Mar 1. — № 18(3). — Рii: E501. — doi: 10.3390/ijms18030501.
17. Ferreira D. Targeting human pathogenic bacteria by si–derophores: A proteomics review / D. Ferreira, A.M. Seca, D.C.G.A. Pinto, A.M. Silva // J. Proteomics. — 2016 Aug 11. — 145. — Р. 153-66. — doi: 10.1016/j.jprot.2016.04.006.
18. Francis J. Mycobactin, a growth factor for Mycobacterium johnei. I. Isolation from Mycobacterium phlei / Francis J., Macturk H.M., Madinaveitia J., Snow G.A. // Biochem J. — 1953 Nov. — № 55(4). — Р. 596-607. — PMID: 13115341.
19. Fu D., Finney L. Metalloproteomics: challenges and prospective for clinical research applications // Expert. Rev. Proteomics. — 2014 Feb. — № 11(1). — Р. 13-9. — doi: 10.1586/14789450.2014.876365.
20. Ganz T. Iron and infection // Int. J. Hematol. — 2018 Jan. — № 107(1). — Р. 7-15. — doi: 10.1007/s12185-017-2366-2.
21. Ge R., Sun X. Iron acquisition and regulation systems in Streptococcus species // Metallomics. — 2014 May. — № 6(5). — Р. 996-1003. — doi: 10.1039/c4mt00011k.
22. González-Chávez S.A., Arévalo-Gallegos S., Rascón-Cruz Q. Lactoferrin: structure, function and applications // Int. J. Antimicrob. Agents. — 2009 Apr. — № 33(4). — Р. 301.e1-8. — doi: 10.1016/j.ijantimicag.2008.07.020.
23. Górska A., Sloderbach A., Marszałł M.P. Siderophore-drug complexes: potential medicinal applications of the 'Trojan horse’ stra–tegy // Trends Pharmacol. Sci. — 2014 Sep. — № 35(9). — Р. 442-9. — doi: 10.1016/j.tips.2014.06.007.
24. Guillén C. Enhanced Th1 response to Staphylococcus aureus infection in human lactoferrin-transgenic mice / C. Guillén, I.B. McInnes, D.M. Vaughan et al. // J. Immunol. — 2002 Apr 15. — № 168(8). — Р. 950-7. — PMID: 11937551.
25. Holden V.I., Bachman M.A. Diverging roles of bacterial si–derophores during infection // Metallomics. — 2015 Jun. — № 7(6). — Р. 986-95. — doi: 10.1039/c4mt00333k.
26. Iglesias-Figueroa B. High-Level Expression of Recombinant Bovine Lactoferrin in Pichia pastoris with Antimicrobial Activity / B. Iglesias-Figueroa, N. Valdiviezo-Godina, T. Siqueiros-Cendón et al. // Int. J. Mol. Sci. — 2016 Jun 9. — № 17(6). — Рii: E902. — doi: 10.3390/ijms17060902.
27. Johnstone T.C., Nolan E.M. Beyond iron: non-classical biological functions of bacterial siderophores // Dalton Trans. — 2015 Apr 14. — № 44(14). — Р. 6320-39. — doi: 10.1039/c4dt03559c.
28. Jung M. Lipocalin-2 and iron trafficking in the tumor microenvironment / Jung M., Mertens C., Bauer R. et al. // Pharmacol. Res. — 2017 Jun. — 120. — Р. 146-156. — doi: 10.1016/j.phrs.2017.03.018.
29. Kim C.M., Shin S.H. Effect of iron-chelator deferiprone on the in vitro growth of staphylococci // J. Korean Med. Sci. — 2009 Apr. — № 24(2). — Р. 289-95. — doi: 10.3346/jkms.2009.24.2.289.
30. Kontoghiorghes G.J. The role of iron and chelators on infections in iron overload and non iron loaded conditions: prospects for the design of new antimicrobial therapies / G.J. Kontoghiorghes, A. Kolnagou, A. Skiada, G. Petrikkos // Hemoglobin. — 2010 Jun. — № 34(3). — Р. 227-39. — doi: 10.3109/03630269.2010.483662.
31. Kruzel M.L., Zimecki M., Actor J.K. Lactoferrin in a Context of Inflammation-Induced Pathology // Front. Immunol. — 2017 Nov 6. — 8. — 1438. — doi: 10.3389/fimmu.2017.01438.
32. Lhospice S. Pseudomonas aeruginosa zinc uptake in chelating environment is primarily mediated by the metallophore pseudopaline / S. Lhospice, N.O. Gomez, L. Ouerdane et al. // Sci. Rep. — 2017 Dec 7. — № 7(1). — 17132. — doi: 10.1038/s41598-017-16765-9.
33. Li X.J. Lactoferrin protects against lipopolysaccharide-induced acute lung injury in mice / X.J. Li, D.P. Liu, H.L. Chen et al. // Int. Immunopharmacol. — 2012 Feb. — № 12(2). — Р. 460-4. — doi: 10.1016/j.intimp.2012.01.001.
34. McFarlane J.S., Lamb A.L. Biosynthesis of an Opine Metallophore by Pseudomonas aeruginosa // Biochemistry. — 2017 Nov 14. — № 56(45). — Р. 5967-5971. — doi: 10.1021/acs.biochem.7b00804.
35. Mobarra N. A Review on Iron Chelators in Treatment of Iron Overload Syndromes / N. Mobarra, M. Shanaki, H. Ehteram et al. // Int. J. Hematol. Oncol. Stem. Cell. Res. — 2016 Oct 1. — № 10(4). — Р. 239-247.
36. Nurchi V.M. Chemical features of in use and in progress chelators for iron overload / V.M. Nurchi, G. Crisponi, J.I. Lachowicz et al. // J. Trace Elem. Med. Biol. — 2016 Dec. — 38. — Р. 10-18. — doi: 10.1016/j.jtemb.2016.05.010.
37. Pan Y. Comparison of the effects of acylation and amidation on the antimicrobial and antiviral properties of lactoferrin / Y. Pan, J. Wan, H. Roginski et al. // Lett. Appl. Microbiol. — 2007 Mar. — № 44(3). — Р. 229-34.
38. Reinhart A.A., Oglesby-Sherrouse A.G. Regulation of Pseudomonas aeruginosa Virulence by Distinct Iron Sources // Genes (Basel). — 2016 Dec 14. — № 7(12). — Рii: E126. Review. — PMID: 27983658.
39. Rosa L. Lactoferrin: A Natural Glycoprotein Involved in Iron and Inflammatory Homeostasis / L. Rosa, A. Cutone, M.S. Lepanto et al. // Int. J. Mol. Sci. — 2017 Sep 15. — № 18(9). — Рii: E1985. — doi: 10.3390/ijms18091985.
40. Russo T.A. Hypervirulent K. pneumoniae secretes more and more active iron-acquisition molecules than "classical" K.pneumoniae thereby enhancing its virulence / T.A. Russo, A.S. Shon, J.M. Beanan et al. // PLoS One. — 2011. — № 6(10). — Р. e26734. — doi: 10.1371/journal.pone.0026734.
41. Saha M. Microbial siderophores and their potential applications: a review / M. Saha, S. Sarkar, B. Sarkar et al. // Environ Sci. Pollut. Res. Int. — 2016 Mar. — № 23(5). — Р. 3984-99. — doi: 10.1007/s11356-015-4294-0.
42. Sheldon J.R., Laakso H.A., Heinrichs D.E. Iron Acquisition Strategies of Bacterial Pathogens // Microbiol. Spectr. — 2016 Apr. — № 4(2). — doi: 10.1128/microbiolspec.VMBF-0010-2015.
43. Sia A.K., Allred B.E., Raymond K.N.Siderocalins: Siderophore binding proteins evolved for primary pathogen host defense // Curr. Opin. Chem. Biol. — 2013 Apr. — № 17(2). — Р. 150-7. — doi: 10.1016/j.cbpa.2012.11.014.
44. Smith D.J. Targeting iron uptake to control Pseudomonas aeruginosa infections in cystic fibrosis / D.J. Smith, I.L. Lamont, G.J. Anderson, D.W. Reid // Eur. Respir. J. — 2013 Dec. — № 42(6). — Р. 1723-36. — doi: 10.1183/09031936.00124012.
45. Soares M.P., Weiss G. The Iron age of host-microbe interactions // EMBO Rep. — 2015 Nov. — № 16(11). — Р. 1482-500. — doi: 10.15252/embr.201540558.
46. Thompson M.G. Antibacterial activities of iron chelators against common nosocomial pathogens / M.G. Thompson, B.W. Corey, Y. Si et al. // Antimicrob. Agents Chemother. — 2012 Oct. — № 56(10). — Р. 5419-21. — doi: 10.1128/AAC.01197-12.
47. Troxell B., Yang X.F. Metal-dependent gene regulation in the causative agent of Lyme disease // Front. Cell. Infect. Microbiol. — 2013 Nov 15. — 3. — 79. — doi: 10.3389/fcimb.2013.00079.
48. Valenti P. Lactoferrin decreases inflammatory response by cystic fibrosis bronchial cells invaded with Burkholderia cenocepacia iron-modulated biofilm / P. Valenti, A. Catizone, F. Pantanella et al. // Int. J. Immunopathol. Pharmacol. — 2011 Oct-Dec. — № 24(4). — Р. 1057-68. — doi: 10.1177/039463201102400423.
49. Wilson B.R. Siderophores in Iron Metabolism: From Mechanism to Therapy Potential / B.R. Wilson, A.R. Bogdan, M. Miyazawa et al. // Trends Mol. Med. — 2016 Dec. — № 22(12). — Р. 1077-1090. — doi: 10.1016/j.molmed.2016.10.005.
50. Zheng T., Nolan E.M. Siderophore-based detection of Fe(III) and microbial pathogens // Metallomics. — 2012 Aug. — № 4(9). — Р. 866-80. — doi: 10.1039/c2mt20082a.

/91-1.jpg)
/92-1.jpg)
/93-1.jpg)
/94-1.jpg)
/95-1.jpg)
/96-1.jpg)