Введение
Нейтропении довольно часто встречаются в практике педиатра. Природа их разнообразна, и каждый случай нейтропении нуждается в проведении тщательной дифференциальной диагностики для определения тактики ведения больного в зависимости от этиологии нейтропении. При дифференцированном подходе к пациентам с нейтропениями возможно предупредить развитие серьезных осложнений инфекционных процессов.
Обзор литературы
Нейтропения определяется как снижение абсолютного количества нейтрофилов в периферической крови менее 1000 кл/мкл (1,0 • 109/л) у детей до года и менее 1500 кл/мкл (1,5 • 109/л) у более старших пациентов [1, 2]. Она наблюдается при разных ситуациях — от варианта нормы до жизнеугрожающих приобретенных или врожденных заболеваний. Тяжесть состояния пациента и риск возникновения тяжелых осложнений инфекционного и бактериального происхождения напрямую зависит от степени выраженности нейтропении.
Абсолютное количество нейтрофилов в пределах 1,0–1,5 • 109/л расценивается как легкая нейтропения и практически не влияет на частоту инфекционных эпизодов [1, 3]. Абсолютное количество нейтрофилов в пределах 0,5–1,0 • 109/л трактуется как умеренная нейтропения, при которой увеличивается риск инфекций у детей. Абсолютное число нейтрофилов 0,2–0,5 • 109/л классифицируется как тяжелая нейтропения, которая ассоциирована с высоким риском инфекций у большинства пациентов. Количество нейтрофилов 0,2 • 109/л и менее, определяемое как агранулоцитоз, несет риск тяжелых, жизнеугрожающих инфекций, как правило с преобладанием оппортунистической флоры [3].
Весь период жизнедеятельности нейтрофильных гранулоцитов занимает 15 суток и делится на три фазы: пролиферация в главном кроветворном органе, свободная циркуляция в потоке периферической крови, а при необходимости в органах и тканях, и их физиологическое разрушение. Нарушение каждого из этих периодов жизнедеятельности нейтрофильных гранулоцитов может провоцировать развитие той или иной формы нейтропении. Продукция нейтрофильных лейкоцитов, как и всех остальных клеток крови, осуществляется в костном мозге. Морфологически распознаваемыми предшественниками гранулоцитов служат миелобласты, число которых в миелограмме в норме менее 5 %. Все клетки гранулоцитарного ряда в миелограмме делятся на пролиферирующий пул (миелобласты, промиелоциты, миелоциты) и созревающий пул (метамиелоциты палочкоядерные и сегментоядерные нейтрофилы). Содержание в миелограмме каждой клеточной популяции возрастает по мере созревания, и максимально в ней представлены палочкоядерные (16–23 %) и сегментоядерные (17–20 %) нейтрофилы. Зрелые нейтрофилы находятся в костном мозге в среднем 76 часов, и их количество в 20–50 раз больше, чем в периферической крови. Это важный резерв нейтрофильных гранулоцитов, которые выходят на периферию в больших количествах при потребности в них (при бактериальных инфекциях).
В сосудистом русле нейтрофильные гранулоциты делятся на два пула: циркулирующий и маргинальный, в которых содержится одинаковое количество клеток, и это контролируется вегетативной нервной системой. При ваготонии увеличивается маргинальный пул нейтрофилов, а при симпатикотонии — циркулирующий. В периферической крови нейтрофильные лейкоциты находятся от нескольких минут до 6 часов и далее уходят в ткани, где и выполняют свою основную функцию: защиту организма от бактериальных и грибковых инфекций путем фагоцитоза. После завершения фагоцитоза нейтрофильные лейкоциты погибают и метаболизируются [1, 4].
Нейтропенические синдромы у детей патогенетически могут быть следствием нарушения миелопоэза в костном мозге, в ряде случаев связанного с генетическими дефектами, следствием процесса перераспределения нейтрофилов в пристеночном и циркулирующем клеточном пуле и повышенной деструкции гранулоцитов в периферической крови. Возможно и сочетание этих патогенетических механизмов [5].
Нарушение пролиферации и дифференциации гранулоцитов в структуре костного мозга может происходить как в результате врожденного дефекта, так и при различных заболеваниях аутоиммунной природы, онкопатологиях различной локализации. Изолированное разрушение большого количества нейтрофилов происходит лишь при воздействии антилейкоцитарных антител.
В связи с тем что больший процент нейтрофилов находится не в свободном состоянии в потоке циркулирующей крови, а в адгезивном к сосудистой стенке (маргинатная фракция), возможно развитие псевдонейтропении. Данное состояние характеризуется уменьшением нейтрофилов в циркулирующей крови, хотя общий уровень нейтрофильных гранулоцитов остается неизменным за счет большого количества адгезированных нейтрофилов. Маргинация нейтрофилов приводит к артефактной нейтропении при заборе крови, что, по сути, не сопровождается снижением выработки или разрушением нейтрофилов [6]. Такие дети не требуют дополнительных диагностических и тем более терапевтических мероприятий.
Клиническая картина обусловлена прежде всего выраженностью нейтропении, а течение болезни зависит от ее причины и формы. Легкие нейтропении могут протекать бессимптомно, или у больных возникают частые ОРВИ, локализованная бактериальная инфекция, хорошо поддающаяся стандартным методам лечения. Среднетяжелые формы характеризуются частыми рецидивами локализованной гнойной инфекции, ОРВИ, рецидивирующей инфекцией ротовой полости (стоматит, гингивит, пародонтоз). Может быть бессимптомное течение, но с агранулоцитозом. Тяжелые нейтропении сопровож–даются выраженной интоксикацией, лихорадкой, частыми тяжелыми бактериальными и грибковыми инфекциями, некротическими поражениями слизистых, реже кожи, деструктивными пневмониями, повышенным риском развития сепсиса и высокой летальностью при неадекватной терапии [5, 7].
Нейтропения относится к разряду полиэтиологичных синдромов, поэтому она может как выступать в качестве первичного состояния, так и являться осложнением других заболеваний. Выделяют врожденные (генетически обусловленные) и приобретенные нейтропении [2, 4, 7]. Безусловно, приобретенные нейтропении составляют большинство и требуют дифференциального диагностического и терапевтического подхода.
Наиболее частая причина возникновения нейтропений в детском возрасте — это острые инфекции. Практически любая вирусная и некоторые виды бактериальных инфекций могут сопровождаться транзиторным снижением количества нейтрофилов в периферической крови. Одним из основных этиологических факторов развития изолированной нейтропении являются вирусы группы герпесвирусов, Эпштейна — Барр, цитомегаловирус, вирус гриппа, гепатита В и С [2, 7, 8]. Нейтропения в таких случаях купируется самостоятельно по мере выздоровления от этих заболеваний и практически никогда не сопровождается осложнениями.
Реже встречаются лекарственно-индуцированные нейтропении. Многие лекарственные препараты (антибактериальные, антигельминтные, противовирусные, противосудорожные и др.), выступая в роли гаптенов, опосредуют разрушение нейтрофилов или их предшественников иммунной системой. В этом случае нейтропения развивается в среднем на 15-е сутки после начала приема препарата [2, 7].
Значительную долю приобретенных нейтропений составляют иммунные или аутоиммунные нейтропении (ИН). Возникают они в результате повышенной деструкции нейтрофилов под воздействием ауто- или аллоантигранулоцитарных антител. Антигранулоцитарные антитела обычно являются IgG-антителами и направлены против специфических нейтрофильных антигенов HNA1а и HNA2b [9, 10]. Диагноз базируется на выявлении антинейтрофильных антител.
Аутоиммунные нейтропении подразделяются на первичные и вторичные. Вторичная ИН развивается на фоне какого-либо аутоиммунного заболевания, как правило, системного характера — системной красной волчанки, ревматоидного артрита, гранулематоза Вегенера и др.
Первичная ИН, как правило, дебютирует в первые 3 года жизни, имеет доброкачественный характер и в 90 % случаев разрешается самостоятельно в течение нескольких лет. Механизмы возникновения иммунной нейтропении до конца не известны. В качестве патогенетических факторов рассматривались наследственная предрасположенность, ассоциации с определенным HLA-фенотипом, инфекция парвовирусом В19, однако четких закономерностей выявлено не было [10]. Важным в подтверждении диагноза иммунной нейтропении является выявление антигранулоцитарных антител. У больных ИН определяются аутоантитела к различным поверхностным антигенам нейтрофилов: FcγRIIIb (CD16b), LCAMb (CD11b/CD18), C3b комплементарному рецептору (CD35), FcγRII (CD32) [9].
Однако ряд исследований показал, что даже при комбинации различных тестов (например, иммунофлуоресцентного и аглютининового) есть некоторая доля больных, имеющих типичную клиническую картину, но при этом отрицательные тесты на аутоантитела [10]. Нейтропения у таких больных классифицируется как идиопатическая, однако в большинстве случаев подразумевается ее иммунный механизм.
В костном мозге больных ИН гранулоцитарный росток, как правило, не изменен. В некоторых случаях отмечается так называемый обрыв созревания, однако это всегда достаточно поздний обрыв, на стадии зрелых форм. В некоторых случаях можно выявить макрофаги, фагоцитирующие сенсибилизированные антителами гранулоциты [11].
ИН крайне редко сопровождается значимыми инфекционными осложнениями и требует специфической терапии только в редких случаях. Диагноз «идиопатическая нейтропения» устанавливается при исключении (или недостаточных данных для постановки диагноза) всех других вышеперечисленных причин нейтропенических состояний.
Наиболее тяжелыми, хотя и крайне редкими состояниями являются врожденные нейтропении (ВН). Врожденными заболеваниями, сопровождающимися нейтропеническим синдромом, являются: первичные иммунодефицитные состояния (болезнь Брутона, сцепленная с Х-хромосомой, дисгаммаглобулинемия, ретикулярный дисгенез, гипоплазия лимфоидной ткани и др.), генетически обусловленный агранулоцитоз, болезни накопления (ацидемия, гликогеноз), фенотипические аномалии (метафизарная хондродисплазия, врожденный дискератоз). Однако под термином «тяжелая врожденная нейтропения» (ТВН) подразумевается изолированная, несиндромальная форма нейтропении [4, 7].
К основным генам, поврежденным при ВН, относятся ELANE (аутосомно-доминантный тип наследования), HAX (аутосомно-рецессивный тип наследования), WASP (Х-сцепленный тип наследования) и некоторые другие [12]. Кроме того, при всех типах наследования существуют больные с неизвестными в настоящее время генетическими дефектами.
К тяжелым формам наследственной нейтропении относится синдром Костмана, который характеризуется аутосомно-рецессивной передачей дефектного гена, однако может наблюдаться и спорадическая заболеваемость. При данной патологии уже в период новорожденности у ребенка наблюдаются частые эпизоды бактериально-инфекционных заболеваний со склонностью к рецидивирующему течению. При синдроме Костмана отмечается выраженное количественное снижение показателей нейтрофильных гранулоцитов в крови, вплоть до развития агранулоцитоза (в 1 мкл менее 300 нейтрофилов). Дети с синдромом Костмана относятся к группе риска по заболеваемости острым миелобластным лейкозом и миелопластическим синдромом. Развитие синдрома Костмана связывают с мутацией гена HAX [4, 7, 11].
Редкой формой наследственного нейтропенического синдрома, наблюдающегося в детском возрасте, является циклическая нейтропения (ЦН), которая наследуется исключительно рецессивным путем. Принципиальным отличием этого нейтропенического синдрома от других форм нейтропении является интермиттирующее течение с наличием кризов. Циклической эта нейтропения называется, так как имеет четкие временные рамки дебюта очередного криза (в среднем 3–8 суток) и четкий межприступный период (2 недели — 3 месяца) [2, 4, 5, 13].
С момента наступления криза у ребенка появляются яркие клинико-лабораторные признаки в виде резкого падения численности нейтрофильных гранулоцитов и одновременного моноцитоза и эозинофилии, появления очагов инфекции различной локализации с гнойным содержимым. После окончания нейтропенического криза у ребенка нормализуется общее состояние здоровья и показатели лейкоцитарной формулы крови. Клинически ЦН протекает более благоприятно, инфекции возникают, как правило, только во время нейтропенической фазы, тем не менее смертность от инфекций при ЦН доходит до 12 % [4, 5].
Собственное наблюдение
Для иллюстрации приводим клинический случай из нашей практики. Ребенок Р., 4 лет, находился на стационарном обследовании и лечении в детском городском пульмонологическом центре. Пациент поступил с жалобами на постоянный влажный, малопродуктивный кашель, эпизодические дистанционные хрипы, частую заболеваемость бронхитами и пневмониями, снижение слуха.
Из анамнеза заболевания известно, что у ребенка с месячного возраста наблюдались повторные отиты. С 6-месячного возраста отмечались рецидивирующие бронхиты с бронхообструктивным синдромом, возникающие на фоне острых респираторных вирусных инфекций. Дважды перенес внегоспитальную правостороннюю пневмонию, однократно — левостороннюю пневмонию.
С 3-месячного возраста, по архивным данным анализов крови из амбулаторной карты, у ребенка в крови периодически отмечалась нейтропения различной степени выраженности. В 4-летнем возрасте у него была диагностирована двусторонняя сенсоневральная тугоухость.
Из анамнеза жизни известно, что ребенок родился от II беременности, протекавшей на фоне токсикоза легкой степени, носительства TORCH-инфекции (токсоплазмоз, цитомегаловирус, вирус простого герпеса 1-го и 2-го типа), угрозы прерывания в 33 недели. Роды вторые, в сроке гестации 38 недель, путем кесарева сечения (наблюдался ди–стресс плода). Вес при рождении — 2200 г, длина тела — 45 см (внутриутробная гипотрофия ІІІ степени). ОША — 7/7 баллов. Период адаптации протекал на фоне геморрагического синдрома (желудочно-кишечного кровотечения), дыхательных расстройств, синдрома пониженной нервно-рефлекторной возбудимости. В динамике появился анемический синдром. В течение 5 суток ребенок находился на ИВЛ, проводилось переливание компонентов крови.
Объективно при поступлении в детское пульмонологическое отделение состояние ребенка было средней степени тяжести за счет интоксикационного и катарального синдромов, белково-энергетической недостаточности I степени. Сознание ясное. Кашель нечастый, малопродуктивный. Частота дыхательных движений — 24 в 1 минуту. Сатурация O2 в крови — 97 %. Дыхание через нос свободное. Кожные покровы и видимые слизистые бледные, чистые. Подкожно-жировая клетчатка развита слабо, распределена равномерно. Тургор мягких тканей снижен. Зев спокоен, миндалины в дужках. Периферические лимфоузлы не увеличены. Аускультативно над легкими дыхание ослаблено, с обеих сторон выслушивались диффузные, сухие, свистящие и влажные разнокалиберные хрипы. Со стороны сердечно-сосудистой системы — границы относительной сердечной тупости в пределах возрастной нормы, тоны сердца громкие, ритмичные. Живот мягкий, доступен глубокой пальпации. Печень и селезенка не увеличены. Мочеиспускание свободное, диурез достаточный. Стул 1 раз в сутки, кал без патологических примесей.
Результаты общеклинических исследований выявили гипохромную анемию I степени, лейкопению. В биохимическом анализе крови — снижение сывороточного железа. При иммунологическом исследовании крови в момент нахождения ребенка в стационаре выявлено только снижение фагоцитарной активности и фагоцитарного числа, что свидетельствовало о нарушении фагоцитарного звена иммунитета (табл. 1).
Ультразвуковое исследование (УЗИ) органов брюшной полости не выявило патологических изменений со стороны печени, поджелудочной железы, селезенки и почек. Были отмечены лишь эхо-признаки деформации желчного пузыря.
Лечебно-диагностическая бронхоскопия выявила двусторонний диффузный катарально-гнойный эндобронхит и исключила пороки развития трахеи и бронхов. Бактериологический посев бронхоальвеолярной жидкости выявил Haemophilus influenza, чувствительную к препаратам пенициллинового и цефалоспоринового ряда. По данным фиброэндогастроскопии патологии не выявлено.
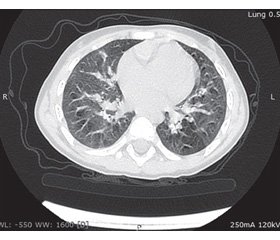
Данные компьютерной томографии (КТ) органов грудной клетки (рис. 1): нарушение пневматизации легочной ткани с обеих сторон по типу матового стекла, расширение просветов бронхов, перибронхиальная и периваскулярная инфильтрация. Трахея и главные бронхи проходимы. Лимфатические узлы средостения не увеличены. Аорта не расширена. Мягкие ткани грудной клетки структурные. Заключение: КТ-признаки диффузных интерстициальных изменений в легких, бронхомаляции.
/62-1.jpg)
Тщательный динамический анализ имеющихся в амбулаторной карте гемограмм позволил заподозрить у пациента циклическую нейтропению (рис. 2). К сожалению, гематологические исследования с определенной временной этапностью проводились только в течение первого года жизни ребенка. Однако период возникновения нейтропении, циклические снижения показателей нейтрофилов, особенно во время циклов обострений (до 1000 кл/мкл), и регулярность возникновения циклов спада нейтрофилов (со средней продолжительностью цикла в 3–4 недели) подтверждали циклический характер нейтропении (рис. 2). Также в гемограммах периодически фиксировались эозинофилия и моноцитоз.
/63-1.jpg)
С учетом частой респираторной заболеваемости, выявленных бронхоскопических и КТ-графических признаков хронизации бронхолегочного процесса, а также симптомов циклической нейтропении было проведено комплексное обследование больного, включающее проведение стернальной пункции с оценкой миелограммы, анализ хлоридов пота, генетическое обследование на муковисцидоз. Ребенок был консультирован гематологом, иммунологом, генетиком.
Дополнительные методы исследования не выявили патологических изменений. В миелограмме: костный мозг нормо- или гиперклеточный, увеличен гранулоцитарный ряд с нормальным соотношением клеточных элементов и преобладанием зрелых клеток.
Отсутствие выраженных изменений в гемограмме и миелограмме пациента, вероятно, было обусловлено периодом ремиссии циклической нейтропении на момент обследования. Однако сопоставление клинических симптомов и данных лабораторных исследований у ребенка в анамнезе позволило заключить, что тяжелое хроническое бронхолегочное заболевание явилось клинической маской циклической нейтропении.
Экспертный анализ тактики ведения данного пациента со стороны врача на амбулаторном этапе выявил ряд ошибок, в частности отсутствие динамичного клинико-лабораторного наблюдения и должной профилактики осложненного течения инфекционных заболеваний.
Выводы
Следует помнить, что общими критериями, характерными для всех наследственных нейтропений, являются: факт отягощенной наследственности, дебют клинико-лабораторных проявлений в течение первых месяцев жизни ребенка. Для установления диагноза циклической нейтропении необходим полный комплекс обследований, включающий:
— определение факта отягощенной наследственности по данной патологии;
— оценку клинических симптомов, имеющихся у ребенка, а также тщательный первичный объективный осмотр;
— еженедельную оценку гемограммы с обязательным подсчетом всех типов кровяных клеток (в случае циклической нейтропении гемограмма оценивается не менее двух раз в неделю на протяжении двух месяцев);
— при определении среднетяжелой нейтропении целесообразно выполнение миелограммы;
— при вирус-ассоциированной нейтропении необходимо исследование сыворотки крови на предмет нарастания титра антигранулоцитарных антител;
— при наличии гнойных очагов следует производить бактериальный посев крови на предмет определения специфической флоры, провоцирующей нейтропеническое состояние.
Таким образом, нейтропения у ребенка должна рассматриваться практикующим врачом как лабораторный симптом, который требует осмысления, сопоставления с клиническими проявлениями и обязательного динамического анализа.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.

/62-1.jpg)
/63-1.jpg)