Вступ
Гострі респіраторні захворювання (ГРЗ) є найбільш поширеною причиною захворюваності та смертності у всьому світі. Щорічно на ГРЗ хворіє близько 112 900 000 населення [1]. Найбільш тяжкі форми захворювання пов’язані з інфекцією нижніх дихальних шляхів, що є причиною частої госпіталізації та майже 20 % усіх смертей дітей молодшого віку у всьому світі [1, 2]. Факторами ризику тяжкого перебігу ГРЗ є недостатнє харчування, низька вага при народженні, пасивне куріння, штучне вигодовування, низький соціально-економічний статус, імунодефіцитні стани тощо [3, 4]. Збудниками ГРЗ є переважно віруси, серед яких переважають респіраторний синцитіальний вірус, метапневмовірус людини, риновіруси та вірус парагрипу [5]. Респіраторні віруси часто ініціюють каскад подій, які в підсумку призводять до розвитку бактеріальної інфекції [6], збудниками якої найчастіше є Streptococcus pneumoniae, Haemophilus influenzae та Moraxella catarrhalis [1]. Серед дітей молодшого віку, які були госпіталізовані з приводу ГРЗ, частота бактеріальної коінфекції сягає понад 40 %, що потребує призначення антибактеріальної терапії [7, 8]. Проте диференціювати на підставі лише клінічних або рентгенологічних ознак вірусні та бактеріальні респіраторні інфекції неможливо [1].
Мета дослідження: визначення інтегральних показників, що визначають ризик захворювання дітей раннього віку на гострий бактеріальний бронхіт, та створення математичної моделі прогнозування розвитку патології.
Матеріали та методи
Групу спостереження становили 74 дитини раннього віку (середній вік — 13,8 ± 1,4 місяця). Верифікація діагнозу проводилась згідно з критеріями діагностики гострого бронхіту в дітей [9].
При зборі анамнезу особливу увагу приділяли особливостям перебігу анте-, інтра- та неонатального періодів, а також виду вигодовування дитини. Обов’язковий комплекс обстеження включав дослідження загального аналізу крові та бактеріологічне дослідження назофарингеального аспірату. За допомогою імуноферментного аналізу досліджувався вміст у сироватці крові 25-гідроксивітаміну D(25(ОН)D), вітамін-D-зв’язуючого білка, бактерицидного білка, що підвищує проникність клітин (hBPI), кателіцидину LL-37, β1-дефензину, лактоферину. Також враховувалися строки госпіталізації дитини та початок застосування антибактеріальної терапії від початку захворювання. Тяжкість перебігу гострого бронхіту в дітей досліджуваної групи визначали згідно зі шкалою ABSS у перші 24 години з моменту надходження до стаціонару [10].
За результатами бактеріологічного дослідження назофарингеального аспірату пацієнти були розподілені на дві групи. Першу групу становили 34 хворі, у яких при мікробіологічному дослідженні не встановлено росту мікроорганізмів, що було розцінено нами як вірусна етіологія гострого бронхіту. У другу групу увійшли 40 хворих, у яких встановлено діагностично значущу колонізацію верхніх дихальних шляхів патогенною мікрофлорою. Мікрофлорою, що домінувала в дітей, хворих на гострий бронхіт, виявилися Haemophilus influenzaе — 17 (42,4 %) дітей та Streptococcus pneumoniae — 13 (32,5 %) дітей. Ураховуючи наявність у цієї когорти дітей ознак бактеріального запалення (відсутність або мінімальні ознаки катаральних проявів, наявність фебрильної лихоманки понад 3 доби, двофазність перебігу захворювання, нейтрофільний лейкоцитоз із зсувом лейкоцитарної формули вліво), виділені мікроорганізми в діагностично значущих титрах (> 105) ми розцінили як етіологічний збудник гострого бронхіту. Контрольну групу становили 20 умовно здорових дітей, репрезентативних за віком.
Для оцінки ризику розвитку гострого бактеріального бронхіту в дітей раннього віку проводили розрахунок відношення шансів (ВШ) у таблицях спряженості 2 × 2 із визначенням 95% довірчих інтервалів (ДІ). До числа найбільш значущих факторів були віднесені інформативні ознаки зі значенням ВШ більше 1,0.
Для виявлення ознак, що найбільшою мірою пов’язані з розвитком бронхіту бактеріальної етіо–логії, використовувався метод факторного аналізу. Основою моделювання для підбору факторних комплексів була вибрана кореляційна матриця Спірмена з подальшим визначенням факторного навантаження показників, що вивчалися. Значущі фактори в моделі досліджували за допомогою критерію «кам’янистого осипу» та критерію Кайзера. Для вибірки показників із високим факторним навантаженням на комплекс (понад 0,7) використовували метод ортогонального обертання varimax. Факторний аналіз із використанням обертання Varimax виконаний з урахуванням результатів початкового аналізу та використанням для опису дисперсії масиву даних головних компонент [11].
Для виявлення стійких груп факторів, що характеризуються спільністю досліджуваних параметрів для всієї вибірки, проводився кластерний аналіз. Процедура класифікації об’єктів здійснювалася за допомогою ієрархічної кластеризації (Hierarchical Cluster Analysis) методом центроїдної кластеризації. Ієрархічна кластеризація полягала в об’єднанні найбільш схожих об’єктів, і завершувалася побудовою дендрограми. Мірою відстані між сформованими кластерами була евклідова відстань (Euclidean distances) [11].
Для прогнозування ймовірності розвитку гострого бронхіту бактеріальної етіології використовувалося рівняння логістичної регресії:
р = 1/(1 + еxp(–z)),
де
z = a0 + a1 • x1 + a2 • x2 + ... + an • xn;
x1, .., xn — незалежні змінні, а0, ..., аn — коефіцієнти регресії2.
Якщо розраховане значення р дорівнює або більше 0,5, то даного хворого слід віднести в групу хворих, у яких гострий бронхіт буде мати бактеріальну природу. Якщо ж розраховане значення р менше 0,5, то даного хворого слід віднести до групи хворих, у яких, найімовірніше, буде спостерігатися вірусний бронхіт. Якість побудованої моделі оцінювали за її чутливістю та специфічністю [12]. Статистичну значущість моделі оцінювали за Omnibus Test (універсальний критерій коефіцієнтів) та прогностичною категоріальною валідністю тесту.
Для виявлення факторів, найбільший ступінь яких пов’язаний із ризиком розвитку гострого бактеріального бронхіту в дітей раннього віку, використовувався метод генетичного алгоритму [13].
Для визначення якості отриманої моделі прогнозування використовувався ROC-аналіз (Receiver Operator Characteristic — операційна характеристика приймача), а також показник AUC (Area Under Curve) — чисельний показник площі під ROC-кривої. Значення площі від 0,9 до 1 відповідає відмінній якості моделі, 0,8–0,9 — дуже добрій, 0,7–0,8 — добрій, 0,6–0,7 — середній, 0,5–0,6 — незадовільній [14]. Для оцінки дискримінуючої здатності моделі розраховувався індекс Gini за формулою:
Gini = 2 • (AUC – 0,5) • 100,
де AUC — площа під ROC-кривою. Значення індексу Gini > 40 % відповідає допустимій якості методики аналізу; Gini > 60 % — відмінній якості методики аналізу [15].
Взаємозв’язок між окремими факторами оцінювали за допомогою коефіцієнта парної кореляції Пірсона, а ступінь вірогідності відмінності характеристик між групами — за допомогою t-критерію Стьюдента. Критичне значення рівня статистичної значущості при перевірці нульових гіпотез приймалося рівним 0,05.
Результати та обговорення
З метою комплексної оцінки взаємозв’язків показників, які могли б пояснити розвиток бронхіту бактеріальної етіології, використовували факторний аналіз, що дозволив виділити фактори ризику розвитку патології.
Було відібрано 25 потенційних предикторів розвитку бронхіту бактеріальної етіології в дітей раннього віку, до складу яких увійшли анамнестичні дані (дані анте-, інтра- та неонатального періодів, характер вигодовування, профілактичне застосування вітаміну D), вік дитини на момент захворювання, строки госпіталізації та призначення антибактеріальної терапії від початку захворювання, бальна оцінка тяжкості перебігу бронхіту, показники гемограми та вмісту кальцію в сироватці крові, вміст у сироватці крові вітаміну D та антимікробних пептидів (вітамін-D-зв’язуючий білок, hBPI, дефензин β1, лактоферин, LL-37).
У результаті проведеного факторного аналізу було виділено 6 факторів із власними значеннями більше 1, в які увійшли 11 із 25 предикторів розвитку бактеріального бронхіту. Дані фактори описували 70,1 % загальної дисперсії змінних, що вивчалися, причому перші 3 головні компоненти становили майже половину (48,3 %) сумарного навантаження, що вказувало на те, що саме ці фактори детермінують основну частину патогенетичних чинників розвитку гострого бактеріального бронхіту в обстежених хворих (табл. 1).
У подальшому за допомогою методу головних компонент була виділена матриця факторних навантажень (табл. 2).
Так, згідно з отриманими даними, найбільшу значущість мав фактор 1, що описував 23,7 % загальної дисперсії і включав 3 змінні з високим факторним навантаженням: вміст вітаміну D у сироватці крові (факторне навантаження 0,744; ВШ 5,04, 95% ДІ 1,1–23,8), профілактичне застосування вітаміну D (факторне навантаження 0,843; ВШ 5,7, 95% ДІ 1,3–24,6) та прояви рахіту (факторне навантаження 0,843; ВШ 5,5, 95% ДІ 1,6–18,7). Умовно цей фактор був позначений як забезпеченість вітаміном D.
У 2-й фактор, що описував 14,1 % дисперсії досліджуваних змінних, із високим навантаженням увійшли показники гемоглобіну (факторне навантаження 0,792; ВШ 10,67, 95% ДІ 1,2–97,2) та бальної оцінки тяжкості перебігу бронхіту (факторне навантаження 0,782; ВШ 3,6, 95% ДІ 1,1–11,6). Таке поєднання чинників є цілком закономірним. Відомо, що при гострому запаленні відбуваються зменшення всмоктування заліза через ентероцити та зниження його виділення з макрофагів під час рециркуляції. Даний процес є захисним механізмом під час гострої інфекції, спрямований на зниження біодоступності заліза, необхідного для зростання патогенних мікроорганізмів [16]. Ще одним механізмом, що сприяє зниженню рівня гемоглобіну та розвитку анемії при запаленні, є синтез прозапальних цитокінів, що призводить до пригнічення утворення еритропоетину, порушення диференціювання і проліферації клітин-попередників еритроїдів та, як наслідок, до зниження тривалості життя еритроцитів [17, 18]. Даний фактор можна назвати фактором анемії.
У структуру 3-го фактора, що був позначений як ятрогенний і становив 10,5 % загальної дисперсії, увійшли показники термінів госпіталізації (факторне навантаження 0,916; ВШ 25,5, 95% ДІ 2,8–31,6) та початку проведення антибактеріальної терапії (факторне навантаження 0,931; ВШ 20,8, 95% ДІ 2,3–87,7). Дана позиція є цілком зрозумілою. У проспективному когортному дослідженні, проведеному в Китаї у 2015 році, було показано, що в середньому у 88 % медичних працівників клінічних стаціонарів визначається безсимптомна бактеріальна колонізація верхніх дихальних шляхів. Таким чином, самі медичні працівники стають джерелом горизонтального поширення інфекції пацієнтам [19]. Ранній початок адекватної антибактеріальної терапії вважається наріжним каменем у лікуванні бактеріальних респіраторних інфекцій, що в низці випадків обумовлено поліпшенням перебігу захворювання [20]. У той же час надмірне або тривале використання антибіотиків у пацієнтів із ГРЗ пов’язане з підвищеною резистентністю звичайних бактерій та розвитком побічних реакцій [21, 22]. Бактеріальна резистентність, ефект якої може зберігатися до 12 місяців, найчастіше є результатом нераціонального використання антибіотиків, особливо на етапі первинної медико-санітарної допомоги [22]. Проведені багатоцентрові рандомізовані дослідження показали, що тільки 10–20 % гострих респіраторних інфекцій потребують призначення антибактеріальної терапії [23]. При цьому не отримано переконливих даних про ефективність застосування антибіотиків при ГРЗ із метою профілактики розвитку бактеріальних ускладнень у дітей раннього віку [24, 25].
Взаємозв’язок показників 4-го фактора, внесок якого в загальну дисперсію становив 8,1 %, характеризував рівень нейтрофілів (факторне навантаження 0,877; ВШ 3,6, 95% ДІ 0,8–15,2) та рівень лімфоцитів у периферичній крові (факторне навантаження 0,913; ВШ 4,3, 95% ДІ 1,1–17,4). Даний фактор можна назвати фактором запалення.
Відомо, що при стимуляції лейкоцитів вірусами в значній кількості починають вироблятися інтерферони (IFN). З одного боку, інтерферони надають сильну противірусну активність, заважаючи реплікації та поширенню вірусу, а також проявляють антибактеріальну дію [26]. Так, у дослідженнях Y. Bao et al. (2014) було доведено, що субпопуляція В-лімфоцитів CD11ahiFcγRIIIhiCD19+ за рахунок генерування IFN-γ сприяє активації макрофагів, тим самим полегшуючи вроджену імунну відповідь проти бактеріальної інфекції [27]. Також IFN I типу сприяють захисту організму від інфекції Streptococcus рneumoniae та Streptococcus pyogenes [28, 29]. У той же час попередня експресія IFN I типу має негативні наслідки щодо вторинної бактеріальної інфекції. По-перше, попередня індукція IFN I типу послаблює експресію хемокінів нейтрофілів, порушуючи антибактеріальні нейтрофільні реакції та бактеріальний кліренс [30, 31]. По-друге, попередня експресія ІФН I типу пригнічує продукцію IL-17 T-клітин, що призводить до зниження секреції антибактеріальних пептидів ліпокаліну-2 та BPIFA-1, що в кінцевому результаті сприяє поширенню бактерій [32–34].
Інтерферони III типу також негативно впливають на захист організму від бактеріальної інфекції, як грампозитивної, так і грамнегативної [35]. Недавні проведені дослідження довели, що активація IFN III типу індукує зміни бар’єрної функції дихального епітелію, викликаючи зрушення мікробіому, порушення імунного статусу та утворення біоплівки, що сприяє приєднанню вторинної бактеріальної інфекції [36, 37].
У фактор 5 увійшов показник вмісту лактоферину в сироватці крові (факторне навантаження 0,700; ВШ 4,5, 95% ДІ 1,1–17,9). Зазначений антимікробний пептид є провідним компонентом неспецифічного захисту респіраторного тракту та є ключовим білком природного імунітету [38]. Лактоферин взаємодіє з клітинними поверхнями мікроорганізмів і таким чином перешкоджає бактеріальній та вірусній адгезії та проникненню в клітини організму. На сьогодні вважається, що лактоферин має противірусну активність проти широкого спектра РНК та ДНК вірусів. Головним механізмом противірусного захисту лактоферину є його здатність на ранніх стадіях інфекції зв’язуватися з клітинними рецепторами гепарасульфат-глікозаміноглікану або вірусними частинками [39]. Лактоферин може модулювати та викликати зміни в балансі Т-клітинного імунітету, а також посилювати фагоцитарну активність макрофагів [40]. Тому фактор, що описував 7,0 % загальної дисперсії, був позначений як імунний фактор.
У 6-му факторі, що був позначений як «материнський», установлено одну змінну, а саме респіраторні інфекційні захворювання матері під час вагітності, із факторним навантаженням 0,814 (ВШ 10,7, 95% ДІ 1,2–97,2). Відомо, що вірусні інфекції під час вагітності є однією з причин зниження резистентності до інфекцій у дитини [41]. В роботі И.А. Мальчикова (2007) було показано, що при розвитку у вагітних жінок вірусної інфекції відбуваються процеси, що супроводжуються зниженням кількості СD3+, CD4+ лімфоцитів, сироваткової концентрації IgM та комплементу, що в подальшому призводить до порушень протиінфекційного захисту в дітей раннього віку та є однією з причин мікст-інфікування бактеріальними агентами [42].
З урахуванням отриманих даних факторного аналізу був виконаний кластерний аналіз провідних патогенетичних факторів. За результатами ієрархічного кластерного аналізу в досліджуваній вибірці патогенетичних факторів розвитку гострого бактеріального бронхіту в дітей раннього віку було виділено 2 кластери (рис. 1).
Проведений ієрархічний кластерний аналіз наглядно демонструє, що на початковому етапі формується асоціативний взаємозв’язок між показниками червоної крові та профілактичного застосування вітаміну D (кластер 1). Відомо, що вітамін D чинить протизапальну дію [43]. У дослідженнях S.M. Zughaier et al. (2014) було показано, що вітамін D діє безпосередньо на антимікробний пептид гепсидин, який відповідає за регуляцію системних концентрацій заліза шляхом зв’язування з ним та індукування деградації його клітинного кон’югата, що призводить до зменшення всмоктування заліза ентероцитами і збільшення секвестрації заліза в макрофагах [44].
Зі свого боку, синтез даного антимікробного пептиду регулюється прозапальними цитокінами IL-6 і IL-1β [45, 46]. Експериментальні дослідження in vivo, проведені на здорових добровольцях, вказують на те, що пероральне введення вітаміну D призводить до значного зниження концентрації гепсидіну в сироватці крові за рахунок пригнічення експресії мРНК гепсидину [47]. При цьому за наявності зростаючих концентрацій гормонально активного 1,25-дигідроксивітаміну D (1,25(OH)2D) відбувається зниження вивільнення IL-6 і IL-1 із моноцитів [44]. Таким чином, проведені дослідження свідчать, що пероральне використання вітаміну D при запаленні призводить до зниження прозапальних цитокінів і гепсидину та сприяє збільшенню біодоступності заліза для еритропоезу та синтезу гемоглобіну.
Далі за результатами кластерного згрупування сформовано агломерацію між показниками строку госпіталізації, початку антибактеріальної терапії та вмістом вітаміну D у сироватці крові з подальшим приєднанням показника лактоферину та наявністю захворювання матері на ГРВІ під час вагітності (кластер 2). Зі свого боку, зазначені складові впливають на тяжкість перебігу захворювання. Отримані лінійні відношення завершували показники нейтрофілів та лімфоцитів, які формували з даними показниками єдиний агломерат. При цьому компоненти сформованих кластерів не тільки логічно доповнюють один одного, але і свідчать про їх патогенетичні ролі в розвитку бактеріального процесу в бронхолегеневій системі в дітей раннього віку.
Для уточнення структурних взаємозв’язків досліджуваних факторів, що впливають на етіологію гострого бронхіту, був проведений кореляційний аналіз змінних. На основі отриманих даних проводилося ранжування показників за ступенем їх впливу на розвиток гострого бактеріального бронхіту. Результати аналізу подані на рис. 2.
/43-1.jpg)
Можна відзначити наявність значущих кореляційних зв’язків між усіма виділеними факторами, як категоріальними, так і параметричними (табл. 3). Як системоутворюючий фактор у даній кореляційній плеяді виступає рівень вітаміну D у сироватці крові, що має закономірні взаємозв’язки не тільки з умістом у сироватці крові LL-37 (r = +0,48, p < 0,05) та лактоферину (r = +0,45, p < 0,01), а й з етіологією захворювання (r = –0,33, p < 0,05). Тобто ризик приєднання бактеріальної інфекції зростав у дітей із низьким вмістом вітаміну D у сироватці крові. При цьому одним із факторів бактеріальної колонізації дихальних шляхів та розвитку вірусно-бактеріальної коінфекції був ранній початок антибактеріальної терапії (r = –0,33, p < 0,05) в поєднанні з ранньою госпіталізацією дитини (r = –0,45, p < 0,01).
/43-2.jpg)
Причому рання госпіталізація дитини, як правило, асоціювалася й з раннім призначенням антибіотиків (r = +0,63, p < 0,001). Слід відмітити, що тяжкість перебігу захворювання не залежала від етіології захворювання (r = +0,07, p > 0,05) та не впливала на строки госпіталізації дитини (r = +0,05, p > 0,05) та вибір етіотропної терапії (r = –0,03, p > 0,05).
Далі методом бінарної логістичної регресії була створена математична модель для прогнозування розвитку гострого бактеріального бронхіту в дітей раннього віку (табл. 4).
За результатами проведеної логістичної регресії модель прогнозу ймовірності розвитку гострого бактеріального бронхіту в дітей раннього віку мала такий вигляд:
р = 1/(1 + exp(–(4,054 – 17,130 • Х1 + 16,391 × × Х2 – 0,012 • Х3 + 0,069 • Х4 – 0,596 • Х5 – – 0,005 • Х6 – 0,024 • Х7 – 0,544 • Х8 + 0,178 • Х9))).
Класифікаційна здатність моделі визначалася за даними навчальної вибірки і становила 78,4 % (табл. 5). Чутливість моделі виявилася рівною 80,0 %, а специфічність — 76,5 %. Результати Omnibus Test (універсальний критерій коефіцієнтів моделі) підтвердили статистичну значущість даної моделі (χ2 = 20,523; df = 9; р = 0,015). Коефіцієнт прогностичної категоріальної валідності тесту становив r = 0,64.
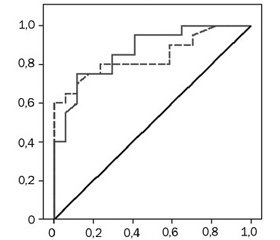
Площа під ROC-кривою, що відбиває представлене рівняння логістичної регресії, дорівнювала 0,866, індекс Gini становив 73,2 %, що характеризує добру якість проведеної класифікації предикторів (рис. 3).
Для виявлення факторів, найбільший ступінь яких пов’язаних із ризиком розвитку гострого бактеріального бронхіту в дітей раннього віку, був проведений відбір найбільш значущих ознак методом генетичного алгоритму. У результаті проведеного аналізу було відібрано 4 факторні ознаки: доба госпіталізації від початку захворювання (Х1), день призначення антибактеріальної терапії від початку захворювання (Х2), вміст вітаміну D у сироватці крові (Х3), вміст лактоферину в сироватці крові (Х4).
Для виявлення сили та спрямованості виділених факторів було побудовано рівняння логістичної регресії:
р = 1/(1 + exp(–(3,137 – 17,392 • Х1 + 16,663 × Х2 – 0,011 • Х3 + 0,055 • Х4.
Із загальної кількості пацієнтів, відібраних для проведення прогнозування, вірогідний прогноз був здійснений у 78,4 % випадків. Прогностична цінність позитивного результату становила 80,0 %. Прогностична цінність негативного результату — 76,5 %. Результати Omnibus Test також підтверджують статистичну значущість другої моделі (χ2 = 18,95; df = 4; р = 0,001). При розрахунку прогностичної категоріальної валідності тесту коефіцієнт валідності становив r = 0,60.
Для оцінки значущості 4 виділених із 9 відібраних факторних ознак та оцінки адекватності побудованих моделей прогнозування розвитку гострого бактеріального бронхіту в дітей раннього віку був використаний метод порівняння ROC-кривих моделей (рис. 4).
При проведенні аналізу встановлено, що площа під ROC-кривою рівняння логістичної регресії, побудованої для всіх 9 факторних ознак, становила AUC1 = 0,866 ± 0,058 (95% ДІ 0,752–0,981, р < 0,0001), для рівняння логістичної регресії, побудованої за 4 факторними ознаками, — AUC2 = 0,840 ± 0,066 (95% ДІ 0,710–0,970, р < 0,0001). Індекс Gini для другої прогностичної моделі становив 68,0 %.
Тобто зменшення числа факторних ознак із 9 до 4 не призвело до істотної зміни прогностичних якостей моделі, що вказує на високу значимість виділених факторів у розвитку гострого бронхіту бактеріальної етіології в дітей раннього віку. Аналіз поданих результатів дозволяє зробити висновок про ефективність запропонованої моделі та доцільності її використання на практиці для прогнозування розвитку гострого бактеріального бронхіту в дітей раннього віку.
Висновки
1. Розвиток гострого бронхіту бактеріальної етіології в дітей раннього віку відбувається в динамічній взаємодії цілої низки факторів. На підставі проведеного факторного аналізу було сформовано прогностичну модель формування патологічного процесу.
2. Проведений аналіз підтвердив пріоритетний внесок у розвиток гострого бактеріального бронхіту в дітей раннього віку стану забезпеченості вітаміном D (ВШ 5,04, 95% ДІ 1,1–23,8), анемії (ВШ 10,67, 95% ДІ 1,2–97,2), ранньої госпіталізації (ВШ 25,5, 95% ДІ 2,8–31,6), нераціонального застосування антибактеріальної терапії (ВШ 20,8, 95% ДІ 2,3–87,7), імунних порушень (ВШ 4,46, 95% ДІ 1,11–27,9) та характеру перебігу антенатального періоду (ВШ 10,7, 95% ДІ 1,2–97,2).
3. Виявлені фактори ризику та результати прогностичного моделювання доцільно використовувати для виявлення дітей, які становлять групу високого ризику з розвитку гострого бронхіту бактеріальної етіології.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Patrícia G.M. Bezerra, Murilo C.A. Britto, Jailson B. Correia et al. Viral and Atypical Bacterial Detection in Acute Respiratory Infection in Children Under Five Years // PloS one. — 2011. — Vol. 6. — № 4. — P. e18928. Doi: 10.1371/journal.pone.0018928.
2. Peng D., Zhao D., Liu J., Wang X., Yang K., Xicheng H., Wang F. Multipathogen infections in hospitalized children with acute respiratory infections // Virology Journal. — 2009. — 6(1). — Р. 155. Doi: 10.1186/1743-422X-6-155.
3. Simoes E. Environmental and demographic risk factors for respiratory syncytial virus lower respiratory tract disease // J. Pediatr. — 2003. — 43. — Р. 118-126. doi: 10.1067/S0022-3476(03)00511-0.
4. Peat J., Keena V., Harakeh Z., Marks G. Parental smoking and respiratory tract infections in children // Paediatr. Respir. Rev. — 2001. — 2. — Р. 207-213. Doi: 10.1053/prrv.2001.0142.
5. Regamey N., Kaiser L., Roiha H., Deffernez C., Kuehni C. et al. Viral etiology of acute respiratory infections with cough in infancy: a community-based birth cohort study // Pediatr. Infect. Dis. J. — 2008. — 27. — Р. 100-105. Doi: 10.1097/INF.0b013e31815922c8.
6. Heikkinen T. Respiratory viruses and children. The Journal of infection, 2006. — 72. — Р. 29. Doi: 10.1016/j.jinf.2016.04.019.
7. Hishiki H., Ishiwada N., Fukasawa C., Abe K., Hoshino T., Aizawa J., Kohno Y. Incidence of bacterial coinfection with respiratory syncytial virus bronchopulmonary infection in pediatric inpatients // Journal of Infection and Chemotherapy. — 2011. — 17(1). — Р. 87-90.
8. Thorburn K., Harigopal S., Reddy V., Taylor N., van Saene H.K. High incidence of pulmonary bacterial co-infection in children with severe respiratory syncytial virus (RSV) bronchiolitis // Thorax. — 2006. — 61. — Р. 611-5. Doi: 10.1136/thx.2005.048397.
9. Наказ Міністерства охорони здоров’я України № 18 від 31 грудня 2005 року «Протокол лікування дітей з гострими бронхітами».
10. Validation of a new clinical scoring system for acute bronchitis / Mwachari C., Nduba V., Nguti R., Park D.R., Sanguli L., Cohen C.R. // Int. J. Tuberc. Lung. Dis. — 2007 Nov. — 11(11). — Р. 1253-9.
11. Тихомиров Н.П.. Методы эконометрики и многомерного статистического анализа: Учебник / Н.П. Тихомиров, Т.М. Тихомирова, О.С. Ушмаев. — М.: Экономика, 2011. — 647 с.
12. Лях Ю.Е., Гурьянов В.Г. Математическое моделирование при решении задач классификации в биомедицине // Український журнал телемедицини та медичної телематики. — 2012. — Т. 10, № 2. — С. 69-76.
13. Петри А., Сэбин К. Наглядная статистика в медицине: Пер. с англ. В.П. Леонова. — М.: ГЭОТАР-Медиа, 2003. — 144 с.
14. Сорокин А.С. К вопросу валидации модели логистической регрессии в кредитном скоринге // Науковедение. — 2014. — № 2(21). — С. 81.
15. Руководство по кредитному скорингу / Под ред. Элизабет Мэйз; пер. с англ. И.М. Тикота; науч. ред. Д.И. Вороненко. — Минск: Гревцов Паблишер, 2008. — 464 с.
16. Nairz M., Haschka D., Demetz E., Weiss G. Iron at the interface of immunity and infection // Front. Pharmacol. — 2014. — 5. — Р. 52. Doi: 10.3389/fphar.2014.00152.
17. Weiss G., Goodnough L.T. Anemia of chronic disease // N. Engl. J. Med. — 2005. — 352. — Р. 1011-1023. DOI: 10.1056 / NEJMra041809.
18. Nemeth E., Ganz T. Anemia of inflammation // Hematol. Oncol. Clin. North Am. — 2014. — 28. — Р. 671-681. Doi: 10.1016/j.hoc.2014.04.005.
19. MacIntyre C.R., Chughtai A.A., Zhang Y., Seale H., Yang P., Chen J., Wang, Q. Viral and bacterial upper respiratory tract infection in hospital health care workers over time and association with symptoms // BMC infectious diseases. — 2017. — 17(1). — Р. 553. Doi: 10.1186/s12879-017-2649-5.
20. Kumar A., Ellis P., Arabi Y., Roberts D., Light B., Parrillo J.E. et al. Initiation of inappropriate antimicrobial therapy results in a fivefold reduction of survival in human septic shock // Chest. — 2009. — 136. — Р. 1237-48. Doi: 10.1378/chest.09-0087.
21. Chung A., Perera R., Brueggemann A.B., Elamin A.E., Harnden A., Mayon-White R. et al. Effect of antibiotic prescribing on antibiotic resistance in individual children in primary care: prospective cohort study // BMJ. — 2007. — 335. — Р. 429. Doi: 10.1136/bmj.39274.647465.BE.
22. Costelloe C., Metcalfe C., Lovering A., Mant D., Hay A.D. Effect of antibiotic prescribing in primary care on antimicrobial resistance in individual patients: systematic review and meta-analysis // BMJ. — 2012. — 18(340). — Р. 2096. Doi: 10.1136/bmj.c2096.
23. Benguigui Y. Acute respiratory infections control in the context of the IMCI strategy in the Americas // Revista Brasileira de Saúde Materno Infantil. — 2003. — 3(1). — Р. 25-6. Doi: 10.1590/S1519-38292003000100005.
24. Arroll B., Kenealy T., Falloon K. Are antibiotics indicated as an initial treatment for patients with acute upper respiratory tract infections? A review // N. Z. Med. J. — 2008, Oct 17. — 121(1284). — Р. 64-70.
25. Autret-Leca E., Giraudeau B., Ployet M.J., Jonville-Béra A.P. Amoxicillin/clavulanic acid is ineffective at preventing otitis media in children with presumed viral upper respiratory infection: a randomized, double-blind equivalence, placebo-controlled trial // Br. J. Clin. Pharmacol. — 2002 Dec. — 54(6). — Р. 652-6.
26. Новиков Д.К. Противовирусный иммунитет // Иммунопатология, аллергология, инфектология. — 2002. — № 1. — С. 6-16.
27. Bao Y. Identification of IFN-gamma-producing innate B cells / Y. Bao, X. Liu, Ch. Han et al. // Cell. Res. — 2014. — Vol. 24, № 2. — P. 161-176. Doi: 10.1038/cr.2013.155.
28. Castiglia V., Piersigilli A., Ebner F., Janos M., Goldmann O., Damböck U., Kröger A., Weiss S., Knapp S., Jamieson A.M. et al. Type I interferon signaling prevents IL-1β-driven lethal systemic hyperinflammation during invasive bacterial infection of soft tissu // Cell Host Microbe. — 2016, Mar 9. — 19(3). — Р. 375-87. Doi: 10.1016/j.chom.2016.02.003.
29. Damjanovic D., Khera A., Medina M.F., Ennis J., Tur–ner J.D., Gauldie J., Xing Z. Type 1 interferon gene transfer enhances host defense against pulmonary Streptococcus pneumoniae infection via activating innate leukocytes // Mol. Ther. Methods Clin. Dev. — 2014. — 1. — Р. 5. Doi: 10.1038/mtm.2014.5.
30. Shahangian A., Chow E.K., Tian X., Kang J.R., Ghaffari A. et al. Type I IFNs mediate development of postinfluenza bacterial pneumonia in mice // J. Clin. Invest. — 2009. — 119. — Р. 1910-1920.
31. Schliehe С., Flynn E.K., Vilagos B., Richson U., Swaminathan S., Bosnjak B., Bauer L., Kandasamy R.K., Griesshammer I.M., Kosack L. et al. The methyltransferase Setdb2 mediates virus-induced susceptibility to bacterial superinfection // Nat. Immunol. — 2015. — 16. — Р. 67-74. Doi: 10.1038/ni.3046.
32. Cao J., Wang D., Xu F., Gong Y., Wang H., Song Z., Li D., Zhang H., Li D., Zhang L. et al. Activation of IL-27 signalling promotes development of postinfluenza pneumococcal pneumonia EMBO // Mol. Med. — 2014. — 6. — Р. 120-140. DOI: 10.1002/emmm.201302890.
33. Kudva A., Scheller E.V., Robinson K.M., Crowe C.R., Choi S.M. et al. Influenza A inhibits Th17-mediated host defense against bacterial pneumonia in mice // J. Immunol. — 2011. — 186. — Р. 1666-1674. pmid: 21178015; Doi: 10.4049/jimmunol.1002194.
34. Lee B., Robinson K.M., McHugh K.J., Scheller E.V., Mandalapu S. et al. Influenza-induced type I interferon enhances susceptibility to gram-negative and gram-positive bacterial pneumonia in mice // Am. J. Physiol. Lung. Cell. Mol. Physiol. — 2015. — 309. — Р. 158-167. pmid:26001778. Doi: 10.1152/ajplung.00338.2014.
35. Cohen T.S., Prince A.S. Bacterial pathogens activate a common inflammatory pathway through IFNlambda regulation of PDCD4 // PLoS Pathog. — 2013. — 9. — e1003682. pmid: 24098127. Doi: 10.1371/journal.ppat.1003682.
36. Planet P.J., Parker D., Cohen T.S., Smith H., Leon J.D. et al. Lambda Interferon Restructures the Nasal Microbiome and Increases Susceptibility to Staphylococcus aureus Superinfection // MBio. — 2016. — 7. — Р. 01939-01915. pmid: 26861017. Doi: 10.1128/mBio.01939-15.
37. Hendricks M.R., Lashua L.P., Fischer D.K., Flitter B.A., Eichinger K.M. et al. Respiratory syncytial virus infection enhances Pseudomonas aeruginosa biofilm growth through dysregulation of nutritional immunity // Proc. Natl Acad. Sci. USA. — 2016. — 113. — Р. 1642-1647. pmid: 26729873. Doi: 10.1073/pnas.1516979113.
38. Бродский И.Б. Антимикробные, иммуномодулирующие и пребиотические свойства лактоферрина / И.Б. Бродский, В.М. Бондаренко, Н.Н. Томашевская и др. // Бюллетень Оренбургского научного центра УрО РАН. — 2013. — № 4. — С. 3-15.
39. Berlutii F., Pantanella F., Natalizi T., Froni A., Paesano R., Polimeni A. et al. Antiviral properties of lactoferrin a natural immnunity molecule // Molecules. — 2011. — 16. — Р. 6992-7018. Doi: 10.3390/molecules16086992.
40. Actor J., Hwang S., Kruzel M. Lactoferrin as a natural immune modulator // Curr. Pharm. Des. — 2009. — 15. — Р. 1956-73. Doi: 10.2174/138161209788453202.
41. Кицак В.Я. Вирусные инфекции беременных: патология плода и новорожденных. — Новосибирск: Кольцово, 2004. — 84 с.
42. Мальчиков И.А. Значение вирусных инфекций в патологии, связанной с нарушениями противоинфекционной защиты, и методы их выявления: Автореф. дис… д-ра мед. наук. — Екатеринбург, 2007.
43. Yin K., Agrawal D.K. Vitamin D and inflammatory disea–ses // J. Inflamm. Res. — 2014. — 7. — Р. 69-87. Doi: 10.2147/JIR.S63898.
44. Zughaier S.M., Alvarez J.A., Sloan J.H. et al. The role of vitamin D in regulating the iron-hepcidin-ferroportin axis in monocytes // J. Clin. Transl. Endocrinol. — 2014. — 1. — Р. 19-25. Doi: 10.1016/j.jcte.2014.01.003.
45. Silva B., Faustino P. An overview of molecular basis of iron metabolism regulation and the associated pathologies // Biochim. Biophys. Acta. — 2015. — 1852. — Р. 1347-1359. Doi: 10.1016/j.bbadis.2015.03.011.
46. Ruchala P., Nemeth E. The pathophysiology and pharmacology of hepcidin // Trends Pharmacol. Sci. — 2014. — 35. — Р. 155-161. Doi: 10.1016/j.tips.2014.01.004.
47. Bacchetta J., Zaritsky J.J., Sea J.L. et al. Suppression of iron-regulatory hepcidin by vitamin D // J. Am. Soc. Nephrol. — 2014. — 25. — Р. 564-572.

/40-1.jpg)
/41-1.jpg)
/42-1.jpg)
/43-1.jpg)
/43-2.jpg)
/44-2.jpg)
/44-1.jpg)
/45-1.jpg)