Введение
В предыдущей публикации представлены современные данные о группе антиоксидантных лекарственных средств — ингибиторах активности NOX [1]. Продолжая тему медикаментозного управления окислительно-восстановительным состоянием организма при заболеваниях органов дыхания, необходимо подчеркнуть, что ключевыми фармакологическими мишенями антиоксидантной терапии считают нуклеарный фактор транскрипции NFE2L2 (nuclear factor, erythroid 2 like 2) и антиоксидантные ферменты. Активаторы NFE2L2 и миметики антиоксидантных ферментов представляют собой лекарственные средства — варианты новых направлений антиоксидантной терапии.
Активаторы фактора транскрипции NFE2L2
Фактор транскрипции NFE2L2, экспрессируемый преимущественно в эпителиоцитах и альвеолярных макрофагах, активируя антиоксидантный ответ и гены, участвующие цитопротекции, играет важнейшую роль в защите ткани легкого при воздействии как экологических неблагоприятных, так и эндогенных патогенетически значимых факторов. В экспериментальных работах на животных и клинических исследованиях было показано, что активация фактора транскрипции NFE2L2 препятствует развитию оксидантного стресса и процесса воспаления. Установлено несколько веществ растительного происхождения, которые оказывают мощный индуцирующий эффект на активность фактора транскрипции NFE2L2 (табл. 1) [8].
Сульфорафан уже находится во II фазе клинических исследований при хронической обструктивной болезни легких (ХОБЛ), организованных американским Национальным институтом здоровья. Однако сульфорафан не является идеальным активатором NFE2L2, так как в малых дозах он недостаточно эффективен, а в больших дозах небезопасен [6].
Christopher J. Harvey и соавт. [14] показали, что индукция активности фактора транскрипции NFE2L2 сульфорафаном способствует не только снижению активности оксидантного стресса, но и увеличению макрофагального фагоцитоза и ускорению эрадикации Haemophilus influenza и Pseudomonas aeruginosa у больных ХОБЛ.
Наиболее терапевтически перспективными синтетическими индукторами фактора транскрипции NFE2L2 являются тритерпеновые производные олеаноловой кислоты (CDDO) — CDDO-имидазолид (CDDO-Im), CDDO-этиламид (CDDO-EA), CDDO-трифлюороэтиламид (CDDO-TFEA) и др. [9, 13]. В настоящее время синтезировано несколько сотен производных CDDO, в лабораторных условиях было показано, что они: 1) при низких наномолярных концентрациях ингибируют развитие оксидантного стресса и воспаления; 2) индуцируют дифференцировку клеток; 3) подавляют пролиферацию клеток; 4) при высокой микромолярной концентрации вызывают апоптоз клеток [9].
Фармакологическая активация фактора транскрипции NFE2L2 сопровождается снижением степени активности LPS-индуцированного воспаления и достоверно увеличивает выживаемость экспериментальных животных. Shyam Biswal и соавт. [3] считают, что новые лекарственные средства, индуцирующие NFE2L2, которые будут разработаны в ближайшее время, станут важнейшим терапевтическим инструментом лечения хронических воспалительных заболеваний органов дыхания. Фармацевтические компании уже активно участвуют в разработке новых индукторов фактора транскрипции NFE2L2. Так, в декабре 2011 года Abbott Laboratories (штат Иллинойс, США) согласилась выплатить 400 млн долларов США фирме Reata Pharmaceuticals, основанной в городе Ирвинг, штат Техас, за лицензию второго поколения активаторов NFE2L2. Исполнительный вице-президент Abbott Laboratories Томас Фрейман сообщил инвесторам в январе 2012 года, что клинические исследования первого из этих активаторов начнутся в конце 2013 года. Также в производстве активаторов NFE2L2 проявляют заинтересованность фирмы Glaxo Smith Kline, Pfizer и Novartis. Однако, несмотря на огромный терапевтический потенциал активаторов NFE2L2 при лечении больных ХОБЛ, у данных препаратов очень низкий профиль безопасности. Это связано с тем, что при физиологических условиях фактор транскрипции NFE2L2 быстро подвергается протеасомной деградации, а свою активность проявляет только в условиях оксидантного стресса. Поэтому использование индукторов NFE2L2 может привести к нарушению физиологически необходимых окислительно-восстановительных реакций в клетках. Также представлены данные о том, что активаторы NFE2L2 способствуют развитию неопластических процессов [6]. Клинические исследования должны определить уровень эффективности и безопасности активаторов NFE2L2 при лечении больных с хроническими заболеваниями органов дыхания [3, 6].
Миметики антиоксидантных ферментов
В настоящее время разработаны миметики SOD, каталазы и глутатионпероксидазы.
Применение препаратов естественных SOD, несмотря на показанную в эксперименте их высокую терапевтическую эффективность, затруднено из-за множества их фармакологических недостатков. Так, молекулы естественных SOD характеризуются выраженной нестабильностью и иммуногенностью. Препараты данной группы не способны преодолевать гематоэнцефалический барьер, не проникают во внутриклеточное пространство. Миметики SOD являются содержащими ион марганца непептидными молекулами, которые обладают каталитическими свойствами естественных ферментов SOD. Они с высокой скоростью нейтрализуют супероксид анион радикал. Среди миметиков SOD различают три класса: макроциклические лиганды на основе марганца (M40401, M40403, M40419 и SC-55858), марганец-металлопорфирины (AEOL-10113 и AEOL-10150) и ароматические соединения Salens — комплексы, содержащие замещенный этилен-диамин (EUK-134, EUK-178, EUK-189) (рис. 1) [10, 11].
/153-2.jpg)
Макроциклические лиганды на основе марганца являются селективными нейтрализаторами супер–оксида анион-радикала и, в отличие от миметиков SOD других групп, не взаимодействуют с такими активными кислород-, азотсодержащими метаболитами, как NO, OONO–, H2O2. Марганецсодержащие металлопорфирины и ароматические соединения Salens обладают как дисмутазной, так и каталазной каталитической активностью. Ингибирование супероксида анион-радикала предотвращает рекрутирование нейтрофилов в регионы воспаления и подавляет продукцию провоспалительных цитокинов (TNF-α, IL-1β и IL-6). Показано, что применение миметиков SOD открывает новые возможности лечения больных с бронхиальной астмой и ХОБЛ [4, 5, 10].
Различают три группы миметиков глутатионпероксидазы: циклические амиды, имеющие селенил Se-N связи; диселенидные и дителлуридные соединения; селеносодержащие пептиды [2].
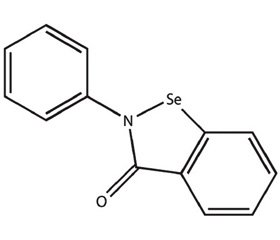
Наиболее изученным миметиком глутатионпероксидазы из группы циклических амидов является эбселен — 2-фенил-1,2-бензисоселеназол-3(2H)-он (PZ51 или DR3305), обладающий пероксидазной активностью (рис. 2).
Эбселен инактивирует супероксид анион-радикал, пероксинитрит, гидроперекиси липидов и фосфолипидов, ингибирует iNOS, липоксигеназу, предотвращает активацию факторов транскрипции NF-κB, AP-1. Кроме того, эбселен имитирует функцию всех селензависимых GPX, в связи с чем он потенциально может быть использован при лечении различных заболеваний, патогенез которых сопряжен с развитием оксидативного стресса. Эбселен назначается перорально и хорошо переносится как животными, так и людьми. Аналог эбселена BXT-51072 обладает более высокой пероксидазной активностью. В настоящее время эбселен проходит клинические исследования эффективности при лечении пациентов с ХОБЛ [2, 7, 10].
Разрабатываются миметические лекарственные средства на основе диселенидных и дителлуридных соединений, которые отличаются значительно более высокой GPX-подобной активностью, чем эбселен. Так, диселенид — 2,2'-деселено-бис-β-циклодекстрин (2-SECD) — инактивирует H2O2 и гидроперекиси, используя в качестве кофактора GSH. Однако до настоящего времени не установлено, могут ли эти соединения использоваться при заболеваниях человека [4, 12].
Большинство протеинов и пептидов, содержащих цистеиновые остатки, могут быть легко модифицированы для образования связи с ионом селена. Включение в их структуру иона селена придает им пероксидазную активность. Например, селен-субтилизин обладает GPX-подобной активностью. Также в целях повышения селективности к GSH используют селенсодержащие моноклональные антитела (Se-4A4 и Se-scFv2F3) с GPX-подобной активностью. Данные об их действии в биологических объектах представлены в единичных работах [4].
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Абатуров А.Е. Медикаментозное управление окислительно-восстановительным состоянием организма при заболеваниях органов дыхания (часть 1) / А.Е. Абатуров, А.П. Волосовец, Т.П. Борисова // Здоровье ребенка. — 2018. — № 1(13). — С. 232-240.
2. Bhabak K.P. Functional mimics of glutathione peroxidase: bioinspired synthetic antioxidants / K.P. Bhabak, G. Mugesh // Acc. Chem. Res. — 2010. — Vol. 43, № 11. — P. 1408-1419. — doi: 10.1021/ar100059g. Epub 2010 Aug 6.
3. Biswal S. Experimental therapeutics of Nrf2 as a target for prevention of bacterial exacerbations in COPD / S. Biswal, R.K. Thimmulappa, C.J. Harvey // Proc. Am. Thorac. Soc. — 2012. — Vol. 9, № 2. — P. 47-51. — doi: 10.1513/pats.201201-009MS.
4. Day B.J. Catalase and glutathione peroxidase mimics // Biochem. Pharmacol. — 2009. — Vol. 77, № 3. — P. 285-296. — doi: 10.1016/j.bcp.2008.09.029. Epub 2008 Oct 1.
5. Esposito E. Role of nitroso radicals as drug targets in circulatory shock / E. Esposito, S. Cuzzocrea // Br. J. Pharmacol. — 2009. — Vol. 157, № 4. — P. 494-508. — doi: 10.1111/j.1476-5381.2009.00255.x.
6. Garber K. Biochemistry: A radical treatment // Nature. — 2012. — Vol. 489, № 7417. — P. S4-6. — doi: 10.1038/489S4a.
7. Lubos E. Glutathione peroxidase-1 in health and disease: from molecular mechanisms to therapeutic opportunities / E. Lubos, J. Loscalzo, D.E. Handy // Antioxid. Redox Signal. — 2011. — Vol. 15, № 7. — P. 1957-1997. — doi: 10.1089/ars.2010.3586. Epub 2011 Apr 10.
8. Lushchak V.I. Glutathione homeostasis and functions: potential targets for medical interventions // J. Amino Acids. — 2012. — Vol. 2012. — doi: 10.1155/2012/736837. Epub 2012 Feb 28.
9. New synthetic triterpenoids: potent agents for prevention and treatment of tissue injury caused by inflammatory and oxidative stress / M.B. Sporn, K.T. Liby, M.M. Yore et al. // J. Nat. Prod. — 2011. — Vol. 74, № 3. — P. 537-545. — doi: 10.1021/np100826q. Epub 2011 Feb 10.
10. Rahman I. Antioxidant therapeutic advances in COPD // Ther. Adv. Respir. Dis. — 2008. — Vol. 2, № 6. — P. 351-374. — doi: 10.1177/1753465808098224.
11. Rahman I. Antioxidant pharmacological therapies for COPD / I. Rahman, W. Macnee // Curr. Opin. Pharmacol. — 2012. — Vol. 12, № 3. — P. 256-265. — doi: 10.1016/j.coph.2012.01.015. Epub 2012 Feb 18.
12. Seleno-cyclodextrin sensitises human breast cancer cells to TRAIL-induced apoptosis through DR5 induction and NF-κB suppression / T. Lin, Z. Ding, N. Li. et al. // Eur. J. Cancer. — 2011. — Vol. 47, № 12. — P. 1890-1907. — doi: 10.1016/j.ejca.2011.04.004. Epub 2011 May 10.
13. Synthetic triterpenoids attenuate cytotoxic retinal injury: cross-talk between Nrf2 and PI3K/AKT signaling through inhibition of the lipid phosphatase PTEN / I. Pitha-Rowe, K. Liby, D. Royce, M. Sporn // Invest. Ophthalmol. Vis. Sci. — 2009. — Vol. 50, № 1. — P. 5339-5347. — doi: 10.1167/iovs.09-3648. Epub 2009 Jun 3.
14. Targeting Nrf2 signaling improves bacterial clearance by alveolar macrophages in patients with COPD and in a mouse mo–del / C.J. Harvey, R.K. Thimmulappa et al. // Sci. Transl. Med. — 2011. — Vol. 3, № 78. — doi: 10.1126/scitranslmed.3002042.

/152-1.jpg)
/153-2.jpg)
/153-1.jpg)