Mycoplasma pneumoniae (Mp) — один из ведущих этиологических факторов внебольничной пневмонии. M.pneumoniae выделена впервые в 1944 году из мокроты у пациента с атипичной пневмонией, в 1961 году культуру культивировали и классифицировали.
Эпидемиология. Наиболее проблемными аспектами в эпидемиологии и течении микоплазменной пневмонии на сегодняшний день считаются цикличность заболеваемости, наличие спорадических случаев с тяжелым течением пневмонии в период спада заболеваемости, а также возрастающая резистентность M.pneumoniae к макролидам. Доказано, что заболеваемость M.pneumoniae имеет волно–образное течение с цикличностью 3–7 лет, так как в период между подъемами увеличивается количество молодых людей, восприимчивых к возбудителю настолько, что они могут становиться резервуаром инфекции. Наибольшая заболеваемость микоплазменными инфекциями отмечается у детей школьного возраста. У лиц старше 40 лет уровень серопозитивности к M.pneumoniae достигает 100 %. Между подъемами регистрируются спорадические случаи заболевания. Особенно высокое распространение микоплазменной пневмонии наблюдаются в Восточноазиатском регионе, где частота достигает 27,4 %, в Европе — около 5 %. Начиная с 2000 года в Азии, Европе, Канаде и США появились устойчивые к макролидам штаммы M.pneumoniae (macrolide-resistant M.рneumoniae (MRMP), а именно 23S-rRNA мутации возбудителя через домен V), которые часто приводят к внелегочным осложнениям [1]. Резистентность M.рneumonia определяют также A2063G и A2064G мутации. MRMP выявляются среди 3–26 % внегоспитальных пневмоний в Европе и 23–97 % — в Китае и Японии [1–3].
Клиническое наблюдение и лечение ребенка 12 лет с пневмонией, вызванной резистентной к макролидам Mycoplasma pneumoniae, инициировало анализ современной мировой литературы. Пациентка А., 12 лет, поступила в стационар с жалобами на лихорадку в течение 5 суток на фоне острой респираторной инфекции, для дифференциальной диагностики между системным заболеванием со–единительной ткани, боррелиозом и инфекционным мононуклеозом. Из анамнеза заболевания выяснено, что ребенок заболел за 11 дней до поступления, когда появились жалобы на повышение температуры тела до 39 °С, боль в спине и мышцах конечностей. Лечились самостоятельно, получала афлубин, ибуфен, парацетамол. На 7-е сутки от начала лечения госпитализирована в центральную районную больницу, где была назначена антибактериальная (цефуроксим) и детоксикационная терапия. Состояние не улучшилось, в связи с чем ребенок направлен в областной детский специализированный стационар. Из анамнеза жизни известно, что ребенок родился в срок. Сразу после рождения был переведен в отделение интенсивной терапии, где проводилась респираторная поддержка (искусственная вентиляция легких (ИВЛ)) и терапия тяжелой внутриутробной пневмонии, осложненной плевритом, последующим развитием сепсиса. ИВЛ продолжалась 12 суток, через 2 месяца пациентка выписана на амбулаторный этап выхаживания в удовлетворительном состоянии. В раннем возрасте девочка развивалась с задержкой (держать голову начала в 6 месяцев, сидеть — с 9 месяцев, ходить — с 1,5 года). После двух лет догнала сверстников в психофизическом развитии. В дошкольном возрасте болела нечасто: острые респираторно-вирусные инфекции 1–2 раза в год, однократно была перенесена ангина и бронхит.
При поступлении в стационар обращали на себя внимание фебрильная температура тела (38,6 °С) и редкий непродуктивный кашель. Лимфатические узлы и паренхиматозные органы увеличены не были. Кожа свободна от сыпи. Выявлена специфическая аускультативная картина над полями легких: ослабление дыхания, сухие свистящие хрипы и единичная крепитация с обеих сторон. Имела место тахикардия (частота сердечных сокращений — до 100 ударов в 1 минуту), тахипноэ не наблюдалось (частота дыхательных движений — 22 в 1 минуту).
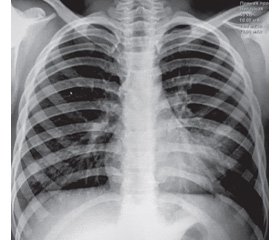
По данным рентгенографии органов грудной клетки выявлена левосторонняя очаговая нижнедолевая пневмония (рис. 1). Выставлен диагноз «внегоспитальная левосторонняя очаговая нижнедолевая пневмония».
/96-1.jpg)
Ребенку проведено углубленное лабораторное обследование, выявлены некоторые изменения. В клиническом анализе крови определялся лейкоцитоз — 15,1–19,8 × 109/л, нейтрофилез — 83–91 % и повышенная скорость оседания эритроцитов (СОЭ) — 46–65 мм/ч. Клинический и микробиологический анализы мочи были в норме. При биохимическом исследовании функции печени, почек, поджелудочной железы изменений не выявлено. Отмечено повышение уровня С-реактивного белка. Протеинограмма в норме, антинуклеарные антитела не повышены. Антистрептолизин О в пределах нормы, ревматоидный фактор отрицательный. При бактериальном исследовании мазка из слизистой зева и носа регистрировалась контаминация условно-патогенной флоры (Staphylococcus haemolyticus, Staphylococcus epidermidis, Streptococcus viridans). Мокроту при первом исследовании выделить не удалось. Трехкратное микробиологическое исследование крови показало стерильность образца. По данным иммуноферментного анализа: антитела IgМ к Micoplasma pneumoniae — 0,722 (норма — до 0,347). Антитела IgМ к Borrelia burgdorferi sensu lato не выявлены. Определение антител к ВИЧ — отрицательный результат. Антитела к вирусу Эпштейна — Барр не выявлены.
Девочка получала лечение по протоколам Ассоциации инфекционных заболеваний Соединенных Штатов Америки и Американской торакальной ассоциации 2016 года [5]. Однако в динамике у ребенка отмечались выраженная стойкая гипертермия, аускультативные изменения в легких, лейкоцитоз и повышенная СОЭ. До получения результатов иммуноферментного анализа назначена стартовая терапия: внутривенно цефтриаксон. Каждые 48–72 часа ввиду неэффективности терапии проводилась замена антибактериальной терапии с учетом микробиологического исследования мазка из зева и носа, мокроты. Через 5 суток от начала терапии выявлено повышение титра IgМ к Micoplasma pneumoniae, что дало основания назначить специфическую терапию азитромицином в стартовой дозе 10 мг/кг/сут. Однако спустя 10 дней пребывания в стационаре (72 часа от начала терапии азитромицином) сохранялись фебрильная температура тела, инфильтративные изменения в легких, изменения в лейкоформуле. Произведена замена азитромицина на линию резерва — левофлоксацин в дозе 10 мг/кг/сут. Фебрильная лихорадка продолжала сохраняться в течение последующих 72 часов (22-й день болезни, 11 суток терапии в стационаре). Данные изменения расценены как чрезмерный клеточно-опосредованный иммунный ответ, с вероятной индукцией провоспалительных цитокинов. В связи с чем, согласно Рекомендациям пульмонологов и инфекционистов Франции, Соединенных Штатов Америки, Японии и Южной Кореи по лечению макролидрезистентных форм микоплазменной пневмонии 2016–2017 годов [2, 3, 5], принято решение о назначении преднизолона 1 мг/кг/сут и внутривенного иммуноглобулина (400 мг/кг/сут) в течение 3 суток. На 2-е сутки иммунокоррекции определилась положительная динамика. Коррекция терапии способствовала снижению температуры тела до субфебрильных цифр, на 3-и сутки температура тела нормализовалась, улучшилось состояние ребенка, появились позитивные изменения в лейкоформуле.
Таким образом, клинический пример демонстрирует резистентное к антибиотикам течение пневмонии с чрезмерным клеточно-опосредованным иммунным ответом, что способствовало анализу литературы, посвященной механизмам и патогенезу данных состояний.
Mycoplasma pneumoniae является одним из ведущих патогенов внегоспитальной пневмонии у детей и других внелегочных проявлений. Наличие поражения интерстиция легочной ткани и бронхио–лит — отличительная особенность микоплазменной пневмонии, что обусловлено цитопатическим эффектом перекиси водорода или других токсинов возбудителя.
Концепция формирования резистентности M.рneu–moniae к макролидам. M.рneumoniae первично резистентна к β-лактамным антибиотикам и другим антибиотикам, влияющим на бактериальную стенку. Поэтому в клинической практике для лечения M.pneumoniae в мире используют антибактериальные препараты, которые препятствуют синтезу белка или ДНК, например комбинации макролида, линкозамида или стрептограмина (хинупристин/далфопристин, не зарегистрирован в Украине), а также кетолиды (MLSK, телитромицин, не зарегистрирован в Украине), тетрациклины и хинолоны [7].
Макролиды действуют на 50S рибосомную субъединицу бактериальной рибосомы, ингибируя синтез белка. Участок образования пептидной связи на большой 50S рибосомной субъединице образует центральную пептидилтрансферазную петлю в области V 23S рРНК (рис. 2) [7, 8]. Наиболее распространенными механизмами резистентности макролидов являются отток антибиотиков (экструзия лекарственного средства из клетки) и модификация сайта-мишени с помощью посттранскрипционной модификации 23S рРНК или мутаций в 23S рРНК рибосомных белках [7]. У макролидов имеется только один механизм действия на M.pneumoniae (модификация мишеней), что и обусловливает быстрое формирование резистентности возбудителя.
/97-1.jpg)
MRMP ассоциирована с мутацией в сайтах 2063, 2064, 2067 и 2617 в домене V 23S-rRNA. Мутация A2063G встречается чаще, чем A2064G. A2067 и C2617 также связаны с резистентностью к макролидам, но они относительно редки. Уровень резистентности к макролидам варьируется в зависимости от положения, в котором происходит мутация. Сравнение результатов секвенирования с тестированием на антимикробную восприимчивость подтвердило, что мутации A2063G и A2064G давали высокий уровень устойчивости к 14- и 15-членным макролидам, хотя мутация A2063G была связана с промежуточным уровнем устойчивости и к 16-членным макролидам. Мутации генов, кодирующих рибосомные белки L4 и L22, также связаны с резистентностью макролидов in vitro, но редко отмечаются в клинических изолятах. На сегодняшний день между кетолидами и другими классами антибиотиков, используемых для лечения M.pneumoniae, не наблюдается перекрестной резистентности. Кроме того, все клинические изоляты с резистентностью к макролидам чувствительны к тетрациклинам и фторхинолонам.
Иммунопатогенез поражения легких, обусловленный макролидрезистентными штаммами, ассоциирован с гиперактивацией иммунного ответа, в том числе с гиперпродукцией цитокинов и Т-клеточной активацией. Исследования показали, что липопротеины M.pneumoniae индуцируют воспалительный ответ через Toll-like рецепторы 2 (возможно, через Toll-like 1, 4, 6) реснитчатого эпителия и оказывают цитопатический эффект за счет перекиси водорода, ковалентного связывания остатка АДФ-рибозы с эндогенными макромолекулами (АДФ-рибозилирование). Возбудитель может продуцировать вакуолизирующий цитотоксин (VacA), вызывающий образование вакуолей внутри цитоплазмы эпителиоцитов [11].
Как правило, микоплазменной инфекцией впервые заболевают в детском возрасте, формируя IgM- и затем IgG-ответы иммунной системы. Обычно течение микоплазменной инфекции у детей доброкачественное, а антибактериальная терапия эффективна. В редких случаях M.pneumoniae может развить тяжелую рефрактерную пневмонию, несмотря на специфическое лечение. В патогенезе тяжелых рефрактерных микоплазменных инфекций играет роль локальное клеточное повреждение, схожее на реакцию на вирус гриппа. Контаминация M.pneumoniae и сильная цитоадгезия к дыхательному эпителию способствуют локальному клеточному повреждению бронхов, что проявляется продукцией супероксидных радикалов, чрезмерным клеточно-опосредованным иммунным ответом и индукцией секреции провоспалительных цитокинов (например, интерлейкина-1β, -2, -8, -18). В ответ на клеточное повреждение лимфоциты, нейтрофилы и макрофаги мигрируют к месту воспаления. После появления специфических клонов Т-клеток и специфических антител, которые эффективно контролируют патогенные белки, повреждение ткани прекращается и начинается реакция восстановления. Однако иногда цитоадгезивность M.pneumoniae (особенно MRMP) инициирует чрезмерное воспаление как в ранней (продолжительность < 48 часов), так и в поздней фазах иммунной реакции (продолжительность от 48 часов до нескольких дней) с последовательными притоками нейтрофилов, лимфоцитов, макрофагов и эозинофилов, что повреждает легочный интерстиций. Во время этого процесса может возникнуть дисбаланс цитокинов и сильнейшее повреждение легочной ткани. Гиперреактивность способствует развитию сильных клеточных иммунных реакций, которые приводят к легочному повреждению и вызывают острую системную воспалительную реакцию, которая наблюдалась у представленного ребенка. Кроме того, сами Т-лимфоциты могут играть критическую роль в остром повреждении легких M.pneumoniae. Интересные результаты получены в недавних исследованиях Т-клеточного ответа на моделях животных, которые показали менее тяжелое течение пневмонии и лучшую выживаемость у особей с недостаточностью или депрессией Т-лимфоцитов по сравнению со здоровыми экземплярами. Более того, некоторые клинические характеристики микоплазменной пневмонии, а именно консолидация пневмонического инфильтрата при тяжелом течении заболевания, коррелируют с ранним назначением кортикостероидов. В связи со сказанным выше существует концепция иммунопатогенеза легочного микоплазменного повреждения, которая включает гипотезу гемостаза системы протеинов легких [12].
Иммунный ответ на инвазию Mycoplasma pneumoniae представлен на рис. 3.
Так, при легком и среднетяжелом течении микоплазменной пневмонии гемостаз системы протеинов сохраняет баланс. Тяжелое течение ассоциируется с дисбалансом цитокинов, протеинов, гиперпродукцией супероксидов, способствуя неконтролируемой воспалительной реакции, что и обу–словливает необходимость назначения стероидов.
Клинические проявления микоплазменной пневмонии. Заболевание передается воздушно-капельным путем и имеет тенденцию к распространению внутри семьи. Наибольший риск заражения у молодых людей в возрасте 5–20 лет. Причем считается, что полный иммунитет к M.pneumoniae формируется около 4 лет. Таким образом, в первые годы после заражения возможны повторные эпизоды заболевания у одного ребенка. Кроме того, у лиц с гипогаммаглобулинемией имеет место повышенная восприимчивость к инфекциям Mp, а у пациентов с серповидноклеточной анемией могут наблюдаться более тяжелые заболевания.
Большинство детей с микоплазменной инфекцией переносят фарингит, средний отит, синусит, круп, бронхит, и инфекция, как правило, локализуется. Только у 3–13 % инфицированных людей развивается бронхиолит или пневмония. После инкубационного периода (от 1 до 3 недель) микоплазменная инфекция манифестирует острым гриппоподобным началом с высокой лихорадки (от 38 до 39,5 °С), боли в горле, недомогания и головной боли. Дебют микоплазменной инфекции может сопровождаться ринитом, что не характерно для гриппа. Через 3–7 дней после начальных симптомов появляются непродуктивный кашель и рентгенологические признаки пневмонии, температура тела может сохраняться повышенной, что продемонстрировано в клиническом наблюдении. Симптомы и физикальная картина часто недостаточно коррелируют с рентгенографическими находками (пневмония «на ногах»), так как рентгенологическая картина микоплазменной пневмонии разнообразна. Наиболее часто выявляются инфильтративные изменения и признаки поражения интерстиция. Дети школьного возраста (≥ 6 лет) обычно имеют более длительную лихорадку, высокие уровни С-реактивного протеина и низкое абсолютное количество лейкоцитов в крови, а также сегментарную или лобарную пневмонию рентгенологически. У младших детей (< 5 лет) данная клиника развивается реже [5]. Доказано, что чем длительнее сохраняются лихорадка, кашель и рентгенологические изменения, тем выше вероятность MRMP. Большинство пациентов с пневмонией MRMP демонстрируют стойкость клинических изменений по сравнению с пациентами с пневмонией MSMP. Кроме того, недавние сообщения продемонстрировали увеличение прогрессирования заболевания и появление осложнений у пациентов с пневмонией MRMP во время проводимой терапии. Клинические исследования показали более частую смену антибактериальной терапии и/или назначение кортикостероидов в тактике лечения пневмонии, вызванной MRMP [7].
Микоплазменная пневмония длится в течение 2–4 недель и обычно разрешается [5]. У 26 % детей лихорадка может сохраняться до 4 недель, имеют место рецидивы синдрома бронхиальной обструкции и крепитация на протяжении 3–6 месяцев. У некоторых детей M.pneumoniae является триггером развития интерстициального заболевания легких, бронхиальной астмы, энцефалита, синдрома Гийена — Барре. Описаны неврологические, дерматологические, желудочно-кишечные нарушения, напрямую или косвенно вызванные инфицированием этим микроорганизмом.
Диагностика. Наряду с обилием различных серологических исследований и доступности полимеразной цепной реакции на ранних стадиях диагностика микоплазменной инфекции ограниченна из-за недостаточной продукции IgM и низкой информативности полимеразной цепной реакции (ПЦР). На начальном этапе инфекции, вызванной M.pneumoniae, нормальная иммунная система синтезирует антитела IgM, затем IgG, и в течение шести недель количество антител достигает пика с последующим снижением в течение нескольких месяцев, в отдельных случаях — лет. В то же время чувствительность серологических исследований к M.pneumoniae составляет 45 %, поэтому при вероятном диагнозе на ранних стадиях заболевания у пациентов с тяжелой пневмонией при отрицательных первичных результатах рекомендовано исследовать сероконверсию IgM парными сыворотками (с короткими промежутками между исследованиями (3–5 дней)). Вторым рекомендованным методом исследования является ПЦР-диагностика культуры M.pneumoniae в мазке из зева, мокроте и бронхоальвеолярном лаваже. Результаты ПЦР-диагностики также могут иметь низкую информативность (до 30 %), что обусловлено особенностями забора материала у детей. Кроме того, после уже перенесенной инфекции M.pneumoniae длительно выделяется из верхних дыхательных путей [6, 7].
На сегодняшний день приоритетной в диагностике M.pneumoniae является комбинация серологического исследования IgM крови (возможно использование метода парных сывороток) и ПЦР-диагностики.
Наряду с диагностикой возбудителя для принятия клинического решения о способе лечения микоплазменной пневмонии рекомендовано раннее выявление MRMP. Продолжительность постановки, медленный рост и чувствительность к средовым факторам M.pneumoniae снижают информативность тестов на чувствительность к антибиотикам. Поэтому разработаны молекулярные методы для быстрого обнаружения MRMP из респираторных образцов. В дополнение к обычной ПЦР и секвенированию гена 23S рРНК для выявления резистентности используется полиморфизм длин рестрикционных фрагментов (Restriction fragment length polymorphism, RFLP), ПЦР в реальном времени, гибридизация ДНК в формате чипов и анализ кривых плавления с высоким разрешением (high resolution melt analysis, HRM) [9, 10].
Лечение. Часто инфекция Мр имеет легкое течение и не требует специального лечения.
У детей препаратами выбора для лечения микоплазменной инфекции являются макролиды (уровень доказательности А). Рекомендован азитромицин перорально (10 мг/кг/сут в 1-е сутки, после — на протяжении 2–5 суток 1 раз в день 5 мг/кг/сут). Максимальная доза азитромицина — 500 мг в 1-й день, на протяжении 2–5 суток — 250 мг 1 раз в день. Возможно назначение кларитромицина
15 мг/кг/сут, разделенных на 2 дозы на протяжении 7–14 суток [2]. Лихорадка является точкой клинического решения для оценки целесообразности применения антибиотика второй линии. Если клинические симптомы не улучшаются в течение 48–72 часов на фоне лечения антибиотиками первой линии, рекомендуются антибиотики второй линии. Педиатрическое общество инфекционных заболеваний и Общество инфекционных заболеваний Соединенных Штатов Америки рекомендуют азитромицин в качестве антибиотика первой линии, а кларитромицин, эритромицин, доксициклин (для детей в возрасте от 8 лет), левофлоксацин или моксифлоксацин (для подростков) — как антибиотики второй линии [3]. Японские общества микоплазмологии, педиатрической пульмонологии, детских инфекционных болезней и Японское педиатрическое общество рекомендуют 14-, 15-, 16-членные макролиды в качестве препарата первой линии, а фторхинолоны или тетрациклины — в качестве препаратов второй линии [3]. Резистентность к тетрациклинам и левофлоксацину к M.pneumoniae в литературе пока не описана, однако выделены левофлоксацинрезистентные штаммы S.pneumoniae [4]. Доксициклин назначается детям ≥ 8 лет, фторхинолоны — пациентам старше 14 лет.
Доксициклин, миноциклин, окситетрациклин, тетрациклин и тигециклин являются доступными в настоящее время тетрациклинами, одобренными Food and Drug Administration (FDA). Биологическое действие тетрациклинов состоит в их ингибирующей синтез белка активности. Выпадение зубов, желудочно-кишечные расстройства, светочувствительность и гепатотоксичность являются наиболее распространенными побочными реакциями лекарств тетрациклинов. Известно, что степень обесцвечивания зубов зависит от дозы на массу тела, продолжительности использования и стадии развития зубов. Так как кальцинирование постоянных зубов завершается до 7–8 лет, это является главным основанием для запрещения его использования у детей в возрасте до 8 лет [13]. Миноциклин одобрен для применения протоколами США и Европейского союза и назначается детям ≥ 8 лет в дозе 4 мг в начальной дозе 4 мг/кг массы тела, в дальнейшем — 2 мг/кг
массы тела каждые 12 ч (уровень доказательности В). На сегодняшний день только 2 клинических испытания оценили эффективность миноциклина у детей с MRMP. Хотя оба они были нерандомизированными и не опубликовали отчет о безопасности, они сообщили о превосходной эффективности лечения миноциклином [14]. Доксициклин рекомендован в дозе 200 мг в 1-е сутки, в последующие сутки — 100 мг 1 раз в день.
Ципрофлоксацин, гемифлоксацин, левофлоксацин, ломефлоксацин, моксифлоксацин, нор–флоксацин, офлоксацин и тосуфлоксацин — это доступные в настоящее время фторхинолоны, одобренные FDA для людей старше 18 лет. Недавний систематический обзор безопасности ципрофлоксацина показал у 1,6 % детей скелетно-мышечную недостаточность, связанную с применением препарата [15]. Левофлоксацин был назван респираторным фторхинолоном из-за его активности против многих респираторных бактерий, таких как Streptococcus pneumoniae и Mycoplasma pneumoniae. Однако 12 мая 2016 года FDA в США сообщило об ограничении использования фторхинолонов для лечения неосложненных инфекций (острый бактериальный синусит и бронхит, неосложненные инфекции мочевых путей) из-за риска возникновения серьезных побочных реакций, таких как тендинит, разрыв сухожилия, миастении и периферические нейропатии [16]. Тем не менее FDA также объявила, что для некоторых серьезных бактериальных инфекций (например, пневмонии) преимущества фторхинолонов перевешивают риски, и для них целесообразно использовать их в качестве терапевтического варианта. Согласно рекомендациям Ассоциации инфекционных заболеваний Соединенных Штатов Америки и Американской торакальной ассоциации 2016 года, левофлоксацин рекомендован в дозе 16–20 мг/кг/сут каждые 12 часов для детей 6 месяцев — 5 лет; 8–10 мг/кг/сут каждые 24 часа — для детей 5–16 лет. Максимальная суточная доза — 750 мг (уровень доказательности В). Ципрофлоксацин — 30 мг/кг/сут каждые 12 часов. Моксифлоксацин — 400 мг 1 раз в день применяется у детей подросткового возраста с развитым скелетом (уровень доказательности В).
Антибиотикотерапия способствует быстрому разрешению пневмонии легкой и средней степени тяжести. Однако у части пациентов на фоне терапии продолжается прогрессирование инфильтрации или возникают осложнения, обусловленные чрезмерным клеточно-опосредованным иммунным ответом и MRMP [6, 7].
Назначение иммуномодуляторов, таких как кортикостероиды или внутривенные иммуноглоблины (IVIG), может уменьшить степень иммунной реакции организма ребенка и улучшить прогноз заболевания [6]. Примерно 0,5–2 % случаев микоплазменной пневмонии имеют фульминантное течение, иногда с летальным исходом. На сегодняшний день нет конкретного биомаркера для прогнозирования прогрессирования молниеносной микоплазменной пневмонии. Таким образом, стратегия лечения во многом зависит от тщательного наблюдения и опыта врача. Хотя пока нет четкой стратегии выбора системных кортикостероидов или внутривенных иммуноглобулинов, как описано выше, тяжесть инфекций M.pneumoniae во многом зависит от иммунного ответа хозяина. Использование иммуномодуляторов эффективно при лечении тяжелой МРМР [17]. К сожалению, показания, время, доза и продолжительность курса кортикостероидов остаются неопределенными. Доза варьируется от перорального преднизолона в дозе 1 мг/кг/сут до внутривенного метилпреднизолона 30 мг/кг/сут в течение 3 дней. Длительная лихорадка и/или уровень лактатдегидрогеназы в сыворотке ≥ 480 МЕ/л являются показаниями к терапии кортикостероидами (уровень доказательности С) [7]. Недавнее рандомизированное контролируемое исследование показало, что терапия метилпреднизолоном (2 мг/кг/
сут в течение 3 дней) и IVIG (400 мг/кг/сут в течение 3 дней) у детей с рефрактерными микоплазменными пневмониями, у которых была лихорадка в течение по меньшей мере 7 суток, или перманентная консолидация более чем одной доли уменьшают длительность лихорадки, резорбцию ателектаза и количество плеврального выпота по сравнению с монотерапией азитромицином (уровень доказательности С) [6]. Кроме того, в недавних исследованиях сообщалось об эффективности раннего (спустя 48 часов неэффективного лечения макролидами) назначения системных иммуномодуляторов (кортикостероидов и/или IVIG) при лечении МРМР (уровень доказательности С).
Прогрессирование и тяжелые осложнения микоплазменной инфекции обусловлены задержкой диагностики и лечения, резистентностью к макролидам, коинфекциями и/или гипериммунными ответом организма. Первоначальные признаки и симптомы обычно не отличаются у детей с MRMP от MSMP. Спустя несколько суток заболевания MRMP-пневмонии характеризуются длительной лихорадкой, что объясняет увеличение сроков госпитализации, использования антибиотиков первой и второй линии и частоту осложнений.
Наиболее частыми осложнениями как MSMP, так и MRMP считаются острый респираторный дистресс-синдром, облитерирующий бронхиолит, формирование ателектаза или плеврита. Возможно поражение печени и поджелудочной железы, почек, суставов и появление сыпи. Редко развиваются синдром Стивенса — Джонсона, мультиформная эритема, гемолитическая анемия, гемофагоцитарный синдром, энцефалит, поперечный миелит, синдром Гийена — Барре или церебеллит.
Таким образом, в настоящее время существует 3 терапевтических варианта лечения пневмонии MRMP. Если у пациентов имеется лихорадка и кашель без осложнений, рекомендуется назначение антибиотиков первой линии и симптоматическая терапия. При лихорадке, прогрессирующей консолидации или формировании осложнений рекомендуется использовать антибиотики второго ряда (тетрациклины, фторхинолоны) и применять иммуномодуляторы (кортикостероиды и/или внутривенный иммуноглобулин). Тем не менее необходимы дальнейшие контролируемые клинические испытания для исследования эффективности и безопасности кортикостероидов, хинолонов, линкозамида, стрептограмина и кетолидов в педиатрической практике, особенно у детей с MRMP [10].
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Kim E.K. Epidemiological comparison of three Mycoplasma pneumoniae pneumonia epidemics in a single hospital over 10 years / E.K. Kim, Y.S. Youn, J.W. Rhim et al. // Korean J. Pediatr. — 2015. — № 58. — P. 172-177.
2. Yamazaki T. Epidemiology of Mycoplasma pneumoniae infections in Japan and therapeutic strategies for macrolideresistant M. pneumonia / T. Yamazaki, T. Kenri // Front. Microbiol. — 2016. — № 7. — P. 693.
3. Pereyre S. Mycoplasma pneumoniae: current knowledge on macrolide resistance and treatment / S. Pereyre, J. Goret, C. Bébéar // Front. Microboil. — 2016. — № 7. — P. 974.
4. Schmitz J. Fluoroquinolone resistance in Streptococcus pneumoniae isolates in Germany from 2004–2005 to 2014–2015 [Электронный ресурс] / J. Schmitz, M. van der Linden, A. Al-Lahham // Int. J. Med. Microbiol. — 2017. Режим доступа: https://doi.org/10.1016/j.ijmm. 2017.04.003.
5. Infectious Diseases Society of America (IDSA)/American Thoracic Society (ATS). 2016. Supplemental material for the management of adults with hospital-acquired and ventilator-associated pneumonia: 2016 clinical practice guidelines by the Infectious Diseases Society of America and the American Thoracic Society [Электронный ресурс] Organ_System. — 2017. Режим доступа: http://www.idsociety.org/Organ System/#Hospital AcquiredVentilatorAssociatedPneumoniaHAPVAP.
6. Shan L.S. Effects of methylprednisolone or immunoglobulin when added to standard treatment with intravenous azithromycin for refractory Mycoplasma pneumoniae pneumonia in children / L.S. Shan, X. Liu, X.Y. Kang, F. Wang // World J. Pediatr. — 2017. Режим доступа: https://doi.org/10.1007/s12519-017-0014-9.
7. Yang H.J. Mechanism of resistance acquisition and treatment of macrolide–resistant Mycoplasma pneumoniae pneumonia in children / H.J. Yang, D.J. Song, J.Y. Shim // Korean J. Pediatr. — 2017. — № 60(6). — P. 167-174.
8. Liu Y. Rapid detection of Mycoplasma pneumoniae and its macrolide-resistance mutation by Cycleave PCR / Y. Liu, X. Ye, H. Zhang, Z. Wu et al. // Diagn. Microbiol. Infect. Dis. — 2014. — № 78. — P. 333-337.
9. Ji M. Singlenucleotide polymorphism PCR for the detection of Mycoplasma pneumoniae and determination of macrolide resistance in respiratory samples / Ji M., Lee N.S., Oh J.M., Jo J.Y. et al. // J. Microbiol. Methods. — 2014. — № 102. — P. 32-36.
10. Lucier T.S. Transition mutations in the 23S rRNA of erythromycin-resistant isolates of Mycoplasma pneumonia / T.S. Lucier, K. Heitzman, S.K. Liu, P.C. Hu // Antimicrob. Agents Chemother. — 1995. — № 38. — P. 2770-2773.
11. Takashi S. Cytadherence of Mycoplasma pneumoniae Indu–ces Inflammatory Responses through Autophagy and Toll-Like Receptor 4 / S. Takashi, K. Yui , K. Yutaka et al. // Dev. Infect. Immun. — 2014. — № 82 (7). — P. 3076-3086.
12. Youn Y.S. Differ ence of clinical features in childhood Mycoplasma pneumoniae pneumonia / Y.S. Youn, K.Y. Lee, J.Y. Hwang et al. // BMC Pediatr. — 2010. — № 10. — P. 48.
13. Sánchez A.R. Tetracycline and other tetracycline-derivative staining of the teeth and oral cavity / A.R. Sánchez, R.S. Rogers, P.J. Sheridan // Int. J. Dermatol. — 2004. — № 43. — P. 709-715.
14. Kawai Y. Therapeutic efficacy of macrolides, minocycline, and tosufloxacin against macrolide-resistant Mycoplasma pneumoniae pneumonia in pediatric patients / Y. Kawai, N. Miyashita, M. Kubo et al. // Antimicrob. Agents Chemother. — 2013. — № 57. — P. 2252-2258.
15. Adefurin A. Ciprofloxacin safety in paediatrics: a systematic review / A. Adefurin, H. Sammons, E. Jacqz-Aigrain, I. Choonara // Arch. Dis. Child. — 2011. — № 96. — P. 874-880.
16. FDA Drug Safety Communication: FDA advises restricting fluoroquinolone antibiotic use for certain uncomplicated infections; warns about disabling side effects that can occur together [Электронный ресурс] / Silver Spring (MD): U.S. Food and Drug Administration. — 2017. Режим доступа: http:// www.fda.gov/Drugs/Drug Safety/ucm500143.htm 2016.
17. You S.Y. Effects of methylprednisolone pulse therapy on refractory Mycoplasma pneumoniae Pneumonia in Children / S.Y. You, H.J. Jwa, E.A. Yang et al. // Allergy Asthma Immunol. Res. — 2014. — № 6. — P. 22-26.

/96-1.jpg)
/97-1.jpg)
/98-1.jpg)